1. Introducción
Las hormonas tiroideas (HT), tiroxina (T4) y triyodotironina (T3), formadas y secretadas por la glándula tiroides, desempeñan un papel importante en la vida y el desarrollo humano, al intervenir en la diferenciación de la mayoría de los tejidos durante la ontogénesis, el desarrollo cerebral, somático, la maduración ósea y la regulación del metabolismo (Chourpiliadi y Paparodis, 2020; Forhead y Fowden, 2014). El nivel de la exposición embrionaria y fetal a T3, resulta indispensable para la inducción del desarrollo y patrón en cada tejido (Dentice y Salvatore, 2011).
Durante el embarazo, ocurre interacción entre las hormonas tiroideas maternas, la placenta y el feto, un proceso complejo y aún no bien definido; sin embargo, es claro que el correcto funcionamiento del eje hipotálamo-hipófisis-tiroides (eje tiroideo) es indispensable para el normal crecimiento y desarrollo embrionario-fetal. En el feto, este eje se activa poco después de que la glándula tiroides alcanza su sitio anatómico definitivo alrededor de la séptima semana de desarrollo. No obstante, se necesita una maduración completa del eje, incluidos el transporte de HT, la disponibilidad del receptor y el completo funcionamiento de los mecanismos posreceptor, para garantizar la acción biológica específica en los tejidos diana (Bernasconi et al., 2015), procesos que se consolidan alrededor de la semana 14 (Liu y Brent, 2018: Moog et al,, 2017).
Por lo anterior, durante el primer trimestre del embarazo, la concentración de HT fetales depende directamente del aporte hormonal de la madre a través de la placenta. Se conoce actualmente que pequeñas fluctuaciones en los niveles de HT maternas, particularmente durante la primera mitad de la gestación, pueden tener una influencia duradera en el desarrollo cognitivo infantil, con modificación del riesgo de presentar trastornos del neurodesarrollo (Miranda y Sousa, 2018); incluso, después del inicio de la secreción de hormona tiroidea fetal, el aporte materno representa del 30 al 60% de la T4 fetal, siendo considerado un factor protector para el neurodesarrollo hasta el nacimiento (Miranda y Sousa, 2018).
Esta transferencia hormonal se produce a través de la barrera placentaria mediada por transportadores localizados en la membrana plasmática del sincitiotrofoblasto (LATI, LAT2, MCT8, MCT10, OATPIA2 y OATP4AI) que controlan el paso de HT dentro y fuera de las células trofoblásticas (Loubière et al., 2012). Al interior del trofoblasto, las enzimas desyodinasas tipo 2 (DIO2) y tipo 3 (DIO3), al modificar la actividad biológica de las HT (Bianco et al., 2019; Chan et al., 2003), regulan la cantidad de T4 y T3 que ingresa a la circulación fetal (Bernasconi et al., 2015); la 2201 actividad y expresión de la DIO3 es mayor (Bianco et al., 2019; Forhead y Fowden, 2014; Peng et al., 2020)
Por otro lado, al ser las HT de naturaleza hidrofóbica, deben ser transportadas en el plasma por medio de proteínas que garanticen su llegada a la placenta y después al feto. Esta acción es desarrollada por la transtiretina (TTR), una proteína transportadora producida por el hígado y la placenta; en este último órgano, es secretada por la superficie apical del trofoblasto a la circulación materna, donde después de exponerse a altos niveles de HT en el plasma, se une a T4, formando el complejo T4-TTR, el cual, por internalización, ingresa a la placenta y es llevado a la circulación fetal; las desyodinasas evitan la modificación enzimática de T4 (Patel, Landers, Li, Mortimer y Richard, 2011a).
Es importante destacar que la placenta no solo media el metabolismo de las HT y el pasaje al compartimento fetal, sino que ella misma es sensible a la acción de estas hormonas que regulan su propio metabolismo, diferenciación y desarrollo (Barber et al., 2005; Bianco et al., 2019; Maruo, 2010).
Dada la importancia de los niveles de HT en el feto, y el papel de proteínas placentarias como DIO3 y TTR en su regulación, se propuso como objetivo de la presente investigación, identificar las zonas de expresión de DIO3 y TTR en la placenta de un biomodelo murino en los estadios 10.5, 12.5, 14.5 de preñez.
2. Marco teórico
El embarazo implica importantes cambios metabólicos y endocrinos a nivel materno. A medida que se establece la gestación, el mantenimiento de los niveles hormonales en los compartimentos materno y embriofetal se encuentran regulados por la placenta, específicamente por la barrera feto placentaria (Landers, Mortimer y Richard, 2013). Esta barrera formada por cito y sinciciotrofoblasto, varía a lo largo del embarazo; es así como, desde su inicio y hasta la primera mitad de la gestación, se produce un aumento relativo de su grosor (Feldt-Rasmussen y Mathiesen, 2011). Posteriormente, hacia el término de la gestación, la cantidad de citotrofoblasto disminuye, la capa sincitial restante se vuelve delgada y apenas visible (Soncin et al., 2018). Esta disposición final facilita el transporte y regulación de los componentes entre los compartimientos materno y fetal (Feldt-Rasmussen y Mathiesen, 2011).
El estado tiroideo materno durante el embarazo cursa con un aumento inicial de las HT, debido a la actividad similar que presenta la gonadotropina coriónica humana (hCG) con relación a la tirotropina (TSH). Durante el primer trimestre se incrementan considerablemente los niveles de hCG, lo cual da como resultado una disminución en los niveles de TSH (Feldt-Rasmussen y Mathiesen, 2011).
Por otro lado, el hiperestrogenismo fisiológico del embarazo induce una mayor producción de la globulina fijadora de tiroxina (TBG) y, por lo tanto, un aumento de aproximadamente el 50% de la T4 total (Feldt-Rasmussen y Mathiesen, 2011). En el segundo y tercer trimestre, la estimulación de la glándula tiroides inducida por hCG disminuye, mientras que el nivel materno de T4 total continúa en el extremo superior de los valores de referencia en mujeres no embarazadas, y los niveles de TSH en el extremo inferior del rango (Feldt-Rasmussen y Mathiesen, 2011; Haddow et al., 2004)
Las HT, además de influir en los tejidos fetales, intervienen en la placenta; particularmente de manera directa en la proliferación, supervivencia, diferenciación y capacidad invasiva del trofoblasto (Barber et al., 2005; Bianco et al., 2019; Maruo, 2010). Esta importante función se denota por la variedad de subtipos de receptores tiroideos THRal, THRa2, THRpi y THRp2 que se expresan a nivel placentario (Ziegelmüller et al.. 2015). Además, T3 estimula de manera directa la producción del factor de crecimiento epidérmico (EGF), el cual aumenta la capacidad invasiva del trofoblasto y estimula la síntesis de hCG y de la hormona lactógeno placentaria (Barber et al., 2005).
Las HT son transportadas en la sangre por tres proteínas secretadas mayoritariamente por el hígado, la globulina fijadora de tiroxina (TBG), la TTR y la albúmina (Felding y Fex, 1982). Tanto la albúmina como la TTR han sido identificadas a nivel placentario (McKinnon, Li, Richard y Mortimer, 2005). La albúmina tiene baja afinidad pero alta capacidad de unión a estas hormonas, aunque su función de transporte a nivel placentario aún no es clara (McKinnon et al.. 2005). La TTR es una proteína homotetramérica de 55 kDa, cuya estructura está altamente conservada entre vertebrados (Hennebry, Wright, Likic, et al., 2006). Su función principal es el transporte de las HT y del retinol en suero sanguíneo (Landers et al., 2013). La TTR se detecta desde la sexta semana de gestación, aumenta de manera lineal hasta la semana 13, y, posteriormente sus niveles se mantienen constantes hasta el término (McKinnon et al., 2005; Patel et al., 2011).
Las enzimas DIO2 y DIO3 se expresan en la placenta y están localizadas mayoritariamente en la membrana celular del trofoblasto (Bianco et al., 2019; Eerdekens et al., 2019; Peng et al., 2020). Aquí, los niveles de actividad de DIO3 son aproximadamente 200 veces más altos que los de DIO2 (Bianco et al., 2019; Eerdekens et al., 2019; Forhead y Fowden, 2014). Esto sugiere que la actividad de DIO2, que convierte T4 en T3, representa un mecanismo homeostático para mantener una adecuada producción de T3 a nivel placentario. En cambio, DIO3, enzima que cataliza la desyodización del anillo interno de T4 a rT3, y de T3 a T2 nactivo, juega un papel importante en conservar niveles bajos de T3 en el feto, evitando así un exceso catabólico (Bernasconi et al.. 2015; Eerdekens et al., 2019; Koopdonk-Kool et al., 1996). Además, la actividad enzimática de DIO3 asegura la disponibilidad de yoduro en la sangre fetal, ion necesario para la síntesis de HT por la tiroides fetal (Peng et al., 2020).
La actividad de DIO2 y DIO3 varía a lo largo del embarazo, con una mayor actividad durante el primer trimestre. Esta disminución de expresión de desyodinasas placentarias al término de la gestación puede estar relacionada con la disminución de la transferencia de HT de la madre al feto (Chan et al., 2003; Peng et al., 2020).
Es importante destacar que la expresión proteica de los reguladores placentarios de las HT cambia a lo largo de la gestación. La información sobre la regulación de las HT en edades tempranas o intermedias es escasa y confusa. Debido a la dificultad para obtener información en estas etapas de la formación embriofetal, los modelos animales se convierten en una herramienta fundamental para el estudio de los eventos que acontecen alrededor del metabolismo de las hormonas tiroideas durante el desarrollo y la maduración placentaria.
El biomodelo murino constituye un modelo adecuado para el estudio de la placentación, ya que es morfológicamente similar a la placenta humana (Maltepe, Bakardjiev y Fisher, 2010) siendo importante resaltar que la estructura de la barrera placentaria en ambas especies es de tipo hemocorial, con una sola capa funcional que separa la sangre materna de los capilares fetales (Georgiades, Fergyson-Smith y Burton, 2002).
3. Metodología
Biomodelos y obtención de placentas
Tres ratones Mus musculus, hembras de seis meses de edad, fueron apareadas con machos de un año de la misma cepa, hasta observar la presencia de tapón vaginal, correspondiente al día 0.5 de preñez.
Los biomodelos fueron mantenidos en un ambiente libre de patógenos, con ciclos de luz/oscuridad de 12 horas, a una temperatura ambiente entre 21-23°C, humedad relativa del 49%, alimento y agua ad libitum. Posteriormente, se realizó eutanasia por inhalación de CO2 en los estadios de preñez 10.5, 12.5, 14.5, edades seleccionadas porque corresponden a las etapas de establecimiento y maduración de la placenta; equivalentes en la gestación humana al primer trimestre e inicio del segundo trimestre de gestación, etapas que, debido a consideraciones éticas, la investigación en humanos no es posible. Se extrajeron tres placentas por estadio bajo estereomicroscopio.
Este estudio se realizó de acuerdo con los protocolos aprobados por comité institucional Animal Care and Use Committee, del Cincinnati Children's Hospital Medical Center (Cincinnati, OH USA).
Análisis histológico y reconstrucción placentaria
Para el análisis histológico, las placentas fueron teñidas con Hematoxilina y Eosina (H&E) y visualizadas bajo aumentos crecientes siguiendo los protocolos descritos previamente (Bolon, 2014). En breve, las placentas fueron seccionadas a la mitad y fijadas a 4°C en paraformaldehído durante la noche. Posterior al pasaje por una serie creciente de alcohol etílico y aclaramiento con xilol, las muestras fueron incluidas en parafina. Para la observación de las zonas placentarias, se cortaron a 7 Lim a nivel central y fueron teñidas con Hematoxilina y Eosina (H&E). Las secciones obtenidas fueron fotografiadas bajo microscopio Nikon Eclipse NI-E, cámara color DS-F13.
Por medio del software NIS Elements AR 5.20.1, se realizó la reconstrucción a 10X para cada edad gestacional y toma de imágenes a 10X y 20X para cada zona de la placenta.
Inmunofluorescencia
Para la inmunofluorescencia (IF) las técnicas se realizaron siguiendo los protocolos propuestos por Cornett et al., (2013) y Gerhard et al., (2018). En breve, las secciones fueron preparadas mediante un proceso de desparafinación y rehidratación con xilol y una serie de alcohol etílico decreciente, con posterior recuperación antigénica con buffer citrato (pH 6.0). Posteriormente, fueron bloqueada con una solución de suero de burro al 10% + albúmina de suero fetal bovino al I% por 2 horas e incubadas con una mezcla de anticuerpos primarios disueltos en la solución de bloqueo, a temperatura ambiente, con agitación constante, durante toda noche.
Los anticuerpos primarios analizados fueron: CD34 monoclonal (Abcam, ab8158, Cambridge, MA, EEUU) a una concentración de 20 μg/mL, CD31 policlonal (Abcam, ab28364, Cambridge, MA, EEUU) a una concentración de 20 μg/mL, Actina α de músculo liso monoclonal (αSMA) a concentración 10 μg/mL (Sigma Aldrich A5228, St. I Louis, MO, EEUU), Deiodinsa tipo tres policlonal (DIO3) 2221 a concentración 33 μg/mL (Abcam, ab234770, Cambridge, MA, EEUU) y transtiretina policlonal (TTR) a concentración 20 Mg/mL (Thermo Fisher Scientific - Invitrogen, PA5-20742, Waltham, MA, EEUU).
Después de 5 lavados con TBS + Tween-20 al 0.1%, se aplicó una mezcla de anticuerpos secundarios anti-IgG, conjugados con fluorocromos a una concentración de 10 μg/mL durante 2 horas a temperatura ambiente.
Los anticuerpos secundarios fueron: Burro anti IgG de pollo (H+L), 488 (Jackson Immunoresearch, 703545155, Philadelphia, PA, EEUU); Burro anti IgG de ratón (H+L) 350 (Thermo Fisher Scientific - Invitrogen, A10035, Waltham, MA, EEUU); Burro anti IgG de conejo (H+L), 594 (Thermo Fisher Scientific - Invitrogen, A21207, Waltham, MA, EEUU); Burro anti IgG de rata (H+L), 488 (Thermo Fisher Scientific - Invitrogen, A21208, Waltham, MA, EEUU). Las secciones fueron preservadas en medio montaje VECTASHIELD sin DAPI (Vector).
Se realizó procesamiento para IF por triplicado, incluyendo un control negativo (incubación sin anticuerpos primarios) y positivo (según el sugerido por el manufacturador). Las muestras inmunomarcadas fueron visualizadas y fotografiadas usando un microscopio de fluorescencia automatizado Zeiss Axioplan 2, cámara Axiocam MCR5 acoplado al software Axiovision Release 4.8. La toma de imágenes se realizó a 10X, 20X y 40X con corrección automática de la exposición y brillo.
Análisis estadísticos
Los análisis se realizaron de manera cualitativa evaluando presencia o ausencia de los marcadores de interés en las placentas correspondientes a los diferentes estadios gestacionales.
4. Resultados
Para definir las zonas de expresión de DIO3 y TTR en la placenta murina, fue necesario realizar la identificación histológica de ella. Se encontró que a partir del día 10.5 de gestación se podían diferenciar las tres (3) zonas constitutivas de la placenta murina: zona del laberinto, zona de unión y decidua (Figura 1, A y B). En el día 12.5, la placenta alcanzó su configuración morfológica definitiva, al diferenciarse la gran mayoría de tipos celulares que la componen (Figura 1, C).
En el día 14.5, se observaron cambios en los tamaños relativos de las zonas, especialmente el crecimiento de la zona del laberinto y la zona de unión (Figura 1, D).
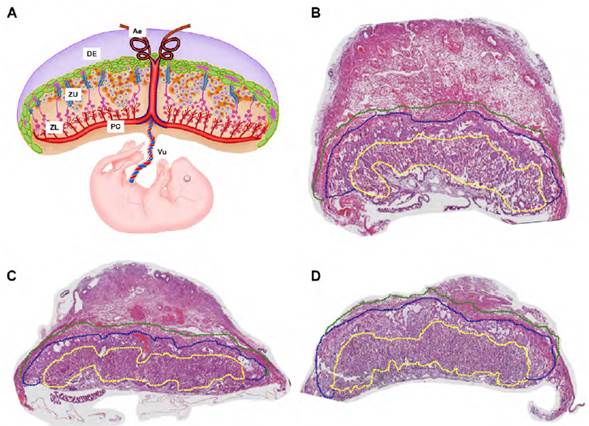
Fuente: Elaboración propia.
Figura 1 Reconstrucciones de placentas de ratón Mus musculus, en los estadios evaluados A: Esquema representativo de la placenta murina. B: E10.5, C: E12.5 y D: E14.5. Se diferencian las tres zonas de la placenta: zona del laberinto (línea discontinua amarilla), zona de unión (línea discontinua azul) y decidua (línea discontinua verde). Aumento 10x. Ae: Arteria espiralada, DE: decidua, ZU: zona de unión, ZL: zona de laberinto, PC: placa coriónica y Vu: cordón umbilical.
En cuanto a la conformación histológica de cada región, la placa coriónica, correspondiente a la estructura que se conecta con el cordón umbilical del feto, se encontró recubierta por un epitelio cúbico o plano simple descansado sobre un estroma de tejido conectivo laxo, el mesénquima. Dentro de este estroma, se observaron los vasos sanguíneos fetales, recubiertos por epitelio plano simple, con eritrocitos con núcleo redondeado, cromatina densa y citoplasma eosinofílico más otras células sanguíneas en maduración en su interior (Figura 2 A-C).
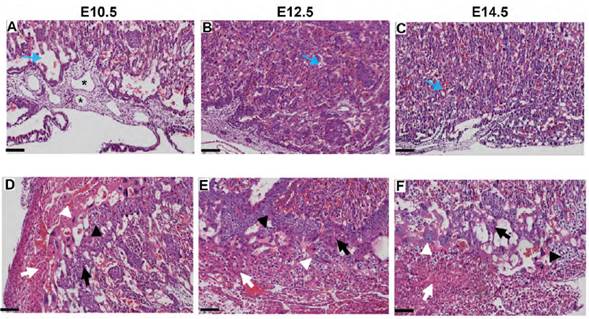
Fuente: Elaboración propia.
Figura 2 Zonas de la placenta de ratón Mus musculus. A, B y C: se distingue la placa coriónica con los vasos fetales (*) y la zona del laberinto con las vellosidades coriónicas y las lagunas maternas (flecha azul). D, E y F: se aprecia la zona de unión con espongiotrofoblastos (flecha negra), células glucogénicas (cabeza de flecha negra), células trofoblásticas gigantes (cabeza de flecha blanca) y la decidua con células deciduales (flecha blanca). Aumento 10x. Barra de escala = 100 μm.
A partir de la placa coriónica los vasos fetales se ramificaron en dirección hacia la cara materna para formar la zona de laberinto, zona compuesta por las vellosidades coriónicas fetales y las lagunas maternas.
Las vellosidades se distinguieron conformadas por tres capas, una capa externa de citotrofoblasto, células con núcleos grandes, esféricos, eucromatina y nucléolos prominentes y, dos capas de sincitiotrofoblasto, células con núcleos ligeramente ovalados, sin límites celulares distinguibles y citoplasma basofílico. Entre ellas se observaron los vasos fetales.
Las estructuras descritas anteriormente, tres capas de trofoblasto y, el endotelio, forman la barrera placentaria, que separa la sangre fetal de la sangre materna, ya que esta última fluye hacia las lagunas sin estar contenida por alguna estructura epitelial (Figura 2 A-C).
Externo a la zona del laberinto se identificó la zona de unión, con presencia de espongiotrofoblastos y células glucogénicas; los primeros fueron reconocidos por su citoplasma basofílico granulado o vacuolado, núcleos redondeados con eucromatina y organizados en grupos, en tanto que las células glucogénicas se observaron con un citoplasma reticulado, núcleo redondeado, pequeño y céntrico. Sobre la zona de unión, se encontraron, separando la cara fetal de la cara materna de la placenta, las células trofoblásticas gigantes, con citoplasma basofílico pálido, gránulos finos y vacuolas, núcleos redondeados, eucromatina y uno o más nucléolos prominentes; por su disposición, entraban en contacto y algunas invadían el estroma decidualizado del útero: la decidua basal, donde se evidenciaron las células deciduales, reconocidas por sus citoplasmas eosinofílicos o ligeramente basofílicos, vacuolados, con núcleos redondeados u ovalados, con uno o dos nucléolos y eucromatina (Figura 2 D-F). Externo a la decidua se observó el estroma del útero, con presencia de músculo liso y vasos sanguíneos medianos y grandes (Figura 1, B, C. D).
La expresión de DIO3 fue detectada en la placenta en los tres estadios evaluados, principalmente en las vellosidades coriónicas (citotrofoblasto y sincitiotrofoblasto) de la zona del laberinto. La inmunomarcación se encontró en el citoplasma y/o la membrana celular en todos los casos (Figura 3).
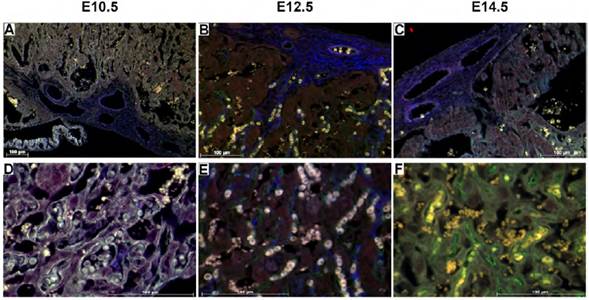
Fuente: Elaboración propia.
Figura 3 Expresión de DIO3 en la placa coriónica y en la zona del laberinto. A, B y C: se observa una porción de la placa coriónica y la zona del laberinto. Nótese la inmunomarcación de DIO3 (rojo) en el trofoblasto, más intensa en el estadio 12.5 y la fuerte marcación de actina de músculo liso (azul) en la placa coriónica. D, E y F: zona del laberinto a un mayor aumento. Se puede detallar el endotelio de las vellosidades coriónicas gracias a la inmunomarcación de CD34 (verde). Aumento 10X (A), 20X (B, C), 40X (D, E, F). Barra de escala = 100 μm.
TTR se detectó en los tres estadios analizados, en la zona del laberinto y la zona de unión, con predominio en la placa coriónica y la zona del laberinto. Su expresión se localizó concentrada en el citoplasma de las células del estroma de la placa coriónica y alrededor de vasos sanguíneos. En la zona del laberinto se identificó expresión en las vellosidades coriónicas (Figura 4). DIO3 y TTR fueron detectados, además, en células del estroma uterino (Figura 5).
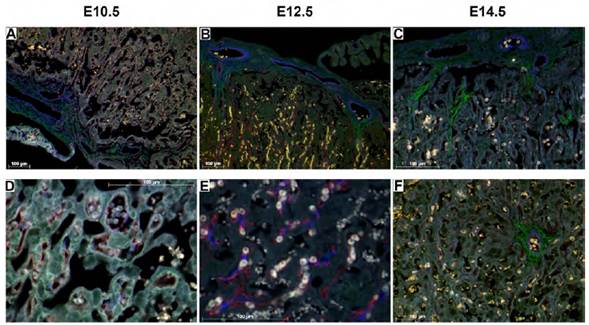
Fuente: Elaboración propia.
Figura 4 Expresión de TTR en la placa coriónica y en la zona del laberinto. A, B y C: se aprecia parte de la placa coriónica y la zona del laberinto. D, E y F: se observa la zona del laberinto en mayor detalle. Nótese la expresión de TTR (verde), actina de músculo liso (azul) y CD31 (rojo). Aumentos 10X (A, B), 20X (C, F), 40X (D, E). Barra de escala = 100 μm.
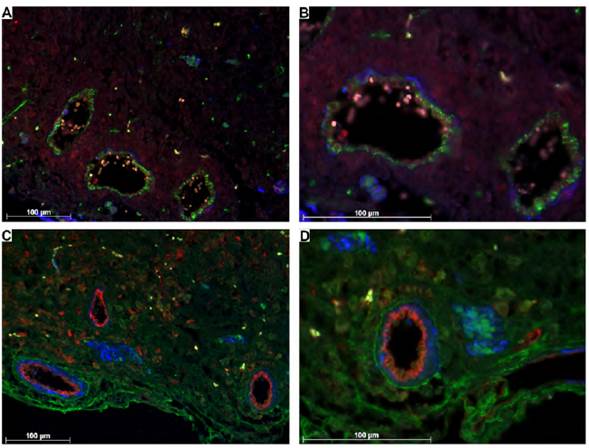
Fuente: Elaboración propia.
Figura 5 Expresión de DIO3 y TTR por fuera de la placenta. A y B: se detalla la expresión de DIO3 (rojo) en células del estroma del útero. Actina de músculo liso (azul), CD34 (verde). C y D: se aprecia la expresión de TTR (verde) en el estroma del útero, así como el músculo liso (azul) de la túnica media de vasos sanguíneos medianos y grandes y el endotelio marcado con CD3I (rojo). Aumentos 20X (A, C) y 40X (B, D). Barra de escala = 100 μm.
5. Discusión
La formación de la placenta inicia tempranamente desde la implantación en el endometrio materno y continúa su expansión a medida que avanza la gestación. Desde este origen, se definen sus componentes, uno materno, la decidua basal y, uno fetal, derivado del blastocisto.
El análisis del establecimiento y la maduración placentaria es de gran interés para conocer el funcionamiento de este órgano; sin embargo, su estudio en condiciones de normalidad está restringido en el humano por razones éticas. Por ello, el uso de biomodelos murinos es común en estudios de placentación, siendo el ratón el modelo animal mejor estudiado (Hemberger, Hanna, y Dean, 2020; Soncin et al., 2018).
Entre los eventos de placentación similares en ambas especies, se encuentran, la conformación de la morfología placentaria, siendo discoidal en ambas especies (Georgiades, Fergyson-Smith y Burton, 2002) y la remodelación de las arterias espirales, evento de adaptación morfológica importante para reducir la resistencia vascular y favorecer el flujo sanguíneo uterino. Este proceso ocurre a un nivel de profundidad equiparable en ambas especies, siendo endovascular e intersticial, con el reemplazo del endotelio y músculo liso por células trofoblásticas (Carter, 2007; I Maltepe, Bakardjiev y Fisher, 2010).
En ambas especies, la función placentaria principal, definida como la habilidad para intercambiar nutrientes y desechos entre la madre y el feto, depende del flujo sanguíneo materno-fetal y de las características físicas de la barrera placentaria (Hemberger et al., 2020).
Las zonas diferenciadas en la placenta de los murinos tienen su equivalencia en la placenta humana; la zona del laberinto identificada en los murinos es equivalente a la placenta fetal en el humano. En esta región se encuentra la barrera placentaria de tipo hemocorial, donde solo componentes fetales, separan la sangre materna de la sangre fetal (Maltepe, Bakardjiev y Fisher, 2010). En humanos, la barrera placentaria está formada por cuatro componentes: una capa continua de sinciciotrofoblasto que cubre la superficie de las vellosidades, una capa de citotrofoblasto discontinua, la membrana basal y el endotelio fetal (Georgiades, Fergyson-Smith y Burton, 2002; Hemberger et al., 2020). La barrera placentaria de murinos, se compone de una capa de citotrofoblasto con fenestraciones (células trofoblásticas gigantes sinusoidales), dos capas de sinciciotrofoblasto (adheridas por uniones tipo Gap), la membrana basal y el endotelio fetal (Georgiades, Fergyson-Smith y Burton, 2002; Hemberger et al., 2020). Si bien es cierto que existe una diferencia en la microarquitectura de la barrera placentaria, la función de esta estructura es equivalente en ambas especies (Georgiades, Fergyson-Smith y Burton, 2002).
Posterior a la zona de intercambio, se encuentra la placa basal (en el humano) o zona de unión (en el ratón), que separa la región materna de las vellosidades placentarias. Bordeando la zona de unión, una capa discontinua de células gigantes del trofoblasto está presente en la placenta murina. Aún no es claro si esta zona tiene una análoga en la placenta humana (Georgiades, Fergyson-Smith y Burton, 2002; Knòfler et al., 2019).
Finalmente, en ambas especies, se encuentra la decidua, región del endometrio materno decidualizado que corresponde a la decidua basal. En esta investigación las tres zonas placentarias fueron evidenciadas en todos los estadios analizados.
En el ratón, el origen de los linajes extraembrionarios que formarán parte del componente fetal de la placenta se diferencia a partir del día 3.5, con la formación del blastocisto. En el día 8.0 se produce la unión del corion y el alantoides. Entre los días 8.5-10.5 continúa la ramificación del laberinto para formar las vellosidades, vitales para el intercambio de nutrientes. Al día 14.5, la placenta ya es madura, funcional, y consta de las tres capas definitivas: laberinto, zona de unión y decidua (Watson y Cross, 2005). Las edades placentarias seleccionadas permitieron observar las etapas de establecimiento y maduración de la placenta, con aumento del tamaño de la zona del laberinto, estrechamente relacionado con su función principal de intercambio de nutrientes y desechos, a nivel materno-fetal. Se seleccionaron los días 10.5, 12.5 y 14.5 porque ellos, al ser el equivalente en la gestación humana al primer trimestre e inicio del segundo, son claves en el metabolismo y transporte a nivel placentario de las HT (Bolon, 2014; Malassiné, Frendo, and Evain-Brion, 2003).
Antes de la primera mitad de la gestación, el feto es completamente dependiente de las HT maternas (Eerdekens et al.. 2019) y el intercambio de las HT entre la circulación materna y fetal ocurre a través de las células del trofoblasto. Los niveles de HT que llegan al feto están determinados por la actividad de DIO3 presente en el trofoblasto placentario.
Nuestros resultados muestran que la expresión de la enzima DIO3 está presente desde el estadio 10.5 al 14.5, principalmente localizada en el citoplasma y membrana plasmática del cito y sincitiotrofoblasto que conforman la zona del laberinto, hallazgos similares a los reportados por Galton et al (1999) y Huang, Dorfman, Genest, Salvatore y Larse (2003), tanto en murinos como en humanos (Galton et al., 1999; Huang et al., 2003). En la placenta humana a término, DIO3 se encuentra expresada en el sincitiotrofoblasto y citotrofoblasto (Huang et al., 2003).
La presencia de DIO3 en los estadios de desarrollo placentario estudiados soporta la importancia que ella tiene en la actividad del eje tiroideo, indispensable para el desarrollo embriofetal murino. Hernández y colaboradores en 2006 encontraron que su ausencia en esta especie, produce un aumento en la mortalidad perinatal, retardo en el crecimiento intrauterino, problemas de fertilidad y alteraciones en el desarrollo y función del eje tiroideo (Hernandez, Martinez, Fiering, Galton y Germain, 2006). Lo anterior va en línea con los hallazgos en humanos, donde esta enzima, además de expresarse en placenta, también se expresa en la mayoría de los tejidos fetales (Darras, Hume, y Visser, 1999; Huang, Chopra, Boado, Solomon y Teco, 1988) incluyendo el sistema nervioso central (Huang, Beredo, Solomon y Chopra, 1986). En contraste, en el adulto, la actividad de DIO3 está limitada principalmente a la piel (Huang, Chopra y Beredo, 1985) y el sistema nervioso central (Darras et al., 1999; Huang et al., 1986) siendo muy baja o ausente en los otros tejidos. La presente investigación estuvo centrada en detectar la presencia de DIO3 en la placenta murina; sería importante en futuras investigaciones, revisar los especímenes embrionarios/ fetales correspondientes, con el objetivo de establecer su presencia en tejido neural y determinar si su desarrollo es acorde a las edades estudiadas.
DIO3 evita la activación de T4 y termina la acción de T3, acción fundamental para limitar la sobreexposición de las HT en los tejidos fetales, situación potencialmente tóxica para el feto (Dentice y Salvatore, 2011). Este concepto está respaldado en humanos por los efectos adversos del hipertiroidismo fetal debido a la enfermedad de Graves en la madre; los infantes afectados pueden presentar enfermedad neurológica y esquelética irreversible, debido a la sinostosis prematura y diferenciación neuronal desordenada (Moleti, Di Mauro, Sturniolo, Russo y Vermiglio, 2019).
Por otro lado, el transportador TTR, también está implicado en la regulación de las HT a nivel de la unidad feto-placentaria. En la presente investigación, la expresión proteica de TTR placentaria fue detectada en los tres estadios estudiados, con predominio en la placa coriónica y el laberinto. Diao et al. (2010), detectaron la expresión de TTR por PCR, RNA in situ e inmunohistoquímica, en zonas de implantación de ratones Wildtype a los 2.5 y 4.5 d.p.c. A su vez, Burnum et al. (2008) a través de hibridación in situ, reportaron la expresión de TTR en las zonas de implantación de ratones a los 5 y 6 días de gestación; lo cual significaría que su acción es necesaria desde tempranos estadios del desarrollo (Burnum et al., 2008; Diao et al., 2010). La expresión de TTR también ha sido detectada mediante técnica de Western Blot en ratas control al final de la gestación (E18) (Ma, Liu, Cao, Zhang, 2020)
En la placenta humana, la síntesis y secreción de TTR se ha reportado a nivel del trofoblasto desde la sexta semana de gestación con un incremento lineal hasta la semana 13, a partir de la cual, los niveles permanecen constantes (McKinnon et al., 2005: Patel, Landers, Li, Mortimer y Richard, 2011b). Este hecho ha sido corroborado recientemente por Landers et al. (2018) quienes reportan por ensayos de inmunomarcación la presencia y captación de TTR en muestras placentarias humanas del primer y tercer trimestre (Landers, Li, Mortimer, Mcleod, D'Emden y Richard, 2018).
En este órgano, la TTR desempeña un papel importante en el transporte de la HT desde el compartimento materno hacia el compartimento fetal (Patel et al., 2011); incluso se ha llegado a considerar que su papel durante el desarrollo temprano resulte indispensable, dada la ausencia de casos humanos en los que se describa una completa ausencia del transportador, hecho que sí ocurre para TBG y albúmina (Harms et al., 1991). Lo anterior es acorde con lo observado en murinos Knockout para TTR, donde ocurre una descompensación en los niveles de HT órgano específico, con principal afectación del desarrollo óseo, del sistema nervioso central, del intestino y del músculo, además de una pobre adaptación a la vida extrauterina (Monk et al., 2013).
Por otro lado, la desregulación de TTR placentaria humana se asocia con restricción del crecimiento intrauterino, preeclampsia (Kalkunte et al., 2013; Tong et al.. 2017); y según Liu et al. (2006) su disminución está relacionada con pérdidas embrionarias tempranas.
En la presente investigación se encontró no solo expresión en placenta de DIO3 y TTR, sino que pudo ser observada también en los vasos sanguíneos del estroma uterino. En tanto que, Galton et al. (1999) reportaron en humanos la expresión de DIO3 en la región adyacente de las células epiteliales que revisten el lumen uterino (Galton et al.. 1999) y, en útero humano no gestante, a nivel de las glándulas endometriales del estroma. En contraste, la expresión de TTR ha sido reportada en el epitelio glandular y en el lumen uterino (Diao et al.. 2010). Estos hallazgos indican que la función de estas proteínas no sólo estaría limitada al transporte de HT feto-placentario, sino que jugarían un I papel en la homeostasis uterina durante la gestación.
6. Conclusión
El presente trabajo indica la presencia de desyodinasa tipo 3 y transtiretina, reguladores proteicos de los niveles de HT en etapas equivalentes a los primeros dos trimestres gestacionales humanos; por lo tanto, continuar los análisis de su expresión asociados a respuestas hormonales fetales y maternas en este biomodelo, contribuirá no solo a comprender sus variaciones durante la gestación, sino además, los hallazgos podrían ser extrapolados y aportarían en la comprensión de la regulación de las HT durante el embarazo , proceso aún no esclarecido, cuyas alteraciones se asocian a complicaciones materno-fetales durante la gestación y en la vida futura del niño.














