1. Introducción
La granadilla (Passiflora ligularis Juss) es una planta originaria de los altiplanos húmedos de la zona Andina, y distribuida en América desde México hasta Bolivia (Ocampo, Arias y Urrea, 2015). Se cultiva en Colombia, Kenia, Costa de Marfil, Sur de África y Australia. En Colombia y Costa Rica es conocida como granadilla, en Estados Unidos, Inglaterra y Holanda la llaman "sweet passion fruit". Colombia se distingue por ser el mayor productor y consumidor de esta fruta a nivel mundial (Yockteng, Coppens, d'Eeckenbrugge y Souza-Chies, 2011). En Colombia en el año 2018 las exportaciones de granadilla alcanzaron las 723 toneladas, con un valor aproximado de $ 3,5 millones de dólares (MADR, 2019). En estos últimos años se ha registrado con un crecimiento de las exportaciones en un 300% entre los años 2009 al 2018. Los principales destinos que se comercializa esta fruta son: Emiratos Árabes con el mayor porcentaje (18,79%), seguido de Canadá (18,23%), Francia (15,13%) y Brasil (8,29%), entre otros (MADR, 2019).
En el cultivo de granadilla (Passiflora ligularis Juss.) la enfermedad más limitante es la pudrición del cuello causada por Fusarium solani f.sp. passiflorae (Tamayo, 1999). Esta enfermedad afecta en los diferentes estados de desarrollo de las plantas, este mismo fitopatógeno se ha reportado afectando cultivos de maracuyá (P edulis f flavicarpa O. Degg) en Brasil (Fischer, Martins, Lourenco, Kimati y Amor-im, 2003); Estados Unidos (Ploetz, 1991) y en Venezuela (Cedeño, Palacios, Marques, Nueva y Tavira, 1990). También se ha reportado que puede afectar a diferentes especies de Passifloras como: gulupa (P edulis Sim.), maracua (P alata Curtis.), cholupa (P maliformis L.) y Badea (P quadrangularis L.) (Ssekyewa, Fina, Swinburne, Van Damme y Abubakar, 1999; Fischer y Rezande, 2008).
Se manifiesta en plantas adultas con marchitamiento y clorosis gradual de las hojas en forma ascendente; posteriormente se observa defoliación severa de las hojas bajeras hasta producir la muerte de las plantas. Cuando esto sucede se observa una pudrición severa de las raíces con la formación de chancros en tallo. Asimismo, las plantas afectadas por el patógeno no se recuperan y mueren (Tamayo, 1999).
La principal medida para el control de enfermedades causadas por Fusarium son las medidas preventivas, esto con el fin de evitar las infecciones causadas por este patógeno; ya que es muy difícil su manejo después de que se ha diseminado en el suelo (Agrios, 2005). Una estrategia de control muy eficiente para patógenos como del suelo, ha sido emplear especies resistentes como portainjertos o para el mejoramiento genético en los diferentes cultivos (Fischer, Rezende, Filho y da Silva, 2005; Dos Santos, Laranjeira, de Oliveira, Carvalho y de Freitasm, 2013). Estudios de resistencia con este patógeno en el cultivo de maracuyá, revelaron que algunas especies del género Passiflora son resistentes como Passiflora candida Mast y P fuchsiiflora Hemsl (Delanoë, 1991). Algunas introducciones de cholupa (P maliformis L.) son parcialmente resistentes a F oxysporum, sp. passiflorae se puede utilizar como porta injertos con híbridos susceptibles de maracuyá (P edulis Sim) (Cole, Hedges y Ndowora, 1992).
Colombia, cuenta con una gran diversidad de especies dentro del género Passiflora con 187 especies descritas (Ocampo et al. 2014), lo que aumenta las posibilidades de establecer diferentes grados de resistencia a la pudrición del cuello. En este trabajo se evaluó la resistencia de diferentes especies de la familia Passifloraceae y genotipos de maracuyá (Pedulis f flavicarpa O. Deg) a Fusarium solani f.sp.passiflorae (MV184) aislado plantas de granadilla, que en pruebas de patogenicidad registro los mayores porcentajes de incidencia y mortalidad. El método de inoculación que se utilizó para esta investigación fueron discos con peritecios que se usaron para las pruebas de resistencia para las diferentes especies de Passifloras.
2. Materiales y Métodos
Esta investigación se realizó en el invernadero y laboratorio de Fitopatología de la Corporación Colombiana de Investigación Agropecuaria (AGROSAVIA) C. I. Tibaitatá, ubicado en el municipio de Mosquera Cundinamarca (2.543 m.s.n.m), con coordenadas 4º41”43,1 N. de latitud norte y 74° 12' 30,0 W. de longitud, con una temperatura media de 13.6°C (Ver Figura 1).
Fuente: Los autores.
Figura 1 Localización del desarrollo de esta investigación AGROSAVIA C. I. Tibaitatá.
Aislamiento e inoculación
El aislamiento de Fusarium solani f.sp. passiflorae que se empleó para este experimento fue el MV184. En laboratorio se identificó por pruebas morfológicas y moleculares, se escogió por registrar los mayores porcentajes incidencia y mortalidad en pruebas de patogenicidad en plántulas de granadilla (>90%).
Preparación del inóculo
El medio de cultivo fue elaborado según el protocolo descrito por Leslie y Summerell (2006), empleando el medio de cultivo Agar V8 y jugo de zanahoria con modificaciones. Este medio se utilizó para favorecer la producción de peritecios que corresponden a la fase sexual de Fusarium solani. El medio se preparó con 300 ml de jugo V8 (Cambell Soup Co, Camben, N.J), 400 ml de agua destilada y 300 ml; de jugo de zanahoria. Por último, se le adicionó 20 g de agar. El pH se ajustó entre 5,5 a 6,5 con CaCO3 y I M NaCl; posteriormente se esterilizó por 20 minutos a 120 lb/p. Se sembró el aislamiento MV184 y finalmente se dejó en incubación durante 20 días con luz continua a 25°C. Trascurrido ese tiempo se cortaron discos de micelio con peritecios con un diámetro de 0,5 cm, con ayuda de un sacabocados.
Para la inoculación de F solani f.sp. passiflorae se utilizó el protocolo descrito por Ortiz y Hoyos (2010). Inicialmente se desinfectaron los tallos con una solución de etanol al 70%, a 2 cm de la base del tallo; luego se lavó con agua destilada estéril; a continuación, se hizo una herida en forma de T con un bisturí estéril retirando parte de la corteza. Sobre esta herida se colocó un disco de 0.5 cm de diámetro con peritecios, se envolvió con parafilm (Fischer et al., 2003).
Como tratamiento control eran plántulas a las que se le realizó una herida en forma de T, teniendo en cuenta el utilizar un disco de PDA estéril y luego se envolvió parafilm. A todas las plantas se les coloco una mota de algodón estéril humedecida con agua destilada estéril.
Material vegetal
Para esta investigación se utilizaron; ocho especies provenientes del Banco de Germoplasma de la Corporación colombiana de investigación agropecuaria (AGROSAVIA) C.I Palmira; siete accesiones de la Corporación centro para la gestión tecnológica de passiflora del departamento del Huila. (CEPASS) y 5 materiales colectados en el departamento de Boyacá (Tabla 1). Como control positivo fueron plántulas de granadilla variedad criolla y un control negativo fue una especie reportada como resistente cholupa (PM02) y plantas de uchuva. Todas las plantas que se evaluaron en este experimento tenían una edad de 2,5 a 3 meses. Al finalizar la evaluación se realizó un re aislamiento del patógeno de las plantas para cumplir con los postulados de Koch (Agrios, 2005).
Tabla 1 Introducciones seleccionadas para la evaluación de resistencia.
| N. | Nombre de la especie | Accesión | Origen del material |
|---|---|---|---|
| 1 | Passiflora maliformis L | PM01 | CEPASS (Huila) |
| 2 | Passiflora maliformis L | PM02 | CEPASS (Huila) |
| 3 | Passiflora maliformis L | PM03 | AGROSAVIA (C.I. Palmira) |
| 4 | Passiflora maliformis L | PM04 | AGROSAVIA (C.I. Palmira) |
| 5 | Passiflora ligularis Juss | CP | CEPASS (Huila) |
| 6 | Passiflora quadrangularis L. | PQ05 | CEPASS (Huila) |
| 7 | Passiflora edulis Sims | PE06 | CEPASS (Huila) |
| 8 | Passiflora edulis Sims | PE07 | COLECTA (Boyacá) |
| 9 | Passiflora tripartita var. mollissima (Kunth) LHBailey | PMO8 | COLECTA (Boyacá) |
| 10 | Passiflora tripartita var. mollissima (Kunth) LHBailey | PMO9 | COLECTA (Boyacá) |
| 11 | Passiflora edulis f. flavicarpa O. Deg purporea | PE011 | CEPASS (Huila) |
| 12 | Passiflora edulis f. flavicarpa O. Deg | PE012 | AGROSAVIA (C.I. Palmira) |
| 13 | Passiflora edulis f. flavicarpa O. Deg | PE013 | AGROSAVIA (C.I. Palmira) |
| 14 | Passiflora edulis f. flavicarpa O. Deg (hibrido) | PE014 | AGROSAVIA (C.I. Palmira) |
| 15 | Passiflora edulis f. flavicarpa O. Deg (hibrido) | PE015 | CORPOICA (C.I. Palmira) |
| 16 | Passiflora edulis f. flavicarpa O. Deg (hibrido) | PE016 | AGROSAVIA (C.I. Palmira) |
| 17 | Passiflora edulis f. flavicarpa O. Deg (hibrido) | PE017 | AGROSAVIA (C.I. Palmira) |
| 18 | Passiflora alata Curtis | PA018 | CEPASS (Huila) |
| 19 | Physalis peruviana L. | CN | COLECTA (Boyacá) |
Fuente: Puntos de colecta de los diferentes genotipos de Passifloras en Colombia realizado por los investigadores.
Diseño experimental
El diseño experimental fue de bloques al azar con cuatro repeticiones cada una conformadas por 10 plantas, cada planta fue una unidad experimental. El arreglo factorial fue de (20 x 1) primer factor fueron las accesiones evaluadas, el segundo el aislamiento inoculado F solani f.sp. passiflorae (MV184). Se llevó un registro de la temperatura y de la humedad durante el experimento. Las plantas permanecieron a una temperatura de + 25°C y una humedad relativa del + 75%, con riego constante, durante todo el experimento las plantas se fertilizaron cada I5 días con el fertilizante Master 30-10-20 (En la Tabla 1 se menciona las diferentes accesiones evaluadas para la resistencia a la pudrición del cuello F solani f.sp. passiflorae).
Variables de respuesta
El estudio llevó un registro del porcentaje de severidad, incidencia, mortalidad, junto con el número de plantas enfermas, sanas, después de la inoculación. Con estos datos se calculó el área de progreso de la enfermedad en escalera (AUDPCs) para todas las accesiones según la metodología de Simko y Piepho (2012). La severidad se midió utilizando la escala propuesta por el Centro internacional de agricultura tropical (1987) para evaluar la severidad de la pudrición de cuello de la raíz en Fusarium solani f.sp phaseoli en fríjol.
Se cálculo del área bajo la curva de progreso de la enfermedad (AUDPCs), para esto se utilizó el programa R, versión 3.4.3. Con los resultados de los (AUDPCs) de cada accesión, se le realizó un clustering usando el método de Ward, para el agrupamiento de acuerdo a la distancia Euclidiana y a su grado de disimilitud. Todos los datos se analizaron con el paquete estadístico XLSTAT 2016.02.28451, comparando el valor de las medias y se estableció las diferencias estadísticas (P<0,001) utilizando la prueba de Kruskal Wallis por ser datos no paramétricos para el valor de cada muestra independiente.
Se construyó las gráficas del AUDPC con cada observación que representa al área de un trapezoide, la suma de cada área daba como resultado un valor unitario para cada accesión según el grado de resistencia y o susceptibilidad a la enfermedad.
3. Resultados
De acuerdo, a los resultados se pudo agrupar las accesiones en cuatro grupos según el nivel de resistencia o susceptibilidad al patógeno, en resistentes, moderadamente resistentes, susceptibles y muy susceptibles El periodo de incubación para las especies muy susceptibles fue entre 6 a 9 días, en este tiempo el 50% de las plantas presentaron síntomas iniciales de la enfermedad correspondían a las accesiones (CP, PQ05), otras que se clasificaron como muy susceptibles fueron las accesiones (PE06 y PE07 y PM01), después de 8 a 12 días la mitad de las plantas manifestaron los primeros síntomas de la enfermedad, después de la inoculación (DPI). En contraste las plantas susceptibles el periodo de incubación fue mayor al anterior entre 10 a 21 días, se registró con las accesiones (PMO08, PM03, PMO09, PA018).
A diferencia de las especies moderadamente resistente, donde los síntomas se desarrollaron en un periodo entre 35 a 43 días manifestando clorosis y una leve disminución en el crecimiento, que corresponden a las accesiones (PM04, PE012, PE014, PE10 y PE13). Por último, para las plantas resistentes no se registró el desarrollo de los síntomas causados por Fusarium solani f.sp, passiflorae, que fueron (PM02, PE011, PE015, PE017 y CN), con diferencias altamente estadísticas que con otros tratamientos (Véase los resultados del periodo de incubación de las accesiones evaluadas en la Figura 2).
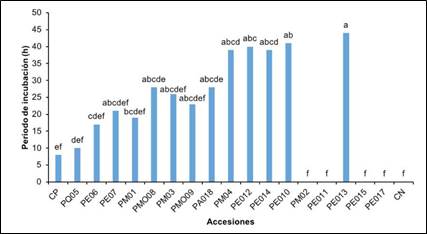
Fuente: Los autores
Figura 2 Periodo de incubación de 18 genotipos de Passifloras después de la inoculación con Fusarium solani f.sp. passiflorae.
Mortalidad
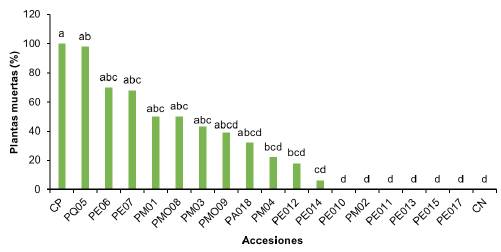
Otro parámetro se calculó durante el experimento fue el porcentaje de plantas muertas al finalizar el experimento al cabo de 70 días después de la inoculación. Según los resultados el mayor porcentaje de mortalidad se registró en plantas de granadilla CP (Passiflora ligularis Juss) y en badea PQ05 (P quadrangularis L.), para este caso la mayoría de plantas murieron entre los 10 a 30 días después de la inoculación (DPI), con diferencias estadísticas con respecto a otras accesiones. En otras especies donde se registró un mayor porcentaje de mortalidad fue para dos accesiones de gulupa PE06 y PE07 (P edulis Sims) entre 67 a 70%. Por último, para dos accesiones de cholupa PM01, PM03 (P. maliformis L.) y una de curubo PMO08, (P tripartita var. mollissima(Kunth) LHBailey), se registró una mortalidad entre un 37 a un 50%.
En las accesiones moderadamente resistentes se registró una mortalidad de tan solo el 6,5 %, eran las accesiones de cholupa PM04 (P. maliformis L.), maracuyá morado PE012 (P edulis f flavicarpa O. Degpurporea) y maracuyá amarillo PE014 (P edulis f. flavicarpa O. Deg). En Las plantas resistentes no se registró mortalidad después de la inoculación con el patógeno eran cinco genotipos de maracuyá (P. edulis f. flavicarpa) (PE10, PE11, PE13, PE15 y PE17), 2 accesiones de cholupa silvestre PM02 y PM03 (P maliformis L.) y control negativo uchuva (Physalis peruviana L) (Véase la Figura 3, porcentaje de mortalidad entre las accesiones después de la inoculación con F. solani f.sp. passiflorae).
Plantas sanas
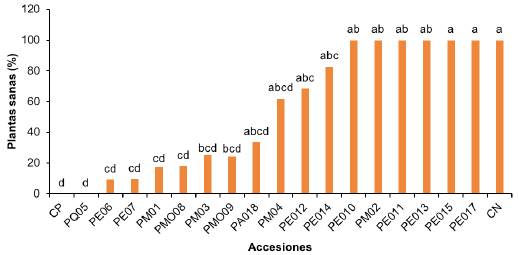
Otro parámetro que se calculó fue el porcentaje de plantas sanas para cada una de las accesiones después de 70 días de la inoculación. Según los resultados las accesiones más resistentes fueron (PE10, PM02, PE011, PE013, PE015, PE017 y CN), ya que permanecieron sanas entre un 98 a 100 %, no se observó la manifestación de síntomas relacionados a la pudrición del cuello causada por F solani f.sp. passiflorae, permaneciendo sanas hasta al final del experimento. Las accesiones que se clasificaron como moderadamente resistentes, permanecieron sanas entre un 62 a un 82%, hasta el final del experimento. Las accesiones susceptibles solo entre un 6 un 29% permanecieron sanas después de la inoculación. Para las especies altamente susceptibles no se registró ninguna planta sana al final de experimento (Figura 4, se muestra el porcentaje de plantas sanas después de la inoculación con F solani f.sp. passiflorae).
Clasificación de las accesiones según el AUDPC
Los genotipos que se clasificaron como susceptibles pertenecen a la supersección, Laurifolia (2) y Tacsonia (4). Todos estos materiales provenían de cultivos comerciales de los departamentos del Huila y Boyacá. Las accesiones moderadamente resistentes se clasifican en la supersección Passiflora (1) y cuatro como Tacsonia, son especies silvestres que en su gran mayoría crecen en climas cálidos, han presentado resistencia la sequía y a la salinidad. Las especies que se clasifican como resistentes se pertenecen a la supersección Passiflora 6 son diferentes genotipos de maracuyás (P edulis f flavicarpa Deneger), que pertenecen al banco de germoplasma de la Corporación colombiana de investigación agropecuaria "AGROSAVIA" C.I. Palmira. La otra accesión que se clasificó como resistente fue una accesión cholupa (Pmaliformis L.), se clasifican en la supersección Tacsonia es una especie silvestre que según lo relatado por agricultores de las zonas productoras en el departamento del Huila es resistente a este patógeno (Véase la Tabla 2, resultado de la clasificación de la resistencia según el AUDPC).
Tabla 2 Resultados de la evaluación de resistencia según el AUDPC
| N. | Accesión | AUDPC2 | Supersección | Nombre científico | N.R3 |
| 1 | CP | 4217 | Laurifolia | Passiflora ligularis Juss | S |
| 2 | PQ05 | 4105 | Laurifolia | Passiflora quadrangularis L. | S |
| 3 | PE06 | 3976 | Tacsonia | Passiflora edulis Sims | S |
| 4 | PE07 | 3579 | Tacsonia | Passiflora edulis Sims | S |
| 5 | PM01 | 3577 | Tacsonia | Passiflora maliformis L | S |
| 6 | PMO08 | 3206 | Tacsonia | Passiflora tripartita var. mollissima | S |
| 7 | PM03 | 2039 | Tacsonia | Passiflora maliformis L | MR |
| 8 | PMO09 | 1121 | Tacsonia | Passiflora tripartita var. mollissima | MR |
| 9 | PA018 | 969 | Tacsonia | Passiflora alata L. | MR |
| 10 | PM04 | 800 | Tacsonia | Passiflora maliformis L | MR |
| 11 | PE012 | 778 | Passiflora | Passiflora edulis f. flavicarpa O. Deg | MR |
| 12 | PE014 | 301 | Passiflora | Passiflora edulis f. flavicarpa O. Deg | R |
| 13 | PE010 | 0 | Passiflora | Passiflora edulis f. flavicarpa O. Deg | R |
| 14 | PM02 | 0 | Tacsonia | Passiflora maliformis L | R |
| 15 | PE011 | 0 | Passiflora | Passiflora edulis f. purporea O. Deg | R |
| 16 | PE013 | 0 | Passiflora | Passiflora edulis f. flavicarpa O. Deg | R |
| 17 | PE015 | 0 | Passiflora | Passiflora edulis f. flavicarpa O. Deg | R |
| 18 | PE017 | 0 | Passiflora | Passiflora edulis f. flavicarpa O. Deg | R |
| 19 | CN | 0 | Solanoideae | Physalis peruviana L. | R |
Fuente: Los autores.
Área bajo la curva del progreso de la enfermedad en escalera (AUDPCs)
En este experimento se calculó el AUDPCs para I8 genotipos Passifloras después de la inoculación con el aislamiento (MV184) de Fusarium solani f.s. pasiflorae. Con el análisis antes descrito se pudo separar en cuatro grupos las accesiones de acuerdo a la susceptibilidad o resistencia al patógeno en un Dendograma que formo los grupos según su grado de disimilitud.
Los rangos comprenden entre 3206.42 - 42I7.9 se clasificaron a las accesiones como susceptibles. Las accesiones que se clasificaron como moderadamente resistentes presentaron los siguientes rangos 778 - 2039.17. Por último, los rangos comprenden para los rangos de 0- 301 fueron para especies resistentes, que registraron un menor progreso de los síntomas. En las especies susceptibles se observó un rápido el progreso de la enfermedad por lo que registró los mayores valores en el AUDPCs, seguidas de las especies susceptibles, moderadamente resistentes y resistentes.
Dendograma
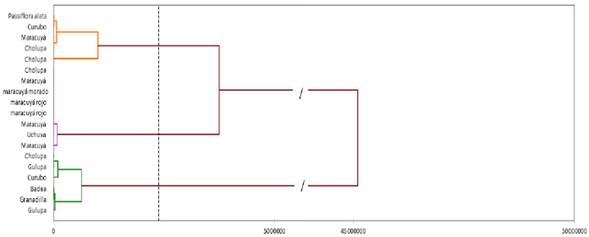
Según los resultados del área debajo de la curva del progreso de la enfermedad en escalera (AUDPCs), para 18 especies de Passifloras inoculadas con F. solani f.sp. passiflorae. Se puede afirmar que el 33% de las accesiones fueron susceptible, el 27% fueron moderadamente resistente y por último el 39% fueron resistentes. Estos resultados concuerdan con los cálculos del porcentaje de plantas enfermas, sanas y muertas.
Con todos estos datos, se realizó por último análisis según los datos del AUDPCs, para cada accesión, se realizó un Dendograma que agrupo a cada accesión de acuerdo a los valores de la disimilitud entre los datos. Se formó tres grupos el primero corresponde a las accesiones susceptibles, el segundo a los moderadamente resistentes y el último grupo a los resistentes. En el primer grupo está dividido en dos subgrupos (muy susceptibles y susceptibles), en el segundo grupo en un solo subgrupo y tercer grupo está dividido en dos grupos.
La explicación de estos resultados, fue porque una especie fue resistente mostró los menores valores según el AUDPCs y las otras que se clasificaron como resistentes no desarrollaron síntomas de la enfermedad por ello su valor fue 0 (Véase la Figura 5, Dendrograma según la clasificación de los genotipos el AUDPCs).
Síntomas
Durante el experimento se llevó un registro fotográfico de los síntomas que manifestaron las plantas durante todo el experimento. Las plantas resistentes después de la inoculación con el patógeno, en los tallos se formó un tejido corchoso sobre la herida donde se hizo la inoculación, en las raíces permanecieron sanas y las plantas crecieron normalmente. En cambio, en las plantas susceptibles se mostró un rápido desarrollo de los síntomas que se concentraron en la base del tallo con la formación de un chancro y en las raíces se observó una necrosis en general y pobre crecimiento. En la Figura 6, se muestra el registro fotográfico de la respuesta de una accesión resiste y una susceptible al patógeno.

Fuente: Los autores.
Figura 6 Respuesta de 18 especies de Passifloras inoculadas con F. solani passiflorae.
ra
4.Discusión
Utilizar especies resistentes es la medida más fácil y efectiva para el control de por patógenos del suelo, desafortunadamente en Colombia no existe variedades de granadillas resistentes a Fusarium solani f.sp. passiflorae (Yamashiro y Cardoso, I982;Tamayo, 1999). En una investigación realizada por Grench y Rijkenberg (1991), concluye que Passiflora caerulea L., puede ser utilizada como patrón resistente a la pudrición del cuello en el cultivo de granadilla. También en trabajos hechos por Gardner (1989) identificó como resistente a este patógeno a P. suberosa L., y puede utilizarse como patrón en granadilla.
En Colombia existe una gran diversidad de Passifloras, aproximadamente 187 especies que están agrupadas en diferentes géneros el 97% pertenece al género Passiflora, Decaloba y Astropeaey el 3% restante pertenece las especies Dysosmia, polyantheaey, entre otras (Ocampo, 2007). El género Passiflora en Colombia cuenta con una gran diversidad de especies que se localizan en la región Amazónica, Pacífica y el Caribe, pero la mayor diversidad de especies se encuentra en la región Andina con cerca del 72% todas las especies descritas, en donde el 48 de las especies son endémicas (Ocampo y Wyckuys, 2010). Esta variabilidad puede ser explotada en programas de mejoramiento genético y aumentar el rendimiento y productividad de los cultivos existentes. Por ello se realizó esta investigación que buscó identificar fuentes de resistencia a la pudrición del cuello (Fusarium solani f.sp.passiflorae) en el cultivo de granadilla.
Según investigaciones hechas por Galeano, Cerón y Arango (2018), realizaron una selección de los genotipos más promisorios de maracuyá de acuerdo, a 17 características relacionadas con productividad, calidad de los frutos como; la forma, color y porcentaje de solidos solubles, para el mejoramiento genético con 30 materiales promisorios. En la actualidad se han adelantado investigaciones se han evaluado la compatibilidad entre crucen interespecificos con diferentes genotipos comerciales y silvestres de maracuyá para procesos de mejoramiento genético (Ocampo, Arias y Urrea, 2016).Trabajos hechos por (Cerqueira et al., 2015) identificaron especies resistentes al virus Passion Fruit WoodinessVirus (PWV), a antracnosis y otras enfermedades usando marcadores 23 SSR junto, según los resultados de incidencia y de severidad en pruebas de patogenicidad
En trabajos hechos por Bernal, Ocampo y Hernández (2014), emplearon marcadores como los microsatélites para identificar 41 accesiones de granadilla que presentaron un alta grado de variabilidad sin una estructura poblacional definida, debido principalmente a su tipo de polinización que esta presenta (alógama). Estudios realizados por Ocampo, Arias y Urrea (2015), determinaron el grado de variabilidad 2641 genética de frutos de granadilla (Pasiflora ligularis Juss. colectados de 35 municipios de 11 departamentos en Colombia. Identificaron accesiones elite para programas de mejoramiento genético. Los resultados mostraron que los frutos presentan una relativa variabilidad intraespecífica. Al final del experimento escogieron 7 accesiones donde los frutos presentaron características agronómicas de interés como: un mayor peso y tamaño. Desafortunadamente estas accesiones presentaron una baja productividad, esto debido a problemas fitosanitarios siendo los más importantes; a la pudrición de cuello (Fusarium solani f.sp. passiflorae), a la mosca del ovario (Dasiops spp.) y antracnosis (Colletotrichum gloeosporioides).
La resistencia de cada especie depende de procesos de reconocimiento específico al ataque de un patógeno y al activar mecanismos de defensa (Gunawardena y Hawes, 2002). Este proceso implica el reconocimiento de efecto-res y proteínas relacionadas a los patógenos, que desencadena una cascada de respuesta, por ejemplo, produciendo enzimas que degradan la pared celular de los patógenos como; las quitinasas y la P-I,2-glucanasas. La interacción de F oxysporum en diferentes especies está bien estudiado se han identificado genes de resistencia en plantas de tomate y fríjol (Sela et al., 2001; Van Loon y Pieterse, 2006).
La diferencia en la respuesta en las plantas al ataque contra plagas y enfermedades como las Passifloras, depende en gran parte de su incompatibilidad gametofítica en estas especies, lo que incrementa la posible resistencia a los patógenos. Un indicador de resistencia parcial a las enfermedades es un periodo prolongado de incubación (Van der Plank, 1963). Las accesiones moderadamente resistentes se registró un prologado periodo de incubación, un menor porcentaje de plantas enfermas y muertas a diferencia del grupo de las especies susceptibles. Es posible, que las plantas resistentes presenten una alta variabilidad genética en las accesiones evaluadas en este estudio.
El cálculo de AUDPCs fue un buen indicador para diferenciar las accesiones, según el grado de resistencia o susceptibilidad a Fusarium solani.f.sp. passiflorae. Los resultados demostraron en dos accesiones de cholupas (Passiflora maliformis L.) como resistentes a este patógeno. Otro resultado interesante que hay que destacar que cinco híbridos de maracuyás fueron PE014, PE015 Y PE0I6, fueron resistentes a la enfermedad podrían ser utilizados como portainjertos o en programas de mejoramiento genético para la transferencia de genes de resistencia. A esta misma conclusión llegaron investigadores como Dos Santos et al (2013), donde evaluaron la resistencia de genotipos de Passifloras a Fusarium oxysporum f.sp. passiflorae, donde las accesiones más resistentes fueron diferentes híbridos de maracuyá.
En una investigación realizada por Oliveira et al. (2016) desarrollaron variedades resistentes a diferentes problemas fitosanitarios que afectan al cultivo de las Passifloras. En esa investigación realizaron cruces interespecificos con los parentales como Pedulis f flavicarpa O. Deg., con Pmucronata Lam. Con la progenie obtenida de este cruce se evaluó en pruebas de resistencia a Fusarium solani. Los resultados demostraron que los genotipos obtenidos de los cruces entre, Pedulis f flavicarpa O. Deg, (susceptible) y P mucronata Lam., (resistente), se obtuvo dos híbridos resistentes a este patógeno que puede ser retrocruzado con P edulis f flavicarpa O. Deg., o pueden ser empleado como portainjerto resistentes (Borges et al., 2004).
En la actualidad los programas de mejoramiento genético en el cultivo de granadilla todavía son muy escasos (Ocampo et al., 2014). Los pocos que existen en su mayoría se han realizado con P edulis Sims y P edulis f flavicarpa O. Deg. (Madeiros et al., 2017). Para ello se debe considerar algunas características agronómicas en materiales que se deseen utilizar para cruzamientos genéticos o como por-tainjertos que se adapten a condiciones adversas como sequía, inundaciones, salinidad y resistencia a enfermedades. Con respecto a esto una especie como la maracua (P. alata L.), es resistente a F oxysporum f.sp passiflorae y tolerante a Phytophthora spp. (Roncatto et al. 2004; Fischer et al. 2005a).
En estudios hechos por Fischer et al (2005b) demostraron que esta especie presenta resistencia a M. javanica una mediana tolerancia condiciones de sequía y salinidad, pero es muy susceptible al ataque de nematodos como Meloidogyne incognita y M. arenaria, a la mancha de aceite (Xantho-monas campestris pv passiflorae), antracnosis (Colletotri-chum gloeosporioides), la roña (Cladosporium herbarum), a la mosca de la fruta (Anastrepha sp.)
La variabilidad genética de diferentes genotipos de maracu-yás es la característica más notable el grado de susceptibilidad o resistencia a patógenos (Delanoë, 1991 ). En países como Brasil algunas accesiones de maracuyá presentan una moderada resistencia a diferentes especies de Fusarium (Ssekyewa et al. 1999). En reportes hechos por Meneses (1990); Fisher et al. (2005b); De Oliveira et al. (2015). Han demostrado que algunas especies de Passifloras son parcialmente afectadas por Fusarium solani, como Pcaerulea L., P sidaefolia M. Roem., P. maliformis L. y P cincinnata Mast., en cambio P nítida Kunth y Palata L., son resistentes al ataque del este patógeno. Emplear especies como P alata L. como como portainjerto en el cultivo del maracuyá mejora la calidad de los frutos y aumenta la precocidad del cultivo y le confiere resistencia ante un exceso de humedad en el suelo (Yamashiro y Landgraff, 1979).
Las Passifloras presentan una gran variabilidad genética natural, estas son características muy importantes para tener en cuenta en programas de mejoramiento (Oliveira et al. 2008). Por lo tanto, se espera aumentar la frecuencia de alelos deseados de resistencia a Fusarium, a través de la recombinación entre las plantas resistentes. La exploración de este conocimiento en programas de mejoramiento genético permitirá emplear estos resultados para el desarrollo de variedades resistentes y así aumentar las zonas aptas para el cultivo y utilizarlos en el manejo de la pudrición del cuello en Passifloraceas en Colombia. Este trabajo permitió realizar una preselección de 6 accesiones que pueden ser clasificadas como resistentes que pueden ser utilizadas en programas de mejoramiento genético en el cultivo de granadilla.