1. Introducción
En la actualidad, la acuicultura es uno de los sectores de producción animal de más rápido crecimiento. Este sector es crucial para mejorar la seguridad alimentaria y la nutrición humana, además de tener un papel cada vez más imprescindible en la lucha contra el hambre (FAO, 2018). Dentro de este sector, el control sexual en los peces, es una de las áreas más importantes de investigación debido a su influencia directa sobre aspectos de manejo, productividad, economia y conservación (Singh, 2013; Jin, Davie y Migaud 2019; Zohar, 2021). Desde hace varios años, investigadores y productores piscícolas buscan explicar y comprender los mecanismos que conducen a la determinación sexual desde etapas tempranas, para asi obtener, benefícios y ventajas productivas - económicas dentro de los sistemas acuicolas (Li y Wang, 2017; Jin et al., 2019). Por lo cual, muchos de los estudios sobre la determinación sexual y diferenciación gonadal de peces están limitadas a algunas especies de interés comercial, siendo aún un área clave de investigación aplicada para la conservación de la mayoría de especies que conforman la biodiversidad íctica (Fernandino y Hattori, 2019).
La determinación del sexo es el mecanismo genético por el cual se define si el individuo será un macho o una hembra. Esto se determina en el cigoto en el momento de la fertilización, mientras que, la diferenciación, inicia después de la eclosión de la larva y absorción del saco vitelino e inicia la formación del tejido gonadal que ha sido determinado por el mecanismo genético. El sexo puede estar determinado por sistemas cromosómicos como XX/XY, ZZ/ZW, XX/X0, ZZ/Z0, XXl, XX2 y XIX2Y o modulado por diferentes genes autosómicos tales como cyp19a1, fox12, figla, dmrtl, sox9, amh, gsdf.
Herramientas moleculares como la reacción en cadena de la polimerasa (PCR) y sus técnicas derivadas como PCR digital, PCR en tiempo real, y técnicas como pirosecuenciación, secuenciamiento del RNA (RNA-seq) y metodologias desarrolladas como RAD-seq han sido utilizadas para conocer y comprender los mecanismos de determinación/ diferenciación sexual en especies como Ictalurus punctatus Rafinesque (Siluriformes: Ictaluridae) [RAD-seq] (Zhang et al., 2019); Scophthalmus maximus L. (Pleuronectiformes: Scophthalmidae) [ddRAD-seq] (Maroso et al.. 2018); Oncorhynchus mykiss Walbaum (Salmoniformes: Salmonidae) [RAD-seq] (Arostegui, Quinn, Seeb, Seeb, Mckinney, 2019); Oreochromis niloticus L. (Perciformes: Cichlidae) [PCR-tiempo real] (Gröner, Höhne, Kleiner, Kloas, 2017; Wei et al., 2019); Danio rerio Hamilton-Buchanan (Cypriniformes: Cyprinidae) [PCR-tiempo real] (Webster et al., 2017); Cyprinus carpio L. (Cypriniformes: Cyprinidae) [PCR-tiempo real] (Anitha et al., 2019) y Clarias gariepinus Burchell (Siluriformes: Clariidae) [PCR-tiempo real] (Santi et al., 2019), sin embargo, debido a la gran biodiversidad y plasticidad de especies de peces, el esclarecimiento de la diferenciación sexual sigue siendo, un área clave de investigación aplicada en la mayoría de las especies, principalmente en especies Neotropicales. En América Latina la investigación sobre los procesos moleculares, celulares, histológicos, o endocrinos implicados en la diferenciación gonadal y los efectos de los factores ambientales son ampliamente desconocidos (Fernandino y Hattori, 2019).
El objetivo de esta revision es brindar información de los principales mecanismos genético-moleculares para el entendimiento de los procesos de determinación y diferenciación sexual en peces teleósteos, además de, motivar a investigadores en realizar futuros estudios que involucren especies de nuestra biodiversidad Neotropical en aras de su conservación. En este sentido, aquí se describe una lista de genes que según la literatura científica desempenan un papel importante en el desarrollo gonadal de peces. Estos genes o mecanismos genéticos-moleculares podrían estudiarse en la biodiversidad íctica del trópico, no solo con interés productivo sino también en aras de la conservación de todas aquellas especies que se encuentran en la lista de los libros rojos de especies marinas y continentales en los diferentes países tropicales.
2. Materiales y métodos
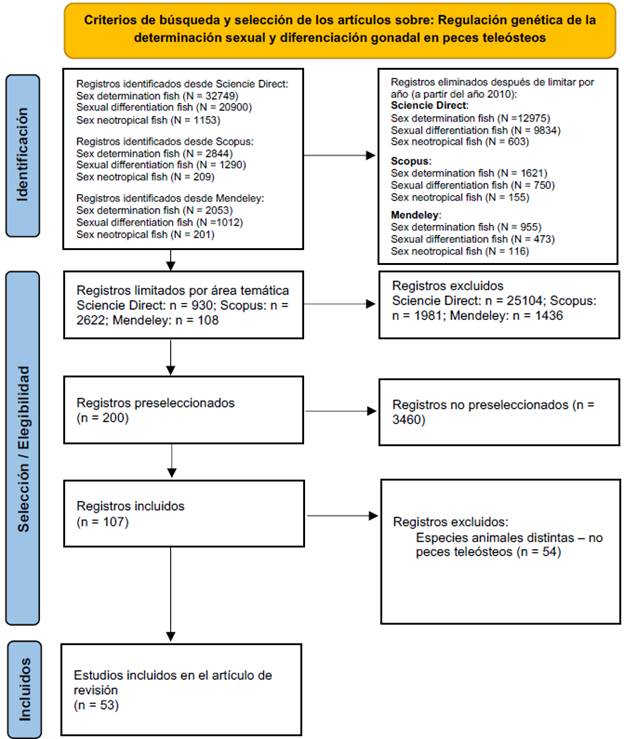
La búsqueda de información bibliográfica se desarrolló por medio de las bases de datos Sciencie Direct, Scopus y Mendeley, utilizando como frases clave: sex determination fish, sexual differentiation fish y sex neotropical fish. La selección de los artículos se realizó llevando en consideración máximo 10 años de publicación (a partir del 2010) y en algunos casos, se hizo la excepción, cuando se encontraron investigaciones que aportaban datos y/o bases de conocimiento relevantes. Adicionalmente, no fueron considerados documentos como tesis de maestria o doctorado (Ver Figura 1 ).
3. Marco teórico
3.1. Determinación sexual
La determinación del sexo en peces se define como el proceso genético que establece el sexo de un organismo (Piferrer, 2001 ; Bahamonde, Munkittrick y Martyniuk, 2013). Es decir, es el control primario que influenciará al proceso de diferenciación gonadal, por lo que, la determinación del sexo ocurre en el cigoto en el momento de la fertilización. En peces, la determinación sexual es un proceso flexible con respecto a los patrones evolutivos observados entre gêneros, familias y especies (Devlin y Nagahama, 2002; Fernandino y Hattori, 2019; Gemmell, Todd, Goikoetxea, Ortega-Recalde y Hore, 2019) y está sujeto a modificaciones por factores externos, por lo que sus mecanismos se agrupan en dos principales categorias, genotipica y ambiental (Devlin y Nagahama, 2002; Fernandino y Hattori, 2019) (Figura 2).
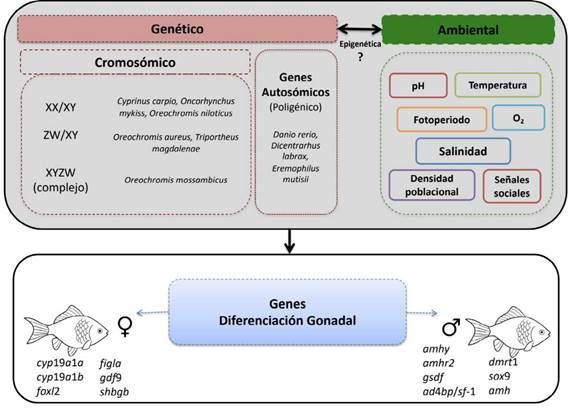
Fuente: Adaptado de (Fernandino y Hattori, 2019).
Figura 2 Determinación y diferenciación genético-ambiental del sexo en peces.
En el proceso de determinación genotipica, el sexo del individuo se establece en la fertilización y en la etapa de fecundación (singamia y anfimixis), generalmente controlado por cromosomas sexuales (Trukhina, Lukina, Wackerow-Kouzova y Smirnov, 2013; Fernandino y Hattori, 2019), sin embargo, la determinación genética del sexo en peces puede involucrar sistemas monogénicos o poligénicos, localizados ya sea en cromosomas sexuales, somáticos o ambos (Pan, Guiguen y Herpin, 2018). Se ha evidenciado que estos sistemas de determinación pueden diferir entre especies estrechamente relacionadas e incluso entre diferentes poblaciones de la misma especie (Pan et al., 2018), por ejemplo, Characidium es el género más diversificado de la familia Crenuchidae, ampliamente distribuida en sistemas de agua dulce de América del Sur con 54 especies reconocidas y aunque la mayor parte de sus poblaciones estudiadas carecen de cromosomas sexuales heteromorfos, se han identificado algunas especies con sistema de determinación sexual cromosómico ZZ/ZW (Vicari, Artoni, Moreira-Filho y Bertollo, 2008).
A nivel general, los cromosomas sexuales albergan genes maestros que determinan el sexo del individuo, y son responsables de la iniciación del proceso de determinación sexual (Gemmell et al., 2019; Pan et al., 2018). Una especie puede tener en sus cromosomas sexuales un solo gen maestro, el cual modula o controla la determinación del sexo, en este caso se le denomina sistema monofactorial; o multiples genes, lo que implica más de dos alelos o bien un locus con múltiples alelos segregantes independientemente, o múltiples loci menores que interactúan a través de epistasis (Biswas et al., 2021 ), en estos casos, el sistema es denominado poligénico (Pan et al., 2018).
La determinación del sexo cromosómico generalmente se establece como XX/XY y ZZ/ZW, pero también es posible que algunas especies carezcan de un cromosoma el cual se denomina XX/X0 o ZZ/Z0 (Siegfried, 2017). Los mamíferos y las aves poseen un sistema heterogamético altamente conservado XX/XY o ZZ/ZW, respectivamente (Pan et al., 2018; Yamamoto, Hattori, Patino y Strüssmann 2019). A diferencia de estas especies, los peces muestran una alta diversidad de sistemas de determinación sexual. Ambos sistemas XY, ZW han sido observados e incluso también exhiben múltiples cromosomas sexuales (XYZ) como es el caso del pez platy Xiphophorus maculatus Günter (Cyprinodontiformes: Poeciliidae) o ningún cromosoma sexual como Apistogramma sp. (Perciformes: Cichlidae) (Bahamonde et al., 2013).
En la Tabla 1 se resumen los sistemas de determinación sexual observados en diferentes especies de peces. La carpa común C. carpio, el guppy Poecilia reticulata Peters (Cyprinodontiformes: Poeciliidae), el medaka Oryzias latipes Temminck y Schlegel (Beloniformes: Adrianichthyidae), la trucha arcoiris (O. mykiss), el espinoso Gasterosteus aculeatus L. (Gasterosteiformes: Gasterosteidae), el pez gato (C. gariepinus) y la tilapia nilótica (O. niloticus), presentan el sistema XX/XY (Santi et al.. 2019: Biswas et al.. 2021); mientras que, especies como la anguila japonesa Anguilla japonica Temminck y Schlegel (Anguilliformes: Anguillidae), la tilapia azul Oreochromis aureus Steindachner (Perciformes: Cichlidae) y la arenca Triportheus magdalenae Steindachner (Characiformes: Characidae), se han identificado con sistema ZZ/ZW (Pan et al., 2018; Valdelamar-Villegas, 2018); y en el pez platy Xiphophorus maculatus y Oreochromis mossambicus Peters (Perciformes: Cichlidae), se han descrito los cromosomas XYZ y XYZW, respectivamente (Devlin y Nagahama, 2002; Wang, Piferrer y Chen, 2019).
Tabla 1 Sistemas de determinación y genes asociados ala diferenciación sexual en pieces
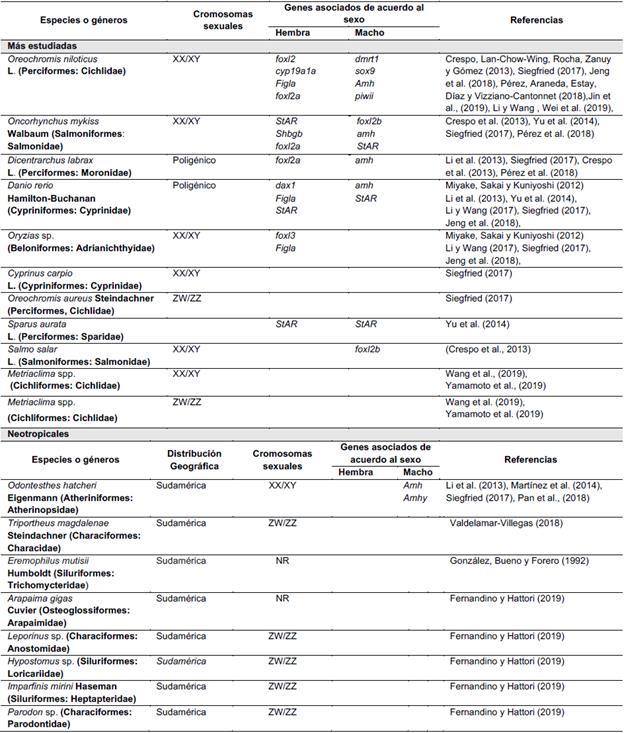
Fuente: Elaboreción propia.
Por otro lado, estudios han mostrado que solo el 7 % de las especies acuícolas muestran cromosomas heteromórficos (Martínez et al., 2014). El pez cebra (D. rerio), lubina Dicentrarhus labrax L. (Perciformes: Moronidae), peces cíclidos africanos (Metriaclima spp.) y el pez Capitán de la Sabana Eremophilus mutisii Humboldt (Siluriformes: Trichomycteridae) carecen de cromosomas sexuales, por lo que la determinación del sexo puede ser modulada por uno o varios genes autosómicos (Gonzalez, Bueno y Forero 1992; Siegfried, 2017; Yamamoto et al., 2019). En el pez cebra y los cíclidos, la determinación del sexo probablemente es el resultado de una combinación de efectos aditivos y epistáticos en varios loci (Moore y Roberts, 2013). En el Capitán de la Sabana, una especie endémica de Colombia (Mojica, Usma, Álvarez-León y Lasso 2012), aún se desconoce el proceso de determinación y diferenciación sexual, por lo que futuros estudios deben realizarse para su determinación, y coadyuvar así a su manejo y conservación.
De acuerdo a lo observado en la Figura 1, el sexo primario de los peces puede estar determinado cromosómicamente y diferenciado ambientalmente, por lo que, la determinación sexual cromosómica en una especie determinada de teleósteo no siempre corresponde con el sexo fenotípico, es decir, la dotación genómica no está directamente relacionada con la definición gonadal fenotípica, debido a cambios o alteraciones producidas como efecto del ambiente (Yamamoto et al., 2019). En este caso, la proporción fenotípica de machos y hembras no son 1:1 y los resultados esperados en relación a las proporciones fenotípicas del sexo son impredecibles (Siegfried, 2017).
Diferenciación gonadal
La diferenciación gonadal en peces, inicia después de la eclosión de la larva y absorción del saco vitelino, con subsecuente formación del tejido gonadal que ha sido determinado por el mecanismo genético. Sin embargo, el patrón genético de la determinación sexual puede ser alterado por el ambiente en un periodo temprano y critico de la gonadogénesis (Devlin y Nagahama, 2002; Fernandino y Hattori, 2019). En los teleósteos existen diversos mecanismos de diferenciación gonadal influenciada por el ambiente, la administración de esteroides sexuales, el cambio de la temperatura o el pH del agua, la salinidad, el fotoperiodo, senales sociales y la densidad poblacional son los principales factores (Gemmell et al.. 2019; Martinez-Bengochea et al., 2020; Biswas et al., 2021). Dichas senales ambientales, son capaces de anular el sexo genético predeterminado o pre-programado y generar cambios irreversibles en el fenotipo sexual o gonadal (Fernandino y Hattori, 2019; Yamamoto et al., 2019). Un ejemplo de este proceso ha sido evidenciado en O. niloticus, en la cual una exposición a altas temperaturas (± 35 °C) favorece la diferenciación gonadal hacia machos fenotipicos, mientras que en temperaturas ambientales de ± 25 °C la diferenciación sexual es más equilibrada en la relación entre sexos (Rodrigues et al.. 2015). Este mecanismo ha sido asociado a la regulación de la expresión de genes a través de mecanismos epigenéticos (Piferrer, 2013). Aquellos procesos epigenéticos incluyen la metilación del ADN, modificación de histonas y no codificación de ARNs (Wang et al.. 2019). Estos mecanismos epigenéticos permiten al organismo integrar factores internos y externos (ambientales) para producir un fenotipo particular o controlar la diferenciación gonadal en los peces (Ribas et al.. 2016;Wang et al.. 2019).
Principales genes que participan en el desarrollo fenotípico sexual de hembras y machos
El fenotipo sexual en los peces está relacionado con los procesos genéticos, moleculares y fisiológicos, donde el primordio gonadal del embrión se diferenciará en ovarios o testiculos (Piferrer, 2001 ; Bahamonde et al.. 2013). La gónada embrionaria (primordio gonadal) en los peces como en las otras clases de vertebrados, es bipotencial y dependiendo de las condiciones genéticas y ambientales durante un periodo específico se diferenciará sexualmente en ovario o testículo (Martinez-Bengochea et al.. 2020).
La diferenciación sexual de los caracteres sexuales secundarios están regulados por la acción de las hormonas esteroides sexuales, debido a la relación entre andrógenos y estrógenos gonadales (Gemmell et al.. 2019). En peces, la hormona II-cetotestosterona (II-CT) y 17-β-estradiol (E2) son el principal andrógeno y estrógeno, producidos por la función ovárica y testicular, respectivamente (Gemmell et al.. 2019; Hayman, Fairgrieve y Luckenbach, 2021 ). La biosintesis de estos andrógenos y estrógenos está regulada por la expresión de una cascada de genes sexuales específicos denominados genes maestros (Jeng et al.. 2018; Burgos-Aceves, Cohen, Smith y Faggio, 2016; Gemmell et al.. 2019). Asi por ejemplo, las vias de producción de E2 o II-CT dependen de la bioconversión de la testosterona (T) y la biotransformación de T en E2 depende de la enzima aromatasa, la cual es codificada por el gen cyp19aIa (Gemmell et al.. 2019). De la misma manera, la enzima II-ß-HSD2 codificada por el gen hsdllb participa en el paso final de la biotransformación de la T en II-CT y la enzima II-ß- hidroxilasa codificada por el gen cypI Ib también está implicada en la via de biosintesis de andrógenos, teniendo mayor participación en la diferenciación de células testiculares (Fernandino y Hattori, 2019; Gemmell et al.. 2019). De esta manera, diferentes genes han sido relacionados con funciones específicas en la diferenciación gonadal en peces como se muestra en la Figura 1.
A continuación, se presenta por separado una descripción corta de los principales genes que participan en el proceso de diferenciación de hembras y machos en peces.
Principales genes que participan en la diferenciación sexual de hembras
Los genes que se han asociado en la literatura como los más importantes en la diferenciación del ovario están: cyp 19, fox1 2 y figla. En la tilapia, por ejemplo, se han identificado genes de enzimas esteroidogénicas (cypI I aI, hscßb, cypI 7aI, cypI 9aI a) y factores de transcripción (fox12 y sfl) asociados con la producción de E2. Estos genes se expresan en el periodo critico (5 dias después de la eclosión) de diferenciación sexual en las gónadas de las hembras (Yu et al.. 2014).
El gen cyp19 es uno de los componentes esenciales de la maquinaria molecular para el desarrollo sexual en hembras (Hu, Xiao.Tian y Meng, 2017; Webster et al.. 2017). Como ejemplificado arriba, cyp19 codifica la aromatasa, una enzima esteroidogénica responsable de biotransformar la T en estradiol (Hu et al.. 2017; Jeng et al.. 2018)
La aromatasa en los vertebrados terrestres es codificada por un único gen (cypI 9) que presenta varios promotores específicos para su regulación en diferentes tejidos (Hu et al.. 2017). Sin embargo, en teleósteos como O. mykiss, O. niloticus, D. rerio, bagre I punctatus, carpa común (C. carpio), medaka japonés O. latipes y anguila Monopterus albus Zuiew (Synbranchiformes: Synbranchidae) se han observado dos isoformas, cyp 19 a I a y cyp 19 a 1 b, cuya presencia se ha asociado a eventos de duplicación cromosómica (Hu et al.. 2017; Li y Wang, 2017; Jeng et al.. 2018).
Según la literatura, estas dos isoformas cyp1 9ª1 a y cyp1 9ª1 b, tienen afinidad por sustratos androgénicos, principalmente testosterona y presentan diferencias en secuencia y expresión. La isoforma cyp19aIa se expresa con regularidad en el ovario en las primeras etapas de desarrollo (Hu et al.. 2017) por lo que es importante para la feminización (Fernandino et al.. 2019), mientras que cyp19aIb se expresa mayoritariamente en el cerebro (Zhang, Zhang, Lu, Zhang y Zhang, 2014; Ramallo, Morandini, Birba, Somoza y Pandolfi, 2017). Según Diotel et al. (2010) la presencia de cyp19aIb en el cerebro de teleósteos también está relacionada con mecanismos de neuroplasticidad y neurogénesis.
La inhibición de la aromatasa evita que haya una conversión de andrógenos a estrógenos (Okubo, Miyazoe y Nishiike, 2019; Martinez-Bengochea et al.. 2020) y con ello se promueve la diferenciación testicular (Fernandino y Hattori, 2019). Este proceso de inhibición o supresión de cyp 19 a I a en peces se logra a través de dos mecanismos, el primero puede ocurrir por metilación del promotor de cyp 19 a 1 a y el segundo por la elevación del cortisol quien suprime directamente la transcripción de cyp19aIa mediante la unión del receptor de cortisol-glucocorticoides (Fernandino y Hattori, 2019; Gemmell et al.. 2019).
De esta manera, la elevación del cortisol puede desencadenar la inversión sexual tipo protogonia (hembra a macho) a través de tres procesos: (a) la diafonia (interferencia) entre las vias de corticosteroides y andrógenos; (b) la inhibición de la expresión de aromatasa a través de la unión del cortisol a los elementos de respuesta a glucocorticoides en el promotor del gen cyp 19 a 1 a; y (c) la depleción de las células germinales primordiales a través de la regulación positiva de amh (gen que codifica la hormona anti-müllerina) (Gemmell et al.. 2019). Por otro lado, cuando las hembras son masculinizadas por medio de tratamientos hormonales con andrógenos, se reprime tanto el gen cyp 19 a I a como el gen fox12, ambos involucrados con la diferenciación temprana de los ovocitos (Bahamonde et al., 2013).
El gen fox12 parece desempenar un papel importante en la diferenciación y el desarrollo de los ovarios en los vertebrados a través de la inhibición de la via de diferenciación gonadal masculina (Zhang et al., 2014). En varias especies de teleósteos se han descrito dos genes parálogos de la familia fox12 [fox12a y fox12b (también denominado fox13)]. Cada uno con diferentes patrones de expresión y en diferentes etapas del desarrollo gonadal en adultos (Crespo, Lan-Chow-Wing, Rocha, Zanuy y Gómez, 2013). La mayoria de los estudios sobre fox12 en teleósteos se han centrado en el papel de fox12a durante la diferenciación ovárica, y en el cambio de sexo de especies protandra y protogina (Crespo et al.. 2013; Pérez et al.. 2018) (Tabla 1). Crespo et al. (2013) observaron que fox12 podria desempenar un papel importante en la esteroidogénesis y en el crecimiento y la maduración del ovario. Durante el desarrollo gonadal temprano de los peces, los estrógenos estimulan la expresión de fox12a y regulan positivamente la transcripción del gen de la aromatasa gonadal cyp19°1 a (Pérez et al.. 2018). Lo anterior explicaria los niveles elevados de expresión detectable de fox12a y cyp 19 a 1 a en el inicio de la diferenciación ovárica observada por algunos autores (Pérez et al.. 2018).
En tilapia, el gen fox12 es un antagonista de la expresión del gen dmrtI (gen involucrado principalmente en el desarrollo testicular), que se expresa especificamente en gónadas indiferenciadas de hembras a los 5 días después de la eclosión, y promueve genes que favorecen el desarrollo de hembras, como el gen cyp19a1 (Okada, Hagihara, Yamashita, Ijiri y Adachi, 2017; Webster et al.. 2017). Igualmente, se ha mostrado que en O. mykiss, los niveles de expresión del gen fox12a y la proteina CYP19AI están positivamente correlacionados (Crespo et al.. 2013). En O. niloticus y D. labrax se ha observado que fox12a se une directamente a los promotores de aromatasa gonadal (cyp 19 a 1 a) y cerebral (cyp 19 a 1 b) para incrementar su transcripción (Crespo et al.. 2013).
Por otro lado, diferentes estudios demuestran que fox12a actúa directamente en el ovario e indirectamente en el eje cerebro-hipófisis-gónada (Crespo et al.. 2013). En varias especies de peces, se ha observado que fox12a se expresa en las células de la granulosa, se une al promotor cyp19aI y activa su transcripción en el ovario (Zhang et al.. 2014; Siegfried, 2017). En D. labrax se han mencionado altos niveles de expresión de fox12 en el eje cerebro-pituitaria-gónada, con un patrón de mayor expresión en hembras, similar a la observada en otras especies de teleósteos (Crespo et al.. 2013) mientras que, en testiculo de peces adultos, la expresión de fox12 es baja durante todo el ciclo reproductivo (Crespo et al.. 2013). Asi mismo, la interrupción de fox12 en tilapia causa la inversión sexual de hembras XX a machos (Webster et al.. 2017). En este proceso, la ausencia de expresión de fox12 resulta en la apoptosis de los ovocitos y disminuye significativamente la expresión del gen y síntesis de la aromatasa (Zhang et al.. 2014). Estos resultados muestran el papel de fox12 en la diferenciación y desarrollo ovárico por el aumento de expresión de cypI 9aI a en teleósteos (Zhang et al.. 2014).
En el caso de fox12b los pocos estudios disponibles sugieren que podría estar implicado en los procesos específicos de la diferenciación gonadal masculina. En O. Mykiss y salmón del Atlántico Salmo salar L. (Salmoniformes: Salmonidae) se ha encontrado alta expresión de este gen en testiculos, por lo que se ha propuesto como un regulador de genes masculinos-específicos (Crespo et al.. 2013).
El gen figla es un factor de transcripción básico que regula genes como zpl, zp2, y zp3 cuyos productos constituyen la matriz extracelular de la envoltura vitelina que rodea a los huevos en teleósteos. Es específico de células germinales y está asociado con el desarrollo y la diferenciación ovárica en los vertebrados (Miyake, Sakai y Kuniyoshi, 2012; Li et al., 2016; Jeng et al.. 2018), incluyendo teleósteos como: O. niloticus, D. rerio, O. latipes y Acanthopagrus schlegelii Bleeker (Perciformes: Sparidae) (Jeng et al.. 2018).
En O. lapites, la expresión de figla se detectó por primera vez en la etapa en que los oogonios se diferencian en ovocitos primarios. En D. rerio ,la expresión de este gen comienza a los 19,5 dias después de la eclosión y se solapa con el inicio del desarrollo ovárico antes de la diferenciación sexual (Miyake et al.. 2012). En individuos de A. japonica feminizados con E2, se ha observado que su expresión se incrementa significativamente durante el desarrollo ovárico (Jeng et al.. 2018). Estos datos sugieren que figla es el gen específico de los ovocitos en fase de foliculogénesis durante la diferenciación sexual (Miyake et al.. 2012), además se ha sugerido que este gen podria desempenar una función clave en el desarrollo ovárico de la tilapia (Jeng et al.. 2018).
Por otro lado, se ha identificado una forma común al gen figla en Cynoglossus semilaevis Günther (Pleuronectiformes: Cynoglossidae), que desempena una función homóloga, llamado figla_tvl; mientras que estudios recientes han encontrado una nueva forma transcripcional, denominada figla _tv2, que puede estar involucrado en la espermatogénesis de pseudomachos (Li et al.. 2016).
Entre otros genes que han sido asociados con el desarrollo sexual de hembras, se ha observado que en O. niloticus, una de las isoformas del gen StAR, StAR2 se expresa abundantemente a partir de 5 dias después de la eclosión de células somáticas de gónadas XX (Yu et al.. 2014). Algunos autores indican que el gen StAR regula el tiempo y la tasa de esteroidogénesis (Hayman et al.. 2021 ; Yu et al.. 2014) y ha sido estudiado en varios teleósteos, como D. rerio, O. mykiss, O. latipes, A. japonica, corvina atlántica Micropogonias undulatus L. (Perciformes: Sciaenidae), ciprinidos de agua dulce Pimephales promelas Rafinesque (Cypriniformes: Cyprinidae), dorada Sparus aurata L (Perciformes: Sparidae), esturión Acipenser transmontanus Richardson (Acipenseriformes: Acipenseridae) y lenguado sereno Solea senegalensis Kaup (Pleuronectiformes: Soleidae) (Yu et al.. 2014).
Por su parte, Anitha et al. (2019) han indicado que el gen zarI desempena un papel esencial durante la transición de ovocitos a embrión y se correlaciona con la expresión de genes que previamente están involucrados en la diferenciación sexual; el gen gdf9 (perteneciente a la superfamilia TGF-ß) quien participa en el desarrollo y diferenciación ovárica (Anitha et al.. 2019). Otras investigaciones sugieren que en la determinación sexual y diferenciación ovárica temprana en O. mykiss está involucrado el gen shbgb, que al parecer es exclusivo de la familia Salmonidae y se expresa principalmente en las células foliculares del ovario (Pérez et al.. 2018).
Principales genes que participan en el desarrollo sexual de machos
A diferencia de las hembras, en el desarrollo gonadal de machos, se han descrito roles importantes de los genes dmrtI, sox9, amh, gsdf, amhy y amhr2. De acuerdo a evidencias de investigaciones, el gen dmrtI junto con sox9 son factores clave para iniciar y asegurar la diferenciación sexual masculina y por ende el desarrollo testicular en muchas especies de peces (Miyake et al.. 2012).
En O. niloticus, dmrtI y sox9b se expresa en las células de Sertoli y células epiteliales del conducto deferente durante la diferenciación gonadal (Banh, Domingos, Zenger y Jerry 2017; Webster et al.. 2017;Wei et al.. 2019) también, se expresan a los 6 dias después de la eclosión en gónadas no diferenciadas de machos (Okada et al.. 2017) y de acuerdo a la literatura, la caida en la expresión de dmrtI conlleva a regresión testicular, por tanto, la inactivación de dmrtI en los machos XY resulta en el cambio de sexo en peces teleósteos (Wei et al.. 2019). En este sentido, en los procesos de reversión sexual, el tratamiento con E2 induce la inhibición de la expresión de dmrtI, generando regresión testicular y promoviendo el desarrollo del ovario (Jeng et al., 2018). En O. niloticus, investigaciones han encontrado que dmrtI es antagonista del gen cyp19aIa (Webster et al.. 2017). Estas evidencias de antagonismo entre dmrtI y cypI 9a I a explicarian el por qué, el tratamiento con E2 provoca regresión testicular. Asi mismo, se han observado relaciones de antagonismo entre los genes dmrtI y figla. En estudios con Halichoeres poecilopterus Richardson (Perciformes: Labridae) una vez que inicia el proceso de cambio del sexo, el ARNm de figla disminuye y el ARNm de dmrtI aumenta con la progresión en la degeneración de los ovocitos e inicio de la espermatogénesis (Miyake et al.. 2012).
En O. niloticus. Dmrt1 precede algunos signos morfológicos de diferenciación sexual específica para machos, incluyendo la linea germinal; sin embargo, en otras especies la expresión de dmrtI se correlaciona con el inicio de la diferenciación sexual somática de los testiculos, pero no se expresa anteriormente durante la linea germinal. Por tal motivo dmrtI puede tener un papel conservado en la diferenciación sexual de las estructuras somáticas y, en algunas especies, influye en la diferenciación sexual de la linea germinal (Siegfried, 2017).
Para el caso del gen sox9, en los peces teleósteos se ha encontrado dos genes co-ortólogos: sox9a y sox9b (Jeng et al.. 2018; Wei et al.. 2019; Lin et al.. 2021) y aparentemente, su expresión no se relaciona tipicamente con el inicio de la diferenciación sexual en la linea germinal, pero si con el inicio de la formación de túbulos seminiferos en varias especies de peces, lo que sugiere que sox9 puede tener un papel conservado en este proceso (Siegfried, 2017).
En O. niloticus, investigaciones describen que sox9a y sox9b presentan alta expresión en las primeras etapas de desarrollo (5 y 30 días) y se expresan específicamente en el testículo en las últimas etapas (90 y 180 días) (Wei et al.. 2019). Asi mismo, hallazgos de Wei et al. (2019) en O. niloticus demuestran que dmrtI regula positivamente la transcripción del gen sox9b mediante la unión especifica dentro del promotor de sox9b, por lo que, una caída significativa de dmrt1 también disminuye la expresión de sox9b en el testiculo.
Otros genes que se han catalogado como importantes en la diferenciación gonadal en peces machos, son los genes amh, gsdf, amhy y amhr2 .Estudios han determinado que amh es contribuyente importante en la regulación de la determinación del sexo en especies de teleósteos como D. labrax. D. rerio. O. latipes, pejerrey Odontesthes microlepidotus Girard (Atheriniformes: Atherinopsidae) y Takifugu rubripes Temminck y Schlegel (Tetraodontiformes: Tetraodontidae) (Li et al.. 2013; Siegfried, 2017). Este gen se expresa exclusivamente en las gónadas y su papel es sustancial en la diferenciación normal de las estructuras reproductivas. Al parecer, su expresión comienza en las células de la granulosa, pero también se ha observado en las células pre-Sertoli y Sertoli, además, su expresión permanece durante la edad adulta (Li et al.. 2013; Siegfried, 2017).
Genes ortólogos de amh han sido estudiados en especies como O. mykiss, D. rerio y O. niloticus. Los resultados han evidenciado que exhiben un patrón de expresión conservada (Li et al.. 2013), mientras que, los genes gsdf. amhy y amhr2 son miembros de la familia TGF-β involucrada en la senalización de la proliferación celular (Hayman et al.. 2021). amhy (especifico para el cromosoma Y) se expresa en las células de Sertoli de los machos XY de pejerrey Odontesthes hatcheri Eigenmann (Atheriniformes: Atherinopsidae). En T. rubripes. amhr2 (receptor de hormona antimülleriana tipo 2) se expresa en células somáticas que rodean a las células germinales y sdY (gen sexualmente dimorfo en el cromosoma Y) está vinculado al locus sexual de los salmónidos y es necesario y suficiente para inducir la diferenciación testicular (Martinez et al.. 2014).
Otro gen que participa en el desarrollo y diferenciación testicular es ad4bp/sf -I, el cual es critico para la regulación transcripcional de cypI 9aI a y otros genes que codifican enzimas esteroidogénicas (Anitha et al.. 2019). Se ha reportado que en O. niloticus las dos isoformas StAR (SARI y StAR2) se detectan 30 dias después de la eclosión hasta la edad adulta (Yu et al.. 2014).
Los genes de la familia piwi (piwilI y piwil2) han sido observados en los espermatocitos de O. niloticus (jin et al.. 2019), sin embargo, a pesar de la importancia aparente de los miembros de esta familia en las células de la linea germinal en diversas especies, se sabe poco acerca de sus caracteristicas moleculares.
Existen otros genes conservados que se han estudiado por su relación con funciones criticas en el desarrollo sexual, potencialmente asociados con la diferenciación gonadal en peces y que requieren mayores estudios para especificar su participación en la diferenciación de ovario o testiculos, entre estos genes están ad4bp/sf-I, daxI, gata4, mis, sox3, StAR, wtI. cyp17. hsd3b.y hsdIIb. dmrt2a. dmrt2b. sycpI y fstl3 (Anitha et al.. 2019).
Aplicabilidad en acuicultura y/o conservación
El entendimiento de todos estos mecanismos moleculares en el proceso de determinación/diferenciación sexual en las diferentes investigaciones, se ha basado principalmente en el estudio de expresión génica, inicialmente con técnicas como PCR en tiempo real (RT-PCR) y PCR digital. En los últimos años, nuevas tecnologias para el estudio de transcriptomas (RNA-sequencing) se han ido implementando para describir el patrón coordinado de expresión de genes en la diferenciación sexual en teleósteos. Asi mismo, otras plataformas moleculares han sido empleadas para investigar este proceso. Plataformas como RAD-Seq y metodologias de secuenciación derivadas de esta técnica (2b-RAD, ddRAD, ezRAD y SLAF-seq) han sido utilizadas en estudios genéticos en acuicultura. Utilizando estas plataformas, diferentes loci se han asociado con la determinación del sexo en Sebastes carnatus jordan y Gilbert (Scorpaeniformes: Sebastidae) y Sebastes chrysomelas jordan y Gilbert (Scorpaeniformes: Sebastidae) (Fowler y Buonaccorsi, 2016). Sin embargo, hasta el momento hay varias incógnitas en los procesos de determinación del sexo y diferenciación gonadal de la mayoria de las especies de teleósteos. Autores han mencionado que refinamientos adicionales mediante el análisis simultáneo con RNA-seq, metilomas (secuenciación de bisulfito de genoma completo, BS-seq) y accesibilidad de la cromatina (nucleosoma de una sola célula, metilación y la secuenciación de la transcripción, scNMTseq) generará nuevas hipótesis de como la migración de nuevas células gonadales primordiales a medida que se continúa buscando componentes del mecanismo desencadenante utilizado en teleósteos para alterar el destino sexual (Gemmell et al.. 2019).
Es importante resaltar que a pesar de que la ictiofauna Neotropical representa uno de los ecosistemas más diversos y extremos del mundo, la información sobre los peces Neotropicales es restringida a pocas especies (de Siqueira-Silva, Da Silva Rodrigues y Nóbrega, 2019). El conocimiento sobre la determinación del sexo y la diferenciación de gónadas en peces neotropicales es muy escaso. Se han realizado algunos estudios sobre la caracterización de cromosomas sexuales, especialmente en peces tropicales de América del Sur (Gonzalez et al.. 1992;Valdelamar-Villegas, 2018; Fernandino y Hattori, 2019) (Tabla 1), sin embargo, la investigación sobre estudios moleculares, relacionados a la determinación del sexo y la diferenciación gonadal en peces tropicales aun es poco conocida. Intentos para identificar marcadores genéticos ligados al sexo o cromosomas sexuales en una de las especies más grandes que habitan principalmente el rio Amazonas, el pirarucu Arapaima gigas Cuvier (Osteoglossiformes: Arapaimidae) han sido realizados sin obtener éxito (Fernandino y Hattori, 2019).
En ambientes de agua dulce de América del sur, varias especies icticas están dentro del libro rojo como especies endémicas y amenazadas. En Colombia, dentro de estas especies podemos destacar a Eremophilus mutissi Humboldt (Siluriformes: Trichomycteridae), el cual ha mostrado signos claros de disminución debido a la pérdida de hábitat, la sobrepesca y la intro-ducción de especies exóticas (Mojica et al.. 2012). En este escenario, la caracterización de la estructura genética poblacional y fenotipica, asi como el control del sexo de estas especies podria ser una de las áreas relevantes a ser urgentemente explorada en la búsqueda de su conservación. Una estrategia podria ser el apoyo en investigación básica para encontrar genes determinantes del sexo o marcadores asociados a procesos de adaptabilidad a través de plataformas de secuenciación como RAD-seq y RNA-seq que permitan una exploración notablemente acelerada y optimizada.
Conocer los mecanismos de determinación del sexo y la diferenciación gonadal de manera temprana, permitirá acelerar procesos como formación de linajes monosexos para obtener animales de mayor tamaño y/o evitar gastos energéticos en procesos reproductivos en sistemas de producción. Por otro lado, actualmente, se han introducido especies de manera ilegal a diferentes paises y en algunos casos se está evaluando, la legalización de dichas especies foráneas, sin embargo, la introducción de especies foráneas puede conllevar a efectos graves de alteración ecosistémica y por ende generar fuerte impacto sobre la biodiversidad y el medio ambiente. Comprender los mecanismos de determinación del sexo y la diferen-ciación gonadal, abre la posibilidad de disminuir posibles impactos ambientales al desarrollar estas lineas monosexo y/o estériles que no afecten la estructura genética y la biodiversidad de las especies Neotropicales.
4. Conclusiones
Desde el punto de vista genético, el sexo en teleósteos puede estar determinado por sistemas cromosómicos como XX/ XY, ZZ/ZW, XX/X0 y ZZ/Z0 o simplemente modulado por diferentes genes autosómicos como cypI 9aI, fox12, figla, dmrtl, sox9. amh. gsdf. ad4bp/sf-I. daxI , gata4. mis. sox3. StAR. wtI. Cyp1 7, hsd3b. y hsdI I b. De esta manera, la diferenciación del sexo de cada especie de teleósteo puede ser controlado por un determinado gen o sistema cromosómico diferente. No obstante, debido a su gran diversidad, la alta plasticidad y dependencia con el medio ambiente, la generación de un sistema modelo para el entendimiento del control del sexo en peces sigue siendo un desafio, particularmente cuando se busca comprender los mecanismos genético-moleculares. Por otro lado, la mayoria de los estudios realizados para entender y explicar la determinación y diferenciación del sexo en especies icticas se han realizado sobre especies de interés comercial por lo que, es grande la deficiencia de estudios relacionados con la ictiofauna Neotropical. Para muchas especies Neotropicales, debido a su condición de vulnerabilidad, es urgente la implementación de programas de conservación y, por tanto, es imprescindible fortalecer la investigación en esta área como herramienta de direccionamiento en los procesos de su conservación.
Estos genes o mecanismos genéticos-moleculares podrian estudiarse en la biodiversidad ictica del trópico, no solo con interés productivo sino también en pro de la conservación de todas aquellas especies que se encuentran en la lista de los libros rojos de especies marinas y continentales en los diferentes paises tropicales.