1. Introducción
El Agrandamiento gingival (AG) o hipertrofia gingival es el aumento patológico localizado o generalizado del volumen de la encía (Beaumont, Chesterman, Kellett, Durey, 2017). Esta alteración es asociada con la ingesta prologada de medicamentos, principalmente anticonvulsivantes, inmunosupresores y los bloqueadores de los canales de calcio (Manzur-Villalobos, Díaz-Rengifo, Manzur-Villalobos, Díaz-Caballero, 2018). También se ha relacionado con diversos síndromes (Simancas-Escorcia, Berdal, Díaz-Caballero, 2019) y como efecto no deseado del tratamiento ortodóntico (Zanatta et al., 2012). En este último proceso es conocido como agrandamiento gingival inducido por tratamiento de ortodoncia (AGTO).
Estudios señalan que el AGTO puede iniciar a partir del primer mes después de haber debutado el tratamiento (Cacciola y Gómez, 2018). La prevalencia de esta patología asciende a un 55% de acuerdo a la población de estudio (Rapone et al., 2019). Sin embargo, su patogenia es desconocida, aunque factores como la acumulación de biofilm bacteriano, el estrés mecánico y la corrosión de las bandas de ortodoncia, son elementos referidos como iniciadores de esta condición patológica (Bandeira, Martinez, Demasi, 2020).
En condiciones fisiológicas, el epitelio gingival constituye una barrera que protege de agentes y fuerzas externas, las estructuras internas de la encía. Para conferir esta capacidad mecánica y resistir a las tensiones, las células epiteliales se interconectan mediante filamentos intermedios, principalmente las citoqueratinas (CK) (Kolsch et al., 2010). Las CK, incluida la CK-14 y la CK-19, constituyen una familia de proteínas multigenéticas que regulan e interactúan con otras proteínas celulares para inducir respuestas durante los procesos de crecimiento y migración de las células epiteliales (Kolsch et al., 2010). En este contexto, el presente estudio tuvo como objetivo identificar la distribución inmunohistoquímica de las CK-14, CK-19 y Ki-67 (marcador de proliferación celular) en el epitelio gingival de pacientes con agrandamiento gingival inducido por tratamiento de ortodoncia.
2. Marco teórico
El tejido gingival de pacientes con AGTO se caracteriza por un engrosamiento de las capas epiteliales, muchas de ellas fusionadas entre sí (Drâghici et al., 2016). Estudios previos realizados por el equipo de trabajo, sugieren que las prolongaciones epiteliales alargadas o fusionadas presente en el AGTO, pueden ser el resultado de una mayor plasticidad del epitelio gingival relacionado con el proceso biológico de transición epitelio mesénquima (EMT) (Simancas-Escorcia, Carmona-Lorduy, Díaz-Caballero, 2021). En la EMT, las células epiteliales adquieren un fenotipo mesenquimatoso, experimentan modificaciones morfológicas y aumenta su capacidad de migración (Lavin y Tiwari, 2020). La EMT ha sido igualmente reportada en pacientes AG por medicamentos. En estos pacientes, se ha indicado una pérdida gradual de la adhesión celular, integridad de la membrana basal y la presencia de fibrosis (Rapone et al.. 2019; Yang et al., 2017). Asimismo, se ha reportado la sobreexpresión de Ki-67, un marcador asociado a la proliferación celular en el tejido epitelial de pacientes con AG (Afonso et al., 2014).
En pacientes con AGTO, donde se hipotetiza que el aumento de las interacciones entre las células del tejido epitelial y conectivo son fundamentales, la expresión y el rol de las CK ha sido escasamente abordado. La evidencia científica indica que el ciclo de ensamblaje de las CK es un mecanismo esencial para la plasticidad del tejido epitelial, confiriéndole una rápida adaptación, especialmente en los procesos de crecimiento y proliferación celular (Kolsch et al., 2010). De hecho, se ha demostrado que las CK experimentan una reorganización, particularmente en respuesta a la presencia de tensiones mecánicas (Cheah et al., 2019).
3. Materiales y métodos
Fueron seleccionados 13 sujetos que habían sido remitidos al Centro de Referencia de Hipertrofia Gingival de la Facultad de Odontología de la Universidad de Cartagena para su observación, diagnóstico y manejo quirúrgico periodontal. Se establecieron dos grupos. El primero, integrado por individuos periodontalmente sanos no portadores de aparatología ortodóntica (control: n=6) con requerimientos de alargamiento coronal por razones protésicas y/o estéticas. El segundo, estuvo formado por pacientes diagnosticados con AGTO (Afectados: n=7) de acuerdo a los criterios señalados por Pinto et al., 2017. Estos pacientes eran portadores de tratamiento de ortodoncia (>i año), presentaron un AGTO generalizado (>30 en la boca) tanto en encía marginal como interdental. Su extensión no excedió el 1/3 de la corona clínica. Al momento del estudio, todos los participantes seleccionados eran sistémicamente sanos, mayores de i8 años y dieron por escrito su consentimiento para participar. Se excluyeron los sujetos bajo tratamiento farmacológico con antihipertensivos, anticonvulsivantes e inmunosupresores. No fueron tenidos en cuenta los sujetos fumadores, en estado de embarazo y aquellos que habían sido sometidos a intervenciones quirúrgicas o tratamientos periodontales inferiores a 1 año.
Antes de proceder a la intervención quirúrgica, los participantes fueron objeto de una fase higiénica periodontal donde se les redujo la carga bacteriana mediante instrumentación ultrasónica y manual de los cálculos dentales. Este procedimiento garantizó un índice de placa O'Leary < 15%. Las biopsias de los tejidos gingivales de los sujetos sanos fueron obtenidas luego de una cirugía de alargamiento coronal. En los pacientes con AGTO, el procedimiento quirúrgico fue la gingivectomía. Todos los procedimientos se realizaron bajo anestesia infiltrativa con Lidocaína 2% y epinefrina 1:80000, previas incisiones a bisel externo e intrasulcular con bisturí Bard Parker número 3 y hoja N°15. Una evaluación a los 7 y 14 días posterior a los procedimientos, permitió constatar la cicatrización tisular dentro de lo esperado, la ausencia de complicaciones y satisfacción de los pacientes.
Procesamiento de tejidos
Luego de retirar el tejido gingival, las biopsias fueron sumergidas y lavadas en solución salina tamponada con fosfato (PBS iX, Gibco) e inmediatamente fijadas en paraformaldehído al 4% por 48 horas. Para su inclusión en parafina, las muestras se deshidrataron en baños de etanol (30%, 60%, 80%, 95%, 100%) y xileno (Leica Biosystems) durante 5 minutos cada uno. Los tejidos fueron cortados con un espesor de 5 mm en un micrótomo Leica RM2i25 RST y recuperados en portaobjetos de adhesión con polisina (Thermo Scientific).
Inmunohistoquímica
Inicialmente, los tejidos fueron desparafinados en xileno (Leica Biosystems) y rehidratados en etanol (100%, 95%, 80%, 60%, 30%). Para la recuperación antigénica, se utilizó una solución de citrato pH6 durante 20 minutos a 97°C. El bloqueo de la peroxidasa endógena fue realizado con peróxido de hidrogeno al 3% durante i5 minutos a temperatura ambiente. Después, los cortes fueron incubados con suero normal de caballo (Vector Laboratories) durante 30 minutos, seguidos de la incubación con los anticuerpos primarios anti-citoqueratina 14 (Mouse monoclonal antibody, dilución 1:500, clone LL002, Novus Biologicals), anti-citoqueratina i9 (Rabbit polyclonal antibody, dilución i:400, clone RCKi08, Novus Biologicals) y anti-Ki/MKI67 (Rabbit polyclonal antibody, dilución 1:300, Novus Biologicals) a 4°C durante toda la noche.
Al día siguiente, se procedió a realizar 3 lavados durante 5 minutos cada uno, utilizando una solución salina tamponada con Tris (TBS iX, Gibco) + 0.05% de monolaurato de polioxietilen (20 sorbitano o Tween®20). Inmediatamente, los cortes fueron incubados con el anticuerpo secundario biotinilado anti-mouse/anti-rabbit, Vector Laboratories y con el sistema Vectastain® ABC (Vector Laboratories) por 30 minutos cada uno a temperatura ambiente. Las reacciones se pusieron en evidencia mediante una solución de sustrato de la peroxidasa (4 minutos). Los cortes fueron contracoloreados con Hematoxilina de Mayer durante 45 segundos para visualizar los núcleos. Finalmente, las láminas con los cortes se sumergieron en agua destilada, etanol graduado (70%, 95% y 100%), xileno y fueron montados con un medio de montaje anhidro (DPX, Sigma-Aldrich). La inmunodetención de la CK-i4 y CK-i9 fueron consideradas positivas al observar una coloración marrón citoplasmática de las células del epitelio gingival. Mientras que el marcaje positivo para Ki-67 fue localizado a nivel nuclear. Todas las observaciones se llevaron a cabo en un microscopio óptico Leica DM 500.
Declaración de los aspectos éticos
Este trabajo contó con la aprobación del comité de ética en investigaciones de la Universidad de Cartagena. El registro de los datos personales, estados clínicos y diligenciamiento del consentimiento informado incluyeron los principios contemplados en la última revisión de la Declaración de Helsinki y la Resolución 008430 de 1993 emanada del Ministerio de Salud de Colombia.
4. Resultados
El 60% de los sujetos participantes evaluados en este trabajo fueron del sexo femenino. En el grupo de afectados el promedio de edad fue 20,8 años y 22,8 años en el grupo control. La evaluación histológica de los tejidos gingivales de los sujetos sanos señaló un epitelio escamoso estratificado queratinizado bien organizados y sin signos aparentes de alteración. Fue identificada un estrato basal formado por células dispuestas en palizadas y perpendiculares a la membrana basal. Esta última, fue continua y sin signos visuales de modificaciones. La contra-coloración con hematoxilina de Mayer permitió la visualización de células epiteliales bien organizadas, con núcleos definidos, redondos u ovalados (Figura 1.A, B; Figura 2. A, B). En pacientes con AGTO, el epitelio fue hipertrófico, denso, con un notable aumento de cada estrato celular y engrosamiento de las prolongaciones epiteliales. Morfológicamente, estas células fueron ovaladas y con núcleos bien definidos. Algunas de estas células, presentaron citoplasmas anormalmente aumentado de tamaño, este aspecto morfológico les otorgaba a las células una forma de 'globo', evocando un aparente estado de vacuolización citoplasmática. En todos los pacientes con AGTO se identificó la pérdida en la integridad de la membrana basal (Figura 1. C, D; Figura 2. C, D).
La detección inmunohistoquímica de la CK-i9 fue puesta en evidencia en los individuos sanos y pacientes con AGTO. En los tejidos gingivales de los sujetos periodontalmente sanos, hubo una ausencia de marcaje inmunohistoquímico en el tejido epitelial de dos participantes. Sin embargo, en cuatro sujetos fue identificado casi de manera exclusiva una expresión positiva de la CK-19 en las células del estrato basal (Figura 2. A, B). Por su parte, la inspección visual puso en evidencia una inmunoexpresión positiva de alta intensidad de CK-i9 en el estrato basal de los pacientes con AGTO en comparación con los individuos periodontalmente sanos. Este marcaje también pudo ser constatado en escasas células de la capa espinosa del epitelio gingival de los pacientes con AGTO (Figura 2. C, D).
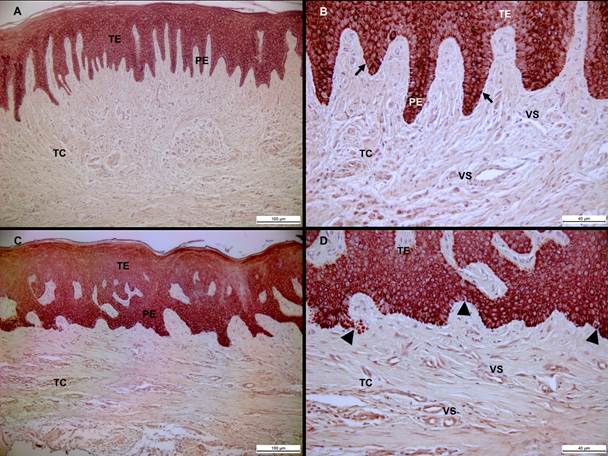
Fuente: Elaboración propia
Figura 1 Localización inmunohistoquímica de la Citoqueratina I4 en tejido gingival. Epitelio gingival de individuo periodontalmente sano con lamina basal continua (flecha negra) (A, B). Epitelio gingival de paciente con AGTO (C, D). Nótese la fusión de las prolongaciones epiteliales (PE) y la perdida de continuidad de la membrana basal (triangulo negro) en pacientes con AGTO. TE: tejido epitelial; TC: tejido conjuntivo. VS: vasos sanguíneos. Barra negra: I00 um (A, C) y 40 um (B, D).
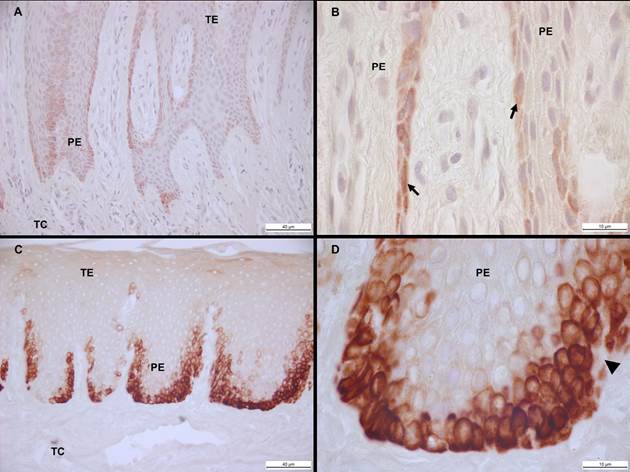
Fuente: Elaboración propia
Figura 2 Expresión de la Citoqueratina 19 en tejido gingival. Epitelio gingival de sujeto periodontalmente sano. Flecha negra indica células basales positivas la CK-19 (A, B). Epitelio gingival de paciente con AGTO. Triangulo negro denota pérdida de la integridad de la membrana basal (C, D). TE: tejido epitelial; TC: tejido conjuntivo; PE: prolongación epitelial. Barra negra: 40 um (A, C) y I0 um (B,D).
Por su parte, el potencial proliferativo de las células epiteliales de los pacientes con AGTO fue puesta en evidencia mediante la expresión inmunohistoquímica del marcador Ki-67. La encía de todos los sujetos periodontalmente sirvieron de control. La inmunoreactividad nuclear para Ki-67 fue fácilmente identificada en todo el tejido epitelial de ambos grupos de sujetos participantes en este estudio. Sin embargo, la localización de la inmunotinción fue notoriamente constatada en las células epiteliales pertenecientes al estrato basal de los pacientes con AGTO portadores de ortodoncia (Figura 3).
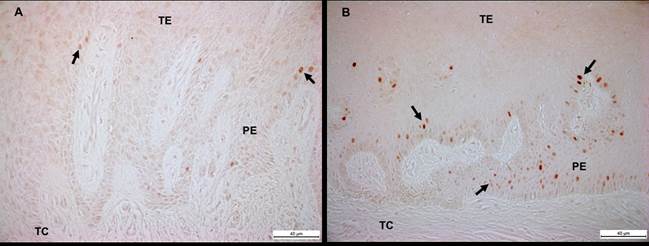
Elaboración propia
Figura 3 Detección de Ki-67 en células sometidas a división celular en epitelio gingival de individuo sano (A) y paciente con AGTO (B). TE: tejido epitelial; TC: tejido conjuntivo; PE: prolongación epitelial. Barra negra: 40 um (A, B). Fuente:
Un resumen de la expresión inmunohistoquímica de la CK-14, CK-19 y Ki-67 es presentada en la Tabla 1.
Tabla 1 Inmunoexpresión de CKI4, CKI9 y Ki67 en sujetos sanos y con AGTO
| CK-14 | CK-19 | Ki-67 | |
| Control 1 | + + | 9% | |
| Control 2 | + + | + | 18% |
| Control 3 | + + | + | 14% |
| Control 4 | + + | 10% | |
| Control 5 | + + | + | 16% |
| Control 6 | + + | + | 15% |
| Paciente 1 | + + + | + + + | 60% |
| Paciente 2 | + + | + + + | 65% |
| Paciente 3 | + + + | + + + | 58% |
| Paciente 4 | + + + | + + | 42% |
| Paciente 5 | + + + | + + + | 54% |
| Paciente 6 | + + | + + + | 62% |
| Paciente 7 | + + | + + + | 53% |
Fuente: Elaboración propia
5. Discusión
Este estudio reporta algunos cambios histológicos del tejido gingival en pacientes sometidos a movimientos ortodónticos. Aquí se confirma que este tratamiento dental correctivo parece al menos, en parte ser responsable del AG, comprobando así, resultados previos que informan sobre el efecto del tratamiento ortodóntico sobre el periodonto (Cacciola y Gómez, 2018). Incluso, investigaciones señalan que el tratamiento ortodóntico puede impactar negativamente en la calidad de vida relacionada con la salud oral de los pacientes que padecen AGTO (Zanatta et al.. 2012). Empero, el conocimiento fisiopatológico de los cambios gingivales presente en el AGTO ha sido escasamente abordado. Por lo tanto, un estudio que pretendiera comprender estos procesos, principalmente las proteínas estructurales afectadas, era esencial. Así, el presente trabajo de investigación permitió la identificación inmunohistoquímica de estructuras del citoesqueleto del epitelio gingival, puntualmente de CK-i4 y CK-i9 y la expresión de un marcador de proliferación celular (Ki-67) en el tejido gingival de pacientes con AGTO.
Este estudio, puso en evidencia por primera vez, de acuerdo a la búsqueda bibliográfica realizada, la expresión inmunohistoquímica de la CK-14 y CK-19 en pacientes con AGTO. Se ha informado que estas citoqueratinas son proteínas cito-esqueléticas cuyas funciones principales son la organización estructural de la célula, sostén y el establecimiento de uniones celulares que mantienen la correcta integridad tisular (Deo y Deshmukh, 2018). La CK-14 y CK-19 tienen funciones reguladoras en procesos de migración, apoptosis y proliferación celular (Dmello et al., 2019). De hecho, Kim et al., 2007, demostraron en un estudio experimental la interacción de algunas CKs con subunidades de Eukaryotic elongation factor-i (eEFi). La eEFi es un factor implicado en la elongación de cadenas peptídicas durante la traducción de ADN, cuya interacción con las citoqueratinas, regularía la síntesis de proteínas en células epiteliales. Por ello, cuando se interrumpe o estimula la interacción entre CKs y eEFIBy se altera el proceso de traducción y la producción de proteínas.
Una sobre-expresión de las CK, como la identificada en los pacientes con AGTO, podría sugerir un desequilibrio en la formación de este complejo. Aunque el presente estudio no evaluó la interacción CKs/eEFiBy, sería pertinente explorar la relación entre eEFIBy-citoqueratina i4/i9 y su posible participación en la patogénesis del AGTO.
La generación de alteraciones en el periodonto en pacientes con tratamiento de ortodoncia parece ser directamente proporcional con la duración del mismo, reacciones celulares debido a las fuerzas inducidas y, materiales como bandas o adhesivos resinosos (Bandeira et al., 2020). En efecto, Pinto et al., 2017, reportaron que las posibilidades de desarrollar AG durante el tratamiento ortodontico incrementaba con el tiempo. Aunque el factor tiempo no fue una variable tenida en cuenta en el presente trabajo de investigación, todos los pacientes con AGTO tenían al menos un año de haber iniciado el tratamiento de ortodoncia. Es probable que el factor tiempo, incida de manera directa en las modificaciones epiteliales y del tejido conectivo gingival, tal como lo demuestran estudios en modelos animales (Jue et al.. 2014). De otra parte, el níquel, agente corrosivo utilizado en aditamentos ortodónticos, parece estimular procesos celulares que van desde proliferación celular hasta mecanismos de apoptosis. Su acumulación en los tejidos epiteliales y la inducción a la proliferación de queratinocitos podría desencadenar una respuesta de hipertrofia gingival en pacientes con aparatología ortodóntica. Sin embargo, actualmente no se ha reportado posibles diferencias en la acumulación de níquel entre pacientes con AGTO e individuos periodontalmente sanos con ortodoncia (Gómez Arcila et al., 2014).
Una expresión inmunohistoquímica de la CK-i4 fue evidente en el epitelio gingival de pacientes con AGTO. La CK-i4 es considerada una mediadora en procesos de diferenciación celular e incluso, como reguladora en los mecanismos de proliferación de células epiteliales. Se ha establecido que la displasia de células epiteliales está inversamente relacionada con la expresión de CK-i4. Una expresión reducida de CK-i4 se relaciona con una mayor probabilidad en desarrollar cambios displásicos. Lo anterior, indicaría que en condiciones fisiológicas (procesos proliferativos y estructurales de los queratinocitos) la CK-i4 mantendría un equilibrio. Por su parte, la ausencia del marcaje de la CK-i4 se relaciona con señales moleculares fundamentales en la interpretación de procesos malignos (Alam et al., 2011). El marcaje positivo de la CK-i4 en los pacientes con AGTO pone de manifiesto que las modificaciones celulares del epitelio gingival parecen no estar relacionada con procesos malignos. Sin embargo, en estos pacientes fue evidente encontrar de manera sistemática una ruptura en la integridad de la lámina basal. Este hallazgo histológico es frecuentemente observado en el proceso de transición epitelio mesénquima (EMT), incluso en pacientes con AGTO (Simancas-Escorcia et al.. 2021).
Por otro lado, la CK-i4 puede intervenir en la proliferación celular, gracias a la interacción con otras moléculas coadyuvantes que fortalecen este proceso. Entre ellas, los receptores intracelulares que interactúan con la proteína quinasa 4 (RIPK4), quienes al igual que las CK son expresados por el factor p63 (Urwyler-Rósselet et al., 2018). Ambas proteínas, realizan su intercambio en el estrato basal del tejido epitelial durante la diferenciación de los queratinocitos (Sümer, Boz, Dinçer, 2019). Estas interacciones demostrarían la importancia de la CK-i4 en el mantenimiento de la homeostasis del tejido epitelial y su posible intervención en procesos patológicos como el AGTO. Asimismo, algunos reportes señalan un incremento en la expresión de la CK-i4 en pacientes que padecen de inflamación sub-epitelial (Kaminagakura et al., 2006). Sin embargo, la relación entre CK-i4 y células inflamatorias no ha sido completamente dilucidada, aunque se ha puesto en evidencia el rol de patógenos periodontales y la participación de citocinas inflamatorias en el inicio y desarrollo del AGTO (Alshahrani et al., 2020). En los pacientes analizados aquí, no se percibió un infiltrado inflamatorio crónico, seguramente por haber incluidos sólo pacientes con un buen estado de salud periodontal en ambos grupos de estudio.
Reportes señalan que la CK-i9 se encuentra principalmente en tejido epitelial simple. Sin embargo, su expresión en tejido escamoso estratificado queratinizado es indicativo de una actividad celular proliferativa, tal como ha sido observado en los pacientes con AGTO. De hecho, en el presente estudio fue observado un aumento importante de núcleos celulares positivos para el marcador de proliferación celular Ki-67 en todos los sujetos con AGTO. Estos hallazgos están en concordancia con resultados reportados en grupos de pacientes con AG por medicamentos (Afonso et al., 2014 ; Buduneli et al., 2007). La evidencia científica señala que la CK-i9 regula la proliferación celular mediante la vía de señalización de la proteína NOTCH y otras moléculas como TFG-B o transglutaminasa tisular (tTG) (Saha, Yin, Chae, Cho, 2019). En otros procesos proliferativos diferentes a la cavidad oral, la expresión aumentada de la CK-i9 se ha relacionado con la formación de un complejo en presencia de tTG para poder activar la enzima SRC tirosina quinasa, involucrada en procesos fisiológicos fundamentales como la proliferación, migración, diferenciación y supervivencia celular (Bagnato et al.. 2020). Sin embargo, en el tejido gingival la interacción de CK-i9 con estas moléculas constituye una vía fisiopatológica a explorar. Asimismo, la CK-i9 suele actuar en diferentes actividades proliferativas como biomarcador en enfermedades que implican una proliferación celular descontrolada (Saha et al.. 2019). En patologías malignas como ameloblastoma periférico (AP), la ubicación y expresión de CK-i9 es vital para su interpretación diagnostica y de tratamiento. Es frecuente encontrar la CK-i9 en lugares poco comunes como en las células de retículo estrellado y células periféricas de pacientes con AP, donde la identificación de CK-i9 suele ser mayor (Chhina y Rathore, 2015). En nuestro estudio la expresión de CK-i9 fue detectada fundamentalmente en el estrato basal y espinoso de los pacientes con AGTO. Esta localización, al igual que la presencia del marcaje positivo Ki-67, nos sugiere una actividad de proliferación celular importante en el tejido gingival de pacientes afectados por el AGTO no relacionada con cambios displásicos. En conjunto, la expresión inmunohistoquímica de la CK-i4, CK-19 y Ki-67 en el tejido gingival de pacientes con AGTO, indicarían que el marcado crecimiento tisular identificado en estos pacientes pudiera detenerse una vez el factor desencadenante (tratamiento de ortodoncia) sea finalizado. La confirmación de esta hipótesis será sin duda, objeto de estudios más profundos mediante técnicas de biología molecular y celular.
Dentro de los límites del estudio, se destaca un número reducido de pacientes, la puesta en evidencia de los marcadores evaluados únicamente por la técnica de inmunohistoquímica. Sin embargo, aunque se trate de resultados preliminares, se puede concluir que el epitelio de los pacientes con AGTO presentan una expresión positiva de la CK-i4 y CK-i9, principalmente en las células de la lámina basal. La localización de estos marcajes coincide con la presencia elevada de células positivas para Ki-67 en el estrato basal de los tejidos de pacientes con AGTO. Estos datos sugieren que los marcadores investigados pudieran ser útiles en el seguimiento del proceso proliferativo asociado al tejido gingival de los pacientes portadores de tratamiento de ortodoncia. Sin embargo, es imperiosa la realización de estudios con una muestra de población más numerosa y el desarrollo de análisis de la expresión antigénica de estos marcadores con el propósito de esclarecer posibles mecanismos fisiopatológicos del AGTO















