Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
CES Medicina Veterinaria y Zootecnia
versão On-line ISSN 1900-9607
Ces. Med. Vet. Zootec. vol.6 no.2 Medellín jul./dez. 2011
*Autor para correspondencia: Juliana Loaiza E. Instituto Colombiano de Medicina Tropical - Universidad CES. Cra. 43A No.52 Sur 99, Medellín, Antioquia - Colombia. Tel: (574) 305 3500 ext 297. Fax: (574) 301 4258. Celular: 314 8856476. E-mail: jloaiza@ces.edu.co
Para citar este artículo: Loaiza J, Sánchez M, Henao S, Cardona-Castro N. 2011. Detección de bacterias contaminantes en huevos para consumo en Medellín y su área Metropolitana. Rev CES Med Vet Zootec. Vol 6 (2): 20-28.
1 Universidad CES. Facultad de Medicina Veterinaria y Zootecnia - Grupo INCA-CES. Calle 10 A # 22-04. Medellín, Colombia.
2 Instituto Colombiano de Medicina Tropical - Universidad CES. Cra. 43 A # 52 Sur 99. Medellín, Colombia.
(Recibido: 03 de Septiembre de 2011; aceptado: 05 de Diciembre de 2011)
Resumen
Objetivo: buscar Salmonella y otras bacterias contaminantes en huevos comerciales. Métodos: Se muestrearon aleatoriamente 38 graneros expendedores de huevos de Medellín y Área Metropolitana, a su vez se escogieron al azar 6 huevos por granero para un total de 228 huevos estudiados. A cada huevo se le extrajeron 4 muestras, para un total de 912 muestras que se dividieron en grupos. Cada grupo de muestras fue procesado para cultivo bacteriano y PCR para Salmonella. Resultados: Se aislaron Bacillus sp; Pseudomonas sp, Enterobacter sp, Serratia sp., Citrobacter sp., E. coli, Streptococcus viridans, Klebsiella sp., Staphylococcus sp., Aeromonas sp., Sarcinas sp., Acinetobacter sp, E. hermanii, Proteus y Stenotrophomonas maltophilia. Todos los cultivos y PCR fueron negativos para Salmonella. Conclusiones: Es importante conocer qué bacterias están contaminando los huevos comerciales, algunas de ellas potencialmente patógenas para los humanos, especialmente para niños, inmunocomprometidos y ancianos, como Aeromonas sp, E. coli y S. aureus. Con los resultados obtenidos se puede concluir que durante los meses Junio-Noviembre de 2007, periodo en el cual se recogió la muestra para este estudio no se detectó Salmonella en huevos comerciales de la ciudad de Medellín y Área Metropolitana.
Palabras clave:Área Metropolitana, bacterias contaminantes, huevos, Medellín, Salmonella.
Abstract
Objective. Search for Salmonella and other bacteria in commercial eggs. Methods. Thirty-eight neighborhood grocery stores in the city of Medellin and its Metropolitan área were chosen at random; also from each grocery store 6 eggs were selected randomly, for a total of 228 tested eggs. Four samples from every egg were taken, 912 samples in total, which were divided in groups. Every group of samples was cultured in bacteriological media and PCR for Salmonella was performed. Results. The bacterium isolated from the samples were: Bacillus sp., Pseudomonas sp., Enterobacter sp., Serrana sp., Citrobacter sp., E. coli, Streptococcus viridans, Klebsiella sp., Staphylococcus sp., Aeromonas sp., Sarcinas sp., Acinetobacter sp., E. hermanii, Proteus and Stenotrophomonas maltophilia. All cultures and PCR were negative for Salmonella. Conclusions. According to these results, the isolation of contaminating bacteria, such as Aeromonas sp, E. coli, and S. aureus, in commercial eggs is relevant since some of them are potentially pathogenic to humans, especially children, the immunocompromised and the elderly We can conclude that from June to November 2007, the period during which the samples were taken for this current study, Salmonella was not detected in commercial eggs in the city of Medellin and it's Metropolitan Área.
Key words: Área Metropolitana, contaminants bacteria, eggs, Medellín, Salmonella.
Resumo
Objetivo. Procurar Salmonella e outras bactérias em ovos comerciais. Métodos. Trinta e oito mercearias de bairro da cidade de Medellín e sua área metropolitana foram escolhidos aleatoriamente; também das mercearias, 6 ovos foram selecionados aleatoriamente, para um total de 228 ovos analisados. Quatro amostras de cada ovo foram tomadas, 912 amostras no total, que foram divididos em grupos. Cada grupo de amostras foi cultivada em meio bacteriológico e PCR para Salmonella foi realizada. Resultados. As bactérias isoladas das amostras foram: Bacillus sp.; Pseudomonas sp, Enterobacter sp, Serratia sp., Citrobacter sp., E. Coli, Streptococcus viridans, Klebsiella sp., Staphylococcus sp., Aeromonas sp., Sarcinas sp., Acinetobacter sp., E. Hermanji, Proteus e Stenotrophomonas maltophilia. Todas as culturas e o PCR foram negativas para Salmonella. Conclusões. É importante conhecer que as bactérias, como Aeromonas sp, E. coli e S. aureus, estão contaminando os ovos comerciais e alguns deles são potencialmente patogênicos para o homem, especialmente para crianças, imune-comprometidos e idosos. Com os resultados obtidos pode-se concluir que durante os meses de junho ao novembro de 2007, o período no qual foi colhidas as amostras pra o estudo atual, Salmonella não foi detectada em ovos comerciais na cidade de Medellín e sua área metropolitana.
Palavras chave: Área Metropolitana, bactérias contaminantes, Medellín, ovos, Salmonella.
Introducción
La Organización Mundial de Salud (OMS) considera a la diarrea de origen alimentario como la enfermedad más común y mas ampliamente diseminada en poblaciones humanas en el mundo. Para el año 2004 se estimaron 2.000 millones de casos al año y 3 millones de muertes de niños7. Los alimentos contaminados se consideran un factor de riesgo para la presentación de diarrea asociada a malnutrición en menores de cinco años. Entre 12 y 13 millones de muertes se producen al año por el efecto combinado de la malnutrición y la infección3.
La carne de pollo y los huevos son una de las mayores fuentes de infección alimentaria en el humano, siendo Salmonella uno de los principales agentes etiológicos. Datos estadísticos aportados por distintos países señalan que entre el 50 al 90% de las carcasas de pollo pueden estar contaminadas con Salmonella6. El consumo de carne de pollo, huevos y subproductos como fuentes de proteínas de origen animal se han incrementado en todo el mundo, incluidos los países en vía de desarrollo debido a la disminución de los costos, por el crecimiento de la explotación agrícola, la apertura económica y la globalización15. La industria avícola en Colombia ha estado en continua expansión; entre 1987 y 1997 creció en un 74.2% en productos de carne de pollo y un 75.2% en producción de huevos. Para el año 2007 el departamento de estudios económicos de la Federación Nacional de Avicultores de Colombia (FENAVI) estimó un consumo per cápita de huevos en Colombia de 188, una cifra superior a la de la mayoría de los países de América Latina, lo cual indica el alto grado de consumo de este tipo de alimento en nuestro país11. La tendencia creciente de infección en humanos y los recientes brotes de origen alimentario, subrayan la necesidad de una mayor vigilancia en todos los aspectos de la producción de alimentos reflejada en la instauración de controles concertados entre gobierno e industria17.
La detección e identificación de los patógenos implicados en las enfermedades transmisibles es un componente fundamental de la vigilancia epidemiológica21. La temprana detección de los microorganismos, prevendría la aparición de brotes y permitiría implementar controles previos a la ocurrencia de enfermedad. Debido a esto es necesario estandarizar técnicas de detección para implementar la vigilancia y el control de dichos microorganismos y prevenir las enfermedades que estos producen en el ámbito nacional, regional y/o mundial21.
El objetivo de este trabajo fue determinar la presencia de contaminación bacteriana en huevos distribuidos en graneros de la ciudad de Medellín y su Área metropolitana a través de dos métodos, los cultivos microbiológicos convencionales y la PCR específica para Salmonella spp.
Materiales y métodos
Muestra
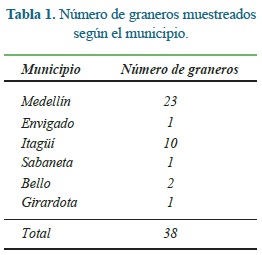
Se estudiaron huevos provenientes de graneros de Medellín y su Área Metropolitana ubicada en Antioquia, Colombia (Tabla 1). Teniendo como base el listado de los graneros de la ciudad de Medellín y su Área Metropolitana, que se publican en las páginas amarillas de PUBLICAR SA. en Internet, se consideró como población a muestrear los 439 graneros publicados. El número de graneros a muestrear se calculó en 38 considerando un error del 10% y un nivel de confianza del 90% para lo cual se utilizó el programa Epi Info 6. Dichos graneros fueron seleccionados al azar utilizando una tabla de números aleatorios. De cada granero seleccionado se obtuvieron 6 huevos escogidos al azar.
El número total de huevos utilizados fue de 228 a cada uno de los cuales se les extrajo 4 muestras diferentes; lavado inicial de cáscara (LIC), clara-yema más agua peptonada (CY+P), clara-yema (CY) y cáscara interna (CI). Para ser analizadas un total de 912 muestras distribuidas en 152 grupos de muestras de 6 huevos cada grupo. Las muestras fueron procesadas para cultivo y PCR siguiendo estos procesos:
-
Lavado inicial de cáscara (LIC): Los huevos se lavaron en 100 ml de agua peptonada en un vaso de precipitado (por 15 minutos en agitación).
-
Clara-yema más agua peptonada (CY+P): Después del lavado inicial con agua peptonada, cada huevo se lavó con agua destilada estéril y con alcohol, se secó con una gasa estéril y se perforó en uno de sus extremos con una puntilla estéril. El contenido del huevo (Clara-Yema) se vacío en un vaso de precipitado de 50 ml. Se mezcló el contenido y se tomaron 5 ml de clara-yema que se inocularon en 45 ml de agua peptonada a una relación 1:9.
-
Clara-yema (CY): En un tubo cónico de 15 ml se almacenaron 10 ml de clara yema para detectar el crecimiento de microorganismos sin previo enriquecimiento de la muestra.
-
Cáscara interna (CI): Una vez vaciada la cáscara del contenido de clara-yema, se llenaron con agua peptonada y se sellaron con papel elástico (parafilm).
Todas las muestras se incubaron a 37 °C por 18 a 24 horas. Posterior a la incubación, 4 ml de cada muestra, LIC, CY+P, CY y CI, se reservaron para proceder a la extracción de ADN y posterior realización de la reacción en cadena de la polimerasa (PCR), y al mismo tiempo otra cantidad de la muestra se utilizó para realizar cultivos en los medios de Mueller Hinton, agar sangre, agar McConkey y XLD (Becton Dikinson, Franklin Lakes, NJ USA). Los cultivos en los agares mencionados fueron incubados a 37 ºC por 12-18 horas. Las enterobacterias obtenidas en cultivo fueron identificadas utilizando el método API 20E® de Biomerieux (Francia). Las bacterias Gram positivas fueron identificadas por métodos bioquímicos tradicionales: coloración de Gram, identificación del tipo de hemólisis, producción de coagulasa, sensibilidad a bacitracina, trimetropim sulfametoxazole8.
Extracción del ADN bacteriano
Se utilizó el protocolo de buffer lisis modificado, descrito por Haque et al12. Se realizó extracción de ADN obteniendo dos alícuotas de 2 ml de cada una de las muestras (LIC, CY+P, CY y CI). Cada muestra se centrifugó a 10,000 rpm por cinco minutos a temperatura ambiente y se descartó el sobrenadante. Al precipitado se le adicionó 1 ml de buffer de lisis (0.2% Triton X-100 en Tris HCL mas EDTA pH 8.0). La mezcla se agitó aspirando con micropipeta varias veces y se centrifugó a 22539 g a temperatura ambiente por seis minutos, el sobrenadante se descartó y el procedimiento se repitió 3 veces. El sedimento obtenido se lavó con agua destilada ultra pura y se centrifugó a 22539 g a temperatura ambiente por 1 min. El sobrenadante se descartó y el sedimento se resuspendió en 300 μl de agua destilada ultra pura estéril. Los tubos se sellaron y fueron sometidos a ebullición por 20 min, y se enfriaron a temperatura ambiente antes de realizar la PCR. Cada muestra se procesó por duplicado desde la extracción del ADN y la PCR. Las muestras extraídas de ADN se almacenaron a -20°C hasta ser procesadas para PCR.
PCR. los iniciadores usados para la amplificación del gen hilA específico de Salmonella son los siguientes:
hilA US 5'-GCATGGATCCCCGCCGGCGAGATTGTG-3'hilA DS 5'-CGGAAGCTTATTTGCGCCATGCTGAGGTAG-3'
El tamaño en pares de bases del producto de amplificación es 854 pb22. Las condiciones de amplificación, los reactivos y condiciones de las pruebas de PCR, se consignan en las tablas 2 y 3. 12 μl de los productos de amplificación fueron sometidos a electroforesis en un gel de agarosa al 1% conteniendo 10 μl de SybrSafe® (Invitrogen). En cada gel se corrieron adicionalmente el control positivo y los dos controles negativos.
Análisis estadístico
Se calcularon frecuencias porcentuales de aislamientos bacterianos obtenidos de acuerdo a la muestra de donde se obtuvieron.
Resultados
Se estudiaron 152 muestras provenientes de 38 huevos provenientes de graneros de la ciudad de Medellín y el área Metropolitana del Valle de Aburrá (Tabla 1).
Aislamientos microbianos
Todas las muestras de los huevos fueron negativas por cultivo para Salmonella. Sin embargo, estas muestras si fueron positivas para otras bacterias potencialmente patógenas (Tabla 2).
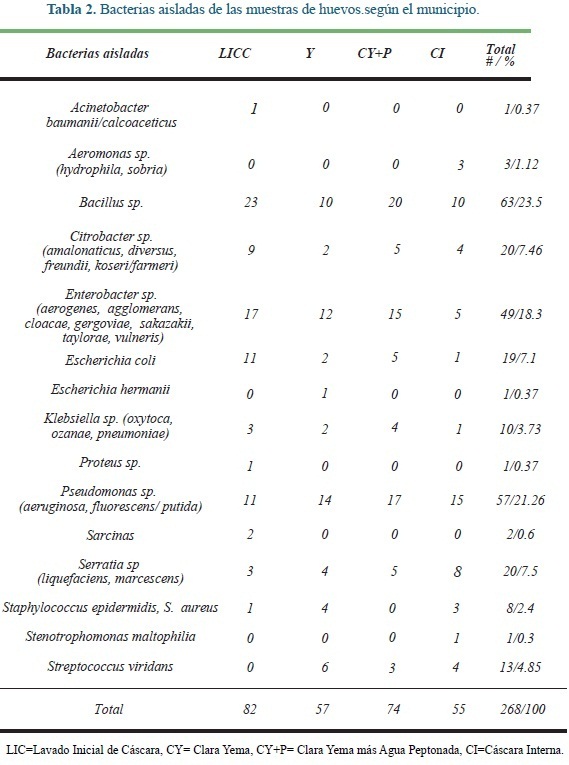
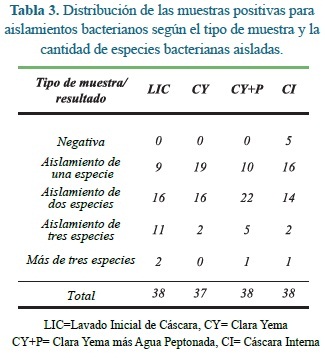
El número de aislamientos de cada bacteria según el tipo de muestra presentó la distribución consignada en la Tabla 3.
Discusión
Basados en los resultados obtenidos en este estudio, se puede especular que en el periodo entre Junio y Agosto del 2007, periodo en el cual se recogió la muestra para este estudio no se detectó Salmonella ni por cultivo ni por PCR en los huevos comerciales estudiados de Medellín y Área Metropolitana.
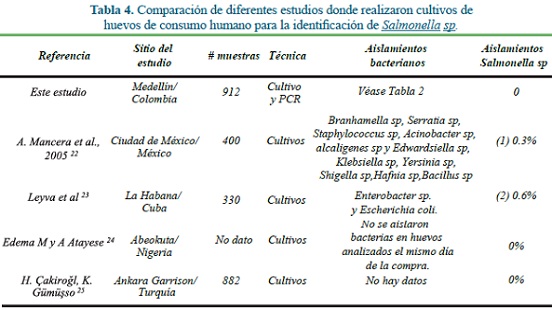
Estos datos concuerdan con otros reportes de estudios similares llevados a cabo en otros países, en los que no encontraron Salmonella en los huevos estudiados o reportan detección de Salmonella en bajos porcentajes (0.1-0.6%) de las muestras estudiadas (Tabla 4). Es de resaltar que los estudios mencionados sólo utilizaron cultivos bacteriológicos para la detección de Salmonella, hecho que los diferencia de este que es el primero en utilizar la técnica de PCR para buscar esta bacteria en huevos23.
La utilización de pruebas moleculares se debe incorporar en la industria de alimentos, debido a sus ventajas entre las cuales tenemos que es una técnica altamente sensible, rápida, sencilla, que puede evitar contaminaciones y favorece la automatización y un alto rendimiento.
Aunque no se aisló Salmonella sp. en los cultivos, estos si fueron positivos para otras bacterias potencialmente patógenas, que pueden ser fuente de infección o intoxicación alimentaria. Bacillus sp, Pseudomonassp y Enterobacter sp, fueron aislados de los huevos estudiados con mas frecuencia, representando el 63% del total de los aislamientos. Estas bacterias están en el ambiente y hacen parte de la flora intestinal de humanos y animales19. En este estudio estas bacterias aisladas pueden provenir del tracto gastrointestinal de las gallinas ponedoras19.
El riesgo de padecer una intoxicación alimentaría por el consumo de huevos es baja, sin embargo, los nutrientes que hacen del huevo un alimento nutritivo para las personas que lo consumen, también puede llegar a ser un excelente medio de crecimiento para las bacterias25. Cualquier comida, en especial, alimentos ricos en proteína como el huevo, pueden traer en su interior microorganismos o se puede contaminar con microorganismos después de la postura, que causan enfermedad en las personas y simplemente arruinan el alimento2.
Si las bacterias están presentes en el huevo, por lo general van a estar ubicadas en la clara y no va a ser posible que crezcan, esto debido a la falta de nutrientes que esta posee. A medida que el huevo envejece la clara disminuye su grosor y las membranas que cubren la yema se debilitan, permitiendo a la bacteria llegar a los nutrientes presentes en la yema y crecer, aún más si el huevo es mantenido a temperatura ambiente. Pero en un huevo limpio, sin fisuras y mantenido en refrigeración o en un lugar fresco, la contaminación ocurre pocas veces25.
De las bacterias encontradas en los cultivos realizados en este estudio, es importante hacer énfasis en Escherichiacoli, Aeromonas hydrophila, Aeromonas sobria y Staphylococcus aureus, por su potencial para producir en algunos casos un cuadro de diarrea semejante a la producida por Salmonella sp., ya que pueden causar infección e intoxicación alimentaría y por producir cuadros de diarrea.
E. coli es el principal anaerobio facultativo de la flora normal microbiana del colon humano, en donde participa de manera importante en el control fisiológico. Típicamente E. coli coloniza el tracto gastrointestinal de los recién nacidos dentro de sus primeras horas y permanece ahí durante toda la vida en simbiosis con el hospedero humano14. Dentro de la misma especie existen serotipos que pueden causar una variedad de enfermedades en el humano incluyendo septicemia, neumonía, meningitis, infecciones en vías urinarias y diarrea24. En este estudio no serotipificamos los aislamientos de E.coli obtenidos, factor limitante y que hubiera sido importante conocer.
Aeromonas es causa de gastroenteritis, debido a que produce toxinas con propiedades enterotóxicas y citotóxicas23. Las tres especies aisladas más frecuentemente de muestras clínicas son A. caviae, A. veronii biotipo sobria y A. hydrophila que representan el 91% de las cepas del género identificadas utilizando métodos genéticos4, en los huevos estudiados encontramos A. sobria y A. hydrophila.
Aeromonas sp. se ha aislado en una gran variedad de alimentos, productos cárnicos, pescado, mariscos, alimentos preparados, productos de pastelería, verduras, leche y derivados lácteos por lo que algunos autores consideran que Aeromonas sp. debería incluirse en la lista de microorganismos que pueden actuar como agentes causantes de intoxicación e infección alimentaria1.La enterotoxina de S. aureus tiene la capacidad de producir síntomas del tubo digestivo (sobre todo vómito) en humanos y animales. Existen varias proteínas de peso molecular bajo que son diferentes desde el punto de vista antigénico (por ejemplo enterotoxina A, B y C). Una vez formadas, estas toxinas son muy estables y mantienen su actividad incluso después de la ebullición o del contacto con enzimas gástricas y yeyunales23.
En la intoxicación alimentaria por S. aureus no ocurre infección pero las bacterias contaminantes producen exotoxina pirógena en el alimento, lo que puede iniciar la acción enterotóxica sobre el intestino horas después de la infección23.
Como se menciona, Aeromonas sp. debería incluirse en la lista de bacterias productoras de infecciones transmitidas por alimentos1, así mismo, de acuerdo a los resultados obtenidos, S. aureus y E. coli, podrían considerarse como potenciales transmisores de infección por consumo de huevos y sus derivados.
Se concluye con los hallazgos obtenidos en esta investigación, que hay evidencia del riesgo de infección para humanos, el consumo de huevos crudos, mal almacenados, quebrados, o mal cocidos, pues la mayoría de ellos portan bacterias o son contaminados en el proceso de recolección, transporte y distribución.
Otros trabajos han reportado aislamientos bacterianos similares a los obtenidos por nuestra investigación. Se ha encontrado diferencias significativas en la contaminación de cáscaras de huevo intactas y quebradas, como también diferencias entre las granjas que usan igual sistema de corrales para ponedoras9. Musgrove et al obtuvieron aislamiento bacterianos de los contenedores usados para el transporte de los huevos, como: Cedecea, Citrobacter, Erwinia, Hafnia, Klebsiella, Kluyvera, Leclercia, Morganella, Proteus, Providencia, Rahnella, Salmonella, Serratia, Aeromonas, Listonella, Chryseomonas, Pseudomonas, Sphingobacterium, Vibrio y Xanthomonas20.
Las bacterias más frecuentemente aisladas, por Jones et al a partir de cultivos de los carros de almacenamiento de los huevos, fueron Citrobacter spp., Escherichia spp., Enterobacter spp., Klebsiella spp., Hafnia spp., Kluyvera spp., Leclercia spp., y Salmonella spp. los cuales serían contaminantes directos de los huevos13.
Los factores que hacen al consumidor más propenso a sufrir infecciones, son la edad en los extremos de la vida, el estado inmunológico, el estado nutricional, la cantidad de inóculo bacteriano ingerido, entre otros7.
La detección de la contaminación por bacterias de huevos comerciales, es importante para el aseguramiento de la calidad del producto y el control de las infecciones transmitidas por alimentos, medidas por demás no asumidas por las autoridades de salud pública. Con este trabajo resaltamos la importancia de proceder a realizar este tipo de control en nuestro medio.
Agradecimientos
Este trabajo fue financiado por la Facultad de Medicina Veterinaria y Zootecnia - Universidad CES y por el Instituto Colombiano de Medicina Tropical -Universidad CES.
Referencias
1. Altwegg M, Martinetti Lucchini G, Lüthy-Hottenstein J, Rohrbach M. Aeromonas-associated gastroenteritis after consumption of contaminated shrimp. Eur J Clin Microbial Infect Dis 1991; 10 (1):44-45. [ Links ]
2. Baumler A, Hargis B, Tsolis R. Tracing the origins of Salmonella outbreaks. Science 2000; 287(5450):50-52. [ Links ]
3. Bern C, Martines J, De Zoysa I, Glass R. The magnitude of the global problem of diarrhoeal disease: a ten year update. Bull World Health Organ 1992; 70(6):705-714. [ Links ]
4. Borrell N, Figueras MJ, Guarro J. Phenotypic identificatión of Aeromonas genomo-species from clinical and environmental sources. Can J Microbiol 1998; 44(10):103-108. [ Links ]
5. Çakiroğl H, K. Gümü§so. Analysis of Salmonella spp. Contamination in Chickens Eggs Served for Consumption in Ankara Garrison. J Health Sci 2005; 14(3): 158-162. 6th Ed. Philadelphia: Churchill Livingstone; 2004. p. 2013-2033. [ Links ]
6. Cogan T, Bloomfield S, Humphrey T. The Effectiveness of Hygiene Procedures for Prevention of Cross-Contamination from Chicken Carcasses in the Domestic Kitchen. Lett Appl Microbiol 1999; 29:354-358. [ Links ]
7. Crump JA, Luby S, Mintz E. The global burden of typhoid fever. Bull World Health Organ 2004; 82(5):346-353. [ Links ]
8. D'Aoust JY. Salmonella species. In: M.P. Doyle L, Beuchat R, Montville TJ (eds).. Food Microbiology: Fundamentáis and Frontiers. Washington, DC: American Society for Microbiology Press; 1997.p. 138-139. [ Links ]
9. De Reu K, Rodenburg TB, Grijspeerdt K, Messens W, Heyndrickx M, Tuyttens FA, Sonck B, Zoons J, Hermán L. Bacteriological contamination, dirt, and cracks of eggshells in furnished cages and noncage systems for laying hens: an international on-farm comparison. Poult Sci. 2009;88(ll):2442-2448. [ Links ]
10. Edema M, Atayese A. Bacteriological Quality of cracked eggs sold for consumption in Abeokuta, Nigeria. Int J Poult Sci 2006; 5(8):772-775. [ Links ]
11. Estadísticas anuales de la industria avícola en Colombia 2007. FENAVI-FONAV [en línea] [fecha de acceso 2 de Marzo de 2008]; URL disponible en http://www.fenavi.org/fenavi/consumo-per-capita2.php?idm=42. [ Links ]
12. Haque A, J Ahmed, J Qureshi. Early detection of typhoid by Polymerase Chain Reaction. Ann Saudi Med 1999; 19(4):337-340. [ Links ]
13. Jones DR, KE Anderson, PA Curtís, FT Jones. Microbial contamination in inoculated shell eggs: Effects of layer strain and hen age. Int J Poult Sci 2002; 81:715-720. [ Links ]
14. Keller LH, Schifferli D, Benson C, Aslam S, Eckroade R. Invasión of chicken reproductive tissues and forming eggs is not unique to Salmonella enteritidis. Avian Dis 1997; 41(3):535-539. [ Links ]
15. Lammerding A, Fazil A. Hazard Identification and Exposure Assessment for Microbial Food Safety Risk Assessment. Int J Food Microbiol 2000; 58(1-2):1-11. [ Links ]
16. LeyvaV,ValdésE, CisnerosE, Pérez O. Determinación de Salmonella y enterobacterias totales en huevos frescos de gallina. Rev Cubana Alim Nutr 1996; 10(2):1-4. [ Links ]
17. Lindner E. Toxicología de los alimentos. 2ª ed. Zaragoza: Acribia; 1995. [ Links ]
18. Mancera A, Vásquez J, Ontiveros ML, Duran S, López D, Tenorio VR. Identificación de Salmonella enteritidis en huevo para consumo en la ciudad de México. Téc Pecu Méx 2005; 43(2): 229-237. [ Links ]
19. Miller S, Hohmann E, Pegues DA. Salmonella (including Salmonella typhi). In: Mandell J, Bennett A, Dolin E (eds). Mandell, Douglas, and Bennett's Principies and Practice of Infectious Diseases. 12. Yamane Y, Leonard J, Kobatake R, Awamura N, Toyota Y, Ohta H, et al. A case study on Salmonella enteritidis (SE) origin at three egg-laying farms and its control with an S. enteritidis bacterin. Avian Dis 2000; 44(3):519-526. [ Links ]
20. Musgrove MT, Jones DR, Shaw JD, Sheppard M, Harrison MA. Enterobacteriaceae and related organisms isolated from nest run cart shelves in commercial shell egg processing facilities. Poult Sci. 2009 Oct;88(10):2113-2117. [ Links ]
21. Oscar TP The Development of a Risk Assessment Model for Use in the Poultry Industry. J Food Saf 1998; 18(4):371-381. [ Links ]
22. Pérez CM, Sánchez M, Henao S, Cardona-Castro N. Standardization of two Polymerase Chain Reaction tests for the diagnosis of Salmonella entérica subspecie entérica in eggs. Arch Med Vet 2008; 40(3):235-242. [ Links ]
23. Ryan KJ, Ray CG. Sherris. Microbiología Medica: una introducción a las enfermedades infecciosas. 4ª ed. Mc Graw Hill. Madrid. 2005. [ Links ]
24. U.S. Department of Agriculture Food Safety and Inspection Service. Salmonella enteritidis risk assessment. Shell eggs and egg products. Final report [on-line] [Fecha de acceso 2 de Marzo de 2008] URL disponible en http://www.fsis.usda.gov/ophs/risk/contents.htm. [ Links ]
25. Yamane Y, Leonard J, Kobatake R, Awamura N, Toyota Y, Ohta H, et al. A case study on Salmonella enteritidis (SE) origin at three egg-laying farms and its control with an S. enteritidis bacterin. Avian Dis 2000; 44(3):519-526. [ Links ]













