Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina Veterinaria y Zootecnia
On-line version ISSN 1900-9607
Ces. Med. Vet. Zootec. vol.7 no.1 Medellín Jan./June 2012
MSc; Natalia Polanco Palencia3, Zoot; Alberto Mestra Pineda4, MVZ, Esp;
Oscar Jaime Betancur Hurtado5, MVZ, Esp.
* Para citar este artículo: Benavides E, Vizcaíno O, Polanco N, Betancur OJ. 2012. Efecto terapéutico de un fármaco frente a los hemoparásitos del bovino Babesia bovis, Babesia bigemina y Anaplasma marginale. Rev CES Med Vet Zootec. Vol 7(1):33-48
** Autor para correspondencia: Efraín Benavides Ortiz. Calle 33 No 16 - 36, Barrio Teusaquillo, Bogotá, Apartado aéreo 39144 de Bogotá- E-mail: efbenavides@unisalle.edu.co.
1 Profesor asociado. Programa de Medicina Veterinaria, Facultad de Ciencias Agropecuarias, Universidad de La Salle. Bogotá, Colombia;
2 Asesor Director producción vacuna Anabasan®, Laboratorios Limor de Colombia. vizcainogerdts@gmail.com.
3 Práctica particular. natapolzoo@gmail.com
4 Docente área parasitología. albertomestra@hotmail.com;
5 Director científico Novartis de Colombia S.A. Región Andina. Mail: oscar.betancur@novartis.com
(Recibido: 15 de abril de 2012; aceptado: 25 de mayo de 2012 )
Resumen
En Colombia todas las zonas ganaderas localizadas en áreas de trópico bajo y trópico medio se consideran regiones enzoóticas para los hemoparásitos del ganado, pero en ocasiones las pérdidas se minimizan por el desarrollo de inmunidad y el alcance de un estado de equilibrio en las poblaciones. Generalmente, en el campo se requiere de fármacos eficaces que ayuden a controlar las manifestaciones clínicas que se asocian con la ocurrencia de estos hemoparasitismos. Esta investigación buscó validar la bondad del uso de un producto protozoaricida y anaplasmicida (Ganaplus®) para el control de episodios clínicos asociados con los hemoparásitos del ganado. El estudio constó de una fase experimental basada en inoculación artificial de bovinos, con Anaplasma margínale, Babesia bovis y Babesia bigemina; y una fase de campo que evaluó episodios clínicos en animales ubicados en zonas endémicas. En ambas fases se realizó recolección de muestras de sangre y medición de temperatura corporal. Se evaluaron cuadros hemáticos completos, hematocrito y los extendidos sanguíneos para análisis parasitológico. Los bovinos de la fase experimental presentaron parasitemias muy bajas, con leves cambios en los parámetros hematológicos, pero los animales que presentaron cuadros clínicos agudos respondieron de forma satisfactoria a la aplicación del compuesto restableciendo sus parámetros hematológicos. Los bovinos de la fase de campo presentaron parasitemias mayores, con reducciones evidentes en el hematocrito y la presencia de cuadros clínicos agudos, que respondieron adecuadamente a la aplicación del producto. Se confirmó que el compuesto evaluado es un buen medicamento para el tratamiento de cuadros clínicos asociados con enfermedad por hemoparásitos.
Palabras clave: Anaplasmosis, Babesiosis, fiebres de garrapata, diminazeno, tratamiento.
Abstract
In Colombia all cattle raising areas located in tropical areas of low and medium altitude are considered endemic for haemoparasites of cattle, but sometimes losses are minimized by the development of immunity and the achievement of a state of equilibrium in populations. Generally, in the field the use of effective drugs is required as a help in the control of clinical manifestations associated with the occurrence of these diseases. This study was aimed to validate the benefit of the use of an anaplasmicid and anti-protozoa product (Ganaplus®) for the control of clinical events associated with blood parasites in cattle. The study consisted of a experimental phase based on artificial inoculation of cattle with Anaplasma marginale, Babesia bigemina and Babesia bovis; and a field phase that evaluated clinical events in animals raised in endemic areas. In both phases, blood sample collection and measurement of body temperature were conducted. Complete hemogram, hematocrit, and blood smears for parasite analysis were performed. Cattle of the experimental phase showed very low parasitemia, with slight changes in hematologic parameters, but the animals that demonstrated clinical acute states successfully responded to the application of the compound, restoring their hematologic parameters. The cattle of the field phase showed higher parasitemias, with clear reductions in the hematocrit and the presence of an acute clinical syndrome, which responded appropriately to the product application. It was confirmed that the compound tested is a good medicine for the treatment of clinical disease associated with blood parasites.
Key words: Anaplasmosis, babesiosis, diminazene, tick fever, treatment.
Resumo
Na Colômbia todas as zonas da pecuária bovina em áreas do trópico baixo e trópico médio consideram-se regiões endêmicas para os hemoparasitos do gado bovino, mas em ocasiões as perdas se minimizem pelo desenvolvimento de imunidade e o alcance de um estado de equilíbrio nas populações. Geralmente, no campo requerem-se de fármacos eficazes que controlem as manifestações clínicas que se associam com a ocorrência destes hemoparasitos. Esta pesquisa teve como objetivo validar a efetividade do uso de um produto protozoaricida e anaplasmicida (Ganaplus®) para o controle de episódios clínicos associados com os hemoparasitos bovinos. O estudo teve uma fase experimental baseada em inoculação artificial de bovinos com Anaplasma margínale, Babesia bigemina e Babesia bovis; e uma fase de campo que avaliou episódios clínicos em animais localizados em zonas endêmicas. Nas duas fases realizou-se a colheita de amostras de sangue e a mensuração da temperatura corpórea. Avaliou-se a hematologia, hematocrito e esfregaços de sangue para análise parasitológica. Os bovinos da fase experimental apresentaram parasitemias baixas, com leves mudanças nos parâmetros hematológicos, mas os animais que apresentaram quadros clínicos agudos responderam satisfatoriamente à aplicação do produto, restabelecendo os seus parâmetros hematológicos. Os bovinos da fase de campo apresentaram parasitemias maiores, com reduções evidentes no hematocrito e a presença de quadros clínicos agudos, que responderam adequadamente à aplicação do produto. Confirmou-se que o composto avaliado é um bom medicamento para o tratamento de quadros clínicos associados com a doença por hemoparasitos.
Palavras chave: Anaplasmose, Babesiose, diminazeno, tristeza parasitária, tratamento.
Introducción
Debido a su ubicación tropical, Colombia ofrece condiciones ambientales favorables para la multiplicación de artrópodos, especialmente garrapatas y moscas picadoras, los cuales son vectores importantes de hemoparásitos. En el país la garrapata Rhipicephalus (Boophilus) microplus es el principal vector de los protozoarios Babesia bigemina, Babesia bovis y la rickettsia Anaplasma marginóle20,21. En el campo estas dolencias son conocidas como Fiebre de Garrapatas y se llama ranilla roja a la enfermedad asociada con Babesia bigemina por la producción de orina coloreada y ranilla blanca a la enfermedad asociada con A. margínale. Esta garrapata también se considera el principal transmisor de A. margínale en condiciones del trópico2,7; debe destacarse que el vector más eficiente para este organismo son las garrapatas12, pero también intervienen en la transmisión los dípteros hematófagos.11,13.
En el trópico, la epidemiología de las fiebres de garrapata es regulada por el fenómeno de la estabilidad enzoótica2,16,17. En zonas donde existen tábanos, particularmente valles interandinos y la costa atlántica existe endemicidad por Trypanosoma vivax18. Los signos comunes asociados con enfermedad hemoparasitaria son fiebre, anemia, disminución del apetito, caída en la producción de leche y pérdida de la condición corporal; llegando a la muerte en algunos animales5,15.
En el campo ocurren diversas formas clínicas de enfermedad asociada con estos organismos, pasando por cursos febriles de diverso nivel e intensidad hasta afecciones crónicas que se acompañan de enfermedad consuntiva2,18,19. Aunque los agentes etiológicos comparten componentes de transmisión por vectores y cuadros clínicos; los ciclos de desarrollo, susceptibilidad a fármacos y patogenicidad son diferentes, por lo que el diagnóstico diferencial es imprescindible para alcanzar un adecuado control en el mediano y largo plazo.
Sin embargo, debido a las dificultades inherentes al diagnóstico, este generalmente no se realiza bajo la mayoría de situaciones de campo sino que se recurre a mezclas de fármacos específicos para disminuir el sufrimiento y afección de los animales10,14.
El producto Ganaplus® de Novartis de Colombia es uno de los medicamentos veterinarios de mayor uso en el país para atender la problemática de enfermedad clínica asociada a los hemoparasitismos del ganado. Consta de una combinación de un fármaco bacteriostático (Oxitetraciclina, 70 mg/ml) y uno protozoaricida (4,4'-diaceturato de diazoamino dibenzamidina= Diminazene, 35 mg/ml). En el campo se recomienda su aplicación para el tratamiento de la anaplasmosis, babesiosis y tripanosomosis del ganado (a una dosis de 1 ml/10 kg, vía intramuscular, atendiendo las recomendaciones del laboratorio). Este tipo de fármaco se recomienda para uso en campo cuando su diagnóstico diferencial no es posible, porque le proporciona al profesional un amplio espectro de acción y seguridad terapéutica mientras se logra el diagnóstico definitivo. Esta investigación se diseñó con el fin de aportar información científicamente válida relacionada con el efecto benéfico de la aplicación de este producto, tanto en animales experimentalmente infectados, como en bovinos afectados por enfermedad clínica compatible con hemoparasitismos, bajo diversas condiciones de campo en el territorio colombiano.
Materiales y métodos
El objetivo del estudio fue confirmar los beneficios del uso del fármaco, tanto en forma experimental como bajo situaciones de ocurrencia clínica en campo. En la fase experimental se inocularon bovinos jóvenes con organismos vivos contenidos en una vacuna comercial disponible en el territorio colombiano y se trataron a medida que se desarrollaba la afección hemoparasitaria consecuente. La fase de campo consistió en realizar tratamiento, diagnóstico y seguimiento hematológico a grupos de bovinos que en campo presentaban afección clínica compatible con la presencia de hemoparásitos en diversas fincas en el territorio colombiano.
Fase experimental
Se inocularon vía subcutánea en el cuello 19 bovinos menores a un año de edad, que no tuvieron exposición previa a garrapatas. Los animales procedían del municipio de Subachoque ubicado a 2663 msnm, donde el propietario aseguró que los animales no habían presentado infestación por garrapatas. Ellos fueron mantenidos en condiciones de pastoreo en un predio cerca a Cota (Cundinamarca). Los animales fueron distribuidos aleatoriamente, en cuatro grupos de acuerdo al organismo inoculado (B. bigemina, B. bovis y A. margínale) y un grupo inoculado de forma trivalente; utilizando una cantidad de organismos a una dosis que se consideró causaría un cuadro clínico moderado en los animales utilizando inóculos de conocida patogenicidad4,23.
Se utilizaron los inóculos de los tres organismos contenidos en la vacuna comercial (Anabasan®, Laboratorios Limor de Colombia), los cuales se conservan en nitrógeno líquido y son descongelados de forma rápida justo al momento de la inoculación. La vacuna contiene organismos moderadamente atenuados4,21, de origen colombiano y que han sido extensivamente trabajados por investigadores en el país21,22,23. Ya se ha establecido experimentalmente4 que a la dosis recomendada por el laboratorio productor (1x107 organismos para cada patógeno) se produce una infección leve en los animales con ligero aumento de la temperatura. Para los efectos de este estudio y con el fin de producir una infección algo más severa pero que no pusiese en riesgo la vida de los animales, o que se generara sufrimiento innecesario, se decidió ajustar la dosis de desafío a ocho veces la dosis vacunal, cuando se trataba del inóculo monovalente, y cinco veces la dosis vacunal, cuando se utilizaron los tres organismos4. De esta forma, se contó con grupos inoculados con los patógenos de forma monovalente, para los cuales se utilizaron dosis de 8x107 organismos vía subcutánea y un cuarto grupo que recibió los tres organismos (inóculo trivalente), en este caso la dosis fue de 5x107organismos para cada inóculo.
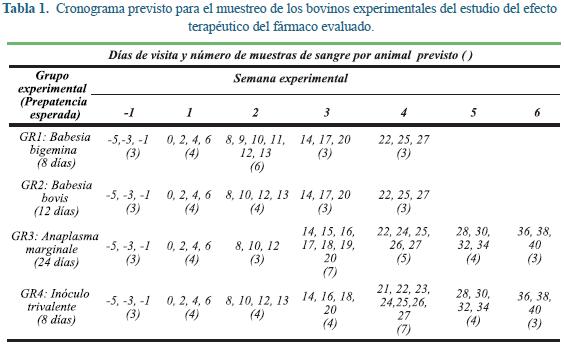
Para evidenciar el beneficio del tratamiento de los animales, se consideró que dos bovinos de cada grupo recibirían tratamiento temprano luego de la detección de la fiebre o de la presencia del parásito en los extendidos sanguíneos asociado con cuadro clínico evidente, mientras los restantes animales del grupo recibirían el tratamiento tres a cinco días después dependiendo de la evolución del cuadro clínico (Tabla 1); este cronograma se elaboró con base en el conocimiento del grupo sobre los períodos de prepatencia para cada una de estas cepas4,22. El tratamiento se aplicó vía intramuscular (1 ml/10 kg) en la tabla del cuello, atendiendo las recomendaciones de la casa farmacéutica que distribuye el producto.
Fase de campo
Consistió en realizar seguimiento y tratamiento de animales que desarrollaran enfermedad clínica consecuente a infección natural de campo por hemoparásitos, determinando parámetros hematológicos y parasitológicos en el momento del tratamiento y a varios tiempos post tratamiento. Para esta fase se contó con animales de dos sitios del país, a saber: Valle del Cauca (Tuluá) y Montería (Córdoba).
Análisis hematológicos y parasitológicos
Muestras de sangre completa con anticoagulante (EDTA) se recolectaron de los animales bien del experimento o de la fase de campo a diversos tiempos del proceso, para ser sometidas a análisis hematológico completo (hematocrito, hemoglobina, recuento total y diferencial de leucocitos, eritrocitos y plaquetas) y preparación de extendidos sanguíneos teñidos con Giemsa para la búsqueda y cuantificación de hemoparásitos. Una vez recolectadas las muestras fueron refrigeradas y enviadas inmediatamente al laboratorio para su proceso. Se prepararon curvas de fluctuación de los diversos parámetros en el tiempo (pre-tratamiento y pos-tratamiento) para evidenciar el beneficio del uso del fármaco. Se consideró como efecto benéfico la cesación de los signos clínicos, la disminución de los niveles de parasitemia y la mejora en los parámetros hematológicos.
En días críticos (Tabla 1) se prepararon directamente en campo frotis sanguíneos a partir de sangre capilar. En cada extendido se examinaron al menos 50 campos microscópicos indicando como resultado el número de glóbulos rojos parasitados (GRP) con cada tipo de organismo. Cuando las parasitemias fueron apreciables, se obtuvo el porcentaje de parasitemia examinando 20 campos, basado en el recuento total de eritrocitos y del número de GRP presente en cada campo9. La ecuación empleada para determinar las parasitemias fue la siguiente:

Ética y bienestar animal
La investigación siguió estrictos protocolos para asegurar el mínimo sufrimiento durante trabajos experimentales o de campo según lo estipulado por comités de expertos en el área*. Atendiendo instrucciones de Novartis Animal Health, se llenaron las formas correspondientes al documento interno de la compañía "Protocol Review for AW Compliance" (version May 2006), que incluyeron entre otros: registro clínico individual por animal, detalles de aplicación de fármacos, resgistros de temperatura y parámetros hematológicos por animal y por grupo. El coautor de este documento representante de Novartis, actuó durante todo el transcurso del trabajo como auditor en el cumplimiento de dichos protocolos.
Análisis estadístico
En la fase experimental, para cada individuo y para cada grupo experimental se construyeron curvas de fuctuación temporal de los valores hematológicos y de los niveles de parasitemia, las que se expresaron en forma de gráficas, utilizando las herramientas de Excel (Microsoft Excel 2007®). Con los parámetros cuantitativos, particularmente el hematocrito, se realizaron análisis de estadística descriptiva. Se hicieron pruebas t pareadas comparando el valor pre inoculación con el nivel del parámetro en cada fecha post inoculación. Adicionalmente, se hicieron análisis de varianza para cada uno de los parámetros recolectados, seguidos de la respectiva prueba de Bonferroni. Para los análisis se contó con la ayuda del programa estadístico XLSTAT 4.424.
Resultados y discusión
Las actividades del experimento de inoculación en Cota se realizaron en el segundo semestre de 2009, las muestras de casos de campo se recibieron de diversas sedes en el segundo semestre de 2008 y el transcurso del 2009. Los resultados se discriminan acorde con la fase experimental o de campo. Cada grupo experimental fue sometido a examen clínico, registro de temperatura corporal y recolección de muestra sanguínea a diversos tiempos (Tabla 1) post inoculación (p.i.), acorde alperíodo de prepatencia conocido para cada organismo4.
Fase experimental
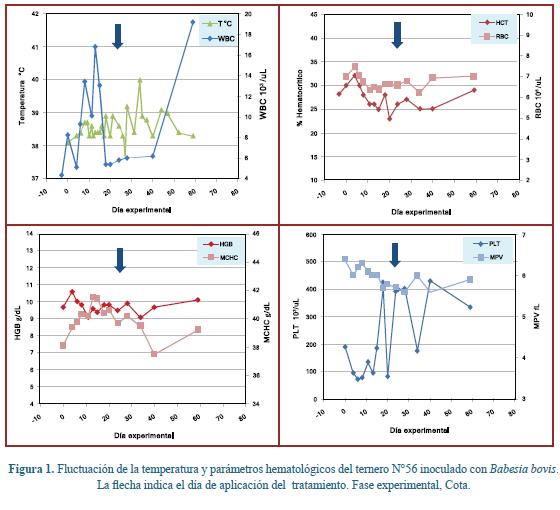
Atendiendo consideraciones de bienestar animal, el inóculo utilizado (8x107 organismos de forma monovalente y 5x107 organismos en el inóculo trivalente) buscaba que los animales desarrollasen parasitemia franca y enfermedad clínica moderada4,22, para evitar sufrimiento innecesario y aún muerte de los animales. Sin embargo, los animales desarrollaron muy leves afecciones clínicas, acompañadas de bajas parasitemias; lo que dificultó la evaluación de la eficacia del compuesto, pero se ganó apreciable información sobre el comportamiento de los organismos en los animales, confirmando los períodos de prepatencia establecidos para cada organismo4, la forma como los piroplasmas desaparecen de los extendidos de sangre venosa rápidamente luego de los accesos febriles iniciales5 y el efecto insidioso de las rickettsemias por A. marginale11, lo que es valioso soporte para el uso apropiado del fármaco en el campo. Para cada animal se construyeron curvas de fluctuación en el tiempo, tanto para los parámetros hematológicos, como para los parasitológicos. A manera de ejemplo, las figuras 1 y 2 presentan respectivamente las curvas de la hematología para el animal Nº 56 inoculado con B. bovis y del bovino Nº 45 que recibió inóculo trivalente. Las tablas 2 a 4 resumen la situación encontrada para los lente. En el transcurso del estudio ningún animal sufrió enfermedad severa y se siguieron criterios de bienestar animal, buen cuidado, alimentación y manejo. Desde el inicio al final del estudio, la ganancia de peso de los animales fue de 400 g/día en promedio, lo que indica que fueron mantenidos bajo buenas condiciones de manejo.
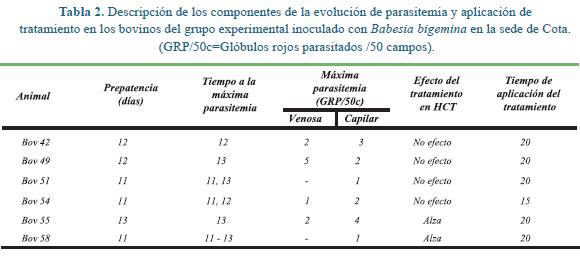


En el grupo inoculado con B. bigemina se observó parasitemia en todos los animales, pero con bajos niveles (Tabla 2), luego de once días de la inoculación, lo que corresponde a la prepatencia conocida para este organismo4. Normalmente las parasitemias por B. hematocrito y el recuento de eritrocitos, logrando recuperación clínica y hematológica luego de la aplicación del producto evaluado. Los efectos del tratamiento sobre los diferentes parámetros tuvieron claras tendencias de retorno a los valores iniciales (normales) mostrando la bondad del uso de los fármacos presentes en el producto.
Los animales inoculados con B. bovis presentaron parasitemias pero a muy bajos niveles desde el día 12 hasta el 18 post inoculación. Al examinar el comportamiento bigemina son más altas que las presentadas por B. bovis5. Los valores hematológicos tuvieron un comportamiento fuctuante pero dentro de los valores normales, sin embargo dos animales específicamente (Bov55 y Bov58) presentaron los mayores descensos en los valores del individual, se destacó el marcado beneficio del tratamiento en dos de los cuatro animales (Tabla 3), debido a que presentaron descensos importantes en los valores del hematocrito y los eritrocitos, alcanzando en el animal (Bov56) un descenso del 23% del valor inicial del hematocrito, lo que correspondió a un hematocrito de 23%. Por su parte, luego de la aplicación del tratamiento hubo una respuesta satisfactoria recuperando los valores normales en todos los parámetros.
Las inoculaciones realizadas con la rickettsia A. margínale en cinco bovinos, condujeron a la presencia de organismos en extendidos sanguíneos en solo tres de ellos. Estos fueron observados después de 18 días de realizada la inoculación (Tabla 4). Las rickettsemias fueron reducidas, siendo este grupo el que presentó cuadros clínicos más moderados. Sin embargo, en los animales que no se les observaron organismos en los análisis sanguíneos algunos parámetros hemáticos se afectaron levemente. Posterior al tratamiento no se observaron organismos en sangre y los valores hematológicos retornaron a la normalidad.
En resumen, el período de prepatencia para B. bigemina fuctuó entre 11-13 días, las parasitemias fueron bajas, el cuadro clínico fue moderado y en dos de cinco animales el hematocrito tendió al alza luego del tratamiento. En el caso de B. bovis el período de prepatencia osciló entre 12-18 días, el efecto clínico fue más marcado y tres de cuatro animales mostraron tendencia al alza del hematocrito luego del tratamiento. Para el grupo inoculado con A. margínale sólo en tres animales se demostraron organismos en los frotis sanguíneos y los períodos de prepatencia fluctuaron entre 18-34 días. Prácticamente no hubo afección clínica en este grupo. En tres de cinco animales los valores hematológicos tendieron a la normalidad luego del tratamiento.
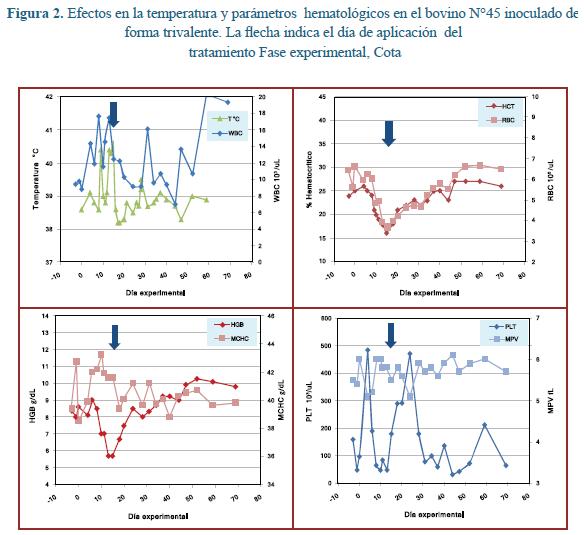
El grupo con inoculación trivalente presentó parasitemia en todos los individuos y estas fueron observadas de acuerdo con los períodos de prepatencia conocidos para cada organismo. Dos animales tuvieron cuadros clínicos agudos pero sólo uno específicamente (Bov45) presentó un cuadro clínico muy intenso (Figura 2, Tabla 5). Este último animal tuvo temperatura superior a 40 °C y una reducción del hematocrito de 36%, con respecto al valor pre inoculación llegando hasta un nivel crítico del hematocrito de 16% y un recuento muy bajo de plaquetas. Se aplicó el compuesto evaluado y la temperatura al otro día ya estaba restablecida y los valores hematológicos iniciaron la tendencia al alza.

El comportamiento hematológico y parasitológico del grupo que recibió inóculo trivalente es más complejo de describir pues los animales desarrollaron parasitemias para cada organismo acorde con su período de prepatencia esperado, pero la afección clínica consecuente fue moderada y los tratamientos se aplicaron a diferentes tiempos (Tabla 5). En dos de cuatro animales el hematocrito tendió al alza luego del tratamiento. La figura 3 resume el comportamiento del hematocrito promedio en los cuatro grupos experimentales. Luego del tratamiento este parámetro tuvo propensión al incremento en todos estos grupos.
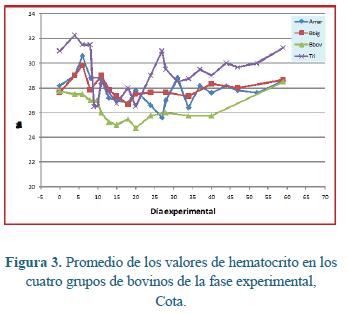
La determinación de la eficacia de cualquier compuesto parasiticida tradicionalmente se basa en la comparación de parámetros biológicos entre grupos tratados y otros no tratados, esquema experimental que no es compatible con lo planteado en este experimento donde se esperaba el desarrollo de enfermedad clínica luego de inoculación experimental, comparando el efecto benéfico del tratamiento temprano o tardío de los animales. Gracias al conocimiento del grupo de investigación sobre el comportamiento de las cepas utilizadas como inóculo y respaldado por más de 100.000 vacunas aplicadas en el territorio nacional4, en el diseño original del experimento, cuando se esperaba que los animales desarrollasen un cuadro clínico patente; se consideró aplicar un tratamiento temprano o tardío de algunos animales seleccionados aleatoriamente.
Esta observación no se pudo realizar debido al insidioso desarrollo de las parasitemias (incluidas las rickettsemias) y al moderado efecto clínico observado. De modo que la valoración del efecto benéfico del tratamiento con Ganaplus® debió basarse en la evaluación de los parámetros hematológicos y parasitológicos antes y después del tratamiento. Entonces, más que eficacia, este estudio pretendía demostrar el beneficio clínico del uso del producto.
En la evolución clínica de los hemoparásitos es característico que luego de una parasitemia inicial, los organismos tienden a desaparecer de la sangre periférica lo que complica el diagnóstico16. En esa fase luego del contacto inicial, el animal bien puede tornarse en un portador, siendo aparentemente sano o puede iniciar una fase crónica de la enfermedad con efectos insidiosos y no siempre claramente diferenciables de otras patologías5,6. De forma que para la evaluación de compuestos hemoparasiticidas, son preferibles situaciones donde la parasitemia sea evidente, lo cual no es siempre fácil de encontrar en condiciones de campo de los sistemas de producción imperantes en las diversas regiones ganaderas del país, de ahí la necesidad del abordaje experimental.
En décadas pasadas, este tipo de investigaciones utilizaba animales esplenectomizados o mayores inóculos de los organismos, lo que garantizaba la ocurrencia de francas parasitemias, pero a su vez colocaba en riesgo la vida del animal22,25. Dadas las consideraciones de bienestar animal, se decidió en este estudio no utilizar altos inóculos, en espera de que el cuadro clínico desarrollado fuese suficiente para evaluar el beneficio del uso del fármaco.
En los animales de los diversos grupos experimentales en la sede de Cota se observaron parásitos en la sangre, pero el cuadro clínico asociado fue leve. Se demostró parasitemia o rickettsemia patente en la mayoría de animales, lo que indica que la infección experimental si tuvo lugar, pero la afección clínica desarrollada y la misma parasitemia fueron más moderadas de lo esperado. Esto pudo ser debido a tres situaciones: Inóculo insuficiente22, variabilidad individual con algunos animales presentando menor susceptibilidad7,10 o inmunidad adquirida por exposición previa7,16,17,.
Según lo declarado por el anterior propietario de los animales, estos no habían sido previamente expuestos a garrapatas y en la región de Subachoque no se conoce que sea endémica para la presentación de este parásito. La vacuna utilizada ha demostrado su efectividad a las dosis sugeridas4 y se consideró que multiplicando su dosis se alcanzaría un efecto patógeno evidente, pero algunos pocos animales si desarrollaron el cuadro clínico esperado lo que evidencia la variabilidad individual.
En bovinos, los casos clínicos por hemoparásitos pueden presentarse; cuando los animales son muy susceptibles (no expuestos previamente a artrópodos vectores que transmiten rickettsias y protozoarios) o cuando son afectados por factores inmunodepresivos que inhiben la acción del sistema inmunológico19,20. También, cuando las cepas de Anaplasma spp. y Babesia spp. que los afectan en ese momento son muy patógenas, son heterogéneas (heterólogas) con respecto a las cepas hacia las cuales poseen inmunidad o son inoculadas natural o artificialmente en dosis mayores a 1x108 organismos en animales con una edad superior a los nueve meses de edad4,17,19,20. Esta complejidad debe tenerse en cuenta cuando se pretende evaluar el efecto de una intervención farmacológica para mejorar la condición de los animales.
En esta investigación se utilizó un grupo relativamente homogéneo de animales que al inicio del estudio tenían entre 7 y 11 meses de edad y se utilizó un inóculo conocido y caracterizado4,22. De tal forma que los cuadros clínicos moderados fueron sorprendentes y no se posee una explicación completa sobre su origen, pero esto no inhabilita la posibilidad de evaluar la bondad de uso del fármaco en esta fase experimental.
Fase de campo
En el caso de las evaluaciones de campo, el abordaje fue diferente; se trabajó con bovinos adultos que desarrollaron un cuadro clínico febril anemizante, a los que una vez confirmado el cuadro clínico compatible se les recolectaba muestra sanguínea antes del tratamiento y luego a diversos intervalos post tratamiento para intentar demostrar su beneficio. Estas muestras se recolectaron en la primera y segunda semana pos tratamiento en el caso de Tuluá, mientras que en Montería los intervalos fueron de 3, 7 y 15 días. De forma que en esta fase de estudio, los datos están organizados por sedes y no por organismo.
Tuluá. Se recibieron muestras de sangre de una finca ubicada en Tuluá (Valle) de cuatro bovinos (N°106, 140, 155 y 213) que presentaron signos clínicos que presumían enfermedad causada por hemoparásitos (Tabla 6).
En todos estos casos se confirmó infección por A.margínale pero en el bovino 155, en la muestra inicial se observaron bajas parasitemias por Babesia spp. El animal N°106 presentó en el día 0 un hematocrito de 13% y los valores de eritrocitos, hemoglobina y plaquetas estuvieron por debajo de los límites inferiores, presentando una anemia evidente. La parasitemia se registró en 2,5% de eritrocitos infectados por A. margínale. Una semana después de la aplicación del tratamiento el hematocrito ascendió a 17% y al día 15 post tratamiento fue de 19%, acompañado del aumento paulatino de los eritrocitos, hemoglobina y plaquetas, seguido de una reducción de parasitemia a 0,14% mostrando el efecto que tuvo el tratamiento sobre la recuperación del animal.
El animal N° 140 en la primera muestra, presentó un hematocrito de 15% también un valor bastante bajo y con la mayor parasitemia registrada para este grupo con 8% de A. margínale. En la semana siguiente a la aplicación del tratamiento el hematocrito ascendió a 18% y la rickettsemia fue de 0,03% lo que es normal en zona endémica17,19,21 y en la muestra final el hematocrito aumentó hasta 23% lo que representa un aumento del parámetro y recuperación evidentes. Con un hematocrito menos crítico llegaron los otros dos animales de este grupo, el 155 con 18% y el animal 213 con 23% con parasitemias bastante leves de 0,04% y 0,2% respectivamente, y también mostraron mejoría en sus valores, a las dos semanas el hematocrito aumentó a 24% en el animal N° 155 y a 26% en el bovino 213.
A nivel grupal los animales obtuvieron al día cero un porcentaje de hematocrito en promedio de 17,2% (±4,3) y parasitemias que oscilaron entre 2,5% y 8%, acompañados de una temperatura mayor a 40°C. En los siete días posteriores al tratamiento el promedio del hematocrito ascendió a 21,7 (± 4,9), y las parasitemias se redujeron hasta 0,1% con restablecimiento de la temperatura corporal. La última muestra de sangre recolectada a los 15 días post tratamiento mostró en promedio un hematocrito de 23% (± 2,9) evidenciando la mejoría.
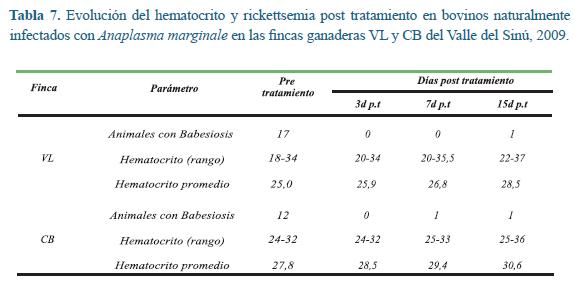
Montería. 1) Finca VL: En este predio se encontró rickettsemia en diez animales con valores que fluctuaron entre 0,01 y 0,02% y 17 animales con Babesia spp. y las parasitemias oscilaron entre 0,01% y 0,04%, ocurriendo infección mixta de Babesia spp. y Anaplasma spp. en diez animales. Los valores de hematocrito fluctuaron entre 18% y 34% (Tabla 7). El hematocrito del grupo en general mostró una tendencia a la mejoría luego del tratamiento. Se utilizó una prueba t pareada para comparar los valores pre tratamiento con los alcanzados en cada fecha de evaluación. Se demostró que luego del tratamiento el hematocrito fue significativamente superior a los valores pre tratamiento, a los tres (t= 4,315; p= 0,0003) a los siete (t= 8,367; p< 0,001) y a los quince días p.t. (t= 3,905; p= 0,0006), indicando la bondad de uso del producto.
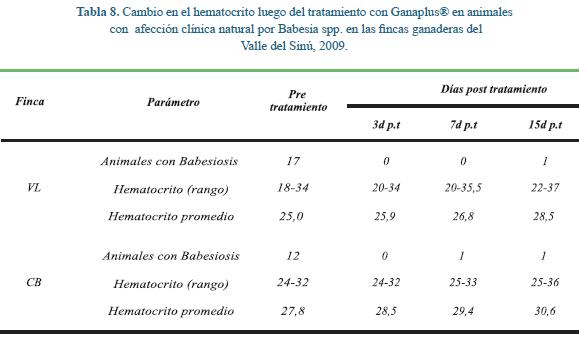
2) Finca CB: En esta finca se encontró infección por Anaplasma spp. en diez animales con valores que fuctuaron entre 0,01% y 0,02% y doce animales con Babesia spp. entre 0,01% y 0,04%, ocurriendo infección mixta de Babesia spp. y Anaplasma spp. en nueve animales; en el bovino N° 333 de este grupo se detectó Trypanosoma spp. Los valores de hematocrito en el grupo fuctuaron entre 24% y 32% (Tabla 8) demostrando una tendencia persistente hacia la mejora. El resultado de la prueba t pareada comparando los valores pre tratamiento con los distintas fechas post, demostró diferencias significativas en cada fecha de evaluación. Luego del tratamiento el hematocrito fue significativamente superior comparado con los valores pre tratamiento, a los tres (t= 2,590; p= 0,01) a los siete (t= 5,397; p= 0,001) y a los quince días p.t. (t= 4,944; p= 0,001), indicando la bondad de uso del producto.
Como resumen del trabajo realizado en el Valle del Sinú (Montería), se evaluaron 31 animales de dos fincas de la región, que presentaron enfermedad por hemoparásitos. En la primera muestra de sangre recolectada pre tratamiento, el hematocrito en promedio fue de 26,3% (±4,2) y las cargas parasitarias fluctuaron entre 0,01% a 0,05% para A. marginale y de 0,01% a 0,04% para Babesia spp. Tres días después, el hematocrito aumentó a 27,1% (±3,9) y las parasitemias post tratamiento fueron cero para todos los animales, excepto dos (No 22 y 536) que presentaron muy bajos niveles de A. marginale (0,01%). A la semana el hematocrito aumentó en un punto (28% ± 4,1) y los mismos animales que presentaron rickettsemia en los tres días mostraron A. marginale a la semana.
Finalmente, en las muestras recolectadas a los 15 días de aplicado el tratamiento, el hematocrito promedio fue de 29,4% (± 4,1) y cuatro animales presentaron parasitemia por Anaplasma spp. y uno por Babesia spp.. Las pruebas estadísticas muestran que hay diferencia significativa p < 0,05) entre el día experimental cero y el 15, esto demuestra la recuperación en los valores hematológicos gracias al producto aplicado. El día siguiente de aplicación del producto se presentó restablecimiento de la temperatura, el retorno al consumo de alimento y del comportamiento habitual de los animales.
En el estudio desarrollado en la finca CB se comprobó la eficacia protozoaricida del compuesto, teniendo en cuenta que a los tres días p.t. todos los animales habían demostrado un despeje total de los organismos en los frotis sanguíneos, tanto para Babesia spp., como para el animal infectado con Trypanosoma spp. La recuperación en los valores hematológicos también fue marcada luego del tratamiento.
Se observaron diferencias significativas en el hematocrito comparando la muestra pre tratamiento con las muestras recolectadas a los 3, 7 y 15 días p.t. con una tendencia continua al alza. La desaparición de los protozoarios de la sangre aunada al restablecimiento de la temperatura corporal y de la mejora de los parámetros hematológicos, indica el beneficio de uso del fármaco en estos animales que poseían afección clínica evidente antes del tratamiento.
Se destaca que en condiciones de infecciones naturales las babesiosis causan cuadros clínicos agudos que generalmente responden muy bien al tratamiento14. Por su parte, dada la naturaleza insidiosa de la anaplasmosis bovina, el cuadro clínico desarrollado, aunque puede ocurrir de forma aguda, tiende a desarrollar ciclos de cronicidad en las cuales es muy difícil de asegurar la esterilización completa del ganado en cuanto a la presencia del organismo, aspecto aunado al hecho que este organismo aprovecha estados de inmunosupresión del animal para crear ciclos de rickettsemia asegurando su permanencia en las poblaciones bovinas del trópico11. Sin embargo, esta investigación demostró que un único tratamiento con el fármaco ayudó a los animales para el control de la rickettsemia y la parasitemia y la mejora del hematocrito.
Este estudio permitió demostrar de manera clara las complejidades metodológicas relacionadas con la evaluación de eficacia bajo condiciones de campo de compuestos dirigidos al control de los hemoparásitos del bovino, Babesia bovis, Babesia bigemina y Anaplasma marginale. Es conocido que en estos hemoparásitos del ganado, el cuadro clínico agudo sólo se da en el primer contacto con el organismo y la intensidad del cuadro clínico es dependiente de la dosis del inóculo pero también de componentes de susceptibilidad individual. Los cuadros clínicos en campo son aún más difíciles de definir y están asociados a múltiples situaciones epidemiológicas. Un compuesto eficaz para el control de los cuadros clínicos relacionados con hemoparasitismos, debe controlar las principales manifestaciones clínicas que pueden poner en peligro la vida del animal, al tiempo que facilite el establecimiento de inmunidad protectiva y retornar a un estado de equilibrio que permita que el animal pueda continuar llevando una vida productiva en ecosistemas endémicos.
En la fase experimental de este estudio, donde terneros de aproximadamente un año de edad, sin exposición previa a hemoparásitos fueron inoculados con dosis moderadas de organismos, se demostró la ocurrencia de parasitemias pero las manifestaciones clínicas fueron moderadas. Esto impidió continuar con el diseño planteado de tratamiento temprano o tardío; solamente tres animales (uno inoculado con B. bigemina y dos del grupo trivalente) fueron tratados de forma temprana debido a la presencia de fiebre y marcada disminución del hematocrito; mientras el resto de los animales se trató al finalizar el experimento. El beneficio del tratamiento fue evidente en los tres casos clínicos confirmados y por lo general en todos los grupos experimentales se demostró la mejora en los parámetros hematológicos luego del tratamiento.
En la fase de campo de este estudio se contaba con situaciones donde la investigación se iniciaba con la detección de animales con afección clínica evidente, que bajo condiciones de campo se pensó requerían de tratamiento; entonces se les recolectaba la muestra y se procedía a la aplicación del fármaco sin conocer el tipo de organismo actuante, realizando muestreos 7 y 14 días luego del tratamiento en una sede y 3, 7 y 15 días en la otra para demostrar su beneficio. Los resultados obtenidos en esta fase del estudio demostraron que los hemoparásitos implicados difirieron en los distintos casos evaluados. En el caso de las muestras procedentes de Tuluá se diagnosticó una situación de anaplasmosis con altas rickettsemias e importantes disminuciones del hematocrito. Aquí la eficacia del tratamiento fue evidente; al día siguiente de la aplicación del producto se presentó restablecimiento de la temperatura, se reanudó el consumo de alimento y el comportamiento habitual de los animales. El hematocrito presentó mejoría en todos los animales tratados.
En el caso de la finca VL del Valle del Sinú el cuadro clínico no era tan marcado pero se demostró infección mixta por A. marginale y Babesia spp. pero a bajos niveles de parasitemia (fluctuando entre 0,01% y 0, 04%). El tratamiento condujo a un incremento significativo en el promedio de los valores de hematocrito con una mejora en tres puntos porcentuales de hematocrito quince días después. Tanto los protozoarios como las rickettsias no fueron evidentes en los frotis sanguíneos recolectados luego del tratamiento.
En la finca CB del Valle del Sinú también se detectó una situación endémica de anaplasmosis y babesiosis con bajos niveles de parasitemia fluctuando entre 0.01% y 0.04% y adicionalmente en un bovino se detectó la presencia de Trypanosoma spp. El hematocrito presentó una mejora significativa luego del tratamiento correspondiente a tres puntos porcentuales a los quince días pos tratamiento. Tres animales del grupo demostraron nuevamente rickettsemia, pero esta investigación demostró que un único tratamiento con el fármaco evaluado ayudó a los animales para la mejora del hematocrito y de su condición clínica.
Estas investigaciones permitieron confirmar que Ganaplus® es un buen medicamento para el tratamiento de los cuadros clínicos asociados con los hemoparásitos de los bovinos que son prevalentes en el trópico colombiano. En ninguno de los casos hubo evidencias que permitieran sugerir la ocurrencia de resistencia a los principios activos del producto.
Agradecimientos
Esta investigación fue financiada por Laboratorios Novartis de Colombia S.A. y la culminación del estudio se logró gracias al esfuerzo conjunto del grupo de trabajo conformado por los autores, pero también de diversos colaboradores de quienes se reconoce su valioso aporte. Un agradecimiento especial al señor Juan Carlos García por permitir el acceso a sus animales durante el tiempo en que se desarrollaron las evaluaciones experimentales en el predio Variety Flowers de Cota y al colega y amigo Aldemar Zuñiga, quién apoyó al equipo de trabajo y prestó toda su colaboración al momento de realizar algunas actividades de campo del proyecto. De la misma manera un sentimiento de gratitud al Sr Drigelio Duarte por brindarnos su amistad y el apoyo incondicional en las actividades de campo y el manejo de los animales de manera impecable en toda la fase experimental del estudio, lo que permitió la culminación del proyecto.
Referencias
1. Allred DR. 2007. Dynamics of anemia progression and recovery in Babesia bigemina infection is unrelated to initiating parasite burden. Vet Parasitol; 146: 170-174. [ Links ]
2. Benavides E. 1985. Consideraciones con relación a la epizootiología de anaplasmosis y babesiosis en los bovinos. Rev ACOVEZ; 9(31): 4-11. [ Links ]
3. Benavides E. 2002. Epidemiología y control de los hematozoarios y parásitos tisulares que afectan al ganado. Carta Fedegan; 72(Anexo coleccionable 9): 112-134. [ Links ]
4. Benavides E, Vizcaíno O, Britto CM, Romero A, Rubio A. 2000. Attenuated trivalent vaccine against babesiosis and anaplasmosis in Colombia. Ann N Y Acad Sci; 916: 613-616. [ Links ]
5. Bock R, Jackson L, De Vos A, Jorgensen W. 2004. Babesiosis of cattle. Parasitol; 129: 247-269. [ Links ]
6. Bundza A, Samagh BS. 1982. Acute anaplasmosis in imported cattle. Can Vet J; 23(11): 337-339. [ Links ]
7. Corrier D. 1975. The epidemiology of bovine anaplasmosis and babesiosis. In: Workshop on hemoparasites (anaplasmosis and babesiosis). Ed. E. A. Wells. Cali, Colombia, CIAT, 23-48. [ Links ]
8. Federation of Animal Science Societies, FASS. 2010. Guide for the care and use of agricultural animals in research and teaching. Third edition. The Federation of Animal Science Societies. 176p. [ Links ]
9. Hoyte HM. 1971. Diferencial diagnosis of Babesia argentina and Babesia bigemina infections in cattle using thin blood smears and brain smears. Aust Vet J; 47(6): 248-450. [ Links ]
10. Kessler RH, Schenk MAM. 1998. Tristeza parasitária dos bovinos (TPB): conceito, etiologia, transmissão, epidemiologia, diagnóstico e controle. In R.H. Kessler, M.A.M. Schenk (Eds.), Carrapato, tristeza parasitária e tripanossomose dos bovinos (pp. 48-67) Embrapa, Campo Grande. [ Links ]
11. Kocan K, De la Fuente J, Guglielmone A, Melendez R. 2003. Antigens and alternatives for control of Anaplasma marginale infection in cattle. Clin Microbiol Rev; 16: 698-712. [ Links ]
12. Kocan KM, De la Fuente J, Blouin EF, Garcia-Garcia JC. 2004. Anaplasma marginale(Rickettsiales: Anaplasmataceae): recent advances in defining host-pathogen adaptations of a tick-borne rickettsia. Parasitology; 129(Suppl): S285-S300. [ Links ]
13. Kuttler KL, Adams L, Zaraza H. 1969. An epidemiologic and geographic survey of Anaplasma marginale and Trypanosoma theileri in Colombia. JAMA; 154: 1398-1399. [ Links ]
14. Kuttler KL, Johnson LW. 1986. Chemoprophylactic activity of imidocarb, diminazene and oxytetracycline against Babesia bovis and B. bigemina. Vet Parasitol; 21(2): 107-118. [ Links ]
15. Lawrence JA, De Vos AJ. 1990. Methods currently used for the control of anaplasmosis and babesiosis: their validity and proposals for future control strategies. Parassitologia; 32(1): 63-71. [ Links ]
16. Mahoney DF, Ross DR. 1972. Epizootiological factors in the control of bovine babesiosis. Aust Vet J; 48(5): 292-298. [ Links ]
17. Mateus G. 1987. Epizootiología de la babesiosis bovina en el piedemonte, área de Villavicencio. Rev ICA; 22(1): 42-54. [ Links ]
18. Otte MJ, Abuabara JY, Wells EA. 1994. Trypanosoma vivax in Colombia: epidemiology and production losses. Trop Anim Health Prod; 26(3): 146-156. [ Links ]
19. Richey EJ, Palmer GH. 1990. Bovine anaplasmosis. Compend Contin Educ Vet; 12(11): 1661-1668. [ Links ]
20. Todorovic RA. 1974. Bovine babesiosis: its diagnosis and control. Am J Vet Res; 35(8): 1045-1052. [ Links ]
21. Vizcaíno O. 1996. Anaplasmosis y babesiosis en bovinos: Avances en su diagnóstico, epidemiología y control. En JE. Quirós, & G. López (Eds.), Epidemiología, Diagnóstico y Control de Enfermedades Parasitarias en Bovinos (pp. 13-23). Medellín, Colombia. [ Links ]
22. Vizcaíno O, Corrier D, Terry M, Carson C, Lee A, Kuttler K, Ristic M, Treviño G. 1980. Comparison of three methods of immunization against bovine anaplasmosis: Evaluation of protection afforded against field challenge exposure. Am J Vet Res; 41(7): 1066-1068. [ Links ]
23. Vizcaíno O, Todorovic RA. 1975. Caracterización de los antígenos de Babesia bovis y Babesia bigemina por los métodos de fijación del complemento, Inmunodifusión, Inmunoelectroforesis e inmunidad cruzada. Rev ICA, 10(2): 77-85. [ Links ]
24. Zar JH. 1996. Biostatistical analysis. 3ra ed. Prentice-Hall International, Englewood Cliffs, New Jersey, USA. 662 p. [ Links ]
25. Zaraza H, Kuttler KL. 1971. Comparative efficacy of different immunization systems against anaplasmosis. Trop Anim Health Prod; 3(2): 77-82. [ Links ]













