Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina Veterinaria y Zootecnia
On-line version ISSN 1900-9607
Ces. Med. Vet. Zootec. vol.7 no.1 Medellín Jan./June 2012
* Para citar este artículo: Camargo O. 2012. Dimorfismo sexual y desviación en la proporción de los sexos en embriones preimplantatorios. Rev Vet Zootec; Vol 7(1): 100-114.
** Autor para correspondencia: Omar Camargo. Universidad Nacional de Colombia Sede Medellín. Calle 59A No 63-20 - Núcleo El Volador, Bloque 50, Oficina 317. Medellín – Colombia. E-mail: ocamargo@unal.edu.co
1 Departamento de Producción Animal, Universidad Nacional de Colombia -Sede Medellín
(Recibido: 27 de marzo de 2012; aceptado: 25 de mayo de 2012)
Resumen
Las diferencias sexuales en tamaño y morfología son comunes en el reino animal y se han explicado principalmente por la selección sexual. De acuerdo con la teoría clásica de la determinación y diferenciación sexual, las diferencias morfológicas entre individuos de la misma especie pero de diferente sexo se empiezan a manifestar poco después y como consecuencia de la formación y desarrollo de las gónadas. No obstante, evidencia creciente coincide en señalar que las diferencias entre machos y hembras se comienzan a manifestar mucho antes de la formación de las gónadas, desde el estado preimplantatorio (semana 1) e inclusive desde el estado cigótico (día 1). Diferencias en la cinética de desarrollo y en el metabolismo energético preimplantatorio han sido explicadas por diferencias genéticas y epigenéticas que les subyacen y que de persistir pueden llegar hasta afectar la normal proporción de los sexos. En la presente revisión sobre el dimorfismo sexual de embriones preimplantatorios se exploran las hipótesis, las evidencias acumuladas, los escenarios (in vivo e in vitro) y, a la luz de los últimos hallazgos, los posibles cambios que deberá enfrentar la embriología.
Palabras clave: Desarrollo temprano, diferencias, in vitro, hembra, macho.
Abstract
Sexual differences in size and morphology are common in the animal kingdom and they have been mainly explained by sexual selection. According to classic theory of sexual determination and differentiation, the morphologic differences between the same specie individuals both different sex starts to show up soon after and as a consequence of the gonads formation and development. However, increasing evidence coincide in signaling that differences between males and females star to be evident long before of gonads formation, from preimplantatory stadium (week 1) or even from zygotic stadium (day 1). Differences in kinetics of development and in energetic preimplantatory metabolism have been explained by genetic and epigenetic differences which underlie it and, in the case of get persistent, they can take them until disrupting the normal sex ratio. In this review about sexual dimorphism in preimplantatory embryos hypothesis, accumulated evidences and scenarios (in vivo e in vitro) are explored, as well as the last findings and possible changes that will have to be faced by the embryology.
Key words: Differences, early development, female, in vitro, male.
Resumo
As diferenças sexuais no tamanho e morfologia são comuns no reino animal e foi explicado principalmente pela seleção sexual. De acordo com a teoria clássica da determinação e diferencia sexual, as diferencias morfológicas entre indivíduos da mesma espécie, porém de diferente sexo começam a manifestar pouco depois e como consequência da formação e desenvolvimento das gônadas. Contudo, evidencia crescente coincide em assinalar que as diferenças entre machos e fêmeas começam a se manifestar muito antes da formação das gônadas, desde o estado preimplantatorio (semana 1) e inclusive desde o estado cigótico (dia 1). Diferenças na cinética de desenvolvimento e no metabolismo energético preimplantatorio foram explicadas por diferenças genéticas e epigenêticas que lhes seguem e que de persistir podem chegar até em afetar a normal proporção dos sexos. Na presente revisão sobre o dimorfismo sexual de embriões preimplantatorios são exploradas as seguintes hipóteses, as evidencias acumuladas, os cenários (in vivo e in vitro) e, à luz dos últimos descobrimentos, as possíveis mudanças que deverá enfrentar a embriologia.
Palavras chave: Macho, fêmea, diferenças, desenvolvimento precoce, in vitro.
Introducción
Se denomina dimorfismo sexual a la existencia de diferencias fenotípicas, no relacionadas con los órganos sexuales, entre individuos de una misma especie pero de diferente sexo. En la mayoría de los mamíferos superiores, las diferencias anatómicas entre sexos caracterizada principalmente por machos de mayor tamaño, son un rasgo casi constante asociado a la acción de las hormonas sexuales y por lo tanto a la formación de las gónadas lo cual marca el comienzo de la diferenciación sexual (semana 6 en embriones humanos y bovinos) y el fin del periodo de indiferenciación sexual o pregonadal que le antecede.
En años recientes se ha hecho evidente que desde el periodo pregonadal ya existen diferencias entre los sexos las cuales han sido atribuidas exclusivamente a las diferencias cromosómicas. Algunos autores se refieren a este periodo como dimorfismo sexual pregonadal y es a esta etapa específica del desarrollo embrionario y a este fenómeno concreto al que se dedica la presente revisión, haciendo especial énfasis en el periodo preimplantatorio de los embriones producidos in vitro, principalmente y tomando como modelo de referencia el bovino por su similitud con el humano.
Si tomásemos en cuenta la definición del término "dimorfismo" en stricto sensu este no podría aplicarse como tal en el caso que nos ocupa ya que las diferencias registradas entre embriones machos y hembras durante su desarrollo preimplantatorio no afectan de manera distintiva y excluyente la morfología de los individuos de uno de los sexos y en su gran mayoría tampoco su ultraestructura. De ser así el sexaje de embriones preimplantatorios sería un procedimiento sencillo y rutinario sin la necesidad del uso de las herramientas moleculares al que nos vemos avocados hoy. Sin embargo, en el presente artículo se hará uso generalizado del término "dimorfismo" para aludir con él a las diferencias entre embriones preimplantatorios; tanto a aquellas que afectan distintivamente la morfología de los embriones según su sexo, como a aquellas que por afectar aspectos moleculares no lo hacen, y que son mayoría.
Desviación en la proporción de los sexos
Embriones in vivo
La mayoría de las desviaciones en la normal proporción de los sexos (50:50) en mamíferos superiores parece obedecer a causales postcigóticas, es decir, a la capacidad de sobrevivencia de embriones de uno de los sexos en función principalmente de factores asociados a la madre, el ambiente materno, el ambiente uterino o el ambiente in vitro.
La teoría evolutiva predice que las madres de diferentes condiciones ajustarán facultativamente la proporción de los sexos de sus hijos en función de su futuro beneficio reproductivo. La hipótesis de Trivers-Willard propone que donde un sexo variable tiene más éxito reproductivo, por ejemplo los machos en especies poliginias, las madres en buenas condiciones, en términos de condición corporal y nivel de glicemia, se verán más favorecidas en cuanto a la continuidad de su paquete genético a próximas generaciones si producen e invierten más de aquel sexo, mientras mad res en pobre condición corporal e hipoglicémicas les es más beneficioso producir más del sexo reproductivo estable. En los programas de reproducción de rinocerontes en cautiverio se ha observado una preocupante desviación en la proporción de los sexos de las crías a favor de los machos explicada en función de la hiperglicemia materna, en este caso inducida por el estrés.
Según la literatura, la desviación en la proporción de los sexos puede obedecer a factores aparentemente tan disímiles como la edad de la madre y su rango social, la dieta materna, la glicemia materna, la condición corporal materna, los niveles de hormonas parentales, el medio ambiente, los protocolos de sincronización y superovulación en vacas, el momento de la inseminación, e incluso las condiciones sociales y materiales de los padres en humanos, entre otros. En la tabla 1 se resumen algunos de los factores que registrados en los padres afectarían la proporción de los sexos de su descendencia.
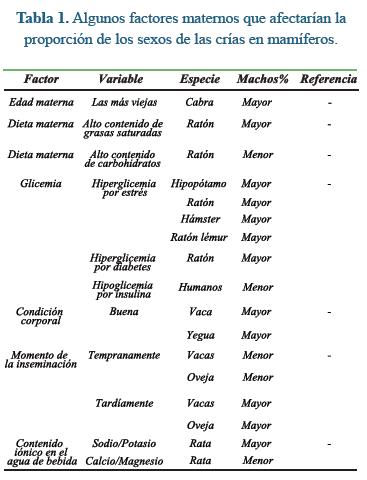
La desviación en la proporción normal de los sexos puede originarse por alteraciones puntuales en el proceso que va desde la inseminación hasta la implantación. Se han postulado cuatro posibles momentos de mayor susceptibilidad: 1) después de la cópula e inseminación favoreciendo la sobrevivencia y desempeño en espermatozoides de un sexo en particular; 2) al momento de la fertilización, facilitándosela a una población de espermatozoides más que a la otra; 3) durante el desarrollo preimplantatorio, privilegiando a los de un determinado sexo y; 4) durante la implantación y el desarrollo post-implantación mediante la reabsorción o aborto selectivo de embriones y fetos en función de su sexo.
Paralelamente, se han sugerido cuatro mecanismos mediante los cuales la madre ajustaría facultativamente la proporción de los sexos de su descendencia: 1) una desviación de la concepción inducida por hormonas: la exposición de los oocitos a elevados niveles de testosterona antes de la ovulación cambiaría a la zona pelúcida de tal manera que la predispondría a la fertilización por parte de espermatozoides Y; 2) una muerte diferencial embrionaria causada por un exceso en el metabolismo de la glucosa; 3) una muerte diferencial embrionaria causada por asincronía entre el embrión en desarrollo y el útero que lo recibe la cual es mediada por progesterona y; 4) una supresión de las hormonas de la preñez y la deprivación de recursos lo cual causaría mayor mortalidad en machos que en hembras.
Embriones in vitro
La desviación en las proporciones normales de los sexos en los embriones producidos in vitro, casi siempre a favor de los machos, algunas veces a favor de las hembras, ha sido asociada principalmente con la presencia de glucosa en los medios de cultivo. Entre otras causas, aunque menos frecuentes pero igualmente admitidas como posibles responsables, se encuentran: la presencia de suero, el tiempo de maduración del oocito o al tiempo transcurrido entre la ovulación/maduración y la fertilización in vitro. Esta ultima asociación causal no ha sido observada en similares diseños experimentales adelantados en modelos in vivo. Los estudios in vitro en donde una desviación en la proporción de los sexos ha sido observada, los medios de cultivo contenían 5.5 mM de glucosa. Se sugiere que concentraciones mayores a 2.5 mM adicionadas al medio de cultivo a las 72 horas post-inseminación causan este efecto.
Se ha aceptado por décadas que la glucosa es tóxica para el oocito durante la fase de maduración bajo el principio que el oocito como tal posee una reducida capacidad para metabolizar la glucosa y que las células del cumulus metabolizan el grueso de la glucosa consumida por el complejo cumulus-oocito para luego proveer de los intermediarios metabólicos al oocito. Igual efecto se le ha atribuido durante el clivaje temprano. No obstante, en los estadios posteriores del desarrollo, sobre todo después de la compactación y la activación mayor del genoma embrionario, la glucosa se convierte en el sustrato energético de elección.
La presencia de glucosa en los medios de cultivo induce importantes modificaciones en el metabolismo embrionario preimplantatorio de manera diferencial entre machos y hembras. Dicho dimorfismo sexual para el metabolismo energético se ha asociado con el dimorfismo sexual para la expresión de algunos genes localizados en el cromosoma X entre los cuales se cuentan el de la glucosa 6-fosfato deshidrogenasa [G6PD], la hipoxantina fosforibosil transferasa [HPRT] y la fosfoglicerato cinasa [PGK]. Una mayor expresión de estos genes en embriones hembras cultivados in vitro se debe posiblemente a la no inactivación oportuna, adecuada y esperada de uno de sus dos cromosomas X. Análisis de embriones hembras y machos en los estadios de mórula y blastocisto generados in vivo, no muestran tal desbalance para la expresión de estas enzimas, indicando que la no compensación de dosis para la expresión de estos genes, ocurre solamente en embriones producidos in vitro. Al igual que en ratones, en embriones bovinos producidos in vitro, la compensación de dosis parece estar retardada y se hace muy evidente en los estadíos de mórula y blastocisto.
Una mayor actividad de la G6PD en embriones hembra cultivados en presencia de glucosa, podría convertirse en una fuente de mensajes metabólicos que, aunque descontextualizados, bastante influyentes sobre el metabolismo energético global lo cual le impediría a los embriones leer realmente su entorno y generar en consecuencia la respuesta fisiológica adecuada. En los embriones bovinos hembra producidos in vitro en presencia de glucosa por encima de 2.5 mM, la vía de las pentosas fosfato [VPF] estaría emitiendo señales erróneas que trastornan el metabolismo energético de la célula. La actividad desproporcionada de esta vía metabólica [VPF] en embriones hembras cultivados in vitro se comenzó a revelar desde los trabajos de Tiff in et al. quienes cultivando embriones bovinos en medios suplementados con 6.11 mM de glucosa hallaron que mientras el metabolismo general de la glucosa era en los machos dos veces el de las hembras, el metabolismo de la glucosa que se metaboliza exclusivamente por la VPF era en las hembras cuatro veces el de los machos.
Dimorfismo sexual
En el modelo clásico formulado por Jost, bajo las condiciones normales de desarrollo in vivo, el desarrollo sexual en la mayoría de los mamíferos pue de ser visto como un proceso ordenado y secuencial en el que cada nuevo paso es dependiente del precedente (Tabla 2).
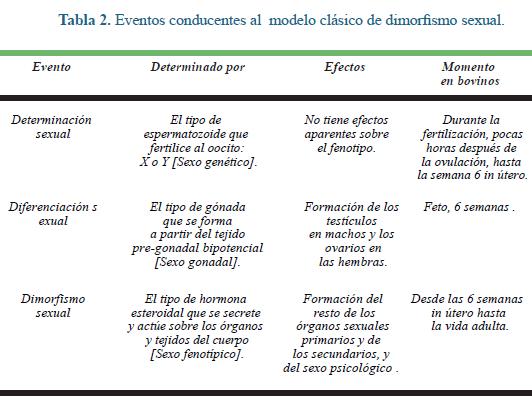
Según este modelo, antes de la semana 6 del desarrollo embrionario, no se registra dimorfismo sexual alguno. No obstante el paradigma imperante, son crecientes los reportes que hablan sobre dimorfismo sexual en los primeros 7 días del desarrollo embrionario in vitro [desarrollo preimpantatorio].
Clásicamente se acepta que el evento con el cual se inicia el fenómeno del dimorfismo sexual es el relacionado con desarrollo de los testículos, el cual se desencadena cuando el gen determinante de los testículos [Sry], ubicado en el cromosoma Y, comienza a expresar adecuadamente la proteína respectiva disparando la primera diferenciación histológica sexualmente dimórfica de que se tenga conocimiento: la formación de las células de sertoli . Esto sucede al fnal de la embriogénesis, día 42. Parecería paracrónico relacionar la expresión del gen determinante de los testículos con el dimorfismo sexual preimplantatorio de los primeros 7 días, sin embargo, en la literatura se reporta la presencia de transcriptos [ARNm] del gen Sry y Zfy en estadios de desarrollo tan temprano que van desde el estado pronuclear hasta el estado de blastocisto, lo cual sugeriría por un lado la existencia de un dimorfismo transcripcional al menos en lo que respecta a la actividad transcripcional de dichos genes y por otro, un comienzo de la diferenciación sexual mucho antes de la diferenciación gonadal.
Se ha sugerido que las responsables de tal dimorfismo sexual en este periodo de indefinición sexual son algunas diferencias epigenéticas derivadas de la presencia de dos cromosomas X activos en las hembras. En concepto de otros autores, el estatus epigenético, especialmente la metilación de ADN o los niveles de metilación o acetilación de histonas, son la base de las diferencias transcripcionales y en consecuencia del dimorfismo sexual.
Cinética de desarrollo
Los reportes acerca de dimorfismo sexual en cuanto a la cinética de desarrollo en embriones producidos in vitro en su mayoría se asocian a una mayor velocidad de desarrollo por parte de los embriones machos la cual eventualmente puede prolongarse y acentuarse hasta afectar la normal proporción de los sexos. El dimorfismo sexual para la cinética de desarrollo embrionario preimplantatorio es atribuido a varias causas: a la presencia de glucosa en el medo de cultivo, a la presencia de suero , la técnica usada para la fertilización in vitro [FIV], a algunas características del semen utilizado, a la acción prematura de factores genéticos asociados al cromosoma Y, el efecto negativo atribuido al cromosoma X, a una acción múltiple de muchos genes orquestada por los cromosomas sexuales y a otros mecanismos aun no conocidos del todo. Finalmente, una acelerada cinética de desarrollo en los embriones machos, también ha sido asociada con una mayor resistencia frente a la criopreservación.
Dimorfismo sexual en el metabolismo
Las diferencias metabólicas reportadas entre embriones machos y hembras producidos in vitro se atribuyen a genes ubicados en el cromosoma X: glucosa 6-fosfato deshidrogenasa [G6PD], hipoxantina fosforibosil transferasa [HPRT] y fosfoglicerato cinasa [PGK]. Algunos estudios han mostrado que los embriones hembras producidos in vitro cuentan con dos cromosomas X activos hasta el estado de blastocisto expandido conduciendo esto a una sobreexpresión de los genes ubicados en él y a una susceptibilidad adicional al desbalance metabólico. La normal inactivación de uno de los cromosomas X en los embriones hembras parece ser afectado tanto por la manipulación in vitro como por el tipo de biotecnología de que sean objeto.
Los genes G6PD e HPRT que juegan un papel muy importante en el metabolismo energético y el control de las cantidades de radicales libres de oxígeno, han sido hallados sobre expresados en embriones bovinos hembras en comparación con los machos. Esta expresión diferencial ha sido confirmada en embriones humanos. Dichos hallazgos confirman las observaciones de Tiffin et al. en 1991, quienes reportaron que embriones bovinos hembras producidos in vitro, en comparación con los machos, registran una actividad cuatro veces mayor en la Vía de las Pentosas Fosfato [VPF], vía metabólica en la cual juegan un papel determinante las enzimas G6PD y la HPRT.
Un producto metabólicamente importante del brazo no oxidativo de la VPF es el NADPH, que como modulador crítico del potencial redox intracelular se constituye en el principal agente reductor en numerosos procesos incluyendo la defensa contra el estrés oxidativo y la lipogénesis. En embriones cultivados en ambientes pro-oxidantes, la competencia para el desarrollo fue mayor en aquellos embriones con mayor actividad de G6PD [hembras] que aquellos con baja actividad. Además existe evidencia que indicaría que los embriones hembra hacen más lipogénesis que los machos [los autores, datos no publicados]. Finalmente, se ha observado que después de la adición de inhibidores de la G6PD tale como la 6-aminonicotinamide [6-AN] o dehydroepiandrosterone [DHEA], a los medios de cultivo embrionario con 4.4mM de glucosa se registra una reducción en la producción del NADPH embrionario, una reducción moderada en las tasas de desarrollo y concomitantemente una reducción o corrección de la desviación de los sexos propia de los medios ricos en glucosa.
La adición a los medios de cultivo de aceptores de electrones tales como la pirrolina-5-carboxilato o la fenazina etosulfato [PES], al anular la función de la NAPDH, por un lado disminuyen la síntesis de lípidos y en consecuencia la anormal acumulación de gotas grasas intracitoplasmáticas observada en embriones cultivados in vitro mientras por otro, aumentan su criotolerancia. Una célula cargada de grasa tiene afectada su capacidad para resistir los procesos de criopreservación. Las mejoras en la criotoleraciatambién han sido observadas con la adición de ácidos grasos poliinsaturados a los medios de cultivo debido tal vez, a la propiedad que tienen estas moléculas para regular negativamente la actividad post-traduccional de la enzima G6PD. Sumando las anteriores evidencias a otras donde se muestra que las hembras son más susceptibles que los machos frente a los procesos de criopreservación y a la nuestra en donde se observa que las hembras en medios de cultivo suplementados con glucosa [4,0 mM] y/o suero [10%] registran una mayor actividad de los genes relacionados con la lipogénesis de novo nos permite sugerir que las regulaciones hechas sobre la VPF orientadas a reducir su actividad mejoraría la sobrevivencia y la criotolerancia principalmente de los embriones bovinos hembras cultivados en presencia de altas concentraciones de glucosa [mayores a 2.5 mM ].
Inactivación de uno de los cromosomas X
Dado que las hembras tienen dos cromosomas X en cada una de sus células somáticas y los machos solo uno, para compensar la asimetría 2:1, en las hembras se da la inactivación de uno de sus cromosomas en un proceso que se llama "compensación de dosis". La inactivación de uno de los cromosomas X [ICX] es un proceso regulado epigenéticamente que incluye modificaciones en el empaquetamiento del DNA y la cromatina, replicación tardía del X inactivo y la expresión de un ARN no traducible, el Xist, el cual cubre uno de los cromosomas X en cis y desencadena el silenciamiento. El Xist es producido por un único locus conocido como el centro de inactivación del X [Xic].
Un indicador de la ICX es la abundancia relativa de ARNm para Xist.
La evidencia sugiere que en los embriones bovinos producidos in vitro la ICX se retarda y que se afecta aún más por efecto de manipulaciones biotecnológicas adicionales como la clonación por ransferencia nuclear. Se ha hallado evidencia de la expresión creciente del Xic tan temprano como desde el estado de clivaje. Otros autores complementariamente han reportado que en blastocisto bovinos la ICX está lejos de su terminación. La presencia de ambos cromosomas parcialmente activos se asocia con una ICX parcial. Se ha observado que la distribución de los genes que escapan a la inactivación a lo largo del cromosoma no es aleatoria, sino agrupada y localizada principalmente en la porción distal del brazo corto [Xp] del cromosoma X, lejos del gen XIST. El retardo en la ICX ha sido asociado con la sobre expresión de genes asociados al cromosoma X, entre ellos los que codifican para G6PD y la HPRT.
Dimorfismo sexual pregonadal genético y epigenéticoLa presencia de transcriptos del gen Sry en embriones preimplantatorios abre la posibilidad de que la diferenciación sexual comience más temprano de lo aceptado actualmente. Aun hoy no se sabe con certeza la función de esos transcriptos. Algunos autores han atribuido el efecto de la mayor rapidez en el desarrollo de los embriones machos a un factor al cual denominan "factor Y de crecimiento" y que asocian al sexo heterogamético. En los mamíferos, se ha establecido que las gónadas masculinas aparecen más temprano que en las hembras mientras en aves, donde el sexo heterogamético corresponde a las hembras, sucede lo contrario, son los ovarios los que aparecen primero durante el desarrollo embrionario. Existen reliquias evolutivas, como es el caso del canguro tammar, que nos muestran que es posible el dimorfismo sexual pregonadal independiente de hormonas.
Otra vía por la cual el componente paterno podía estar afectando las cinéticas de desarrollo embrionario sería a través del cromosoma X paterno. Se ha reportado que el X paterno ejerce un efecto retardante sobre la cinética de desarrollo de embriones hembras. En este mismo sentido, Bermejo y colaboradores al estudiar la expresión diferencial entre embriones bovinos machos y hembras en estado preimplantatorio hallaron que cinco [BEX, CAPN6, BEX2, SRPX2 y UBE2A] de los ocho genes del cromosoma X que mostraron dimorfismo sexual transcripcional, fueron expresados de forma preferente por el cromosoma X paterno lo cual sugeriría que el imprinting podría incrementar el dimorfismo transcripcional causado por la doble dosis del cromosoma X en hembras.
Se ha sugerido además que el efecto ejercido por el componente paterno, llamado "factor Y de crecimiento" podría estar mediado por insulina y sus receptores, o que pueden ser debidas a diferencias en la actividad metabólica, mayor en los machos, orquestadas por la acción del Sry. Al respecto, estudios recientes advierten que los embriones bovinos preimplantatorios machos contienen mayor cantidad de copias de ADN mitocondrial que los embriones bovinos hembras y que, en general, los genes relacionados con la membrana mitocondrial interna son más activos en embriones machos que en los hembra.
Estudios previos habían evidenciado diferencias epigenéticas entre los sexos de embriones bovinos en estado preimplantatorio. Más recientemente, utilizando la tecnología del GeneChip Bovine Genome Array, el grupo de investigación de Gutiérrez-Adán analizó un total de 9322 transcriptos presentes en los blastocistos bovinos machos y hembras producidos in vitro. Reportan que cerca de un tercio de los transcriptos detectados [2921] mostraron expresión sexualmente dimórfica con base en lo cual sugirieren los investigadores que en ausencia de influencias hormonales [estado pregonadal] los cromosomas sexuales ejercen una extensa regulación de la transcripción sobre genes autosomales. El análisis general sugiere una mayor actividad transcripcional global en hembras y una mayor actividad del metabolismo proteico en machos. La mayoría [88.5%] de los transcriptos ligados al cromosoma X, se hallaron sobre-expresados en hembras, aunque la mayoría de ellos [70%] exhibieron cambios no superiores a las 1.6 veces.
Consideraciones finales
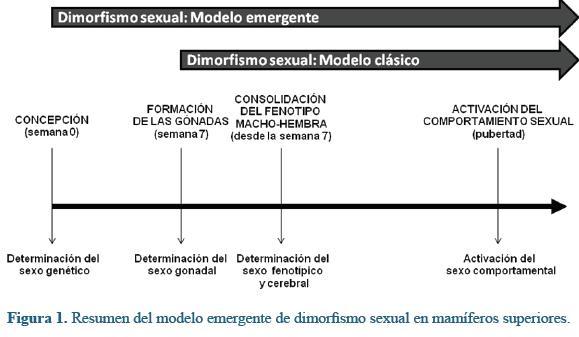
La creciente evidencia acerca del dimorfismo sexual pregonadal temprano sugiere un replanteamiento de paradigma, introduce nuevos conceptos a la vez que representa un nuevo reto en el campo de la embriología (Figura 1). Las diferencias en los patrones de expresión genética registradas entre los embriones preimplantatorios de sexo diferente se hacen manifiestos durante el desarrollo subsecuente mediante variables como la cinética de desarrollo, el metabolismo energético o la misma sobrevivencia. El que machos y hembras sean diferentes desde el primer día significa que para efectos investigativos y algunos efectos médicos (reproducción asistida) los embriones requieren de cuidados diferentes según su sexo. El estado del arte nos permite inferir que en el campo de la producción in vitro de embriones los ambientes comunes para machos y hembras comportan un riesgo parcial dado que en ambientes compartidos un sexo tendrá mayores oportunidades a expensas de los esfuerzos del otro. La desviación circunstancial o inducida en la proporción de los sexos en humanos es un tema que despierta gran interés pero también grandes pasiones dadas sus implicaciones bioéticas. En el campo de la producción in vitro de embriones, un mayor conocimiento al respecto permitiría por ejemplo un mayor control sobre la proporción de los sexos, un mejoramiento en la calidad y cantidad de los embriones producidos in vitro, un mayor entendimiento acerca del origen y tratamiento de ciertos síndromes asociados al sexo y a la manipulación in vitro y adicionalmente un mayor entendimiento acerca de cómo utiliza la naturaleza ciertos atajos para hacer ajustes facultativos en la proporción de los sexos en función del medio ambiente.
Referencias:
1. Agung B, Otoi T, Wongsrikeao P, Taniguchi M, Shimizu R, Watari H, Nagai T. 2005. Effect of maturation culture period of oocytes on the sex ratio of in vitro fertilized bovine embryos. J Reprod Dev 52:123-127. [ Links ]
2. Alomar M, Tasiaux H, S Remacle, George F, Paul D, Donnay I. 2008. Kinetics of fertilization and development, and sex ratio of bovine embryos produced using the semen of different bulls. Animal reproduction science 107:48-61. [ Links ]
3. Ao A, Erickson RP, Winston RM, Handyside AH. 1994. Transcription of paternal Y-linked genes in the human zygote as early as the pronucleate stage. Zygote 2:281-287. [ Links ]
4. Avner P, Heard E. 2001. X-chromosome inactivation: counting, choice and initiation. Nat Rev Genet 2:59-67. [ Links ]
5. Barceló-Fimbres M, Seidel GEJ. 2007. Effects of either glucose or fructose and metabolic regulators on bovine embryo development and lipid accumulation in vitro. Molecular Reproduction and Development 74:1406-1418. [ Links ]
6. Barceló-Fimbres, M, Seidel GEJ. 2007. Effects of fetal calf serum, phenazine ethosulfate and either glucose or fructose during in vitro culture of bovine embryos on embryonic development after cryopreservation. Molecular Reproduction and Development 74:1395-1405. [ Links ]
7. Barnett DK, Bavister BD. 1996. What is the relationship between the metabolism of preimplantation embryos and their developmental competence? Molecular Reproduction and Development 43:105-133. [ Links ]
8. Berkeley EV, Linklater WL, Dierenfeld ES. 2010. ORIGINAL ARTICLE: Dietary impact on circulating glucose profiles in the white rhinoceros. Journal of Animal Physiology and Animal Nutrition:no-no. [ Links ]
9. Bermejo-Álvarez P, Lonergan P, Rath D, Gutiérrez-Adan A, Rizos D. 2010. Developmental kinetics and gene expression in male and female bovine embryos produced in vitro with sex-sorted spermatozoa. Reproduction, Fertility and Development 22:426-436. [ Links ]
10. Bermejo-Álvarez P, Rizos D, Rath D, Lonergan P,. Gutiérrez-Adan A. 2008. Epigenetic differences between male and female bovine blastocysts produced in vitro. Physiol. Genomics 32:264-272. [ Links ]
11. Bermejo-Álvarez P, Rizos D, Rath D, Lonergan P, Gutiérrez-Adan A. 2010. Sex determines the expression level of one third of the actively expressed genes in bovine blastocysts. Proceedings of the National Academy of Sciences 107:3394-3399. [ Links ]
12. Bernardi M, Delouis C. 1996. Sex-related differences in the developmental rate of in-vitro matured/in-vitro fertilized ovine embryos. Hum Reprod. 11:621-626. [ Links ]
13. Biggers J, Whittingham D, Donahue R. 1967. The pattern of energy metabolism in the mouse oocyte and zygote. Zoology 58:560-567. [ Links ]
14. Blanchard P, Festa-Bianchet M, Gaillard JM, Jorgenson JT 2005. Maternal condition and offspring sex ratio in polygynous ungulates: a case study of bighorn sheep. Behavioral Ecology 16:274-279. [ Links ]
15. Blecher S, Erickson R. 2007. Genetics of sexual development: A new paradigm. American Journal of Medical Genetics Part A 143A:3054-3068. [ Links ]
16. Boyer TR, Erickson RP. 1994. Detection of Circular and Linear Transcripts of Sry in Preimplantation Mouse Embryos: Differences in Requirement for Reverse Transcriptase. Biochemical and Biophysical Research Communications 198:492-496. [ Links ]
17. Bredbacka K, Bredbacka P. 1996. Glucose controls sex-related growth rate differences of bovine embryos produced in vitro. J Reprod Fertil 106:169-172. [ Links ]
18. Brennan J, Capel B. 2004. One tissue, two fates: molecular genetic events that underlie testis versus ovary development. Nat Rev Genet 5:509-521. [ Links ]
19. Burgoyne PS. 1993. A Y-chromosomal effect on blastocyst cell number in mice. Development 117:341-345. [ Links ]
20. Callesen H, Lovendahl P, Bak A, Greve T. 1995. Factors affecting the developmental stage of embryos recovered on day 7 from superovulated dairy cattle. J. Anim Sci. 73:1539-1543. [ Links ]
21. Camargo O. 2011. Efecto de la glucosa sobre la abundancia relativa de ARNm de genes lipogénicos en embriones bovinos machos y hembras producidos in vitro. Universidad de Antioquia, Medellín. [ Links ]
22. Camargo RO, Ruiz T, Olivera M. 2008. Modelo teórico para explicar la acumulación de gotas lipídicas en embriones bovinos machos y hembras producidos in vitro Acta biol. Colomb 13:89-102. [ Links ]
23. Cameron EZ. 2004. Facultative adjustment of mammalian sex ratios in support of the Trivers-Willard hypothesis: evidence for a mechanism. Proc. R. Soc. Lond. B 271:1723-1728. [ Links ]
24. Cameron EZ, Lemons PR, Bateman PW, Bennett NC. 2008. Experimental alteration of litter sex ratios in a mammal. Proceedings of the Royal Society B: Biological Sciences 275:323-327. [ Links ]
25. Cameron EZ, Linklater WL. 2007. Extreme sex ratio variation in relation to change in condition around conception. Biology Letters 3:395-397. [ Links ]
26. Cameron EZ, Linklater WL, Stafford KJ, Veltman CJ. 1999. Birth sex ratios relate to mare condition at conception in Kaimanawa horses. Behavioral Ecology 10:472-475. [ Links ]
27. Cao QP, Gaudette MF, Robinson H, Crain WR. 2005. Expression of the mouse testis-determining gene Sry in male preimplantation embryos. Molecular Reproduction and Development 40:196-204. [ Links ]
28. Carrel L, Willard HF. 2005. X-inactivation profile reveals extensive variability in X-linked gene expression in females. Nature 434:400-404. [ Links ]
29. Carrel L, Willard HF. 2005. X-inactivation profile reveals extensive variability in X-linked gene expression in females. Nature 434:400-404. [ Links ]
30. Carvalho RV, Campo MRD, Palasz AT, Plante Y, Mapletoft RJ. 1996. Survival rates and sex ratio of bovine IVE embryos frozen at different developmental stages on day 7. Theriogenology 45:489-498. [ Links ]
31. Côté SD, Festa-Bianchet M. 2001. Offspring sex ratio in relation to maternal age and social rank in mountain goats [Oreamnos americanus]. Behavioral Ecology and Sociobiology 49:260-265. [ Links ]
32. De La Fuente R, Hahnel A, Basrur PK, King WA. 1999. X Inactive-Specific Transcript (Xist) Expression and X Chromosome Inactivation in the Preattachment Bovine Embryo. Biology of Reproduction 60:769-775. [ Links ]
33. Dominko T, First NL. 1997. Relationship between the maturational state of oocytes at the time of insemination and sex ratio of subsequent early bovine embryos. Theriogenology 47:1041-1050. [ Links ]
34. Filosa S, Fico A, Paglialunga F, Balestrieri M, Crooke A, Verde P, Abrescia P, Bautista JM, Martini G. Failure to increase glucose consumption through the pentose-phosphate pathway results in the death of glucose-6-phosphate dehydrogenase gene-deleted mouse embryonic stem cells subjected to oxidative stress. [ Links ]
35. Fountain ED, Mao J, Whyte JJ, Mueller KE, Ellersieck MR, Will MJ, Roberts RM, MacDonald R, Rosenfeld CS. 2008. Effects of Diets Enriched in Omega-3 and Omega-6 Polyunsaturated Fatty Acids on Offspring Sex-Ratio and Maternal Behavior in Mice. Biology of Reproduction 78:211-217. [ Links ]
36. Gardner D. 1998. Changes in requirements and utilization of nutrients during mammalian preimplantation embryo development and their significance in embryo culture. Theriogenology 49:83-102. [ Links ]
37. Grant VJ. 2007. Could maternal testosterone levels govern mammalian sex ratio deviations? Journal of Theoretical Biology 246:708-719. [ Links ]
38. Grant VJ, Chamley LW. 2010. Can mammalian mothers influence the sex of their offspring peri-conceptually? Reproduction 140:425-433. [ Links ]
39. Gray RH, Simpson JL, Bitto AC, Queenan JT, Li C, Kambic RT, Pérez A, Mena P, Barbato M, Stevenson W, Jennings V 1998. Sex ratio associated with timing of insemination and length of the follicular phase in planned and unplanned pregnancies during use of natural family planning. Human Reproduction 13:1397-1400. [ Links ]
40. Grisart B, Massip A, Collette L, F Dessy 1995. The sex ratio of bovine embryos produced in vitro in serum-free oviduct cell-conditioned medium is not altered. Theriogenology 43:1097-1106. [ Links ]
41. Gutiérrez-Adán A, Pérez-Garnelo J, Granados J, Garde M, Pérez-Guzmán B, Pintado, De La Fuente J. 1999. Relationship between sex ratio and time of insemination according to both time of ovulation and maturational state of oocyte. Zygote 7:37-43. [ Links ]
42. Gutiérrez-Adán A, Behboodi E, Murray JD, Anderson GB. 1997. Early transcription of the SRY gene by bovine preimplantation embryos. Mol Reprod Dev.48:246 -250. [ Links ]
43. Gutiérrez-Adán A, Granados J, Pintado B, De La Fuente J. 2001. Influence of glucose on the sex ratio of bovine IVM/IVF embryos cultured in vitro. Reproduction, Fertility and Development 13:361-365. [ Links ]
44. Gutiérrez-Adán A, Lonergan P, Rizos D, Ward FA, Boland MP, Pintado B, Fuente JDI. 2001. Effect of the in vitro culture system on the kinetics of blastocyst development and sex ratio of bovine embryos. Theriogenology 55:1117-1126. [ Links ]
45. Gutiérrez-Adán A, Martínez-Madrid OMB, Pintado B, De La Fuente J. 2000. Differential expression of two genes located on the X chromosome between male and female in vitro-produced bovine embryos at the blastocyst stage. Molecular Reproduction and Development 55:146-151. [ Links ]
46. Gutiérrez-Adán A, Pérez-Crespo M, Fernández-González R, Ramírez MA, Moreira P, Pintado B, Lonergan P, Rizos D. 2006. Developmental Consequences of Sexual Dimorphism During Pre-implantation Embryonic Development. Reproduction in Domestic Animals 41:54-62. [ Links ]
47. Gutiérrez A, De La Fuente J, Fuentes S, Payas A, Ugarte C, Pintado B. 1995. Influence of biopsy sexing and in vitro culture on losses of female mouse and bovine embryos. Animal Biotechnology 6:101-109. [ Links ]
48. Hochi S, Kimura K, Hanada A. 1999. Effect of linoleic acid-albumin in the culture medium on freezing sensitivity of in vitro-produced bovine morulae. Theriogenology 52:497-504. [ Links ]
49. Iwata H, Kimura K, Hashimoto S, Ohta M, Tominaga K, Minami N. 2002. Role of G6PD Activity on Sex Ratio and Developmental Competence of Bovine Embryos under Oxidative Stress. Journal of Reproduction and Development 48:447-453. [ Links ]
50. Iwata H, Shiono H, Kon Y, Matsubara K, Kimura K, Kuwayama T, Monji Y. 2008. Effects of modification of in vitro fertilization techniques on the sex ratio of the resultant bovine embryos. Animal reproduction science 105:234-244. [ Links ]
51. James WH. 2008. Evidence that mammalian sex ratios at birth are partially controlled by parental hormone levels around the time of conception. J Endocrinol 198:3-15. [ Links ]
52. James WH. 2010. Sex ratio of offspring of male mountaineers. Journal of Epidemiology and Community Health 64:96. [ Links ]
53. Jiménez A, Madrid-Bury N, Fernández R, Pérez-Garnelo S, Moreira P, Pintado B, De la Fuente J, Gutiérrez-Adán A. 2003. Hyperglycemia-induced apoptosis affects sex ratio of bovine and murine preimplantation embryos. Molecular Reproduction and Development 65:180-187. [ Links ]
54. Josso N. 2008. Professor Alfred Jost: The Builder of Modern Sex Differentiation. Sex Dev 2:55-63. [ Links ]
55. Kimura K, Spate LD, Green MP, Roberts RM. 2005. Effects of D-glucose concentration, D--fructose, and inhibitors of enzymes of the pentose phosphate pathway on the development and sex ratio of bovine blastocysts. Molecular Reproduction and Development 72:201-207. [ Links ]
56. Kimura, K, Spate LD, Green MP, Roberts RM. 2005. Effects of D-glucose concentration, D-fructose, and inhibitors of enzymes of the pentose phosphate pathway on the development and sex ratio of bovine blastocysts. Molecular Reproduction and Development 72:201-207. [ Links ]
57. Kochhar H, Kochhar K, Basrur P, King W. 2003. Influence of the duration of gamete interaction on cleavage, growth rate and sex distribution of in vitro produced bovine embryos. Animal reproduction science 77:33-49. [ Links ]
58. Krackow S. 1995. The developmental asynchrony hypothesis for sex ratio manipulation. Journal of Theoretical Biology 176:273-280. [ Links ]
59. Krackow S. 1997. Further evaluation of the developmental asynchrony hypothesis of sex ratio variation. 51:243-250. [ Links ]
60. Krackow S, Hoeck HN. 1989. Sex ratio manipulation, maternal investment and behaviour during concurrent pregnancy and lactation in house mice. Animal Behaviour 37:177-186. [ Links ]
61. Kurilo L, Tepliakova N, Lavrikova G. 1987. Development of ovaries in bovine fetuses. Ontogenez 18:500-506. [ Links ]
62. Larson MA, Kimura K, Kubisch HM, Roberts RM. 2001. Sexual dimorphism among bovine embryos in their ability to make the transition to expanded blastocyst and in the expression of the signaling molecule IFN-tau. Proceedings of the National Academy of Sciences:171305398. [ Links ]
63. Latham KE, Patel B, Bautista FDM, Hawes SM. 2000. Effects of X Chromosome Number and Parental Origin on X-Linked Gene Expression in Preimplantation Mouse Embryos. Biology of Reproduction 63:64-73. [ Links ]
64. Linklater WL. 2006. Does excess circulating glucose in pregnant females drive male-biased birth sex ratios? Beginning a study of the world herd funding by the IRF. Proceedings of the Australasian Regional Association of Zoological Parks and Aquaria Annual Conference (Ed. K. Johnson.) pp. 1-6. (Australasian Regional Association of Zoological Parks and Aquaria: Perth,WA. [ Links ]).
65. Linklater WL. 2007. Translocation reverses birth sex ratio bias depending on its timing during gestation: evidence for the action of two sex-allocation mechanisms. Reproduction, Fertility and Development 19:831-839. [ Links ]
66. Lonergan P, Khatir H, Piumi F, Rieger D, Humblot P, Boland MP. 1999. Effect of time interval from insemination to first cleavage on the developmental characteristics, sex ratio and pregnancy rate after transfer of bovine embryos. Journal of Reproduction and Fertility 117:159-167. [ Links ]
67. Lucas-Hahn A, Herrmann D, Lemme E, Korsawe K et. al. 2001. Sex-related expression of the two X chromosome specific transcripts (G6PD, PGK) and the X inactive-specific transcript (XIST) in bovine blastocysts. Theriogenology 55:412. [ Links ]
68. Lyon MF. 1961. Gene Action in the X-chromosome of the Mouse (Mus musculus L.). Nature 190:372-373. [ Links ]
69. Machado AF, Zimmerman EF, Hovland Jr. DN, Weiss R, Collins MD. 2001. Diabetic Embryopathy in C57BL/6J Mice. Diabetes 50:1193-1199. [ Links ]
70. Magnuson A, Bodin L, Montgomery SM. 2007. Father's occupation and sex ratio of offspring. Scandinavian Journal of Public Health 35:454-459. [ Links ]
71. Martin JF. 1997. Length of the follicular phase, time of insemination, coital rate and the sex of offspring. Human Reproduction 12:611-616. [ Links ]
72. Martínez F, Kaabi M, Martínez-Pastor F, Álvarez M, Anel E, Boixo JC, Paz PD, Luis A. 2004. Effect of the interval between estrus onset and artificial insemination on sex ratio and fertility in cattle: a field study. Theriogenology 62:1264-1270. [ Links ]
73. Mathews F, Johnson PJ, Neil A. 2008. You are what your mother eats: evidence for maternal preconception diet influencing foetal sex in humans. Proceedings of the Royal Society B: Biological Sciences 275:1661-1668. [ Links ]
74. McCarthy MM, Wright CL, Schwarz JM. 2009. New tricks by an old dogma: Mechanisms of the Organizational / Activational Hypothesis of steroid-mediated sexual differentiation of brain and behavior. Hormones and Behavior 55:655-665. [ Links ]
75. McMillen M. 1979. Differential mortality by sex in fetal and neonatal deaths. Science 204:89-91. [ Links ]
76. Merighe GKF, Biase FH, Santos-Biase WKF, Miranda MS, de Bem THC, Watanabe YF, Meirelles FV. 2009. Gene silencing during development of in vitro-produced female bovine embryos. Genetics and Molecular Research 8:1116-1127. [ Links ]
77. Miller AP, Willard HF. 1998. Chromosomal basis of X chromosome inactivation: Identification of a multigene domain in Xp1 1.21-p1 1.22 that escapes X inactivation. Proceedings of the National Academy of Sciences of the United States of America 95:8709-8714. [ Links ]
78. Mittwoch U. 2004. The elusive action of sex-determining genes: mitochondria to the rescue? Journal of Theoretical Biology 228:359-365. [ Links ]
79. Mittwoch U. 1971. Sex Determination in Birds and Mammals. Nature 231:432-434. [ Links ]
80. Mittwoch U, Delhanty JDA, Beck F. 1969. Growth of Differentiating Testes and Ovaries. Nature 224:1323-1325. [ Links ]
81. Navara KJ, Nelson RJ. 2009. Prenatal environmental influences on the production of sex-specific traits in mammals. Seminars in Cell & Developmental Biology 20:313-31. [ Links ]
82. Nedambale TL, Dinnyes A, Yang X, Tian XC. 2004. Bovine Blastocyst Development In Vitro: Timing, Sex, and Viability Following Vitrification. Biology of Reproduction 71:1671-1676. [ Links ]
83. Nef S, Verma-Kurvari S, Merenmies J, Vassalli JD, Efstratiadis A, Accili D, Parada LF. 2003. Testis determination requires insulin receptor family function in mice. Nature 426:291-295. [ Links ]
84. Noden D, De Lahunta A. 2001. Embriología de los animales domésticos, 1 ed. Acribia, Zaragoza (Espana). [ Links ]
85. Peippo J, Bredbacka P. 1995. Sex-related growth rate differences in mouse preimplantation embryos in vivo and in vitro. Molecular Reproduction and Development 40:56-61. [ Links ]
86. Peippo J, Farazmand A, Kurkilahti M, Markkula M, Basrur PK, King WA. 2002. Sex-chromosome linked gene expression in in-vitro produced bovine embryos. Molecular Human Reproduction 8:923-929. [ Links ]
87. Peippo J, Kurkilahti M, Bredbacka P. 2001. Developmental kinetics of in vitro produced bovine embryos: the effect of sex, glucose and exposure to time-lapse environment. Zygote 9:105-113. [ Links ]
88. Peippo J, Kurkilahti M, Bredbacka P. 2001. Developmental kinetics of in vitro produced bovine embryos: the effect of sex, glucose and exposure to time-lapse environment. Zygote 9:105-113. [ Links ]
89. Pereira RM, Baptista MC, Vásques MI, Horta AEM, Portugal PV, Bessa RJB, e Silva JC, Pereira MS, Marques CC. 2007. Cryosurvival of bovine blastocysts is enhanced by culture with trans-10 cis-12 conjugated linoleic acid (10t,12c CLA). Animal Reproduction Science 98:293-301. [ Links ]
90. Pérez-Crespo M, Ramírez MA, Fernández-González R, Rizos D, Lonergan P, Pintado B, Gutiérrez-Adán A. 2005. Differential sensitivity of male and female mouse embryos to oxidative induced heat-stress is mediated by glucose-6-phosphate dehydrogenase gene expression. Molecular Reproduction and Development 72:502-510. [ Links ]
91. Perret M. 1990. Influence of social factors on sex ratio at birth, maternal investment and young survival in a prosimian primate. Behavioral Ecology and Sociobiology 27:447-454. [ Links ]
92. Pratt NC, Lisk RD. 1989. Effects of social stress during early pregnancy on litter size and sex ratio in the golden hamster (Mesocricetus auratus). J Reprod Fertil 87:763-769. [ Links ]
93. Pursley JR, Roy WS, Milo CW. 1998. Effect of Time of Artificial Insemination on Pregnancy Rates, Calving Rates, Pregnancy Loss, and Gender Ratio After Synchronization of Ovulation in Lactating Dairy Cows. Journal of dairy science 81:2139-2144. [ Links ]
94. Ray PF, Conaghan J, Winston RML, Handyside AH. 1995. Increased number of cells and metabolic activity in male human preimplantation embryos following in vitro fertilization. J Reprod Fertil 104:165-171. [ Links ]
95. Rivers JPW, Crawford MA. 1974. Maternal nutrition and the sex ratio at birth. Nature 252:297-298. [ Links ]
96. Rjasanowski I, Kloting I, Kovacs P. 1998. Altered sex ratio in offspring of mothers with insulin-dependent diabetes mellitus. Lancet 351:497-498. [ Links ]
97. Roche JR, Lee JM, Berry DP. 2006. Climatic Factors and Secondary Sex Ratio in Dairy Cows. Journal of Dairy Science 89:3221-3227. [ Links ]
98. Roche JR, Lee JM, Berry DP. 2006. Pre-Conception Energy Balance and Secondary Sex Ratio--Partial Support for the Trivers-Willard Hypothesis in Dairy Cows. Journal of Dairy Science 89:2119-2125. [ Links ]
99. Roelofs JB, Bouwman EB, Pedersen HG, Rasmussen ZR, Soede NM, Thomsen PD, Kemp B. 2006. Effect of time of artificial insemination on embryo sex ratio in dairy cattle. Animal reproduction science 93:366-371. [ Links ]
100. Rorie RW. 1999. Effect of timing of artificial insemination on sex ratio. Theriogenology 52:1273-1280. [ Links ]
101. Rosenfeld CS, Roberts RM. 2004. Maternal Diet and Other Factors Affecting Offspring Sex Ratio: A Review. Biology of Reproduction 71:1063-1070. [ Links ]
102. Sheldon BC, West SA. 2004. Maternal Dominance, Maternal Condition, and Offspring Sex Ratio in Ungulate Mammals. The American Naturalist 163:40-54. [ Links ]
103. Smith L, Hateren NV, Willan J, Romero R, Blanco G, Siggers P, Walsh J, R. Banerjee, P. Denn y, C. Ponting, and A. Greenfield. 2003. Candidate testis-determining gene, Maestro [Mro], encodes a novel HEAT repeat protein. Developmental Dynamics 227:600-607. [ Links ]
104. Stabile LP, Hodge DL, Klautky SA, Salati LM. 1996. Posttranscriptional Regulation of Glucose-6-phosphate Dehydrogenase by Dietary Polyunsaturated Fat. Archives of Biochemistry and Biophysics 332:269-279. [ Links ]
105. Stabile LP, Klautky SA, Minor SM, Salati LM. 1998. Polyunsaturated fatty acids inhibit the expression of the glucose-6-phosphate dehydrogenase gene in primary rat hepatocytes by a nuclear posttranscriptional mechanism. Journal of Lipid Research 39:1951-1963. [ Links ]
106. Stephens S, Cheadle E, Smith V. 2007. Reproductive management of the white rhino population (Ceratotherium simum simum) in Australasia - problems and potential solutions. Proceedings of the Australasian Regional Association of Zoological Parks and Aquaria Conference Wellington, New Zealand. [ Links ]
107. Sutton-McDowall ML, Gilchrist RB, Thompson JG. 2010. The pivotal role of glucose metabolism in determining oocyte developmental competence. Reproduction 139:685-695. [ Links ]
108. Suzuki H, Nakamura Y, Yamada K. 1991. Differential cleavage rate and sex ratio of rabbit embryos. Bull. Fac. Agric. Hirosaki Univ. 55:13-20. [ Links ]
109. Tarín JJ, Bernabeu R, Baviera A, Bonada M, Cano A. 1995. Sex selection may be inadvertently performed in in-vitro fertilization-embryo transfer programmes. Human Reproduction 10:2992-2998. [ Links ]
110. Taylor DM, Handyside AH, Ray PF, Dibb NJ, Winston RML, Ao A. 2001. Quantitative measurement of transcript levels throughout human preimplantation development: analysis of hypoxanthine phosphoribosyl transferase. Molecular Human Reproduction 7:147-154. [ Links ]
111. Thompson JG. 2000. In vitro culture and embryo metabolism of cattle and sheep embryos -- a decade of achievement. Animal Reproduction Science 60-61:263-275. [ Links ]
112. Thornhill AR, Burgoyne PS. 1993. A paternally imprinted X chromosome retards the development of the early mouse embryo. Development 118:171-174. [ Links ]
113. Tiffin GJ, Rieger D, Betteridge KJ, Yadav BR, King WA. 1991. Glucose and glutamine metabolism in pre-attachment cattle embryos in relation to sex and stage of development. Reproduction 93:125-132. [ Links ]
114. Tominaga K, Hamada Y, Yabuue T, T A. 2000. Effect of Linoleic Acid-Albumin on Post-Thaw Survival of in vitro-Produced Bovine Embryos at the 16-Cell Stage. J. Vet. Med. Sci. 62:465-467. [ Links ]
115. Tominaga K, Shimizu M, Ooyama S, Izaike Y. 2000. Effect of Lipid Polarization by Centrifugation at Different Developmental Stages on Post-Thaw Survival of Bovine In Vitro Produced 16-Cell Embryos. Theriogenology 53:1669-1680. [ Links ]
116. Trivers RL, Willard D. 1973. Natural selection of parental ability to vary the sex ratio of offspring. Science 179:90-92. [ Links ]
117. Tsunoda Y, Tokunaga T, Sugie T. 2005. Altered sex ratio of live young after transfer of fast- and low-developing mouse embryos. Gamete Research 12:301-304. [ Links ]
118. Vahidi AR, Sheikhha MH. 2007. Comparing the Effects of Sodium and Potassium Diet with Calcium and Magnesium Diet on Sex Ratio of Rats' Offspring. Pakistan Journal of Nutrition 6:44-48. [ Links ]
119. Valdivia R, Kunieda T, Azuma S, Toyoda Y 1993. PCR sexing and developmental rate differences in preimplantation mouse embryos fertilized and cultured in vitro. Mol Reprod Dev 35:121-126. [ Links ]
120. Wai-Sum O, Short RV, Renfree MB, Shaw G. 1988. Primary genetic control of somatic sexual differentiation in a mammal. Nature 331:716-717. [ Links ]
121. Wales RG, Du ZF. 1993. Contribution of the pentose phosphate pathway to glucose utilization by preimplantation sheep embryos. Reproduction, Fertility and Development 5:329-340. [ Links ]
122. Wilhelm D, Martinson F, Bradford S, Wilson M, Combes A, Beverdam A, Bowles J, Mizusaki H, Koopman P. 2005. Sertoli cell differentiation is induced both cell-autonomously and through prostaglandin signaling during mammalian sex determination Developmental Biology 287:111-124. [ Links ]
123. Wilhelm D, Palmer S, Koopman P. 2007. Sex Determination and Gonadal Development in Mammals. Physiological Reviews 87:1-28. [ Links ]
124. Wrenzycki C, Lucas-Hahn A, Herrmann D, Lemme E, Korsawe K, Niemann H. 2002. In Vitro Production and Nuclear Transfer Affect Dosage Compensation of the X-Linked Gene Transcripts G6PD, PGK, and Xist in Preimplantation Bovine Embryos1. Biology of Reproduction 66:127-134. [ Links ]
125. Xu KP, Yadav BR, King WA, Betteridge KJ. 2005. Sex-related differences in developmental rates of bovine embryos produced and cultured in vitro. Molecular Reproduction and Development 31:249-252. [ Links ]
126. Yadav B, King W, Betteridge K. 2005. Relationships between the completion of first cleavage and the chromosomal complement, sex, and developmental rates of bovine embryos generated in vitro. Molecular Reproduction and Development 36:434-439. [ Links ]
127. Zwingman T, Erickson RP, Boyer T, Ao A. 1993. Transcription of the sex-determining region genes Sry and Zfy in the mouse preimplantation embryo. Proc Natl Acad Sci U S A 90:814-817. [ Links ]













