Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
CES Medicina Veterinaria y Zootecnia
versão On-line ISSN 1900-9607
Ces. Med. Vet. Zootec. vol.8 no.2 Medellín jul./dez. 2013
Inmunolocalización hepática de CYP P450 en un experimento de toxicidad subaguda por Clorpirifos 0,0-dietil 0-(3, 5, 6-tricloro-2-piridil fosforotioato) en machos juveniles de tilapia Oreochromis spp)
Liver immunolocation of CYP P450 in an subacute toxicity experiment with Clorpirifos o,o-(3, 5, 6- trichloride -2-pyridyl phosphorotioato in young male tilapia (Oreochromis spp)*
Inmunolocalização hepática de CYP P450 num teste de toxicidade subaguda por Clorpirifos 0,0-dietil 0-(3, 5, 6-tricloro-2-piridil fosforotioato) em machos juvenis de tilápia (Oreochromis spp.)
Jenny Chaparro G1, MV, Msc, DrSc; Diego Alfonso Aranzazu Taborda1, MV, Esp Patol, Msc; Laura Urrea1 Est MV; Berardo de J Rodríguez1*, MV, Esp Patol, PhD
*Autor para correspondencia: Berardo Rodríguez. Carrera 75 No. 65-87 Escuela de Medicina Veterinaria (Medellín, Antioquia, Colombia). E-mail: birdo77@yahoo.com
1 Grupo de Investigación Quirón, Escuela de Medicina Veterinaria, Facultad de Ciencias Agrarias, Universidad de Antioquia, Calle 70 No. 52-21, Medellín, Colombia.
(Recibido: 9 de agosto, 2013; aceptado: 2 de noviembre, 2013)
*Para citar este artículo: Chaparro J, Aranzazu Taborda DA, Urrea L, Rodríguez B de J. Inmunolocalización hepática de CYP P450 en un experimento de toxicidad subaguda por Clorpirifos 0,0-dietil 0-(3, 5, 6-tricloro-2-piridil fosforotioato) en machos juveniles de tilapia (Oreochromis spp). Rev CES Med Zootec. 2013; Vol 8 (2): 61-72.
Resumen
En Colombia son escasas las técnicas de diagnóstico implementadas con biomarcadores inmunohistoquímicos para realizar biomonitoreo de contaminación ambiental. Objetivo: Implementar una técnica inmunohistoquímica para inmunolocalizar CYP 1A en tejidos de peces, luego de realizar un experimento de exposición subaguda al Clorpirifos en tilapias juveniles machos. Métodos: el experimento de dosis subletal, se realizó en un sistema semiestático, con recambio diario del 50% del volumen de agua manteniendo la concentración correspondiente en cada grupo experimental mediante la adición de la mitad de la dosis hasta el día 28. Las concentraciones de Clorpirifos para la exposición fueron 4, 8, y 12 μg/L, en los grupos tratados y 0,0 μg/L en el grupo control. Se tomaron muestras para estudio histopatológico e inmunohistoquímico. Resultados: se encontró diferencia significativa (p<0,05) para algunas lesiones en el hígado, confirmando que este es un órgano de impacto de los efectos del Clorpirifos a bajas dosis. Se verificó la inducción de CYP 1A en el hepatocitos, endotelio y células biliares tanto de los animales expuestos como en los no expuestos. Desde el punto de vista multidimensional no se encontró diferencia estadística entre los tratamientos para las variables estudiadas. Conclusión: se implementó y normalizó una técnica de inmunohistoquímica para la inmunolocalización tisular de CYP 1A, que podrá utilizarse en futuras investigaciones para realizar biomonitoreo de contaminación en las cuencas hidrográficas de Colombia.
Palabras clave: biomarcadores, hígado, inmunohistoquímica, organofosforados, xenobióticos.
Abstract
In Colombia the diagnostic techniques for implementing immunohistochemical biomarkers to fulfill biomonitoring of environmental contamination are limited. Objective: To implement an immunohistochemical technique to immunolocate CYP 1A in the tissue of fish, performing a subacute exposition experiment of Clofopirifos in the liver of young male tilapia. Methods: the sublethal dosage was carried out in semi-static state, with a daily refill of 50% of the water volume, maintaining the corresponding concentration in each group through the addition of half of the dosage until the 28th day. The Cloropirifos concentrations for the exposition were 4, 8, and 12 μg/L in the treated groups and 0.0 μg/L in the control group. Samples were taken for histopathological and immunohistochemical study. Results: A significant difference (p<0.05) for some liver lesions, confirming that it is an organ affected by low dosages of Cloropirifos. It verified that the induction of CYP 1A in hepatocyte, endothelium and biliary cells equally in exposed animals and those that weren't exposed. From a multidimensional perspective, no statistical difference was found between the treatments for the variables under study. Conclusion: this study implemented and normalized an immunohistochemical technique for the tissue immunolocation of CYP 1A that could be used in future investigations to fulfill biomonitoring of contamination in Colombia's hydrographic basins.
Key words: biomarkers, endocrine disruption, immunohistochemistry organophosphate compounds, vitellogenin.
Resumo
Na Colômbia são escassas as técnicas de diagnóstico realizadas com biomarcadores imuno-histoquímicos para realizar biomonitoramento da contaminação ambiental. Objetivo: Estandardizar uma técnica imuno-histoquímica para fazer imunolocalização do CYP 1ª em tecidos de peixes, logo de realizar um experimento de exposição subaguda ao Clorpirifós em machos juvenis de tilápia. Métodos: O teste da dose subletal realizou-se num sistema semiestático, com recambio diário de 50% do volume de água mantendo a concentração correspondente em cada grupo experimental mediante a adição da metade da dose até o dia 28. As concentrações de Clorpirifós para a exposição dos peixes foram 4, 8 e 12 μg/L, nos grupos tratados e 0,0 μg/L no grupo controle. Tomaram-se amostras para o estudo histopatológico e imuno-histoquímico. Resultados: Encontrou-se diferença significativa (p<0.05) para lesões no fígado, confirmando que este é um órgão que recebe diretamente o impacto dos efeitos do Clorpirifos em baixas doses. Verificou-se a indução de CYP 1A nos hepatócitos, endotélio e células biliares tanto nos animais que estiveram expostos ao Clorpirifós quanto nos animais que não estiveram expostos. Desde o ponto de vista multidimensional não se encontrou diferença estadística entre os tratamentos para as variáveis estudadas. Conclusão: Estandardizou-se e normalizou-se uma técnica de imuno-histoquímica para a imunolocalização tissular de CYP 1A, que poderá se utilizada em futuras pesquisas para realizar biomonitoramento da contaminação das bacias hidrográficas da Colômbia, além disto.
Palavras chave: biomarcadores, fígado, imuno-histoquímica, organofosforados, xenobióticos.
Introducción
Algunos autores y la Gobernación de Antioquia en el plan de gobierno 2008-2011, planteo que los desarreglos o "patologías ambientales" son un problema que involucra simultáneamente elementos de los ámbitos biofísico, cultural y de poder; reconoció que el Departamento no cuenta con un sistema de información ambiental consolidado que permita efectuar un diagnóstico profundo y pertinente de las relaciones causales de estos problemas(25,28). Por esta razón planteó como acción prioritaria el diseño e implementación de una metodología, que permita visualizar periódicamente (monitorear) la evolución de ciertos parámetros que definen la calidad del ambiente en el Departamento, haciendo énfasis en las cuencas hidrográficas(20).
La medición de los cambios biológicos inducidos por la contaminación química en los ambientes acuáticos puede ser útil en programas de biomonitoreo para determinar la exposición a tóxicos ambientales(5, 6, 34). Esta aproximación se ha utilizado extensamente en los ecosistemas acuáticos en Norte América(19) y en Europa(19, 27, 34); sin embargo, los estudios de las respuestas biológicas inducidas por los contaminantes en las aguas tropicales y suramericanas son escasos(1,4). Esto se debe entre otras causas a la carencia de especies animales centinelas identificadas y validadas para realizar estos estudios, a la escases de herramientas de diagnóstico implementadas para ese fin y al bajo número de profesionales debidamente capacitados en ictiopatología para realizar esos estudios.
Varias especies de peces se han utilizado para monitorear problemas de toxicología ambiental utilizando pruebas implementadas por la Organización para el Desarrollo y la Cooperación Económica (OECD) y por la Agencia de protección Ambiental de los EEUU (USEPA); sin embargo, estas entidades no incluyen especies propias de Suramérica y mucho menos de Colombia. Estas pruebas permiten medir el impacto de las descargas de desechos tóxicos sobre las fuentes de aguas(6, 18). Esos bioensayos incluyen pruebas de supervivencia, crecimiento y reproducción. Recientemente la atención de los investigadores se ha dirigido hacia el desarrollo de indicadores sensitivos del estrés inducido por la contaminación en las especies acuáticas(3). La identificación y la cuantificación histopatológica de los efectos sobre la salud y de las lesiones inducidas por esos contaminantes, se usan actualmente como biomarcadores de contaminación(6, 35, 36).
La expresión de algunas moléculas o del material genético que las codifica también se ha utilizado como biomarcador de contaminación(24). La enzima citocromo P450 1A monooxigenasa tiene una función importante en la biotransformación de muchos xenobióticos, entre los que se incluyen hidrocarburos aromáticos polinucleares y compuestos organoclorinados(17,33). La exposición de los peces a estos compuestos lleva a la inducción mediada por receptor del gen CYP 1A(1). La respuesta inducida puede analizarse cuantitativamente por medio de técnicas moleculares (RT-PCR, Northerm Blootting) y métodos enzimáticos (EROD) en el nivel catalítico (11). Los estudios inmunohistoquímicos proporcionan información cualitativa sobre la distribución de CYP 1A en células y tejidos de los peces teleósteos(14).
En este contexto, y considerando que los resultados encontrados previamente en Colombia sugieren un efecto tóxico de las fuentes de agua sobre estas especies animales(15), se implementó una técnica de inmunocitoquímica para evaluar la expresión de Citocromo P450 1A (CYP 1A) en tilapias, la principal especie de cultivo en Colombia, mantenidas en condiciones controladas y expuestas de manera subaguda al insecticida organofosforado Clorpirifos, plaguicida más utilizado en este país(2, 25).
Materiales y métodos
Consideraciones éticas
En esta investigación se acató la normatividad vigente en Colombia para la investigación Biomédica: ley 84 de 1989 y las normas reglamentarias de la resolución 08430 de 1993 del Ministerio de Salud. El trabajo fue aprobado para su realización por el Comité de Bioética para la Experimentación Animal de la Universidad de Antioquia, Acta No.44 de agosto de 2008. El personal encargado del experimento observó las medidas de seguridad recomendadas para el uso del producto. El Clorpirifos es un producto aprobado en los Estados Unidos por la FDA-CVM. En Colombia está aprobado su uso como insecticida para el control de insectos de pastos y cultivos por el Instituto Colombiano Agropecuario ICA.
Animales experimentales
Se utilizaron 120 peces machos juveniles de tilapia (Oreochromis spp), con longitud corporal de 15.9±1.5 cm, peso 89.1±10.2 gramos, clínicamente sanos, obtenidos de un mismo desove y criados en estanques de la estación piscícola del Politécnico Colombiano Jaime Isaza Cadavid, en el municipio de San Jerónimo departamento de Antioquia, Colombia.
Condiciones experimentales
El experimento se realizó en el Laboratorio de Bioensayos del Politécnico Colombiano Jaime Isaza Cadavid (San Jerónimo, Antioquia, Colombia) ubicado a una altura de 750 msnm, con una temperatura promedio de 25°C. Los animales experimentales se alojaron en acuarios de vidrio, con capacidad para 64 litros, con aireación constante y filtro XY - 380; se alimentaron con concentrado comercial (34% de proteína) dos veces/día con un suministro del 2% de la biomasa total de cada grupo tanto durante la fase de aclimatación de una semana de duración, como de la fase experimental subletal de 28 días de duración.
Durante el período de aclimatación y durante el transcurso de la fase experimental, se midieron diariamente los parámetros de calidad del agua: temperatura (Termómetro estándar de varilla -10 a 150ºC BRAND), oxígeno disuelto (oxímetro LCD HQ10) y pH (pH-metro PINPOINT). El agua utilizada provenía del acueducto municipal del municipio de San Jerónimo.
El experimento de dosis subletal, se realizó en un sistema semiestático, con recambio diario del 50% del volumen de agua manteniendo la concentración correspondiente en cada grupo experimental mediante la adición de la mitad de la dosis hasta el día 28. Los peces se sometieron a un período de aclimatación de 7 días. Previo al período de aclimatación, los peces se sometieron a un baño en 10 g/L de sal no yodada durante una hora para eliminar ectoparásitos.
Sustancia experimental
El Clorpirifos utilizado (0,0-dietil 0-3,5,6-tricloro-2-piridil fosforotioato), 480 gramos por litro de formulación a 20 °C se adquirió de una fuente comercial Lorsban* 4 EC. Dow AgroSciences. Las diluciones requeridas se realizaron en el agua de acueducto utilizada en los acuarios.
Exposición subaguda
Las concentraciones para la exposición fueron de 4 µg/L, 8 µg/L y 12 µg/L, teniendo como base los estudios previos de toxicidad con Clorpirifos; en los que se determinó que estas son concentraciones subletales y corresponden entre el 4 - 10% de la Concentración Letal (CL) 50 estimada para el estadio de dedinos de tilapia nilótica(30). Con cada concentración se trataron 12 juveniles, con tres replicas para cada tratamiento. El grupo de 12 peces establecido como control no recibió dosificaciones con Clorpirifos.
Anatomopatología
El número de animales vivos y muertos, así como los signos clínicos de los individuos se monitorearon todos los días, por un período de 12 horas hasta la culminación del experimento al día 28. Tres animales por grupo, por cada semana, considerando los peces muertos y los vivos, los días 7, 14, 21 y 28, se sometieron a evaluación macroscópica, y se tomaron muestras de tejido hepático de cada animal para realizar estudio histopatológico. De los animales que murieron durante el experimento, no se tomaron muestras para histopatología, ya que presentaron cambios autolíticos evidentes.
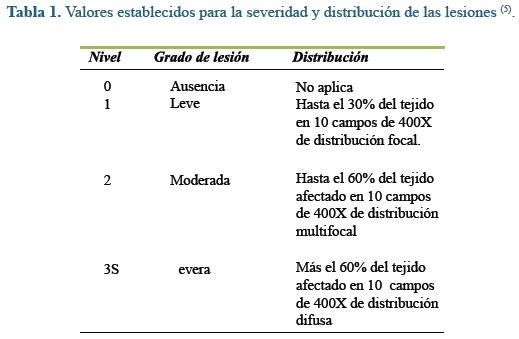
Las muestras se procesaron por técnicas de histopatología convencional, así: se fijaron en formalina tamponada al 4.0%, se incluyeron en parafina, se cortaron a 4 µm de espesor y se colorearon con hematoxilina-eosina como se ha descrito antes32. La evaluación histopatológica se realizó con un microscopio óptico Leica DLM. Para la denominación de las lesiones se utilizaron criterios establecidos previamente por otros investigadores(5, 16 ,32). Las variables identificadas se categorizaron por medio de una escala ordinal de valores según el grado de severidad, de acuerdo a los parámetros propuestos por Bernet et al (1999)(5), como se presenta en la tabla 1.
Las imágenes de lesiones representativas de los diferentes se tomaron con cámara digital una cámara para microscopía digital instantánea Leica EC3 (Leica Microsystems, Heerbrugg, Switzerland).
La detección de CYP 1A se realizó tanto para el grupo control como para los grupos tratados con concentraciones variables de Clorpirifos, utilizando la técnica de inmunohistoquímica Advance (Biocompare, 2008) de acuerdo al protocolo recomendado por Laboratorios Dako(7). El procedimiento se describe a continuación: Para la inmunomarcación de CYP 1A, las muestras de hepatopáncreas se fijaron en formalina bufferada neutra (4,0% de concentración final), se incluyeron en parafina, se realizaron cortes de tejido de 4 µm, posteriormente se colocaron en láminas cubiertas con poli-L-lisina (Slide Tech.® CA. USA) y se secaron en estufa durante toda la noche a 58°C.
Los cortes se desparafinaron, hidrataron y lavaron en agua destilada. Luego se realizó la recuperación antigénica de los cortes sumergidos en buffer citrato a pH 6.0 durante 30 minutos, utilizando un vaporizador a 100°C aproximadamente. Posteriormente se dejaron reposar en la solución buffer durante 30 minutos y se estabilizaron en PBST (Solución phosphate buffered saline whith tween 20) (Merck Chemicals. Darmstad. Alemania), durante 5 minutos. Después, se bloqueó la actividad de la peroxidasa endógena con la aplicación de peróxido de hidrógeno H2O2/ 40% en metanol (Merck Chemicals. Darmstad. Alemania) por 10 minutos.
Los cortes se inmunocolorearon con el anticuerpo monoclonal mouse anti-fish CYP 1A C10-7 (Biosense Laboratorios AS, Bergen, Noruega) a diluciones de 1/200 por una hora a temperatura ambiente. Las diluciones se realizaron en PBS conteniendo 1 % de BSA (Sigma-Aldrich. Saint Louis MO. USA). Luego de la incubación con este anticuerpo primario, los cortes se lavaron con PBST durante 5 minutos, se incubaron con AdvanceTM HRP Link durante 30 minutos (Dako. San Antonio. USA), seguido de un lavado con PBST durante 5 minutos. Luego se incubaron con la enzima Advance 30 minutos, para posteriormente hacer un lavado con PBST durante 10 minutos.
Los cortes se colorearon durante 5 minutos utilizando diaminobenzidina (Sigma-Aldrich. Saint Louis MO. USA) y se realizó contratinción con hematoxilina de Harris durante 60 segundos. Posteriormente los cortes se lavaron con agua corriente y se colocaron 3 segundos en agua amoniacal. Se lavaron nuevamente en agua corriente para finalmente realizar deshidratación, aclaración en xilol y el montaje en resina. Como controles positivos se utilizaron hígado y ovario de tilapia hembra sexualmente madura. Para verificar y controlar la ocurrencia de de tinción inespecífica algunos cortes no se procesaron con el anticuerpo primario.
El conteo se hizo a partir de las nueve microfotografías tomadas del corte histológico del hepatopáncreas de cada pez en un aumento de 1000x. Se tomaron 3 fotos por región siendo éstas región con predominio de hepatocitos, región de hepatopáncreas y región perivascular central. Se contaron positivas aquellas células que tenían expresión de CYP 1A con intensidad de coloración tanto leve, moderada, como fuerte.
Análisis estadístico
Después de obtenidos los análisis de laboratorio se creó una base de datos en el paquete Excel, luego se efectuó su control de calidad verificando la adecuada consignación de la información y se realizó el análisis estadístico referido a continuación.
Se utilizó un diseño de clasificación experimental completamente aleatorizado, efecto fijo, desbalanceado, mediante MANOVA con contraste canónico de tipo ortogonal, determinando vía máxima verosimilitud la dimensionalidad del contraste. Las variables se transformaron con base en la familia BOX - COX debido a la naturaleza probabilística asociada a las mismas. El análisis se suplementó por medio de una función que permitió docidar el efecto de los tratamientos. Se empleó el paquete estadístico SAS versión 8.2.
Resultados
Parámetros de calidad del agua
Los parámetros de calidad del agua se mantuvieron constantes durante la fase experimental. La temperatura promedio en los acuarios fue de 24 ± 0.8 ºC, el pH promedio fue de 6.90 ± 0.20 y el oxígeno disuelto en los acuarios fue de 7.0 ± 0.2 mg/L, con una dureza total del agua de 80 mg/L.
Manifestaciones clínicas
No se observaron manifestaciones clínicas en los peces durante la fase experimental, relacionadas con los tratamientos utilizados durante el período diurno de 12 horas por día de observación de los peces (6:00 a.m. a 6:00 p.m.).
Mortalidad durante el período del ensayo
En el tratamiento de 12 µg/L se presentaron dos muertos para la primera semana del experimento y uno para la tercera semana. En el tratamiento de 8 µg/L solamente se presentó un muerto en la tercera semana del experimento. Para el tratamiento de 4 µg/L se presentaron dos muertes la primera semana del experimento. No se presentó mortalidad en el grupo control. En general, las muertes ocurrieron en horas de la noche, período en que no se observaba a los peces, estos se encontraron en la mañana fuera de los acuarios (saltaron al exterior). Al realizar las necropsias de estos animales sus órganos presentaron autolisis y no fueron aptos para análisis histopatológico.
Hallazgos macroscópicos
La evaluación macroscópica de los hepatopáncreas evidenció en forma general las siguientes características: color rojizo con áreas blanco amarillentas irregulares distribuidas en un patrón multifocal.
Hallazgos histopatológicos
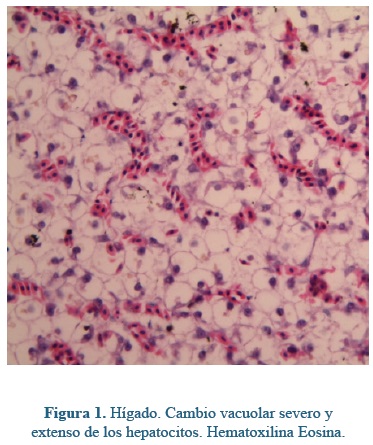
Las lesiones encontradas en los hepatopáncreas fueron: cambio vacuolar (Figura 1), congestión sinusoidal, infiltrado de células granulares eosinofílicas asociadas principalmente a grandes vasos portales, alteraciones nucleares como cariomegalia y binucleación, y por último la presencia de inclusiones eosinófilas en el citoplasma de los hepatocitos. Al realizar el análisis MANOVA se encontró significancia en una dimensión (p<0.0001), para las alteraciones nucleares y la presencia de gránulos citoplasmáticos eosinófilos entre los tratamientos.
Hallazgos inmunohistoquímicos
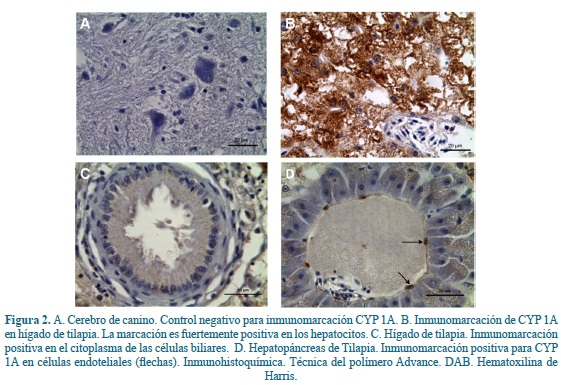
La inmunomarcación de CYP 1A en hepatopáncreas se evidenció intensa en los hepatocitos como granulaciones pequeñas de color pardo en su citoplasma, no se observó zonificación en la distribución de la coloración en el parénquima hepático. Se evidenció coloración de las células biliares, de las células endoteliales y ocasionalmente y con menor intensidad en los pancreocitos (Figura 2). Desde el punto de vista multidimensional no se encontró diferencia estadística entre los tratamientos para las variables dosis de tratamiento, tiempo e inmunolocalización de CYP 1A. El efecto de las dosis fue igual para los diferentes grupos en el órgano evaluado. Los resultados se observaron con relación al P de Wilks Lambda. Las inclusiones intracitoplasmáticas eosinófilas observadas con la coloración de hematoxilina - eosina no fueron positivas para la inmunomarcación.
Discusión
Los parámetros de calidad del agua evaluados durante el experimento no presentaron variaciones significativas entre los diferentes tratamientos. Estos parámetros en general se encontraron dentro del rango adecuado descrito para la especie9 y por lo tanto se considera que estos no se relacionan directamente con las alteraciones encontradas en los peces evaluados.
No se observaron manifestaciones clínicas asociadas a las diferentes concentraciones de Clorpirifos empleadas, aunque los compuestos organofosforados se han considerado responsables de efectos neurológicos y alteraciones del comportamiento debido a su mecanismo de acción(8,21). Estas observaciones difieren de lo observado en trabajos previos de exposición subaguda con Clorpirifos en juveniles de P. reticulata durante 14 días, en los que se evidenciaron manifestaciones clínicas de parálisis y edema ventral que se relacionaron directamente con la dosis del tóxico(12).
Las concentraciones utilizadas en nuestro estudio se ubican entre el 4 y 10% de la CL-50 para la especie y no indujeron efectos clínicamente observables; esto posiblemente se debió a las bajas concentración utilizadas, a una mayor resistencia relacionada con la edad de los individuos y a la sinergia de los dos factores anteriores favoreciendo una detoxificación más eficiente del compuesto tóxico(11).
La toxicidad de los pesticidas es altamente dependiente de la duración, frecuencia, e intensidad de la exposición, pero de igual manera es importante la susceptibilidad del organismo blanco(13, 23, 26), lo que está influenciado por la edad, el estado de salud y la variación genética. La inhibición de la actividad de la enzima acetilcolinesterasa en el cerebro del pez en exposiciones tóxicas a compuestos organofosforados es muy específica y las concentraciones cercanas a la CL50 pueden inducir una disminución del 60% en la actividad fisiológica normal(10,12, 31).
Las muertes ocurridas durante el experimento, probablemente fueron accidentales, ocasionadas por asfixia en peces que escaparon de los acuarios, es importante indicar que las muertes cesaron cuando se utilizaron mayas para cubrir los acuarios.
Histopatología
Las lesiones encontradas en hepatopáncreas coinciden con las descritas previamente por otros investigadores(31). Se encontró diferencia estadística significativa para la frecuencia de lesiones hepáticas entre el grupo control y los grupos tratados, lo que indica un efecto sobre el hígado del Clorpirifos a bajas concentraciones en condiciones de exposición subaguda.
Las alteraciones nucleares presentaron diferencias significativas entre los grupos tratados, con respecto al grupo control, con predominio de cariomegalia y binucleación. Estas lesiones se han reportado previamente en estudios en peces de estuario34 y bajo la exposición al glifosato(15). Estos cambios, y principalmente la cariomegalia se ha observado como una lesión en respuesta a la exposición a tóxicos y a químicos carcinogénicos(35). De esta manera, la detección histopatológica de atipias nucleares podría ser útil como biomarcador de la exposición a contaminantes, donde el Clorpirifos podría desempeñar un papel importante para su desarrollo.
La presencia de inclusiones eosinófilas en el citoplasma de los hepatocitos también fue una lesión relacionada directamente a las mayores concentraciónes de Clorpirifos. Al parecer estos gránulos hialinos están compuestos esencialmente de albúmina sérica y el desarrollo de estas inclusiones citoplasmáticas se puede deber al aumento en su disponibilidad y a alteraciones en la permeabilidad producidas por un incremento en la presión portal. Ultraestructuralmente las gotas hialinas poseen una matriz granular limitada por retículo endoplásmico rugoso, o bien pueden estar constituidas por lisosomas secundarios. Esta lesión se ha asociado a excesos de proteína(22) y se ha observado en peces expuestos a glifosato15. En este estudio se constata que también puede ser ocasionada por exposición subaguda a Clorpirifos.
Inmunohistoquímica
En éste trabajo se verificó la inducción de CYP 1A tanto en los hígados de los animales expuestos a bajas concentraciones de Clorpirifos 4, 8 y 12 µg/L, como en los de los no expuestos. La expresión de CYP 1A en el hígado de los peces en este estudio, es consistente con lo comunicado por otros autores quienes resaltan la importancia de este órgano en el metabolismo y la excreción de xenobióticos24,33. Aunque la expresión de CYP 1A en los hepatocitos puede ser constitutiva, su expresión en células endoteliales y biliares se ha considerado de naturaleza inducida, como se observó en este estudio(11,14).
La enzima citocromo monoxigenasa dependiente P450, comprende una familia de proteínas que participan en el metabolismo oxidativo de un amplio rango de sustratos que incluyen químicos ambientales, entre los que se incluyen hidrocarburos aromáticos polinucleares y compuestos organoclorinados(14, 24, 33). Los xenobióticos inducen la síntesis de novo de CYP 1A en mamífero y en peces(17), por esta razón se ha sugerido su uso como biomarcador en estudios de monitoreo de contaminación en el ambiente acuático(14,17). Un amplio número de estudios en las últimas décadas ha establecido que CYP 1A se aumenta en peces muestreados en aguas contaminadas(14).
Las especies acuáticas parecen ser particularmente vulnerables a los tóxicos ambientales, debido a que sus ecosistemas reciben una amplia variedad de contaminantes(35,36). Este es el caso del presente trabajo donde la inmunomarcación para CYP 1A se presentó tanto en los animales tratados con Clorpirifos, como en el grupo control sin tratamiento en células endoteliales y biliares. Lo anterior sugiere que la expresión observada en machos de tilapia se debe a xenobióticos circulantes en el agua utilizada en este experimento, procedente de un acueducto municipal, la cual es empleada para el consumo humano, por lo que puede constituir un riesgo para la salud pública.
En este estudio se implementó y normalizó una técnica de inmunohistoquímica para la inmunolocalización tisular de CYP 1A, que podrá utilizarse en futuras investigaciónes, junto con otras técnicas implementadas previamente por este grupo para realizar biomonitoreo de contaminación en las cuencas hidrográficas de Colombia.
Los resultados de este estudio, junto con los obtenidos por otros investigadores en Colombia evaluando el impacto de los herbicidas y sus mezclas(15, 28, 29), son documentos que sugieren la necesidad de establecer programas de monitoreo en nuestro medio que proporcionen información para la toma de decisiones, que ayuden a evaluar el impacto de estos contaminantes para la salud animal, para la salud pública, y para actualizar nuestra legislación al respecto.
Agradecimientos
Los autores agradecen al Politécnico Jaime Isaza Cadavid por el apoyo brindado durante la ejecución de éste trabajo en sus instalaciones: Laboratorio de Bioensayos (San Jerónimo, Antioquia). A la señora Beatriz Vieco del Laboratorio de Patología del Hospital San Vicente de Paúl. La ejecución de esta investigación fue posible gracias a los recursos de la convocatoria CODI para proyectos de menor cuantía 2010 de la Universidad de Antioquia, concedidos al grupo de investigación en Patobiología Quirón.
Referencias
1. Al-Arabi SA, Goksøyrc A. Cytochrome P4501A responses in two tropical fish species, riverine catfish (Rita rita) and marine mudfish (Apocryptes bato). Comp Biochem Physiol C 2002;131:61-71. [ Links ]
2. Arboleda JP, Peinado JE, Urdaneta MA, Carrascal E. Informe nacional sobre uso y manejo de plaguicidas en Colombia, tendiente a identificar y proponer alternativas para reducir el escurrimiento de plaguicidas al Mar Caribe. Ministerio del Medio, proyecto PNUMA//UCR/CAR. 2000; [23/03/2006] URL: http://www.ine.gob.mx/cenica/cydif/seminario/c/. [ Links ]
3. Banerjee S, Bhattacharya S. Histopathology of kidney of Channa punctatus exposed to chronic nonlethal level of Elsan, mercury and ammonia. Ecotoxicol Environ Saf 1994; 29: 265-275. [ Links ]
4. Bainy A, Woodin B, Stegeman J. Elevated levels of multiple cytochrome P450 forms in tilapia from Billings Reservoir-São Paulo, Brazil. Aquat Toxicol 1999; 44: 289-305. [ Links ]
5. Bernet D, Schmidt H, Meier W, Burkhardt-Holm P, Wahli T. Histopathology in fish: proposal for a protocol to asess aquatic pollution. J. Fish Dis 1999; 22: 25-34. [ Links ]
6. Beyer J, Bechmann RK, Taban IC, Aas E, Reichert W, Seljeskog E, Sanni S. Biomarker measurements in long term exposures of a model fish to produced water components (PAHs and alkylphenols). Akvamiljø 2007; 2: 1-28. [ Links ]
7. Biocompare. The buyer's guide for life scientist. Rabbit / Mouse Ig Kit, Advance-HRP Detection from Dako. [acceso: Julio de 2008] URL: http://www.biocompare.com/Product.Details.html. [ Links ]
8. Córdoba D. Toxicología. 4ta. Ed. Colombia: Manual Moderno Bogotá; 2001. [ Links ]
9. Córdoba J. Calidad de agua: su papel en la producción acuícola. En: I Curso - Seminario Internacional de Patología y Sanidad Piscícola. Bogotá Colombia, 2006. [ Links ]
10. Chandrasekara LWHU, Pathiratne A. Body size-related differences in the inhibition of brain acetylcholinesterasa activity in juvenile Nile tilapia (Oreochromis niloticus) by chlorpyriphos and carbosulfan. Ecotoxicol Environ Saf 2007; 67: 109-119. [ Links ]
11. Dai D, Tang J, Rose R, Hodsong E, Bienstock R, et al. Identification of variants of CYP3A4 and characterization of their abilities to metabolize testosterone and chlorpyrifos. Pharmacology 2001; 29: 825-823. [ Links ]
12. De Silva PMCS, Samayawardhena LA. Effects of Clorpirifoson reproductive performances of guppy (Poecilia reticulata). Chemosphere 2005; 58: 1293-1299. [ Links ]
13. De Silva PMCS, Samayawardhena LA. Low concentrations of Lorsban in water result in far reaching behavioral an histological effects in early life stages in guppy. Ecotoxicol Environ Saf 2002; 53: 248-254. [ Links ]
14. Desantis S, Corriero A , Cirillo F. Immunohistochemical localization of CYP1A, vitellogenin and zone radiate proteins in the liver of swordfish (Xiphias gladius L) taken from the Mediterranean Sea, South Atlantic, South Western Indian and Central North Pacific Oceans. Aquat Toxicol 2005; 71:1-12. [ Links ]
15. Eslava PR, Ramírez WF, Rondón IS. Sobre los efectos del glifosato y sus mezclas: impacto en peces nativos. Universidad de los Llanos. Colombia: Juan XXIII; 2007. [ Links ]
16. Ferguson H W. Systemic Pathology of Fish. Scotian Press. London 2006. [ Links ]
17. Fink-Gremmels J. Implications of hepatic cytochrome P450-related biotransformation processes in veterinary sciences. Eur J Pharmacol 2008; 585: 502-509. [ Links ]
18. Frenzilli G, Falleni A, Scarcelli V, Del Barga I, Pellegrini S, Savarino G, et al. Cellular responses in the cyprinid Leuciscus cephalus from a contaminated freshwater ecosystem. Aquat Toxicol 2008; 10: 6-16. [ Links ]
19. Giesy JP, Solomon KR, Coats JR, Dixon KR, Giddings JM, Kenaga EE. Chlorpyrifos: Ecological Risk Assessment in North American Aquatic Environments. Rev Environ Contam Toxicol 1999; 160: 1-129. [ Links ]
20. Gobernación de Antioquia. Plan de Gobierno 2008-2011; 194-199 [ Links ]
21. Gul A. Investigation of acute toxicity of clorpirifos-metyl on Nile tilapia (Oreochromis niloticus L.) larvae. Chemosphere 2005; 59: 163-166. [ Links ]
22. Iregui CA, Hernández E, Jiménez A, Pulido A, Rey AL, Comas J, et al. Primer Mapa Epidemiológico de las Enfermedades de los Peces en Colombia. Universidad Nacional de Colombia, Facultad de Medicina Veterinaria y de Zootecnia,Grupo de Fisiopatología veterinaria. Ministerio de Agricultura y Desarrollo Rural. Bogotá D.C,; 2004. [ Links ]
23. Jiraungkoorskula W, Upathama ES, Kruatrachuea M, Sahaphongc S, Vichasri-Gramsa S, Pokethitiyooka P. Histophatological effects of Roundup, a glyphosate herbicide, on Nile tilapia (Oreochromis niloticus). Sci Asia 2002; 28: 121-127. [ Links ]
24. Lee YM, Williams TD, Jung SO, Lee JS. cDNA cloning and expression of a cytochrome P450 1A (CYP1A) gene from the hermaphroditic fish Rivulus marmoratus. Mar Pollut Bull 2005; 51: 769-775. [ Links ]
25. Loaiza A, Jaramillo J, León F. Incidencia de factores sociales, económicos, culturales y técnicos en el uso de agroquímicos por pequeños productores del departamento de Antioquia. Programa Nacional de Transferencia de Tecnología. PRONATTA, Instituto Colombiano Agropecuario, ICA. Diciembre 2000; 172p. [ Links ]
26. Mahmut S, Sarikaya R, Erkoc F, Kocak O. Investigation of acute toxicity of clorpirifos-metyl on guppy Poecilia reticulata. Chemosphere 2005; 60: 93-96. [ Links ]
27. Matthiessen P, Johnson I. Implications of research on endocrine disruption for the environmental risk assessment, regulation and monitoring of chemicals in the European Union. Environ Poll 2006; 146: 9-18. [ Links ]
28. Morales CA, Rodríguez N. El Clorpirifos: posible disruptor endocrino en bovinos de leche. Rev Col Cienc Pec 2004; 17: 255-266. [ Links ]
29. Murcia MA, Stashenko E. Determinación de plaguicidas organofosforados en vegetales producidos en Colombia. Agro Sur 2008; 36: 71-81. [ Links ]
30. Pathiratne, A., Athauda, P. Toxicity of chlorpyrifos and dimethoate to fingerlings of the Nile tilapia, Oreochromis niloticus: cholinesterase inhibition. Sri Lanka J. Aquatic Sci. 1998; 3: 77-84. [ Links ]
31. Rajeswary S, Ramudu K. Studies on toxicological effects of chlorpyrifos in the brain of freashwater fish, Oreochromis mossambicus (Peters) under subletal exposure. Environmental crisis and Security in the new millennium. 2005; 241- 248. [ Links ]
32. Roberts RJ. Fish Pathology. W B Saunders, Edinburgh 2001. [ Links ]
33. Smith EM, Wilson JY. Assessment of cytochrome P450 fluorometric substrates with rainbow trout and killifish exposed to dexamethasone, pregnenolone-16_-carbonitrile, rifampicin, and naphthoflavone. Aquat Toxicol 2010; 97: 324-333. [ Links ]
34. Simpson MG, Parry M, Kleinkauf A, Swarbreck D, Walker P, et al. Pathology of the liver, kidney and gonad of flounder (Platichthys flexus) from a UK estuary impacted by endocrine disrupting chemicals. Mar Environ Res 2000; 50: 283-287. [ Links ]
35. Stentiford GD, Longshaw M, Lyons BP, Jones G, Green M, Feist SW. Histopathological biomarkers in estuarine fish species for the assessment of biological effects of contaminants. Mar Environ Res 2003; 55: 137-159. [ Links ]
36. Thophon S, Kruatrachue M, Upatham ES, Pokethitiyook P, Sahaphong S, Jaritkhuan S. Histopathological alterations of white seabass, Lates calcarifer, in acute and subchronic cadmium exposure. Environ Pollut 2003; 121: 307-320. [ Links ]