Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina Veterinaria y Zootecnia
On-line version ISSN 1900-9607
Ces. Med. Vet. Zootec. vol.8 no.2 Medellín July/Dec. 2013
Diseño y evaluación de una prueba de PCR para detección de Brucella spp. y Brucella abortus
Design and evaluation of a PCR test for detection of Brucella spp. and Brucella abortus*
Desenho e avaliação de um teste de PCR para a detecção de Brucella spp. e Brucella abortus
*Miryan Margot Sánchez-Jiménez1, Bact, MSc; Nora Cardona-Castro1*, MD, MSc
* Autor para correspondencia: Nora Cardona-Castro. Universidad CES. E-mail: ncardona@ces.edu.co.
1Grupo Medicina Tropical, Instituto Colombiano de Medicina Tropical - Universidad CES. Carrera 43ª # 52 Sur 99, Sabaneta, Antioquia.
(Recibido: 1 de marzo, 2013; aceptado: 26 de octubre, 2013)
*Para citar este artículo: Sánchez-Jiménez MM, Cardona-Castro N. Diseño y evaluación de una prueba de PCR para detección de Brucella spp. y Brucella abortus. Rev CES Med Zootec. 2013; Vol 8 (2): 73-82.
*Basado en el número de casos humanos reportados y depende de una combinación de exposición al patógeno e infectividad.
Resumen
Problema: el diagnóstico oportuno de la brucelosis, zoonosis que afecta ganado y trabajadores pecuarios, es difícil. Las pruebas serológicas Rosa de Bengala y ELISA, el hemocultivo y mielocultivo, tienen sensibilidades entre 15-70% dependiendo del estadío de la infección. El desarrollo de métodos diagnósticos rápidos, sensibles y específicos utilizando técnicas moleculares como la PCR, permite diagnosticar y tratar oportunamente esta enfermedad. Objetivo: Desarrollar y evaluar dos pruebas de PCR para detección de Brucella spp. y B. abortus. Materiales y métodos: se diseñaron y evaluaron iniciadores para detectar el gen ugpA utilizando Primer3, y otros reportados en la literatura. Se calculó sensibilidad y especificidad, usando 3 grupos (G) de muestras humanas y bovinas utilizando el teorema de Bayes: G1:30 muestras de suero y 30 de sangre de humanos sanos y 30 de suero y 30 de sangre de bovinos sanos, inoculadas con Brucella abortus; G2: 30 muestras de suero y 30 de sangre de humanos sanos y 30 de suero y de 30 sangre de bovinos sanos inoculadas con Salmonella Typhi, Escherichia coli, Klebsiella sp., Psudomonas aeruginosa, Staphylococcus aureus, Streptococcus pneumoniae y Enterococcus sp. G3: 60 muestras de suero y 60 sangre de bovinos y 60 muestras de suero y 60 sangre de humanos asintomáticos. Resultados: se obtuvo una sensibilidad y especificidad de detección de Brucella sp. y Brucella abortus del 100% en muestras humanas y bovinas. Conclusiones: por la alta sensibilidad y especificidad encontradas en las pruebas de PCR estudiadas, se recomienda continuar un estudio clínico de aplicación para evaluar su comportamiento en muestras de pacientes y animales infectados.
Palabras clave: Brucella spp, B. abortus, PCR, zoonosis.
Abstract
Problem: brucelosis is a zoonosis that affects livestock and livestock workers. This disease is characterized by the difficulties for its early diagnosis. Sensitivity of marrow and blood cultures as well as serological tests (Rose Bengal and ELISA) ranges between 15 and 70%, depending on the stage of infection. Development of rapid, sensitive, and specific diagnostic methods using molecular techniques such as PCR would allow timely diagnose and treatment of the disease. Objective: To develop and evaluate two PCR tests for detection of Brucella spp. and B. abortus. Materials and methods: primers to detect ugpA gene were designed and evaluated using Primer3 and others reported in the literature. Sensitivity and specificity were calculated for 3 groups (G) of human and bovine samples using Bayes' theorem. G1 consisted of healthy human and healthy bovine samples (30 serum and 30 blood samples of each species); bovine blood samples were inoculated with Brucella abortus. G2 consisted of healthy human and healthy bovine samples (30 serum and 30 blood samples of each); bovine blood samples were inoculated with Salmonella typhi, Escherichia coli, Klebsiella sp., Pseudomonas aeruginosa, Staphylococcus aureus, Streptococcus pneumonia, and Enterococcus sp. G3 consisted of 60 serum and 60 blood samples from asymptomatic bovines, as well as 60 serum and 60 blood samples from asymptomatic humans. Results: sensitivity and specificity of the PCR test to detect Brucella sp. and Brucella abortus reached 100% in human and bovine samples. Conclusiones: considering the high sensitivity and specificity observed in the PCR tests studied, we recommend doing a follow up of the test in a clinical trial to evaluate its performance in infected humans and animals.
Key words: Brucella spp, B. abortus, PCR, zoonoses.
Resumo
Problema: é difícil o diagnostico oportuno da brucelose, zoonose que afeta o gado e os trabalhadores pecuários. Os testes serológicos Rosa de Bengala e ELISA, e a hemocultura e mielocultura têm sensibilidades entre 15 e 70% dependendo do estádio da infecção. O desenvolvimento de métodos diagnósticos rápidos, sensíveis e específicos utilizando técnicas moleculares como a PCR, permite diagnosticar e tratar oportunamente esta doença. Objetivo: desenvolver e avaliar dois testes de PCR para a detecção de Brucella spp. e B. abortus. Materiais e métodos. Desenharam-se e avaliaram-se iniciadores utilizando o software Primer3 para detectar o gene ugpA, também se avaliaram outros iniciadores reportados previamente na literatura. Calculou-se a sensibilidade e especificidade do teste por PCR usando três grupos (G) de amostras humanas e bovinas utilizando o teorema de Bayes: G1: 30 amostras de soro e 30 de sangue de humanos sãos e 30 de soro e 30 de sangue de bovinos sãos, inoculadas com Brucella abortus; G2: 30 amostras de soro e 30 de sangue de humanos sãos e 30 de soro e de 30 sangue de bovinos sãos inoculadas com Salmonella Typhi, Escherichia coli, Klebsiella sp., Psudomonas aeruginosa, Staphylococcus aureus, Streptococcus pneumoniae e Enterococcus sp. G3: 60 amostras de soro e 60 de sangue de bovinos e 60 amostras de soro e 60 sangue de humanos assintomáticos. Resultados. Obteve-se uma sensibilidade e especificidade de detecção da Brucella spp. e Brucella abortus de 100% em amostras humanas e bovinas. Conclusões: pela alta sensibilidade e especificidade encontrada com o teste de PCR estudado, recomenda-se continuar um estudo clínico de aplicação para avaliar seu comportamento em amostras de pacientes e animais infetados.
Palavras chave: Brucella spp, B. abortus, PCR, zoonose.
Introducción
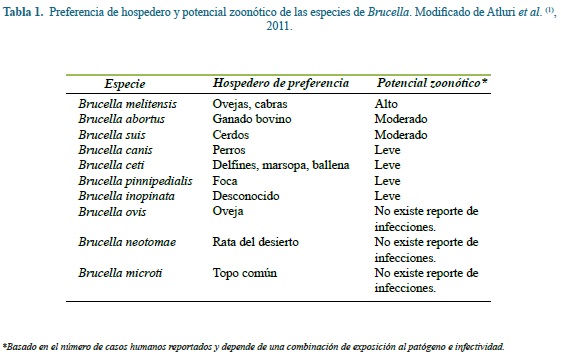
La brucelosis es una importante zoonosis de impacto económico, que produce graves complicaciones en animales y humanos. Es causada por bacilos Gram negativos del género Brucella, al que pertenecen 10 especies descritas en la tabla 1. La especie de mayor patogenicidad en el humano es B. melitensis.
La brucelosis es una enfermedad granulomatosa crónica causada por una bacteria intracelular(2). En el ser humano la infección se da por el consumo de productos derivados de animales como leche sin pasteurizar, a través del contacto directo con partes de animales infectados y a través de la inhalación de partículas aerosoles infectadas(3). El periodo de incubación varía entre dos a 4 semanas y se clasifica desde el punto de vista clínico en aguda, subaguda y crónica(4).
Entre los síntomas más frecuentes se encuentran decaimiento físico, fiebre, escalofríos, sudoración, mialgias, artralgias y cefaleas, dolor de piernas y articulaciones, irritabilidad, depresión e insomnio y alteraciones vasomotoras y taquicardia entre otros, que dependen del sitio anatómico donde se ubique la bacteria(5).
La brucelosis humana se considera una enfermedad ocupacional en trabajadores pecuarios, ordeñadores, obreros de salas de beneficio, médicos veterinarios y en general de todas aquellas personas que manipulan animales o material proveniente de estos sin adecuadas medidas de bioseguridad.
Aproximadamente medio millón de nuevos casos de brucelosis humana, son reportados cada año en todo el mundo(6), aunque se considera que este dato es un sub registro del número real de casos, debido a la falta de un adecuado diagnóstico de esta enfermedad.
En el mundo predomina B. melitensis pero en Colombia se ha identificado hasta el momento solo la presencia de B. abortus como la principal causante de infección en ganado bovino, pero no se tienen datos exactos sobre el número de casos en humanos(7).
En nuestro país, la brucelosis bovina se diagnostica a través de pruebas serológicas como la Rosa de Bengala y el Ensayo Inmunoabsorbente Ligado a Enzimas (ELISA). La brucelosis humana, además de las dos pruebas anteriores, se puede diagnosticar también por clínica, hemocultivo y mielocultivo en medio Ruiz-Castañeda, siendo los cultivos las pruebas de oro(8), con sensibilidades que varían dependiendo de las prácticas de cada laboratorio, entre un 15 a un 70%(9).
El desarrollo de un método diagnóstico definitivo para brucelosis permanece todavía pendiente.
La utilización de técnicas moleculares como la prueba de reacción en cadena de la polimerasa, PCR, permiten en forma rápida, sensible y específica determinar la infección en muestras clínicas, pues detectan directamente ADN circulante de la bacteria y no requiere que este intacta. Esta prueba se convierte en una técnica innovadora de fácil realización y de más bajo costo y rapidez que el cultivo bacteriológico convencional(10).
En Colombia, no se conoce con certeza el problema de salud pública que representa la brucelosis debido a las dificultades diagnósticas ya que no se encuentran disponibles aún comercialmente métodos rápidos, sensibles y específicos. Se evidencia así la necesidad de disponer de un método de diagnóstico con las características mencionadas, para detectar directamente de la muestra clínica a Brucella sp.
En este trabajo se diseñaron y evaluaron iniciadores para la detección del género Brucella y para B. abortus directamente de muestras de sangre total y suero humanas y bovinas inoculadas experimentalmente, con el fin de calcular la sensibilidad y especificidad bajo condiciones de laboratorio, en los diferentes grupos de muestras.
Materiales y métodos
Tipo de Estudio
Este estudio se diseñó de acuerdo a las normas para evaluar una prueba (Prueba de una prueba)(11).
Muestra
La muestra para probar la sensibilidad (S), la especificidad (E), el valor predictivo positivo (VPP) y el valor predictivo negativo (VPN) de la PCR, se determinó utilizando una prevalencia de la enfermedad del 50%. Se seleccionaron tres grupos de muestras, cada uno de ellos con diferentes características:
Grupo 1: 30 muestras de suero y 30 de sangre total de bovinos y 30 muestras de suero y 30 de sangre total de voluntarios humanos sanos, que se inocularon con B. abortus en diferentes concentraciones conocidas. En total en este grupo tuvimos 120 muestras, 60 de humanos y 60 de bovinos sanos.
Grupo 2: 30 muestras de suero y 30 de sangre total de bovinos y 30 muestras de suero y 30 de sangre total de voluntarios humanos sanos, que se contaminaron con inóculos controlados de las bacterias: S. Typhi, E. coli, Klebsiella spp., P. aeruginosa, S. aureus, S. pneumoniae y Enterococcus sp. Total 120 muestras, 60 de bovinos y 60 de humanos sanos.
Grupo 3: 60 muestras de suero y 60 de sangre total de bovinos asintomáticos y 60 muestras de suero y 60 de sangre total de voluntarios humanos asintomáticos para brucelosis y quienes no presentaban ningún reporte de problemas de salud. Total 240 muestras.
Las muestras de sangre total y suero contaminadas fueron evaluadas por hemocultivo y PCR.
Aspectos éticos
Este proyecto se sometió al Comité de ética del Instituto Colombiano de Medicina Tropical, el cual lo consideró de mínimo riesgo. Las muestras bovinas utilizadas pertenecen al banco de muestras del Instituto Colombiano de Medicina Tropical - CES. Todas las personas participantes en el estudio, firmaron un consentimiento informado que cumple con los lineamientos de la resolución 008430 de 1993 del Ministerio de Salud de Colombia.
Las bacterias que se usaron para contaminar las muestras pertenecen al cepario del ICMT-CES. La cepa de B. abortus se extrajo de la vacuna Brucella abortus cepa 19.
Contaminación de las muestras
Los aislamientos bacterianos empleados, fueron cepas confirmadas por métodos bacteriológicos convencionales. Cada muestra se infectó con un inóculo de 106 Unidades Formadoras de Colonias/ml (UFC/ml) obtenido de la siguiente manera: en el caso de las bacterias S. Typhi, E. coli, Klebsiella spp., P. aeruginosa, S. aureus, S. pneumoniae y Enterococcus sp , se tomó una colonia aislada en agar sangre o MacConkey y se sembró en solución salina, se leyó a 650 nm en espectrofotómetro, para determinar el número de colonias, este inóculo se preparó de acuerdo al manual de la Asociación Americana de Microbiología (12). Con base en este inóculo se realizaron 3 diluciones seriadas y se contaminaron las muestras de sangre y suero con 10 µl; estas se incubaron a 37 ºC por 12 horas. Se realizó un control de inóculo sembrando 10 µl de la muestra infectada para recuento en agar Sangre o MacConkey.
Para infectar las muestras con B. abortus se inocularon las muestras de sangre y suero con 25 μl de la vacuna Brucella abortus cepa 19, la cual contiene 1010 UFC/ml vivas. (http://www.vecol.com.co/sitio/index.php?tipoDoc=FinalProducto&idProducto=94&categoria=15)
Hemocultivos
Cinco mililitros de las muestras de sangre inoculadas con B. abortus, se sembraron en el medio bifásico Ruiz-Castañeda (tripticasa soya agar y tripticasa soya caldo). Los cultivos se incubaron a 37 ºC en atmósfera de CO2 al 5% y se revisaron periódicamente para detectar crecimiento por turbidez o hemólisis, momentos en los que se repicaron en agar sangre. Si los cultivos después de una semana permanecían negativos, se realizaban repiques ciegos a los 10, 20 y 30 días.
Los hemocultivos para las muestras infectadas con S. Typhi, E. coli, Klebsiella spp., P. aeruginosa, S. aureus, S. pneumoniae y Enterococcus sp, se realizaron de la siguiente forma: cada muestra de sangre total se sembró en 3 frascos de tripticasa soya caldo, estos se incubaron a 37 ºC hasta observar crecimiento y posteriormente se repicaron en agar sangre y agar Macconkey.
Extracción del ADN bacteriano
Para realizar el proceso de extracción se probaron tres protocolos: el descrito por Miller y colaboradores(13) con modificaciones de Morata y colaboradores(14), el estuche comercial Wizard® (Promega Research) y el método de buffer de lisis descrito por Haque y colaboradores(15). Los tres métodos presentaron buenos resultados, pero por facilidad y menor consumo de tiempo se decidió utilizar el método propuesto por Haque (datos no mostrados).
Brevemente, cada muestra fue centrifugada a 12,000 rpm por cinco minutos a temperatura ambiente para separar el plasma o suero. Un ml de buffer de lisis (0.2% Triton X100 en Tris HCL mas EDTA pH 8.0) se adicionó al sedimento. La mezcla se aspiro varias veces y se centrifugó a 12,000 rpm a temperatura ambiente por seis minutos, el sobrenadante fue descartado y el procedimiento se repitió nuevamente. El sedimento fue lavado una vez con agua destilada y centrifugado a 12,000 rpm a temperatura ambiente por 1 minuto. El sobrenadante se descartó y el sedimento fue resuspendido en 100 μl de agua destilada ultra pura estéril. Los tubos fueron sellados y se pusieron en agua en ebullición por 20 minutos y se dejaron enfriar a temperatura ambiente antes de realizar la PCR.
Se determinó la concentración de ADN de cada muestra por espectrofotometría. Cada muestra de ADN se almacenó a -20 ºC hasta ser usada para la amplificación.
Iniciadores
Se diseñaron iniciadores específicos del género Brucella sp. utilizando el software Primer3, disponible en http://frodo.wi.mit.edu/cgi-bin/primer3/primer3_www.cgi. Los iniciadores se desarrollaron con base en la secuencia del gen ugpA (número de acceso GenBank L28044.1), que es una lipoproteína de membrana externa de Brucella sp. Las secuencias de los iniciadores diseñados son:
ugpA Forward: 5'-TTGTTTTGTCGCATTTTCCA-3'
ugpA Reverse: 5'-GGATCGAGAAACCATTTCCA-3'
Estos cebadores amplifican una región de 461 pares de bases.
Para identificar la especie B. abortus se usaron los iniciadores diseñados por Ratushna et al., previamente publicados(16) y específicos para B. abortus:
BruAb2_0168 Fw: TGCAGCTCACGGATAATTTG
BruAb2_0168 Rv: ACACCTTGTCCACGCTCAC
Estos iniciadores amplifican una región específica de 783 pares de bases en el ORF BruAb2_0168 (número de acceso GenBank: AE017224.1) que codifica para una proteína transportadora de membrana externa.
Condiciones de la amplificación. Para la PCR, se utilizaron 40 ml de supermix (Invitrogen®) 0,5 ml de cada iniciador a una concentración de 10 μM y 9 μl de ADN, independientemente de la concentración de ADN, para un volumen final de reacción de 50 μl.
Se utilizó un Primus 96 plus Termal Cycler (MWG AG Biotech, Germany) para amplificar el ADN sometiendo las muestras al siguiente protocolo: ciclo 1, desnaturalización inicial a 94 ºC por 5 minutos; ciclo 2, paso 1 a 94 ºC por 1 minuto; ciclo 2, paso 2 a una temperatura de 56 ºC por 1 minuto; ciclo 2, paso 3, a 72 ºC por 1 minuto; el ciclo dos se repitió 35 veces; ciclo 3, extensión final, a 72 ºC por 10 minutos y 4 ºC indefinidamente. Cada muestra se amplificó por duplicado. Se procesaron adicionalmente un control positivo (Brucella cepa vacunal 19) y dos controles negativos que no incluían ADN.
Detección de productos de amplificación
Se fraccionaron por electroforesis a 100 Voltios por una hora, 12 μl de cada producto de amplificación en geles de agarosa al 1% teñida con Sybr Safe (Invitrogen), en solución TAE 1X. En las muestras positivas para el gen ugpA se observó una banda de 461 pb y en las positivas para B. abortus se observó una banda de 783 pb.
Análisis estadístico
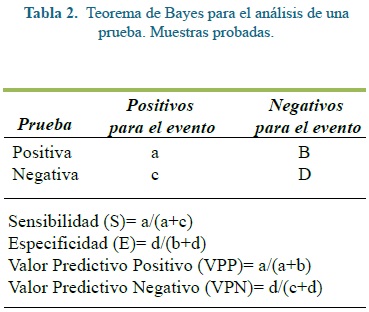
La evaluación de la PCR (prueba de una prueba) se determinó con la sensibilidad (S), especificidad (E), valor predictivo positivo (VPP) y valor predictivo negativo (VPN) aplicando el teorema de Bayes(17). La tabla 2 muestra cómo se evaluaron los aspectos ya enunciados.
Resultados
Grupo 1:
Las 30 muestras de sangre y suero tanto de bovinos como de humanos contaminadas con Brucella abortus, las 30 fueron positivas tanto por cultivo en medio Ruiz Castañeda como para las PCR del gen ugpA y el ORF BruAb2_0168.
Grupo 2:
Las 30 muestras de suero y sangre total de bovinos y las 30 muestras de suero y sangre total de voluntarios humanos sanos infectadas con otras bacterias fueron positivas por cultivo para el crecimiento de las bacterias con las que fueron contaminadas y PCR negativas para Brucella sp y B. abortus, no se observó ninguna banda, ni se presentaron reacciones inespecíficas para ninguna de las dos pruebas de PCR.
Grupo 3:
Las 60 muestras de suero y sangre total de bovinos y 60 muestras de suero y sangre total de voluntarios humanos asintomáticos, fueron hemocultivo y PCR negativas.
En la Figura 1 se puede observar la amplificación para muestras positivas para Brucella sp. y Brucella abortus y en la Figura 2 la ausencia de amplificación en muestras del grupo 2 ( infectadas con otras enterobacterias).
Con base en estos datos, las dos pruebas de PCR evaluadas comparadas con el hemocultivo (prueba de oro), mostró a nivel de estandarización en el laboratorio S, E, VPP y VPN del 100%, respectivamente (Tablas 3 y 4).
Discusión
El diagnóstico de brucelosis requiere la confirmación a través de pruebas serológicas o el aislamiento de la bacteria. El cultivo presenta problemas de sensibilidad y rapidez del resultado, dependiendo de la fase de la enfermedad, la especie de Brucella, el medio de cultivo utilizado, la cantidad de la bacteria circulando en el torrente sanguíneo que determina el inóculo, y el tipo de técnica de cultivo utilizado(10).
La utilización de técnicas de PCR ha mejorado la rapidez y el diagnóstico de Brucella, pero la sensibilidad y especificidad de las diferentes pruebas varía entre laboratorios por problemas como la estandarización de la preparación de la muestra, los genes blancos y los iniciadores seleccionados y los métodos de detección empleados(10).
Con la prueba de PCR para el gen ugpA probada en esta investigación, las 30 muestras de sangre y 30 de suero de humanos tanto como las 30 muestras de sangre y 30 de suero de bovinos, infectadas con B. abortus, fueron positivas (100%) por PCR.
La PCR para detección a nivel de género presenta la misma sensibilidad (100%) pero diferente especificidad que la desarrollada por Queipo-Ortuño et al.(18), quienes reportan una especificidad del 98.3%, por la presencia de un falso positivo, esto se puede explicar a que la prueba de Queipo-Ortuño fue aplicada directamente en muestras clínicas y la de este trabajo en muestras contaminadas bajo condiciones de laboratorio. En casos de enfermedad real, se podrían presentar falsos negativos en los resultados de PCR, en muestras de pacientes que hayan recibido antibióticos o por la presencia de sustancias interferentes en las muestras como la misma hemoglobina, que puede inhibir la prueba.
En un estudio posterior realizado por Morata et al.(14) realizaron el proceso de optimización de esta prueba y obtuvieron una sensibilidad y especificidad del 100% y 98% respectivamente, pero al intentar ser reproducida por Navarro y colaboradores (19), esta prueba solo presentó un 50% de sensibilidad y un 60% de especificidad, lo que evidencia las diferencias entre laboratorios que es común para este tipo de pruebas.
En esta investigación se utilizaron los iniciadores reportados por Ratushna et al.(16) con los cuales se puede identificar también la especie B. abortus, a diferencia del estudio realizado por Padilla y colaboradores(20) en Perú y Nimri en Jordania(21), quienes estandarizaron dos pruebas de PCR diferentes para la detección del género Brucella bajo condiciones de laboratorio pero que no diferencia entre B. abortus y otras especies como B. melitensis.
Las PCR probadas en este estudio presentan varias ventajas sobre el método de diagnóstico convencional para el diagnóstico de brucelosis, tales como la rapidez, seguridad, alta sensibilidad y especificidad bajo condiciones de laboratorio.
Se debe realizar una segunda fase del trabajo en la cual se lleve a cabo la aplicación clínica de estas pruebas para determinar la sensibilidad y especificidad cuando se trabaja a partir de muestras de humanos y bovinos enfermos y no en muestras contaminadas, pues el número de UFC/ml presente en la muestra y otras características como la presencia de interferentes y haber recibido antibióticos previamente pueden influir en los resultados de la PCR.
Además, ampliar la aplicación clínica de las dos pruebas a otro tipo de muestras como aspirados de médula, biopsias de hígado, líquido cefalorraquídeo o cultivos primarios de pocos días, para detectar no solo casos de infección aguda si no también subagudos o crónicos que son los de mayor problema diagnóstico en el caso de los humanos; debido a que la bacteria es intracelular y se encuentra en los tejidos y no circulando en el torrente sanguíneo(22).
En el caso de los bovinos las muestras analizadas se podrían extender a muestras de leche y fetos abortados. Se planea realizar también la unión de la PCR de género y la de especie B. abortus en una PCR múltiple que confirme directamente la presencia de B. abortus.
Agradecimientos
Este proyecto fue financiado por la Dirección de Investigaciones de la Universidad CES y por el Instituto Colombiano de Medicina Tropical - Universidad CES.
Referencias
1. Atluri VL, Xavier MN, de Jong MF, den Hartigh AB, Tsolis RM. Interactions of the Human Pathogenic Brucella Species with Their Hosts. Annu Rev Microbiol 2011; 65:523-541. [ Links ]
2. Pappas G, Akritidis N, Bosilkovski M, Tsianos E. Brucellosis. N Engl J Med. 2005; 352: 2325-36. [ Links ]
3. Von Bargen K, Gorvel JP, Salcedo SP. Internal affairs: investigating the Brucella intracellular lifestyle. FEMS Microbiol Rev 2012; 36: 533-562. [ Links ]
4. Sauret JM, Vilissova N. Human brucellosis. JABFP. 2002; 15: 401-6. [ Links ]
5. Godfroid J, Cloeckaert A, LiautardJP, Kohler S, Fretin D, Walravens K, Garin-Bastuji B, Letesson JJ. From the discovery of the Malta fever's agent to the discovery of a marine mammal reservoir, brucellosis has continuously been a re-emerging zoonosis. Vet. Res. 2005; 36: 313-326. [ Links ]
6. Purwar S. Human brucellosis: a burden pf half-million cases per year. Sout Med J. 2007; 100:1074. [ Links ]
7. Rivera DY, Rueda OE, Calderón CP, Mariño OC, Gall D, Nielsen K. Evaluación comparativa del método inmunoenzimático indirecto en leche para la detección de bovinos infectados con Brucella abortus, en hatos del departamento de Cundinamarca, Colombia. Rev Sci Tech Off int Epiz. 2003; 22: 1065-75 [ Links ]
8. Corbel M, Brucellosis in humans and animals, WHO Disponible en: http://www.who.int/csr/resources/publications/Brucellosis.pdf. [Fecha de acceso]: Noviembre 2011. [ Links ]
9. Pappas, G., 2010. The changing Brucella ecology: novel reservoirs, new threats. Int. J. Antimicrob. Agents 36 Suppl 1, S8-11. [ Links ]
10. Navarro E, Casao MA, Solera J. Diagnosis of human brucellosis using PCR. Expert Rev Mol Diagn. 2004; 4: 115-23. [ Links ]
11. Riegelman RK, Hirsch RP. Como estudiar un estudio y probar una prueba: lectura crítica de la literatura médica. Organización panamericana de la salud, Publicación científica 531 Washington, DC, 20037, EUA, (1992). [ Links ]
12. Logan NA, Turnbull PC. Brucella genera. In: Murray PR, Baron EJ, Pfaller MA, Tenover RC, Yolken RH, eds. Manual of Clinical Microbiology. 7th ed. Washington, DC: American Society for Microbiology; 1999:357-69. [ Links ]
13. Miller SA, Dykes DD, Polesky HF. A simple salting out procedure for extracting DNA from human nucleated cells. Nucleic Acids Res. 1988; 16:1215. [ Links ]
14. Morata P, Queipo Ortuño MI, Colmenero JD. Strategy for optimizing DNA amplification in a peripheral blood PCR assay used for diagnosis of human brucellosis. J Clin Microbiol. 1998; 36: 2443-6. [ Links ]
15. Haque A, Ahmed J, Qureshi J. Early detection of typhoid by polimerase chain reaction. Ann Saudi Med. 1999; 19: 337-40. [ Links ]
16. Ratushna VG, Sturgill DM, Ramamoorthy S, Reichow SA, He Y, Lathigra R, Sriranganathan N, Halling SM, Boyle SM, Gibas CJ. Molecular targets for rapid identification of Brucella spp. BMC Microbiology. 2006, 6:13-32. [ Links ]
17. Westover MB, Eiseman NA, Cash SS, and Bianchi MT. Information Theoretic Quantification of Diagnostic Uncertainty. Open Med Inform J. 2012; 6: 36-50. [ Links ]
18. Queipo-Ortuño MI, Morata P, Ocón P, Manchado P, Colmenero JD. Rapid Diagnosis of Human Brucellosis by Peripheral-Blood PCR Assay. J Clin Microbiol. 1997; 35: 2927-30. [ Links ]
19. Navarro E, Fernández JA, Escribano J, Solera J. PCR Assay for Diagnosis of Human Brucellosis. J Clin Microbiol. 1999; 37: 1654-5. [ Links ]
20. Padilla C, Montoya Y, Carrillo C. Estandarización de una prueba de PCR para la detección de Brucella sp. Rev Perú Med Exp Salud Pública. 2003; 20: 102-4. [ Links ]
21. Nimri LF. Diagnosis of recent and relapsed cases of human brucellosis by PCR. BMC Infectious Diseases. 2003, 3:5. [ Links ]
22. Mirnejad R, Vahdati A, Ahmadi A, Mortazavi S, Piranfar V. Comparison of Culture and Multiplex PCR Technique for Detection of Brucella abortus and Brucella melitensis from Human Blood Samples. 2013; 15: 5-8. [ Links ]