Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
CES Medicina Veterinaria y Zootecnia
versión On-line ISSN 1900-9607
Ces. Med. Vet. Zootec. vol.8 no.2 Medellín jul./dic. 2013
ELISA indirecta para el diagnóstico de fasciolosis bovina en leche
Indirect ELISA for diagnosing bovine fasciolosis from milk samples*
ELISA indireta para o diagnostico de fasciolíase bovina no leite
Mónica Uruburu Gómez1,2, Microb Bioan; Juan Carlos Bedoya Blandon1,2*, Bact, MSc; Luz Elena Velásquez Trujillo1,2, Biol, MSc
*Autor para correspondencia: Juan Carlos Bedoya Blandón. Escuela de Microbiología, Universidad de Antioquia, Calle 67 Nº 53 - 108, Bloque 5 oficina 410, Medellín, Colombia. E-mail: jukbed@yahoo.es.
1Grupo de Microbiología Ambiental, Escuela de Microbiología, Universidad de Antioquia.
2PECET - Programa de Estudio y Control de Enfermedades Tropicales, Unidad de Investigación Malacología Médica y Trematodos, Universidad de Antioquia.
(Recibido: 27 de agosto, 2013; aceptado: 9 de noviembre, 2013)
*Para citar este artículo: Uruburu Gómez M, Bedoya Blandón JC, Velásquez Trujillo LE. ELISA indirecta para el diagnóstico de fasciolosis bovina en leche. Rev CES Med Zootec. 2013; Vol 8 (2): 93-100.
Resumen
Se estandarizó una prueba de ELISA para la detección de anticuerpos anti-F. hepatica en leche de bovinos. Se emplearon 80 muestras, de las cuales 44 se usaron como control positivo y 36 como control negativo. Como control de reactividad cruzada se utilizaron muestras de bovinos que presentaron en las heces huevos de un paramphistomido. La sensibilidad y especificidad diagnóstica de la prueba fueron del 80% y del 72,2% respectivamente, con un intervalo de confianza del 95%. Los resultados obtenidos son comparables con los reportados en estudios realizados en otros países. Se propone la prueba estandarizada como herramienta diagnóstica alternativa y de tamizaje en estudios epidemiológicos de fasciolosis.
Palabras clave: epidemiología, Fasciola hepatica, hatos lecheros, inmunodiagnóstico.
Abstract
We standardized an ELISA test for the detection of anti-F. hepatica antibodies in bovine milk. A total of 80 samples were used, of which 44 were used as positive controls and 36 as negative controls. Milk samples from bovines presenting paramphistomidae eggs in feces were used as cross-reactivity controls. Sensitivity and specificity of the diagnostic test were 80 and 72,2%, respectively, with 95% confidence interval. These results are comparable with those reported in studies conducted in other countries. We propose this standardized test as an alternative diagnostic and screening tool in epidemiological studies of fasciolosis.
Key words: dairy herds, epidemiology, Fasciola hepatica, inmunodiagnosis.
Resumo
Estandardizou-se um teste de ELISA para a detecção de anticorpos anti Fasciola hepatica no leite de bovinos. Empregaram-se 80 amostras, das quais 44 usaram-se como controle positivo e 36 como controle negativo. Como controle da reatividade cruzada utilizaram-se amostras de bovinos que apresentaram ovos de um paramphistomido nas fezes. A sensibilidade e especificidade diagnosticam do teste foi de 80 e 72% respectivamente, com um intervalo de confiança de 95%. Os resultados obtidos são comparáveis com os reportados em estudos realizados em outros países. Propõe-se o teste estandardizado como ferramenta diagnostica alternativa e de tamisado em estudos epidemiológicos de fasciolíase.
Palavras chave: epidemiologia, Fasciola hepatica, granjas leiteiras, inmunodiagnostico.
Introducción
La infección por Fasciola hepatica es una helmintiasis muy prevalente en el mundo, que afecta cerca de 600 millones de bovinos y ovinos, ocasionando pérdidas en la economía pecuaria mundial estimadas en 3.200 millones de dólares anuales(15,17,30). En Colombia F. hepatica es el tremátodo de mayor importancia veterinaria, donde la población más afectada son los bovinos del trópico alto andino dedicados a la producción lechera(4). Esta zona se caracteriza por presentar clima frío y lluvioso, que favorece el establecimiento de focos de la parasitosis(21,26). Las pérdidas en el sector ganadero nacional se estiman en 12.500 millones de pesos(1).
En consecuencia, los estudios de foco en Antioquia demuestran una alta prevalencia del parásito en municipios lecheros, como Donmatías, Entrerríos, San Pedro de los Milagros y Carmen de Viboral con prevalencias de 9, 15, 26 y 57.18%, respectivamente(27,34). También registran la coinfección de F. hepatica con un digeneo de la familia Paramphistomidae, que se aloja en el rumen de los bovinos, como ocurre en un hato lechero del municipio de Rionegro donde encuentran una prevalencia del paramphistomido del 100% y coinfección con F. hepatica del 80%13. En un estudio más reciente en ganado doble propósito del municipio de Gómez Plata se enuncia una prevalencia del 47.6% de paramphistomidos y 13.1% de F. hepatica; 9% de los bovinos presentaron coinfección(2). La alta prevalencia de F. hepatica en los bovinos de este departamento, constituye además un factor de riesgo de infección para otros animales y para las personas encargadas de los hatos lecheros e incluso para quienes habitan en las zonas bajas, que se surten del agua proveniente del sector lechero(14).
En Antioquia, como en otros departamentos de Colombia, la prevalencia de F. hepatica y su impacto en el sector económico pueden ser mayores, si se tiene en consideración que el diagnóstico de animales en pie se realiza por métodos coproparasitológicos con baja sensibilidad(11); esta obedece a la baja carga parasitaria, a la intermitencia en la ovoposición de los parásitos y a migraciones erráticas. Así mismo, la detección de huevos en heces solamente es posible durante la fase crónica de la infección, cuando el daño hepático es avanzado(8). Además estos métodos son poco prácticos si se tiene en consideración los miles de bovinos que requieren diagnóstico. De otro lado hay una alta probabilidad de falsos positivos, ante la coinfección con los paramphistomidos, dada la similitud entre los huevos de ambos parásitos.
Por lo tanto, como alternativa diagnóstica, se han desarrollado pruebas serológicas más sensibles y específicas, basadas en la detección de anticuerpos generados contra el parásito durante su invasión y migración en el hospedero vertebrado. Esta respuesta inmune se caracteriza principalmente por ser de tipo Th2 (type 2 helper) con altos títulos de inmunoglobulinas G1 (IgG1)(9,10,23). Métodos como el ELISA (Enzyme-Linked Immuno Sorbent Assay) indirecto para detección de anticuerpos IgG específicos para la fasciolosis, son útiles desde la segunda semana de infección(6, 31).
Diferentes estudios demuestran que la presencia de anticuerpos en suero y en leche de animales infectados con F. hepatica pueden ser similares; las IgG son detectables en suero desde 1-4 semanas posinfección y en leche desde el comienzo de la lactancia; además se mantienen estables durante este periodo(18). La IgG1 es selectivamente trasferida de la circulación sanguínea a las secreciones lácteas tres semanas antes del parto y durante el periodo de lactancia, gracias a la presencia de receptores específicos presentes en las glándulas mamarias. Durante el parto los niveles de IgG son muy altos (60-100mg/ml) y disminuyen durante la primera semana del periodo de lactancia (0.7-1.0mg/ml); sin embargo la proporción de IgG1 frente a otras inmunoglobulinas es mayor en el calostro y en la leche madura que en suero, como consecuencia de la transferencia selectiva(18).
La leche se convierte entonces en una muestra alternativa al suero, ante la necesidad de disponer de procedimientos diagnósticos igualmente sensibles y específicos pero menos invasivos y más económicos(22, 24, 25). Es así como se han desarrollado pruebas inmunológicas para diagnosticar la presencia del parásito en el hato, a través del análisis de muestras obtenidas en los tanques de leche. Estas pruebas han sido útiles para establecer la prevalencia y la distribución de fasciolosis en Inglaterra, Wales y Bélgica(3, 16, 30); de igual manera el ELISA en leche ha evidenciado la correlación entre los niveles de anticuerpos anti-F. hepatica con aspectos productivos de los bovinos(19), y a su vez ha permitido supervisar y monitorear estrategias de intervención contra fasciolosis(12).
Teniendo en cuenta que la leche constituye una muestra valiosa para la detección de la infección por F. hepatica, el presente trabajo tuvo como objetivo estandarizar bajo las condiciones locales una prueba de ELISA para la detección de anticuerpos anti-F. hepatica en leche de bovinos, como una alternativa para el diagnóstico epidemiológico de la fasciolosis en Colombia.
Materiales y métodos
Aval del Comité de Ética para la experimentación animal
Esta investigación fue avalada por el Comité de Ética para la Experimentación con Animales - CEEA, de la Sede de Investigación Universitaria - SIU, Universidad de Antioquia, como consta en el acta 61 del 29 de abril de 2010.
Muestras de leche
Se utilizaron 44 muestras de leche de bovinos con diagnóstico positivo para fasciolosis confirmado por la técnica coprológica de Dennis modificada(13). De las muestras, 38 provenían de hatos lecheros del municipio de Rionegro y seis del municipio de San Pedro de los Milagros, zonas de Antioquia donde se han descrito focos de fasciolosis. A su vez, se emplearon 36 muestras negativas procedentes de bovinos de Acacias, Meta (zona sin registros para F. hepatica) a los que se les realizó diagnóstico coprológico con resultado negativo para huevos de F. hepatica. En 25 de estas muestras se encontraron huevos de un paramphistomido, por lo que se utilizaron como muestras control de reactividad cruzada. Las muestras de leche se colectaron durante el ordeño, se almacenaron a 4 °C y se trasportaron al laboratorio, donde se filtraron; de cada muestra se prepararon alícuotas que se almacenaron a -20 ºC.
Obtención de antígenos de excreción-secreción de F. hepatica (FhES)
Los antígenos FhES se obtuvieron a partir de parásitos adultos colectados en los conductos biliares de bovinos naturalmente infectados con F. hepatica que llegaban para sacrificio a la Central Ganadera de Medellín. Los parásitos se lavaron tres veces con Buffer fosfato salino (PBS) más antibiótico (200 Ul/L de penicilina-estreptomicina) durante 30 minutos/lavado. Posteriormente, los parásitos se incubaron en PBS más antibiótico a 37 ºC con 5% de CO2 hasta cuatro horas, reemplazando el medio cada 60 min. El producto obtenido de la cuarta hora se centrifugó a 2500 rpm durante 15 minutos y se filtró en membranas con poro de 0.20 µm a 4 °C. Se formaron alícuotas y se almacenaron a -20 ºC. Se determinó la concentración de proteínas por el método de Bradford (Bio-Rad®, Hercules, CA).
Estandarización del ELISA para la detección de anticuerpos anti-F. hepatica en leche
Para la realización del test se siguió el protocolo propuesto por Chauvin(7), con modificaciones. Los platos de ELISA se sensibilizaron con 100 µL/pozo de FhES a una concentración de 2.0 µg/mL en buffer carbonato-bicarbonato pH 9.6 durante toda la noche, se saturaron con gelatina porcina al 2.5% durante 45 minutos y se incubaron con las muestras de leche a evaluar diluidas 1:16, 1:32 y 1:64 en PBS Tween (PBST) al 0.05% por 20 minutos; posteriormente se adicionó como anticuerpo secundario antinmunoglobulina G de bovino, marcado con peroxidasa (Sigma®, St Louis, MO) durante 1 hora y luego se adicionó el sustrato Ortofenilendiamina (OPD) (Sigma®) por 30 minutos. Se detuvo la reacción con 50 µL de ácido sulfúrico (H2SO4) 2.5 M y se leyó la reacción a 490 nm en un lector de ELISA automatizado Benchmark (Bio-Rad®, Hercules, CA). Entre cada paso se realizaron tres lavados con PBST durante 5 minutos cada uno. Cada muestra se evaluó por duplicado y los resultados se expresaron como el promedio de las densidades ópticas (DO). Como punto de corte de la prueba se asumió el promedio de las DO de las muestras negativas más 1.5 desviaciones estándar.
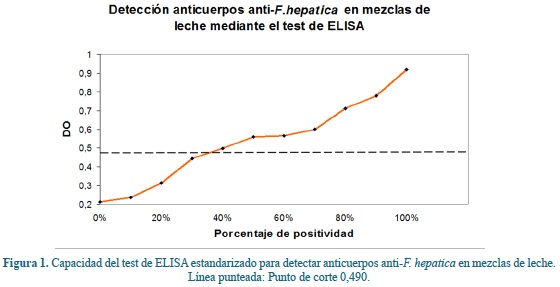
Evaluación de la sensibilidad de la prueba para detectar anticuerpos contra F. hepatica en mezclas de leche
Se tomaron muestras de leche de 20 bovinos con fasciolosis y de 20 bovinos libres de la infección y con ellas se realizaron mezclas de tal manera que la proporción de muestras positivas entre el total fuera del 10, 20, 30, 40, 50, 60, 70, 80, 90 y 100%. Una vez preparadas las mezclas, se analizaron mediante la prueba de ELISA estandarizada.
Análisis estadísticos
Los parámetros diagnósticos del ELISA estandarizado para usar con muestras de leche se obtuvieron con el software Epi info versión 6.04 con un intervalo de confianza del 95%, asumiendo como prueba de referencia el diagnóstico coproparasitológico realizado a los bovinos del estudio.
Resultados
Determinación del punto de corte, sensibilidad y especificidad del test de ELISA
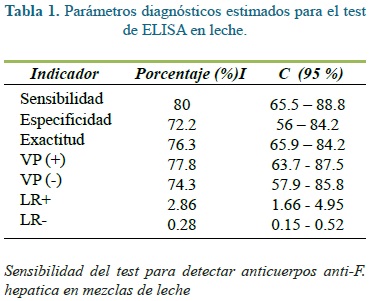
Luego de procesar todas las muestras de leche negativas con el protocolo descrito, se estableció un punto de corte correspondiente a una DO de 0,490. El 80% (35/44) de las muestras positivas y el 72,2% (26/36) de las negativas fueron correctamente clasificadas por la prueba. Con base en lo anterior, se estimaron parámetros diagnósticos del ELISA, como sensibilidad, especificidad, valores predictivos positivo y negativo (VP+, VP-), así como las razones de verosimilitud (LR+, LR-), cuyos resultados se muestran en la tabla 1.
Una vez procesadas las mezclas de leches descritas anteriormente, se determinó que con la prueba de ELISA estandarizada se obtiene un resultado positivo cuando el 40% o más de las muestras provienen de animales infectados con F. hepatica (Figura 1).
Discusión
Dado que la fasciolosis bovina es una parasitosis de alta prevalencia en Colombia y en consecuencia genera cuantiosas pérdidas en el sector pecuario, es necesario disponer de herramientas que permitan realizar un diagnóstico temprano y específico del digeneo a precios asequibles. Así mismo, es importante tener en cuenta la dificultad que tienen los administradores de los hatos, para que las muestras de los bovinos sean objeto de análisis en los laboratorios especializados.
En el contexto colombiano también hacen falta las estrategias de control y prevención de la fasciolosis; sin embargo está claro que éstas deben integrar aspectos biológicos, ambientales, terapéuticos y culturales. En dicha red de acciones, el diagnóstico oportuno y específico constituye tanto el punto de partida, como la actividad que se realiza a través del tiempo. De ahí que el ELISA en leche constituya una alternativa para implantar en las zonas afectadas por el parásito, donde se utilizaría para el monitoreo de la dinámica de expansión y disminución de los focos de la infección, para el monitoreo de programas de prevención y para la evaluación de estrategias de control.
Es importante resaltar que la leche es una muestra con mayores ventajas que el suero, al ser más asequible, pues se obtiene directamente del ordeño sin generar mayores costos y el procedimiento no genera estrés en los animales.
De otro lado, los parámetros diagnósticos obtenidos en nuestro estudio (sensibilidad de 80% y especificidad de 72,2%), son moderados al compararlos con los registros de otros autores quienes también utilizan extractos totales de FhES como fuente de antígenos en el ELISA y como prueba de referencia el examen coproparasitológico(28,30,32). Estos registran sensibilidad del 92 al 98% y especificidad del 80 al 96%. Estas diferencias podrían estar relacionadas con variaciones metodológicas en la obtención del antígeno, así mismo con la raza, la edad y el estado inmunológico de los animales,. También, se ha demostrado que los títulos de anticuerpos en suero y en leche, pueden fluctuar a través del tiempo sobretodo en animales con baja carga de fasciolidos(18). Todas estas variables pueden afectar la concentración de anticuerpos en la muestra de leche(5, 28, 31).
En lo que respecta a la especificidad obtenida en nuestra prueba, se destaca el hecho de que para la reactividad cruzada se utilizó leche de animales parasitados con un Paramphistomidae, filogenéticamente más relacionado con F. hepatica, que los protozoos o nemátodos utilizados en otros trabajos(5, 32). Sin embargo, los casos de reactividad cruzada que se presentaron en nuestro estudio, no se atribuyen al paramphistomido; las causas que generaron dicha reacción se deben establecer.
En cuanto a la mezcla de leche, se destaca que para nuestra prueba de ELISA se necesita un porcentaje menor de bovinos parasitados (40%) que la de Reichel et al.(28) cuya prueba requiere al menos el 60% de las muestras positivas para F. hepatica, a pesar de que ellos utilizaron un kit comercial del basado en la detección de anticuerpos contra antígenos purificados de la fracción f2 de F. hepatica (Institut Pourquier, Montpellier, France). Otro estudio que también utiliza antígenos FhES requiere de al menos el 25% de seroprevalencia en los hatos para que los títulos de anticuerpos sean detectables en la prueba(30). Para nuestras condiciones, donde la prevalencia de fasciolosis bovina en algunos municipios lecheros supera el 57% y en algunos hatos el 80%, el ELISA en leche se percibe como una herramienta de tamizaje epidemiológico para fasciolosis útil ya que permite de manera rápida el diagnóstico de grandes áreas geográficas dedicadas a la producción lechera.
Es necesario acotar que los resultados obtenidos con las pruebas de ELISA diseñadas a partir de los antígenos FhES, son inferiores a los obtenidos con algunos kits comerciales, como el MM3-SERO ELISA, donde la sensibilidad y especificidad de la prueba en muestras de leche individuales es de 93.9 y 98.1%, respectivamente. Por su parte en muestras de tanques de leche la especificad es del 100% y la sensibilidad del 100% solo en hatos con prevalencias iguales o superiores al 12%. Cuando la prevalencia es entre 0-7% los anticuerpos anti-F. hepatica no son detectables y la sensibilidad del kit disminuye a un 87.9%(20). La importación de un kit diagnóstico como este a Colombia supone altos costos.
Conclusión
Se hace necesario realizar la evaluación y validación en campo de la prueba de ELISA en leche estandarizada, incluyendo un n muestral estadísticamente significativo, para recomendarlo como herramienta diagnóstica a utilizar en estudios de tamizaje sobre fasciolosis bovina y para determinar la distribución del parásito. A su vez, estos resultados preliminares sugieren extender la búsqueda de alternativas para el diagnóstico de la fasciolosis, entre ellas la producción y purificación de antígenos recombinantes específicos de F. hepatica, que aumenten la sensibilidad y especificidad del diagnóstico, y que a su vez sean útiles para el seguimiento de esquemas terapéuticos y para el monitoreo de estrategias de manejo y control.
Agradecimientos
Las autores expresan su agradecimiento a Juan Fernando Alzate MSc. PhD, por su valiosa asesoría. Al equipo humano del grupo de Parasitología de la Facultad de Medicina de la Universidad de Antioquia por permitir que en su laboratorio se realizaran los ensayos. A quienes facilitaron el acceso a los animales en ordeño en Rionegro y San Pedro de los Milagros. A Jessika López por facilitar las muestras desde Acacías, Meta. Este proyecto fue financiado por COLCIENCIAS - GENESIS (Incubadora de Empresas de Rionegro) Universidad de Antioquia y Cooperativa Lechera de Antioquia COLANTA Ltda. (Grant 111540020086).
Referencias
1. Becerra WM. Consideraciones sobre estrategias sostenibles para el control de Fasciola hepatica en Latinoamérica. Rev Col Cienc Pec 2001; 14(1):28-35. [ Links ]
2. Bedoya J, Hurtado Y, Perez J, Solano S, Usuga VM, Vanegas M, et al. Primer registro de focos de fasciolosis y paramphistomosis en bovinos doble propósito, Gómez Plata, Antioquia, Colombia. Hechos Microbiol 2012; 3(1):31-39. [ Links ]
3. Bennema S, Vercruysse J, Claerebout E, Schneider T, Strube C, Ducheyne E, et al. The use of bulk-tank milk ELISAs to assess the spatial distribution of Fasciola hepatica, Ostertagia ostertagi and Dictyocaulus viviparus in dairy cattle in Flanders (Belgium). Vet Parasitol 2009; 165:51-57. [ Links ]
4. Blanco A, Jaramillo G, Restrepo J. Detección de coproantígenos de Fasciola hepatica por ELISA en bovinos sacrificados en el Matadero Municipal de Medellin. Rev Col Cienc Pec 1996; 9(1):46-48. [ Links ]
5. Charlier J, Duchateau LE, Claerebout WD, Vercruysse J. Associations between anti-Fasciola hepatica antibody levels in bulk-tank milk samples and production parameters in dairy herds. Prev Vet Med 2007; 78:57-66. [ Links ]
6. Charlier J, De Meulemeester L, Claerebout E, Williams D, Vercruysse J. Qualitative and quantitative evaluation of coprological and serological techniques for the diagnosis of fasciolosis in cattle. Vet Parasitol 2008; 153:44-51. [ Links ]
7. Chauvin A, Bouvet G, Boulards C. Humoral and cellular immune response to Fasciola hepatica experimental primary and secondary infection in sheep. Int J Parasitol 1995; 25:1227-1241. [ Links ]
8. Chen MG, KE Mott. Progress in assessment of morbidity due to Fasciola hepatica infection: a review of recent literature. Trop Dis Bull 1990; 87:1-38. [ Links ]
9. Clery D, Torgerson P, Mulcahy G. Immune responses of chronically infected adult cattle to Fasciola hepatica. Vet Parasitol 1996; 62:71-82. [ Links ]
10. Clery D, Mulcahy G. Lymphocyte and cytokine responses of young cattle during primary infection with Fasciola hepatica. Res Vet Sci 1998; 65:169-171. [ Links ]
11. Conceiçao M. Evaluation of a simple sedimentation method (modified McMaster) for diagnosis of bovine fascioliosis. Vet Parasitol 2002; 105(4):337-343. [ Links ]
12. Duscher R, Duscher G, Hofer J, Tichy A, Prosl H, Joachima A. Fasciola hepatica - Monitoring the milky way? The use of tank milk for liver fluke monitoring in dairy herds as base for treatment strategies. Vet Parasitol 2011; 178:273-278. [ Links ]
13. López LP, Romero J, Velásquez LE. Aislamiento de Paramphistomidae en vacas de leche y en el hospedador intermediario (Lymnaea truncatula y Lymnaea columella) en una granja del trópico alto en el occidente de Colombia. Rev Col Cienc Pec 2008; 21:9-18. [ Links ]
14. Mas-Coma S, Bargues MD, Esteban JG. Human Fasciolosis. In Fasiolosis. JP Dalton, ed. (Wallingford, UK, CABI Publishing). 1999. [ Links ]
15. Mas-Coma S. Epidemiology of fascioliasis in human endemic areas. J Helminthol 2005; 79:207-216. [ Links ]
16. McCann CM, Baylis M, Williams DJL. Seroprevalence and spatial distribution of Fasciola hepatica-infected dairy herds in England and Wales. Vet Rec 2010; 166:612-617. [ Links ]
17. McManus DP, Dalton JP. Vaccines against the zoonotic trematodes Schistosoma japonicum, Fasciola hepatica and Fasciola gigantica. Parasitology 2006; 133, S43-61. [ Links ]
18. Mezo M, González-Warleta M, Castro-Herminda JA, Carro C, Ubeira FM. Kinetics of anti-Fasciola IgG antibodies in serum and milk from dairy cows during lactation, and in serum from calves after feeding colostrum from infected dams. Vet Parasitol 2010; 168:36-44. [ Links ]
19. Mezo M, González-Warleta M, Castro-Hermida JA, Muino L, Ubeira FM. Association between anti-F. hepatica antibody levels in milk and production losses in dairy cows. Vet Parasitol 2011; 180:237-242. [ Links ]
20. Mezo M, Gonzalez-Warleta M, Castro-Hermida JA, Muiño L, Ubeira FM. Field evaluation of the MM3-SERO ELISA for detection of anti-Fasciola IgG antibodies in milk samples from individual cows and bulk milk tank. Parasitol. Int 2010; 59:610-615. [ Links ]
21. Molina G, Restrepo C. Los parásitos y su importancia económica en bovinos. Seminario Universidad Nacional de Colombia 1990., sede Medellín. p: 46-50. [ Links ]
22. Molloy JB, Anderson GR, Fletcher TI, Landmann J, Knight BC. Evaluation of a commercially available enzymelinked immunosorbent assay for detecting antibodies to Fasciola hepatica and Fasciola gigantica in cattle, sheep and buffaloes in Australia. Vet Parasitol 2005;130:207-212. [ Links ]
23. O'Neill SM, Brady MT, Callanan JJ, Mulcahy G, Joyce P, Mills HG, et al. Fasciola hepatica infection downregulates Th1 responses in mice. Parasite Immunol 2000; 22:147-155. [ Links ]
24. Pritchard GC. Milk antibody testing in cattle. In Pract 2001; 23:542-549. [ Links ]
25. Pritchard GC, Kirkwood GM, Sayers AR. Detecting antibodies to infectious bovine rhinotracheitis and BVD virus samples from individual cows. Vet Rec 2002; 150:182-183. [ Links ]
26. Pulido A, Salazar R, Arbelaez G. Fasciola hepatica: Pedagogía de diagnóstico por laboratorio y su situación en Colombia. Rev Electrónica de Veterinaria 2010; 5B (12):1-11. [ Links ]
27. Quintero DL, Valencia GA, Zuluaga MS, Velásquez LE, Valencia N, Gómez C. Vereda La Madera de El Carmen de Viboral - Antioquia: Distribución de focos de fasciolosis bovina. Colanta Pecuaria 2013; No. 40. [ Links ]
28. Reichel MP, Vanhoff K, Baxter B. Performance characteristics of an enzyme-linked immunosorbent assay performed in milk for the detection of liver fluke (Fasciola hepatica) infection in cattle. Vet Parasitol 2005; 129:61-66 [ Links ]
29. Reichel MP. Performance characteristics of an enzyme-linked immunosorbent assay for the detection of liver fluke (Fasciola hepatica) infection in sheep and cattle. Vet Parasitol 2002; 107:65-72. [ Links ]
30. Salimi-Bejestani MR, Daniel RG, Felstead SM, Cripps PJ, Mahmoody H, Williams JL. Prevalence of Fasciola hepatica in dairy herds in England and Wales measured with an ELISA applied to bulktank milk. Vet Rec 2005; 156:729-731. [ Links ]
31. Salimi-Bejestani MR, McGarry JW, Felstead S, Ortiz P, Akca A, Williams DJ. Development of an antibody-detection ELISA for Fasciola hepatica and its evaluation against a commercially available test. Res Vet Sci 2005; 78(2):177-181. [ Links ]
32. Salimi-Bejestani MR, Daniel R, Cripps P, Felstead S, Williams DJ. Evaluation of an enzyme-linked immunosorbent assay for detection of antibodies to Fasciola hepatica in milk. Vet Parasitol 2007; 149(3-4):290-293. [ Links ]
33. Spithill TW, Piedrafita D, Smooker PM. Immunological approaches for the control of fasciolosis. Int J Parasitol 1997; 27:1221-1235. [ Links ]
34. Velásquez LE, Gómez C, Romero J, Valencia N. Levantamiento de un mapa de distribución de fasciolosis y evaluación de tres estrategias para su control en zonas del trópico alto antioqueno. Informe técnico, Convenio 057/2007. Medellín, Colombia: Universidad de Antioquia. 2011. [ Links ]