Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina Veterinaria y Zootecnia
On-line version ISSN 1900-9607
Ces. Med. Vet. Zootec. vol.9 no.1 Medellín Jan./June 2014
Efectos inmunotoxicológicos e histopatológicos de la exposición a concentraciones subletales de cloruro de mercurio (HgCl2) en cachama blanca (Piaractus brachypomus)
Immunotoxicological and histopathological effects of exposure to sublethal concentrations of mercuric chloride (HgCl2) in red-bellied pacu (Piaractus brachypomus)¤
Avaliação imunotoxicológica e histopatológica da exposição a concentrações subletais de cloreto de mercúrio (HgCl2) em Pirapitinga branca (Piaractus brachypomus)
Juan S Naranjo-Gómez1-2, Est. Biología; Roberto Chacón-Novoa1, Est. MVZ; Fabián Zambrano-Cardona1, Est. MVZ; Fabián Uribe-García1, Est. MVZ; Karol Ramírez1, Est. MVZ; Julieth A Vargas-Morales1, Est. MVZ; Iang S Rondón-Barragán1, 3*, MVZ, MSc.
*Autor para correspondencia: Iang S Rondón-Barragán. Laboratorio de Diagnóstico Veterinario, Universidad del Tolima, Bloque 33 L 105, Santa Helena Carrera 4B, isrondon@ut.edu.co
1Grupo de Investigación en Inmunbiología y Patogénesis - GIP, Departamento de Sanidad Animal, Facultad de Medicina Veterinaria y Zootecnia, Universidad del Tolima. Tolima-Colombia.
2Programa de Biología, Facultad de Ciencias. Colombia.
3Grupo de Investigación en Enfermedades Neurodegenerativas. Universidad del Tolima. Tolima-Colombia.
¤Para citar este artículo: Naranjo-Gómez JS, Chacón-Novoa R, Zambrano-Cardona F, Uribe-García F, Ramírez K, Vargas-Morales JA, Rondón-Barragán IS. Efectos inmunotoxicológicos e histopatológicos de la exposición a concentraciones subletales de cloruro de mercurio (HgCl2) en cachama blanca (Piaractusbrachypomus). Rev CES Med Zootec. 2014; Vol 9(1): 26-42
(Recibido: 2 de octubre, 2013; aceptado: 29 de abril, 2014)
Resumen
El mercurio es un contaminante xenobiótico encontrado frecuentemente en ecosistemas naturales, representando un aspecto relevante en salud pública y ambiental debido a los niveles encontrados en fuentes de agua en correlación con la bioacumulación en organismos vivos. El objetivo fue evaluar los efectos inmunotoxicológicos e histopatológicos de la exposición a concentraciones subletales de Cloruro de Mercurio (HgCl2) en cachama blanca (Piaractus brachypomus). Se utilizaron alevinos de cachama blanca, con un peso de 10 ± 2,1 g, distribuidos en acuarios con aireación constante, sin filtro. El periodo experimental fue de 18 días, utilizando 4 concentraciones basadas en la décima parte de la CL50 descrita para cachama, así como un grupo control. Se realizaron seis muestreos (días 1, 2, 4, 7, 12 y 18) en los cuales se tomaron muestras de sangre para la evaluación de la explosión respiratoria y la capacidad bactericida del plasma. Se calculó el índice hepatosomático y se tomaron muestras para procesamiento histopatológico. Se evidenció una elevación del nivel de explosión respiratoria (estrés oxidativo) en animales expuestos a HgCl2 de una manera dependiente de la concentración, siendo más marcado este efecto al día 12 de exposición. No se encontraron diferencias significativas en los valores de índice hepatosomático (IHS). En la actividad bactericida del plasma se halló una actividad menor en animales expuestos a HgCl2. En el análisis histopatológico se encontraron cambios como hiperplasia, aneurismas y sinequias en branquias; inclusiones hialinas en hígado y centros melanomacrófagos en riñón. Los alevinos de cachama blanca expuestos a dosis subletales de HgCl2, muestran un incremento significativo en la explosión respiratoria (estrés oxidativo), así como cambios en la actividad bactericida del plasma, además de cambios anatomopatológicos a nivel branquial, hepático y renal.
Palabras clave: Actividad bactericida plasmática, cloruro de mercurio, estrés oxidativo, patología, peces.
Abstract
Mercury is a xenobiotic contaminant often found in natural ecosystems. It is relevant for public and environmental health because of the existing correlation between its content in water sources and mercury bioaccumulation in living organisms. This work assessed the immune and histopathological effects of exposure to sublethal concentrations of mercury chloride (HgCl2) in Pacu (Piaractus brachypomus). Pacu fingerlings weighing 10 ± 2.1 g were distributed in constantly aerated tanks with no filter. The experimental period was 18 days. A negative control group and four Hg levels were used based on the tenth of LC50 for Pacu. Six blood samples were taken on days 1, 2, 4, 7, 12 and 18 to measure respiratory burst and bactericidal activity of the plasma. The hepatosomatic index was calculated and samples were taken for histopathological examination. Increased respiratory burst (oxidative stress) was observed in animals exposed to HgCl2 in a concentration-dependent manner. This effect was more pronounced at day 12 of exposure. Hepatosomatic index (HSI) values showed no significant differences. Animals exposed to HgCl2 showed low bactericidal activity of plasma. Histopathological changes such as hyperplasia, aneurysms and synechiae were found in gills, while hyaline inclusions were observed in liver and melanomacrophage centers in kidney. Pacu fingerlings exposed to sublethal doses of HgCl2 had a significant increase in oxidative stress and changes in plasma bactericidal activity in addition to pathological changes in the gills, hepatic and renal tissues.
Key words: Fish, mercuric chloride, oxidative stress pathology, plasma bactericidal activity.
Resumo
O mercúrio é um contaminante xenobiótico encontrado frequentemente nos ecossistemas naturais, o qual representa um aspecto muito importante na saúde pública e ambiental devido aos níveis encontrados nas fontes de agua, as quais além, tem correlação com a bioacumulação em organismos vivos. O objetivo desta pesquisa foi avaliar os efeitos imunotoxicológicos e histopatológicos da exposição a concentrações subletais de Cloreto de Mercúrio (HgCl2) em Pirapitinga branca (Piaractus brachypomus). Utilizaram-se alevinos de Pirapitinga branca com um peso médio de 10 ± 2,1 g, distribuídos em aquários com tanques de aireação constante sem filtro. O período experimental foi de 18 dias, utilizando quatro concentrações baseadas na decima parte da CL50 descrita para Pirapitinga branca assim como no grupo controle. Realizaram-se seis amostragens (dias 1, 2, 4, 7, 12 e 18) nos quais tomaram-se amostras de sangue para a avaliação da explosão respiratória e a capacidade bactericida do plasma. Calculou-se o índice hepatosomático e pegaram-se amostras para processamento histopatológico. Evidenciou-se uma elevação do nível de explosão respiratória (estresse oxidativo) em animais expostos ao HgCl2 de uma maneira dependente da concentração, sendo mais marcado este efeito ao dia 12 da exposição. Não se encontraram diferenças significativas nos valores do índice hepatosomático (IHS). Na atividade bactericida do plasma achou-se uma atividade menor em animais expostos ao HgCl2. Na análise histopatológica encontraram-se mudanças como hiperplasia, aneurisma e sinéquias em brânquias, inclusões hialinas no fígado e centros melanomacrófagos nos rins. Os alevinos de Pirapitinga branca expostos a doses sub-letais de HgCl2, amostraram um incremento significativo na explosão respiratória (estresse oxidativo) assim como mudanças na atividade bactericida do plasma, além de mudanças anatomopatológicas no nível branquial, hepático e renal.
Palavras chave: Atividade bactericida plasmática, cloreto de mercúrio, estresse oxidativo, patologia, peixes.
Introducción
El mercurio (Hg) es un metal encontrado frecuentemente como contaminante en ecosistemas naturales dada su utilización como fungicida, herbicida y conservante de semillas en agricultura así como en procesos industriales1 y reconocido internacionalmente por ser un contaminante persistente en el medio ambiente49, 57, aunado a su capacidad de bioacumulación y toxicidad en los organismos circundantes43, 45. Además, se ha prestado atención en aspectos de salud pública y ambiental debido a los niveles encontrados en fuentes de agua y su correlación con la bioacumulación en animales, incluyendo aquellos para consumo humano8, 24, 28. En Colombia, se han adelantado estudios de diagnóstico del impacto ambiental de la dinámica de dicho metal y su interacción con la biota circundante21, 51, no obstante, los estudios de subletalidad en modelos acuáticos son incipientes.
Además de poseer una gran estabilidad al proceso de biodegradación, el Hg es un elemento que se absorbe fácilmente a través de membranas biológicas y se une a las proteínas gracias a su gran afinidad al grupo sulfhídrilo20, 38. Este es biotransformado por microorganismos, e incorporado a las cadenas tróficas como metilmercurio; acumulándose en glóbulos rojos, tejido muscular, intestinal, piel así como el sistema nervioso central8, 28. Una de las variedades de mercurio encontradas en el medio por contaminación antropogénica es el cloruro de mercurio (HgCl2), el cual ha demostrado toxicidad en mamíferos9, 53, así como en organismos acuáticos71, 45.
En peces, se ha demostrado una CL50-96h entre 0,090 y 3,710 mg Hg/L dependiendo de la especie, condiciones ambientales y características fisicoquímicas del agua23, 67, 71. En especies nativas se ha demostrado la toxicidad en cachama blanca con un valor de CL50-96h de 0,56 mg Hg/L46. La forma orgánica del mercurio es la más tóxica, no obstante, el mercurio inorgánico es la forma más común liberada en el ambiente acuático causando daños en la salud de los peces44.
A pesar de la existencia de estudios sobre el efecto letal de la exposición a Hg, los efectos subletales han sido poco estudiados y las alteraciones orgánicas no han sido descritas claramente. En peces se han realizado estudios de bioacumulación de metil mercurio en tejidos8, 28, 31, mostrando problemas reproductivos, de absorción de nutrientes y en producción de energía; por otro lado se han realizado estudios de bioacumulación de HgCl2 en peces carnívoros y no-carnívoros, y sus efectos en el estado oxidativo de los organismos6, 29, 30. Además se han descrito alteraciones en el neurocomportamiento73.
El objetivo del presente trabajo fue evaluar los efectos inmunotoxicológicos (explosión respiratoria y actividad bactericida del plasma) e histopatológicos de la exposición a concentraciones subletales de Cloruro de Mercurio en cachama blanca (Piaractus brachypomus), una especie nativa de las cuencas del Orinoco y amazonas en Colombia así como de otros afluentes nacionales, ampliamente utilizada para producción y experimentación debido a su susceptibilidad a concentraciones de mercurio relativamente bajas46.
Materiales y métodos
Localización
El experimento se llevó a cabo en el Laboratorio de Toxicología de la Universidad del Tolima, adscrito a la Facultad de Medicina Veterinaria y Zootecnia, en la ciudad de Ibagué, Departamento del Tolima, localizada a 1.248 m.s.n.m., con una temperatura promedio de 22°C y una humedad relativa del 50%.
Animales experimentales
Se emplearon juveniles de cachama blanca (Piaractus brachypomus) (n=120) clínicamente sanos, con un peso de 10 ± 2,1 g, provenientes de un mismo desove, obtenidos de un proveedor comercial y mantenidos en acuarios de vidrio.
Sustancia experimental
Se utilizó Bicloruro de mercurio (HgCl2) con un 99% de pureza (Mercury(II)chloride purum p.a. ≥99.0% (KT), CAS Number 7487-94-7, Sigma Aldrich, Germany) donado por el Departamento de Química de la Universidad de los Andes (Bogotá-Colombia), el cual fue diluido y disuelto en 1000 mL de agua desionizada, y mantenido a temperatura ambiente, protegido de la luz, para evitar su foto activación.
Condiciones experimentales
Los experimentos fueron realizados siguiendo los lineamientos descritos por Organisation for Economic Cooperation and Development48 y aprobados por el Comité de Ética del centro de Investigaciones de la Universidad del Tolima acta a referendum del 16 de enero de 2012. Los peces fueron distribuidos a una densidad ≤ 1 g/L en acuarios con capacidad de 80 L con aireación constante sin filtro, y diariamente fueron monitoreados los parámetros de oxígeno, temperatura y pH. Estas condiciones fueron las mismas tanto en la fase de aclimatación (15 días) como en la fase experimental (temperatura 27,6 ± 0,18; pH 6,3 ± 0,07; Dureza 28 ± 0,1 mg/L). Al iniciar la aclimatación, los animales fueron tratados con cloruro de sodio (NaCl) al 0,2% con el fin de eliminar ectoparásitos según lo descrito por Floyd1. Durante el periodo de aclimatación los peces fueron alimentados con concentrado comercial (30% de proteína) con una ración correspondiente al 2% de la biomasa total.
Ensayo subletal
El periodo experimental fue de 18 días, utilizando cuatro concentraciones basadas en la décima parte de la CL50 descrita para cachama blanca46 así como un grupo control. Los tratamientos correspondieron a T1 (0,1 mg Hg/L), T2 (0,05 mg Hg/L), T3 (0,025 mg Hg/L) y T4 (0,0125 mg Hg/L), con sus respectivas replicas. El experimento fue semiestático con renovación diaria del 25% del volumen de agua y de la concentración del metal.
Muestreo de los peces
Para cada uno de los ensayos, previo al inicio del periodo de aclimatación (15 días), los animales fueron anestesiados con Eugenol (30 mg/L) para realizar su análisis morfométrico y para calcular el peso de cada uno de los alevinos.
Una vez terminado el periodo de aclimatación e iniciado el periodo de experimentación el muestreo, tanto de sangre como para el análisis histopatológico, se realizaron los días 1, 2, 4, 7, 12 y 18; tomando cuatro peces por cada tratamiento. Se realizó extracción de sangre por venipunción caudal a la altura de la inserción de la aleta anal, 1 a 1,5 cm por debajo de la línea lateral, con uso de jeringa de capacidad para 1 mL con heparina sódica como anticoagulante y aguja número 30. Posterior a ello se hizo corte de la medula a la altura del arco branquial para insensibilizar y realizar la toma de muestras para histopatología y el sacrificio de los alevinos.
Explosión respiratoria
Para evaluar la respuesta inmune se utilizó el método de reducción de Nitroblue Tetrazolium (NBT) por ensayo espectrofotométrico descrito en Mohanty & Sahoo41. Brevemente, 0,1 mL de sangre se dispusieron en una placa de microtítulos (fondo en U de 96 pozos) y luego se adicionó una cantidad igual de solución al 0,2% de NBT. Después de la incubación a temperatura de 25 ºC por 30 min, se removió 0,05 mL de la suspensión NBT-células sanguíneas y se agregó a un tubo que contenía 1,0 mL de N,N dimetil formamida. Después de la centrifugación a 2000 g x 5 minutos, se realizó la lectura de la densidad óptica del sobrenadante en lector de placas ELISA (espectrofotómetro) (ELx-800; Biotek® Instruments, Inc. USA) a 620 nm.
Actividad bactericida del plasma
La actividad bactericida del plasma se realizó siguiendo los lineamientos descritos por Low & Sin35. Brevemente, 100 μL de plasma de pez fueron mezclados con 100 μL de una suspensión bacteriana de Aeromonas hydrophila en un vial (La suspensión bacteriana se ajusto al tubo 0 de la escala de Macfarland aproximadamente además de esto se midió la densidad óptica dando como valor 0.080 a una lectura de 650 nm, posterior a ello se realizó la siembra de esta para realizar el conteo de las UFC el cual fue por encima de 200 UFC hasta incontables), e incubada a 25 °C por una hora. Posteriormente, esta mezcla fue sembrada en TSA (Agar Tripticasa Soya) para determinar las unidades formadoras de colonias (UFC).
Índice hepatosomático
El índice hepatosomático (IHS) de cada animal se determinó en cada etapa de muestreo por medio de la fórmula:
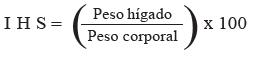
Los hígados al igual que los peces completos fueron pesados mediante balanza analítica (ADAM® 250 x 0,0001 g).
Análisis histopatológico
Al cabo de la fase experimental se registró la mortalidad de cada grupo. A los peces de cada tratamiento, en cada muestreo, se les realizó examen de necropsia según los lineamientos descritos por Yanong74. Se tomaron muestras para histopatología las cuales fueron fijadas en formalina bufferada al 3,7%, y cortadas de 4–5 μm de grosor para procedimientos histopatológicos teñidos con Hematoxilina y Eosina (H&E). La evaluación histopatológica se realizó en un microscopio óptico Motic® (Motic, USA), con el fin de verificar daños en tejidos indicativos de toxicidad como lo son el hígado, riñón y branquias. La captura de las imágenes se realizó mediante cámara y el software Motic Images Plus - Versión 2.0.
Análisis estadístico
Para el análisis de los datos se utilizó un diseño experimental completamente aleatorizado efecto fijo balanceado con la técnica de ANOVA y MANOVA donde las variables respuesta fueron: índice hepatosomático, número de colonias (actividad bactericida del suero) y densidad óptica (explosión respiratoria). El modelo se ajustó de acuerdo al siguiente diagrama:
Donde µ es la media, τI el efecto tratamiento, y εj(I) el error experimental.
Se realizó un análisis de Kruskall-Wallis seguido de una prueba de comparación múltiple de Dunn. Se validaron los supuestos del modelo y se empleó un análisis descriptivo exploratorio unidimensional para hallar media, desviación y coeficiente de variación. Los datos obtenidos fueron analizados estadísticamente con el programa GraphPad Prism versión 5.01 para Windows (GraphPad Sofware, Inc. 2007 California, USA).
Resultados
En los parámetros de calidad de agua no se evidenciaron diferencias significativas entre tratamientos y réplicas experimentales. Dichos parámetros estuvieron dentro del rango de confort descrito para la especie (temperatura 27,6 ± 0,18; pH 6,3 ± 0,07; Dureza 28 ± 0,1 mg/L). Así mismo no se presentó mortalidad durante el periodo experimental.
Índice hepatosomático (IHS)
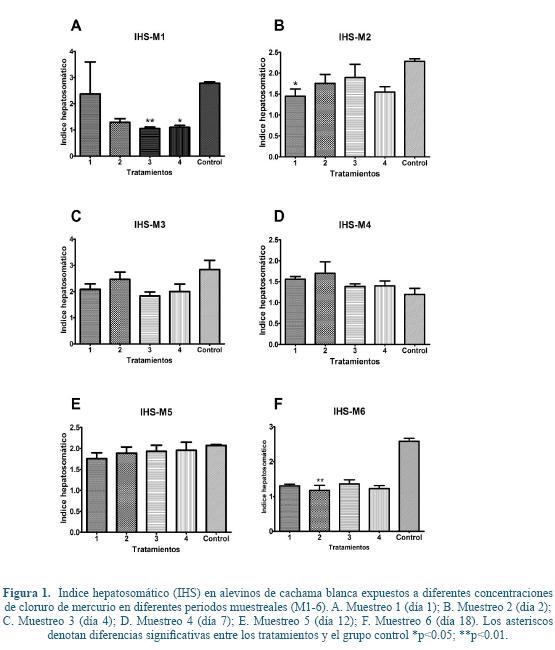
Los valores de índice hepatosomático (IHS) presentaron diferencias significativas en los T3 y T4 con respecto al grupo control (Figura 1A) al día 1 de muestreo, así como entre el T1 y el grupo control (Figura 1B) al día 2 de muestreo. De la misma manera, al día 18 de muestreo se evidenciaron diferencias significativas entre el T2 y el grupo control (Figura 1F).
Explosión respiratoria
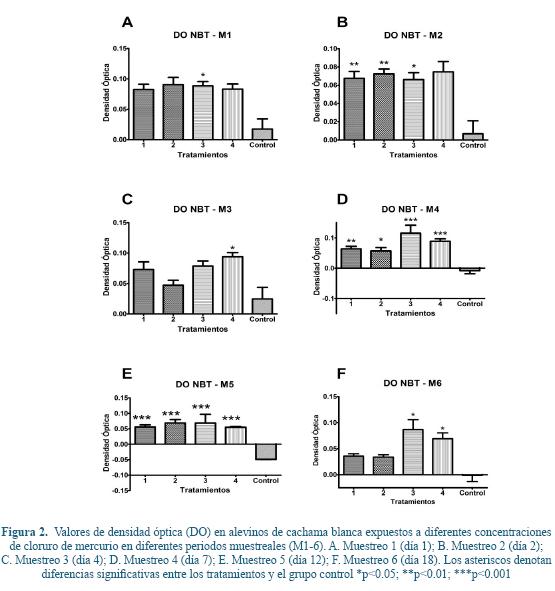
En la explosión respiratoria se evidenciaron diferencias estadísticamente significativas entre el T3 y el grupo control el día 1 (Figura 2A), entre los T1, T2 y T3 con respecto al grupo control el día 2 de muestreo (Figura 2B). De la misma manera, el día 4 de muestreo se evidenciaron diferencias significativas entre el T4 y el grupo control (Figura 2C). Para los días 7 y 12 de muestreo se evidenciaron diferencias significativas entre todos los tratamientos con respecto al grupo control (Figura 2D, E). Por último, el día 18 de muestreo solo se evidenciaron diferencias entre el T3 y T4 con respecto al grupo control (Figura 2F).
Actividad bactericida del plasma
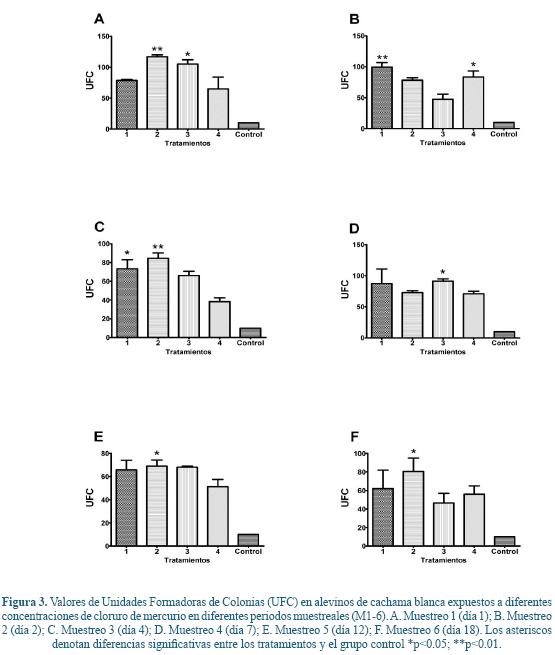
Con respecto a la actividad bactericida del plasma se halló una disminución de la actividad bactericida en los grupos expuestos a diferentes concentraciones de HgCl2, esto se ve reflejado en el aumento de unidades formadoras de colonias (UFC), ya que hay una relación inversa entre la capacidad bactericida del plasma y la cantidad de colonias presentes en el agar posterior a las 24 horas de incubación. En el muestreo 1 se hallaron diferencias estadísticamente significativas entre el tratamiento 2 y 3 con respecto al grupo control, siendo mayor la inhibición del crecimiento bacteriano en este último (Figura 3A). Para el muestreo 2, se presentaron diferencias entre el grupo 1 y 4 con respecto al grupo control (Figura 3B). Para el muestreo 3 se hallaron diferencias entre los tratamientos 1 y 2 con respecto al control (Figura 3C). Con respecto al muestreo 4 solo se evidenció diferencia entre el tratamiento 3 con respecto al control (Figura 3D). Para los muestreos 5 y 6 se halló diferencia entre el tratamiento 2 con respecto al grupo control (Figura 3E y 3F, respectivamente).
Histopatología
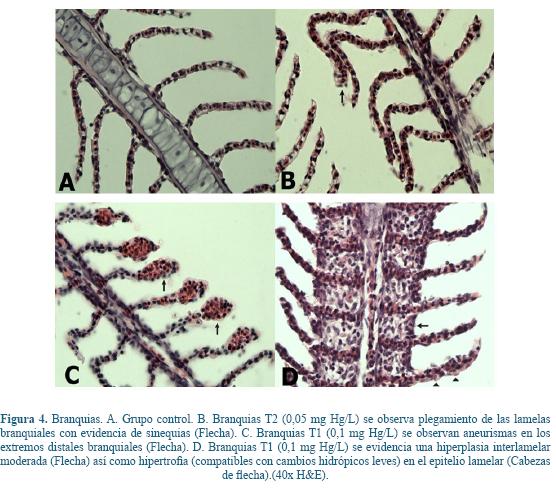
Branquias. En las branquias se observó plegamiento lamelar acompañado de infiltración mononuclear, en todos los grupos expuestos a mercurio, siendo mayor este plegamiento e infiltración en las concentraciones mayores (Figura 4B). En los tratamientos de mayor concentración (0,1 mg Hg/L; 0,05 mg Hg/L) se evidenciaron aneurismas en el extremo distal de las lamelas (Figura 4C). De la misma manera, algunos animales presentaron hiperplasia interlamelar moderada (Figura 4D).
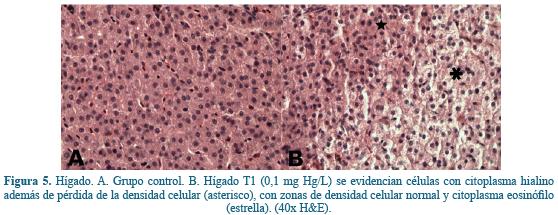
Hígado. A nivel hepático en el tratamiento de mayor concentración; i.e. T1 (0,1 mg Hg/L), se evidenciaron, de manera multifocal leve, áreas de células con citoplasma hialino (Figura 5B) compatible con cambios grasos16.
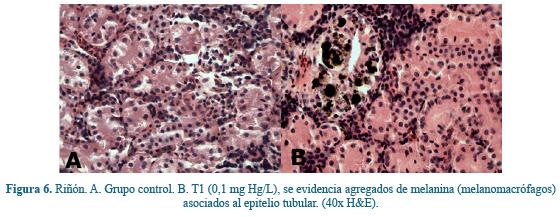
Riñón. A nivel renal, en los grupos expuestos a HgCl2 se evidenció mayor expresión de centros melanomacrófagos asociados a los túbulos renales comparados con el grupo control, donde estos no fueron observados, (Figura 6B), con un comportamiento dependiente de la concentración, siendo mayor en concentraciones más altas.
Discusión
Las prácticas mineras han demostrado efectos sociales, económicos y sobre todo ambientales deletéreos en diferentes partes del mundo, dados estos últimos por contaminación directa e indirecta de ecosistemas, y, a pesar de tener una alta rentabilidad, no compensa los efectos, en muchos casos irreversibles, sobre el ambiente14, 39, 55, 59. Los ecosistemas acuáticos se convierten en receptores finales de los residuos industriales producto de las explotaciones, principalmente en países de Latinoamérica y el continente Africano, en los cuales la extracción de minerales ha venido en aumento55, pese a la carencia de una legislación sólida así como de una evaluación del impacto de esta industria en los ecosistemas circundantes.
En Colombia, estudios realizados por Olivero50, 51 en poblaciones rurales ubicadas a lo largo del Canal del dique se evidenció un incremento, por encima de la concentración mínima, de mercurio medido a nivel de tejido muscular (7,4 µg/kg) aceptada por la OMS en cuatro diferentes especies de peces que comúnmente se encuentran en el río Magdalena; en Triportheus magdalenae se determinó la concentración de Hg en un rango de 26-129 µg/kg, en Rhamdia sebae sebae fue de 9-112 µg/kg, en Pseudoplatystoma fasciatum fue de 19-117 µg/kg, mientras que en Prochilodus reticulatus magdalenae la concentración a nivel muscular de mercurio estuvo por debajo de la concentración mínima.
Índice hepatosomático
El Índice Hepatosomático (IHS) es un biomarcador fisiológico no específico que refleja el daño irreversible, demanda metabólica y estatus nutricional del organismo, de manera indirecta considerando un cambio como respuesta a la presencia de polutantes como lo es el mercurio2.
En general la mayoría de peces encontrados en sitios impactados ambientalmente con algún polutante muestran una hipertrofia hepática e hiperplasia, esto con el fin de maximizar los mecanismos hepáticos de detoxificación17, 18, 56, 66, sin embargo, los valores y diferencias encontradas en el IHS en este estudio no permiten inferir un efecto directo del tóxico sobre este índice. No obstante, en trabajos de Monteiro43, 44 se han descrito cambios en el IHS, de peces expuestos a HgCl2, así como de peces carnívoros como el Hoplias malabaricus alimentados con peces expuestos a HgCl2. En estudios realizados por Larose30 se halló un valor menor en peces expuestos al mercuriocomparados con el grupo control. A pesar de que en el índice hepatosomático no hubo cambios significativos durante el periodo de experimentación, el aumento del tamaño sumado a los cambios grasos e inclusiones hialinas evidenciadas histopatológicamente, puede llevar a una disminución en la densidad y así mismo una disminución de la masa del hígado (m= V x ρ), y de ahí una disminución significativa en el peso como se puede observar en la gráfica en los muestreos 1, 2 y 6 (Figura 1)
Explosión respiratoria
La explosión respiratoria es un proceso mediante el cual las células fagocíticas incrementan el consumo de oxígeno con el fin de producir radicales libres para eliminar partículas fagocitadas o como reacción contra una posible injuria65. Dicha reacción puede verse afectada por la presencia de polutantes60 incluyendo el Hg11, 43, 44.
En el presente trabajo se halló un incremento en la explosión respiratoria (estrés oxidativo) en animales expuestos a concentraciones subletales de mercurio, similar a lo reportado en diversos estudios12, 40, 68, 6. Sin embargo, difiere de los descrito por Sarmento62 quienes demostraron una disminución en la producción de especies reactivas de oxígeno en células de sea bass (Dicentrarchus labrax) expuestas a mercurio, así como de trabajos de Sanchez-Dardon61 en los cuales se demostró que la exposición a 0.5 μg/L en trucha arco iris (Onchorhynchus mykiss) redujo la actividad de explosión respiratoria. De la misma manera, Voccia72 demostraron una reducción de la actividad de explosión respiratoria en esta misma especie a concentración de 10-4 – 10- M de Hg, sin embargo, describen una amplia variabilidad de los valores registrados, atribuidos a efectos citotóxicos de los mercuriales.
Así, Monteiro44 establecen que el HgCl2 puede causar una sobrecarga de radicales libres llevando al organismo a un estrés oxidativo debido a la incapacidad del sistema antioxidante de compensar la alta producción de radicales libres provocados por la exposición a este polutante, esto se ve reflejado en este sistema enzimático al haber un aumento en la cantidad de GSH (Glutatión reducido) además de otras enzimas como la Superóxido dismutasa (SOD), Catalasa (CAT), Glutatión peroxidasa (GPx), Glutatión s-transferasa (GST), Glutatión reductasa (GR) en branquias e hígado (excepto GPx) en la especie Brycon amazonicus comparados con organismos que no estaban expuestos, resaltando la capacidad del HgCl2 de provocar un estrés oxidativo además de daño celular debido a su facilidad de unión con grupos sulfhídrilo y lípidos causando cambios conformacionales y funcionales llevando a la peroxidación lipídica12.
En trabajos de Olivieri52 se evidenció estrés oxidativo en células de neuroblastoma expuestas a mercurio, mediada por depleción de GSH y en un periodo de tiempo corto. Además, estudios in vitro sugieren que HgCl2 aumenta los niveles de ARNm, después de la elevación de la transcripción proteíca, la fosforilación de tirosina de numerosas proteínas celulares y la fosforilación oxidativa en las mitocondrias desacopladas. Por lo tanto, HgCl2 a menor concentración y exposición a corto plazo induce citotoxicidad11 la cual ha sido demostrada en diversos tipos celulares10, 52.
Similar a lo reportado en el presente trabajo, Berntssen6 en el Salmón del Atlántico (Salmo salar) demostraron que la exposición al mercurio por vía oral incrementó significativamente la peroxidación lipídica a nivel cerebral y renal, en una manera dependiente de la concentración. Al igual que en trabajo de Bano & Hasan4 a dosis de 200 μg/L (10, 20 y 30 días de exposición) en el bagre, Heteropneustes fossilis.
En estudios de Verlecar70 se demostró que en crustáceos, Mesopodopsis zeylanica, expuestos a mercurio había estrés oxidativo (mayor producción radicales libres así como de lipoperoxidación), principalmente por incapacidad antioxidante de enzimas como la CAT, GST y LPX. Un efecto similar fue demostrado en bivalvos (Perna viridis)68, 6.
El órgano blanco para la acumulación de Hg, en peces es el hígado ya que este es el encargado no solamente de almacenar, sino de distribuir63, además de producir una gran cantidad de enzimas para el mantenimiento del balance oxidativo del organismo, el hígado es el encargado de la detoxificación frente a desafíos con polutantes, incluyendo el mercurio. Cabe resaltar que una alteración del hígado puede llevar a un desbalance en este sistema por lo que ya se han reportado cambios en el hígado por exposición del HgCl2 como el tamaño y la funcionalidad al haber un aumento en la oxidación de las proteínas por cambios conformacionales y formación de radicales carbonil causando cambios irreversibles, disminuyendo la actividad catalítica del hígado47. En este estudio se evidenció un posible estrés oxidativo al haber un aumento significativo en todos los muestreos aunque no en todos los tratamientos de la actividad de la NADPH oxidasa (Figura 2) la cual sirve como dador de electrones, para la reacción de explosión respiratoria y así mismo de la producción de radicales libres, lo que podría explicar este aumento es la posible pérdida de funcionalidad del hígado al haber cambios celulares en el parénquima.
En algunas fuentes hídricas de Colombia se han reportado concentraciones en musculo como en Triportheus magdalenae entre 26-129 µg/kg50, 51, valores de mercurio muy cercanos a los expuestos en peces en este trabajo 0,1-0,0125 mg Hg/L o 100-12,5 µg Hg/L, sin contar que la cantidad de exposición para que el pez bioacumule esta cantidad en musculo debe ser mayor44; según Monteiro44 al usar una cantidad de 0,150 mg Hg/L en Brycon amazonicus el pez bioacumuló en músculo un aproximado de 0,63 mg Hg/kg casi la mitad del compuesto usado, por lo que nos lleva a que en la actualidad en Colombia para que estos peces tuvieran esa concentración, es debido a que estuvieron expuestos a una concentración mucho más elevada, teniendo en cuenta la envergadura y efecto caudal de la fuente hídrica. Por lo que nos permite inferir el grado de contaminación de la fuente y los posibles efectos que los peces pueden estar teniendo frente a esta exposición. Proponiendo este estudio como un posible reflejo de lo que sucede en la realidad con algunas especies en Colombia.
Capacidad bactericida del plasma
En el presente trabajo se hallaron cambios en la capacidad bactericida del plasma en alevinos de cachama blanca en diferentes tiempos y a diferentes concentraciones, lo cual concuerda con lo descrito por Sánchez-Dardon61 quienes demostraron en trucha arco iris a niveles de 0.5 μg/L se redujo la actividad bactericida del plasma. Por el contrario los resultados del presente trabajo difieren parcialmente de lo descrito en trabajos de Low & Sin32, 35 en los cuales se demostró que la exposición a niveles de 90 μg/L de mercurio no afectó la respuesta bactericida del plasma en gouramis (Trichogaster trichopterus, Pallus). De la misma manera, Low & Sin33, 34 demostraron una actividad bactericida y de lisozima mayor, la cual fue atribuida a daños celulares consecuentes a un proceso inflamatorio inducido por el metal. Aunque no hay una descripción exacta de los mecanismos moleculares de estas alteraciones es posible que se encuentre mediada por cambios en las proteínas de fase aguda y en alteraciones estructurales de las mismas como se demostró en trabajos de Paul54 a concentraciones de 100 μg/L.
Histopatología
Diferentes estudios realizados en organismos acuáticos especialmente en peces demuestran los efectos disruptivos a nivel tisular y celular asociados a la exposición a metales pesados3, 22, 42. En general se reporta que la severidad y el tipo de lesión están directamente relacionados con la concentración y la clase de irritante37. Y se describen el hígado y branquias como los principales órganos bioindicadores de contaminación por metales13, 15.
La exposición del pez a metales pesados genera lesiones branquiales de tipo funcional y estructural, y sólo algunas de estas son de carácter reversible3, 37. En el presente trabajo se encontraron lesiones histopatológicas a nivel branquial, hepático y renal en Cachama blanca (Piaractus brachypomus) expuestos a cloruro de mercurio en concentraciones subletales. Las lesiones encontradas a nivel branquial fueron hiperplasia en los filamentos de las lamelas similar a lo encontrado por Sheir64 en donde se reporta una hiperplasia en los filamentos (lamelas primarias), en bivalvos (Mytlus edulis) expuestos a 50 µg/L de cloruro de mercurio, lo cual puede estar asociado a un proceso inflamatorio debido a la exposición a este polutante. Comparado con los estudios realizados en Cichalosoma dimerus (Pisces, Cichlidae) expuestos a concentraciones subletales de 150 µg/L y 300 µg/L de HgCl2 en donde a los 7 días de exposición fueron evidentes hiperplasia, hipertrofia y fusión total de algunas lamelas y parcial en otras, y a nivel hepático se reporta degeneración vacuolar y gránulos hialinos distribuidos focalmente23. En el presente estudio se evidenciaron cambios hidrópicos leves en las células epiteliales branquiales en los animales expuestos a la concentración más alta. Esto es compatible con lo descrito por Kaoud & El-Dahshan25 y Montaser42 quienes reportan que el edema del epitelio branquial es uno de los principales cambios estructurales causados por la exposición a metales pesados.
En un estudio de tipo subletal a exposiciones de 0.3 mg/L de Mercurio en Clarias batrachus L. Las branquias evidenciaron daño extensivo en el epitelio de las lamelas primarias y secundarias, las células epiteliales y mucosas presentaron un daño significativo en forma de vacuolización dejando únicamente en algunos lugares núcleos picnóticos. El epitelio lamelar se presentaba necrótico en algunos lugares y degeneración de las células pilares con núcleos picnóticos, además de atrofia lamelar5, los cuales son compatibles con los hallazgos encontrados en cachama blanca (Piaractus brachypomus) en donde se presentaron daños y plegamiento de las lamelas branquiales así como la formación de aneurismas, lo cuales se producen por la desintegración de las células pilares que induce una expansión del lumen de los vasos sanguíneos, resultando en congestión sanguínea58.
A nivel hepático en el presente trabajo fueron evidentes, a concentraciones de 0,1 mg/L, cuerpos hialinos (compatibles con cambios grasos16) y pérdida de densidad celular, las cuales no son compatibles con lo encontrado en ensayos de tipo agudo realizados en Tilapia Nilótica (Oreochromis niloticus) en donde se presentaron hemorragias en el parénquima, vacuolización de hepatocitos, disociación hepatocelular, además de infiltración linfocítica con necrosis hepato-celular, posiblemente asociado al tipo de estudio en cuanto a concentraciones (0,40 mg/L) y tiempo de exposición26. Sin embargo, en algunos trabajos realizados con Oreochromis niloticus expuestos a concentraciones subletales de mercurio se evidencian daños histológicos como hemólisis intravascular, picnosis nuclear en los hepatocitos y por ende necrosis, además de agregación de células mononucleares e infiltración leucocítica en la zona hepática27.
En trabajos realizados con metales pesados se ha demostrado pérdida de densidad celular de hepatocitos así como pérdida de los límites celulares, degeneración vacuolar e infiltraciones mononucleares42 los cuales son compatibles con los hallazgos evidenciados en este estudio. Así mismo, estudios de Bano & Hasan4 demostraron que la exposición a mercurio (200 μg/L, en periodos de 10, 20 y 30 días) induce una acumulación de lípidos (colesterol) en el tejido hepático, lo cual es histopatológicamente similar a lo hallado en el presente trabajo.
A nivel renal los estudios son escasos no obstante, algunos estudios realizados de tipo agudo (96 horas) en salvelino (Salvelinus alpinus) expuestos a 15 µg/L de Hg inorgánico y luego como ensayo subletal (30 días) agregando 0,30 µg/g de alimento, a las 12 horas. A nivel renal las glándulas interrenales presentaron núcleo alargado, vacuolizado y ubicado en la parte central del citoplasma, además de una disminución en el número y tamaño de estas células y en el tejido hematopoyético con un incremento de eritrocitos, macrófagos y núcleos picnóticos después de las 96 horas de exposición58, hallazgos que no fueron evidenciados en el presente trabajo. No obstante se sabe, que la aparición de centros melanomacrófagos en la zona renal puede deberse a procesos inflamatorios y deposiciones de melanina, lipofuscina y hemosiderina los cuales han sido usados como bioindicadores de estrés oxidativo, lo que puede explicarse debido al aumento en los niveles de explosión respiratoria expresados en la prueba con Nitroblue Tetrazolium (NBT)7, 36.
Conclusiones
La exposición crónica subletal a mercurio (HgCl2) bajo condiciones de laboratorio induce estrés oxidativo, disminución de la capacidad bactericida del plasma así como alteraciones anatomopatológicas en alevinos de cachama blanca, Piaractus brachypomus. Esto hallazgos revisten importancia dada la creciente carga de mercuriales en fuente de agua naturales donde habitan estos peces así como los posibles efectos de este metal sobre la fisiología de los animales, principalmente los acuáticos, gracias a sus propiedades de bioacumulación y a los procesos de biomagnificación subyacente. Este trabajo además plantea la necesidad de estudios sobre otras variables, e.g. genética o reproductivas, que de manera subclínica pueden verse afectadas.
Agradecimientos
A la Universidad del Tolima y su Comité Central de Investigaciones por el apoyo mediante el proyecto “Efecto del Cloruro de Mercurio (HgCl2) en la respuesta inmune innata (fagocitosis y explosión respiratoria) en Cachama blanca (Piaractus brachypomus)” código: 250212. Al Laboratorio de Toxicología y su director Dr. Ángel Enrique Céspedes por el apoyo. Al Departamento de Química de la Universidad de los Andes (Bogotá, Colombia) y a su director Wolfram Baumann. Al Laboratorio de Diagnóstico Veterinario de la Universidad del Tolima, especialmente a Luis Ortiz. A los estudiantes del Grupo de Investigación en Inmunología y Fisiopatología Animal – IFA, de manera especial, a Luisa Fernanda Vargas Rojas, Natalia C. Reyes Chaux, por el apoyo en el montaje de los experimentos.
Referencias
1. Acherman J. Análisis del estado de alteración y contaminación del humedal Jaboque Bogotá (Colombia) Tesis de pregrado. Pontificia Universidad Javeriana de Bogotá, Bogotá (Colombia), 2007. p. 110. [ Links ]
2. Adams SM, Brown AM, Goege RW. A quantitative health assessment index for rapid evaluation of fish condition in the field. Trans Am Fish Soc 1993; 122:69-73. [ Links ]
3. Agnihotri U, Bahadure R, Akarte S. Gill lamellar changes in fresh water fish Channa punctatus due to influence of arsenic trioxide. Biochem Biophys Res Commun 2010; 3: 61-65. [ Links ]
4. Bano Y, Hasan M. Mercury induced time-dependent alterations in lipid profiles and lipid peroxidation in different body organs of cat-fish Heteropneustes fossilis. J Environ Sci Heal B 1989; 24: 145-166, [ Links ].
5. Begum SA, Banu Q, Hoque B. Effect of chromium, cadmium and mercury on the gill histology of Clarias batrachus L. The Chittagong Univ. J. b. sci. 2009; 4(1 &2): 13-23. [ Links ]
6. Berntssen M, Aatland A, Handy R. Chronic dietary mercury exposure causes oxidative stress, brain lesions, and altered behaviour in Atlantic salmon (Salmo salar) parr. Aquat Toxicol 2003; 65: 55-72. [ Links ]
7. Burnett KG. Impacts of environmental toxicants and natural variables on the immune sytem of fishes. En: Biochemistry and Molecular Biology of Fishes. Vol. VI. Environmental toxicology, ed. by T. P. Mommsen and T. W. Moon, Elsevier, Amsterdam; 2005. P. 231-253. [ Links ]
8. Cambier S, Bernard G, Mesmer-Dudons N, González P, Rossignol R. At environmental doses, dietary methylmercury inhibits mitochondrial energy metabolism in skeletal muscles of the zebrafish (Danio rerio). Int J Biochem Cell Biol 2009; 41: 791-799. [ Links ]
9. Das K, Siebert U, Gillet A, Dupont A, Di-Poï C, et al. Mercury immune toxicity in harbour seals: links to in vitro toxicity. Environ Health 2008; 7 (52): 1-17 [ Links ]
10. Drevnick PE, Sandheinrich MB, Oris JT. Increased ovarian follicular apoptosis in fathead minnows (Pimephales promelas) exposed to dietary methylmercury. Aquat Toxicol 2006; 79(1): 49-54. [ Links ]
11. Durak D, Kalender S, Gokce FU, Demır F, Kalender Y. Mercury chloride-induced oxidative stress in human erythrocytes and the effect of vitamins C and E in vitro. Afr J Biotechnol 2010; 9(4): 488-495 [ Links ]
12. Elia AC, Galarini R, Taticchi MI, Dörr AJ, Mantilacci L. Antioxidant responses and bioaccumulation in Ictalurusmelas under mercury exposure. Ecotoxicol Environ Saf 2003; 55(2):162-167. [ Links ]
13. El-Naggar AM, Mahmoud SA; Tayel SI. Bioaccumulation of Some Heavy Metals and Histopathological Alterations in Liver of Oreochromis niloticus in Relation to Water Quality at Different Localities along the River Nile, Egypt. W J Fish & Marine Sci 2009; 1(2): 105-114. [ Links ]
14. EPA. An Assessment of Potential Mining Impacts on Salmon Ecosystems of Bristol Bay, Alaska. External Peer Review of EPA's Draft Document. Final Peer Review Report. Contract No. EP-C-07-025 Task Order 155. September 17, 2012. [ Links ]
15. Fatma AS. Bioaccumulation of Selected Metals and Histopathological Alterations in Tissues of Oreochromis niloticus and Lates niloticus from Lake Nasser, Egypt. Global Veterinaria 2008; 2 (4): 205-218 [ Links ]
16. Ferguson HW. Systemic pathology of fish. 2th ed. 2006. London: Scotian Press. p. 366. [ Links ]
17. Fernandes C, Fontainhas-Fernandes A, Cabral D, Salgado MA. Heavy metals in wáter, sediment and tissues of Liza saliens from Esmoriz Paramos lagoon, Portugal. Environ Monit Assess 2007; 136: 267-275. [ Links ]
18. Figueiredo-Fernandes A, Fontaínhas-Fernandes A, Peixoto F, Rocha E, Reis-Henriques MA. Effects of gender and temperatura on oxidative stress enzymes in Nile tilapia Oreochromis niloticus exposed to paraquat. Pest Biochem Physiol 2006; 85: 97-103. [ Links ]
19. Floyd R. The use of salt in aquaculture. Fact Sheet VM 86. Series of the Department of Large Animal Clinical Sciences, Florida Cooperative Extension Service, Institute of Food and Agricultural Sciences, University of Florida 1995; [acceso: 23 de marzo de 2013]. URL: http://edis.ifas.ufl.edu/vm007. [ Links ]
20. Foulkes EC. Transport of toxic heavy metals across cell membranes. Proc Soc Exp Biol Med 2000; 223: 234-240. [ Links ]
21. Guerrero E, Restrepo M, Podlesky E. Mercurio: un contaminante ambiental ubicuo y peligroso para la salud humana. Biomédica 1995; 15(3): 144-154. [ Links ]
22. Gupta N, Dua A. Mercury induced architectural alterations in the gill surface of a fresh water fish, Channa punctatus. J Environ Biol 2002; 23, 383-386. [ Links ]
23. Hirt LM, Domitrovic HA. Toxicidad y respuesta histopatológica en Cichlasoma dimerus (Pisces, Cichlidae) expuestos a bicloruro de mercurio en ensayos agudos y subletales. Revista Ictiología 2002; 10(1/2): 37-52 [ Links ]
24. Jahed GR, Alli I, Nowroozi E, Nabizadeh R. Mercury contamination in fish and public health aspect: a review. Pak J Nutr 2005; 4(5): 276-281 [ Links ]
25. Kaoud HA, El-Dahshan AR. Bioaccumulation and histopathological alterations of the heavy metals in Oreochromis niloticus fish. Nat Sci 2010; 8(4): 147-156. [ Links ]
26. Kaoud HA, Mahran MA, Rezk A, Khalf MA. Bioremediation the toxic effect of mercury on liver histopathology, some hematological parameters and enzymatic activity in Nile tilapia, Oreochromis niloticus. Researcher 2012; 4(1): 60-70. [ Links ]
27. Kaoud HA, Mekawy MM. Bioremediation the Toxic Effect of Mercury-Exposure in Nile Tilapia (Oreochromis niloticus) by using Lemna gibba L. J Am Sci 2011; 7(3): 336-343. [ Links ]
28. Kehring H, Howard B, Malm O. Methylmercury in a predatory fish (Chichla spp.) inhabiting the Brazilian Amazon. Environ Pollut 2008; 154: 68-76 [ Links ]
29. Kim J, Lee J, Kang J. Effect of Inorganic Mercury on Hematological and Antioxidant Parameters on Olive Flounder Paralichthys olivaceus. Fish Aquat Sci 2012; 15(3): 215-220. [ Links ]
30. Larose C, Canuel R, Lucotte M, Di R. Toxicological effects of methylmercury on walleye (Sander vitreus) and perch (Perca flavescens) from lakes of the boreal forest. Comp Biochem Phys C 2008; 147: 139-149 [ Links ]
31. Leaner JJ, Mason RP. Methylmercury accumulation and fluxes across the intestine of channel catfish, Ictalurus punctatus. Comp Biochem Phys C 2002; 132: 247-259 [ Links ]
32. Low KW, Sin YM. Effects of mercuric chloride and sodium selenite on some immune responses of blue gourami, Trichogaster trichopterus (Pallus). Sci Total Environ 1998; 214: 153-164 [ Links ]
33. Low KW, Sin YM. Effects of mercuric chloride on chemiluminescent response of phagocytes and tissue lysozyme activity in tilapia, Oreochromis aureus. Bull Environ Contam Toxicol 1995a; 54: 302-308. [ Links ]
34. Low KW, Sin YM. In vitro effect of mercuric chloride and sodium selenite on chemiluminescent response of pronephros cells isolated from tilapia, Oreochromis aureus. Bull Environ Contam Toxicol 1995b; 55: 909-915. [ Links ]
35. Low KW, Sin YM. In vivo and in vitro effects of mercuric chloride and sodium selenite on some non-specific immune responses of blue gourami, Trichogaster trichopterus (Pallus). Fish Shellfish Immunol 1996; 6: 351-362 [ Links ]
36. Lund BO, Miller DM, Woods JS. Studies on Hg (II)-induced H2O2 formation and oxidative stress in vivo and in vitro in rat kidney mitochondria. Biochem. Pharmacol. 1993; 45: 2017- 2024. [ Links ]
37. Mallat J. Fish gill structural changes induces by toxicants and other irritants: a statistical review. Can J Fish Aquat Sci 1985; 42: 630-648 [ Links ]
38. Mancera-Rodríguez NJ, Álvarez-León R. Estado del conocimiento de las concentraciones de mercurio y otros metales pesados en peces dulceacuícolas de Colombia. Act Biol Col 2006; 11 (1): 3-23. [ Links ]
39. Maslyuk S, Dharmaratna D. 2012. Impact of Shocks on Australian Coal Mining. Discussion paper 37/12. Department of Economics. ISSN 1441-5429. 26p [ Links ]
40. Milaeva ER. The role of radical reactions in organomercurials impact on lipid peroxidation. J Inorg Biochem 2006; 100: 905-915 [ Links ]
41. Mohanty BR, Sahoo, PK. Immune responses and expression profiles of some immune-related genes in Indian major carp, Labeorohita to Edwardsiellatarda infection. Fish Shellfish Immunol 2010; 28(4): 613-621. [ Links ]
42. Montaser M, Mahfouz M, El-Shazly S, Abdel-Rahman G, Bakry S. Toxicity of Heavy Metals on Fish at Jeddah Coast KSA: Metallothionein Expression as a Biomarker and Histopathological Study on Liver and Gills. W J Fish & Marine Sci 2010; 2: 174-185 [ Links ]
43. Monteiro DA, Rantin FT, Kalinin AL. Dietary intake of inorganic mercury: bioaccumulation and oxidative stress parameters in the neotropical fish Hoplias malabaricus. Ecotoxicology 2013; 22: 446-456. [ Links ]
44. Monteiro DA, Rantin FT, Kalinin AL. Inorganic mercury exposure: toxicological effects, oxidative stress biomarkers and bioaccumulation in the tropical freshwater fish matrinxã, Brycon amazonicus (Spix and Agassiz, 1829). Ecotoxicology 2010; 19(1): 105-123. [ Links ]
45. Muñoz-Escobar EM, Palacio-Baena JA. Efectos del cloruro de mercurio (HgCl2) sobre la sobrevivencia y crecimiento de renacuajos de Dendrosophus bogerti. Actual Biol 2010; 32 (93): 189-197. [ Links ]
46. Naranjo-Gómez JS, Vargas-Rojas LF, Rondón-Barragán IS. Toxicidad aguda de cloruro de mercurio (HgCl2) en cachama blanca, Piaractus brachypomus. Actual Biol 2013; 35 (98): 85-93. [ Links ]
47. Nyström T. Role of oxidative carbonylation in protein quality control and senescence. EMBO J 2005; 24: 1311-1317. [ Links ]
48. OECD. Test No 203: Fish, Acute Toxicity Test. Paris: OECD Publishing 1992; p. 1-9. [ Links ]
49. Oh S, Kim M, Yi S, Zoh K. Distributions of total mercury and methylmercury in surface sediments and fishes in lake Shihwa, Korea. Sci Total Environ 2010; 408: 1059-1068 [ Links ]
50. Olivero J, Navas V, Pérez A, Solano B, Acosta I, Arguello E, Salas R. Mercury Levels in Muscle of Some Fish Species from the Dique Channel, Colombia. R. Bull Environ Contam Toxicol 1997; 58: 865-870. [ Links ]
51. Olivero J, Restrepo BJ. El lado gris de la minería del oro: la contaminación con mercurio en el norte de Colombia. Cartagena: Editorial Universitaria; 2002 [ Links ]
52. Olivieri G, BrackCh, Müller-Spahn F, Stähelin HB, Herrmann M, Renard P,. Brockhaus M, Hock C. Mercury Induces Cell Cytotoxicity and Oxidative Stress and Increases beta-Amyloid Secretion and tau phosphorylation in SHSY5Y neuroblastoma Cells. J Neurochem 2000; 74: 231-236. [ Links ]
53. Patnaik BB, Roy A, Agarwal S, Bhattacharya S. Induction of oxidative stress by non-lethal dose of mercury in rat liver: possible relationships between apoptosis and necrosis. J Environ Biol 2010; 31(4):413-6. [ Links ]
54. Paul I, Mandal C, Mandal C. Effect of environmental pollutants on the C-reactive protein of a freshwater major carp, Carla catla. Dev Comp Immunol1998; 22: 519-532. [ Links ]
55. Peña JD. Minería y medio ambiente en Colombia. Tesis Especialización en Gerencia del Medio Ambiente y Prevención de Desastres, Universidad Sergio Arboleda. Bogotá. 2003, 150p. [ Links ]
56. Porter CM, Janz DM. Treated municipal sewage discharge affects multiple levels of biological organization in fish. Ecotoxicol Environ Saf 2003; 54: 199-206. [ Links ]
57. Ravichandran M. Interactions between mercury and dissolved organic matter-a review. Chemosphere 2004; 55:319-331 [ Links ]
58. Ribeiro CA, Belger L, Pelletier B, Rouleauc C. Histopathological evidence of inorganic mercury and methyl mercury toxicity in the arctic charr (Salvelinus alpinus). Environmental Research 2002; 90: 217-225. [ Links ]
59. Robles R. Efectos de la minería moderna en tres regiones del Perú. Revista de Antropología 2003; 1: 31-70 [ Links ]
60. Rondón-Barragán IS, Pardo-Hernández D, Eslava-Mocha PR. Efectos de los herbicidas sobre el sistema inmune en peces. Revista Complutense de Ciencias Veterinarias 2010; 4(1): 1-22. [ Links ]
61. Sánchez-Dardon J, Voccia I, Hontela A, Anderson P, Brousseau P, Blakely B, Boermans H, Fournier M. Immunotoxicity of cadmium, zinc and mercury after in vivo exposure, alone or in mixture in rainbow trout (Oncorhynchus mykiss). Dev. Comp. Immunol.1997; 21:133 [ Links ]
62. Sarmento A, Guilhermino L, Afonso A. Mercury chloride effects on the function and cellular integrity of sea bass (Dicentrarchus labrax) head kidney macrophages. Fish Shellfish Immunol 2004; 17: 489-498 [ Links ]
63. Sary AA, Mohammadi M. Comparison of Mercury and Cadmium Toxicity in Fish species from Marine water. Res J Fish & Hydrobiol 2012; 7(1), 14-18. [ Links ]
64. Sheir SK, Handy RD, Galloway TS. Tissue injury and cellular immune responses to mercuric chloride exposure in the common mussel Mytilus edulis: modulation by lipopolysaccharide. Ecotoxicol Environ Saf 2010; 73 (6): 1338-1344. [ Links ]
65. Tizard I. Veterinary Immunology: an introduction. Saunders Company. 9a ed. 2012. p 568 [ Links ]
66. Van der Oost R, Beyer J, Vermeulen NPE. Fish bioaccumulation and biomarkers in environmental risk assessment: a review. Environ Toxicol Phar 2003; 13: 57-149. [ Links ]
67. Verep B, SibelBesli E, Altionk I, Mutlu C. Assessment of Mercuric chloride toxicity on Rainbow trouts and cubs. Pak J. Biol Sci. 2007; 10: 1098-1102. [ Links ]
68. Verlecar XN, Jena KB, Chainy GBN. Biochemical markers of oxidative stress in Per naviridis exposed to mercury and temperature. Chem Biol Interac 2007; 167: 219-226. [ Links ]
69. Verlecar XN, Jena KB, Chainy GBN. Modulation of antioxidant defences in digestive gland of Perna viridis (L.), on mercury exposures. Chemosphere 2008; 71: 1977-1985 [ Links ]
70. Verlecar X, Das P, Jena K, Maharana D, Desai S. Antioxidant responses in Mesopodopsis zeylanica at varying salinity to detect mercury influence in culture ponds. Turk J Biol 2012; 36:711-718. [ Links ]
71. Vieira LR, Gravato C, Soares A, Morgado F, Guilhermino L. Acute effects of copper and mercury on the estuarine fish Pomatoschistus microps: Linking biomarkers to behavior. Chemosphere 2009; 76:1416-1427 [ Links ]
72. Voccia I., K. Krzystyniak, M. Dunier, D. Flipo and M. Fournier. In vitro mercury-related cytotoxicity and functional impairment of the immune cells of rainbow trout (Oncorhynchus mykiss). Aquat Toxicol 1994; 29: 37-48. [ Links ]
73. Xu X, Weber D, Carvan MJ, Coppens R, Lamb C, Goetz S, Schaefer LA. Comparison of neurobehavioral effects of methylmercury exposure in older and younger adult zebrafish (Danio rerio). NeuroToxicology 2012; 33:1212-1218 [ Links ]
74. Yanong RPE. Necropsy techniques for fish. En: Echols S, editor. Practical gross necropsy of exotic animal species. Seminars in avian and exotic pet medicine. Philadelphia (U. S. A.): W. B. Saunders Co 2003. p. 89-105. [ Links ]