Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina Veterinaria y Zootecnia
On-line version ISSN 1900-9607
Ces. Med. Vet. Zootec. vol.9 no.2 Medellín July/Dec. 2014
Artículos originales de investigación
Serological and molecular detection of Hepatitis E virus in pig farms of Antioquia¤
Detección serológica y molecular del virus de la Hepatitis E en cerdos de granjas antioqueñas
Detecção serológica e molecular do vírus da hepatite E em suínos no departamento de Antioquia, Colômbia.
Cristian Camilo Gutiérrez Vergara1, 2*, Zoot, MSc, PhD (e); Daniel Alberto Ospina Vélez2, Zoot, MSc; Jorge Eduardo Forero Duarte2, 3, Bact, MSc, PhD (c); Berardo de Jesús Rodríguez3, MV, Esp, PhD, Lina Andrea Gutiérrez Builes1, Microbióloga, MSc, PhD, Guillermo Correa Londoño, Ing. Forestal, MSc, PhD, Albeiro López Herrera2, MV, Zoot, MSc, DrSci, Jaime Parra Suescún2, Zoot, MSc, PhD.
¤Para citar este artículo: Gutiérrez Vergara CC, Ospina Vélez DA, Forero Duarte JE, Rodríguez B de J, Gutiérrez Builes LA, Correa Londoño G, López Herrera A, Parra Suescún J. Detección serológica y molecular del virus de la Hepatitis E en cerdos de granjas antioqueñas . Rev CES Med Zootec. 2014; Vol 9(2): 158-168.
*Autor para correspondencia: Cristian Camilo Gutiérrez Vergara. Facultad de Ciencias Agraria, Universidad Nacional de Colombia sede Medellín, Laboratorio de Biotecnología Animal. Bloque 19-113, Calle 59A No 63 - 20, Autopista Norte, Antioquia, Colombia, ccgutier@unal.edu.co
1 Grupo Biología de Sistemas; Escuela de Ciencias de la salud, Facultad de Medicina; Universidad Pontificia Bolivariana; Sede Central Medellín; Calle 78B N°72A-109, Medellín, Colombia.
2 Grupo Biodiversidad y Genética Molecular BIOGEM, Departamento de Producción Animal, Facultad de Ciencias Agrarias, Universidad Nacional de Colombia, Medellín, Colombia. Calle 59A No 63 - 20 Autopista norte. Bloque 50, Ofic 310.
3 Grupo de Investigación en Patobiología QUIRON Laboratorio de Patología Veterinaria Facultad de Ciencias Agrarias, Universidad de Antioquia, Medellín, Colombia.
(Recibido: 4 de abril, 2014; aceptado: 24 de octubre, 2014)
Abstract
Hepatitis E virus (HEV) is the viral agent that produces most cases of acute hepatitis worldwide. Four genotypes and 24 subtypes of HEV have been identified. Presence of viral strains in pigs suggests this species is a reservoir for HEV. A case of Hepatitis E in humans has been reported in Antioquia, the largest pig producer and pork consumer province in Colombia. This study investigated the presence of HEV in pigs from several swine farms in Antioquia by looking for anti-HEV antibodies and viral RNA in pig feces. Serological tests were performed for detecting IgG and IgM anti-HEV. Molecular assays (RT-PCR) were also used for detecting the ORF-1 marker of HEV viral genome. These procedures were performed on 210 animals from 30 pig farms. Presence of antibodies and molecular analysis were organized by frequencies and analyzed using the R software (version 2.15.2). 100% of the samples were positive for IgG antibodies, while 57% of the samples were positive for IgM antibodies. According to the molecular analysis, 26% of pig feces had genetic material from HEV. This study demonstrates exposure and circulation of HEV in pig farms of Antioquia.
Key words: Antibodies, feces, Hepatitis E virus, pigs, Zoonosis.
Resumen
La Hepatitis E es una enfermedad producida por el Virus de Hepatitis E (HEV), considerado el agente vírico con mayor producción de hepatitis agudas alrededor del mundo. Se han determinado 4 genotipos y 24 subtipos de HEV. La presencia de cepas virales tanto en humanos como en otras especies, ha sugerido que existen reservorios animales para HEV, entre los cuales el cerdo juega un papel importante. En Antioquia se ha reportado un caso de Hepatitis E en humanos. Teniendo en cuenta que este departamento es el principal productor y consumidor de cerdos en Colombia, se investigó la presencia de este virus en los cerdos de diferentes granjas porcícolas, con el fin de determinar anticuerpos anti-HEV y RNA viral en heces porcinas. Para lograr esto, se realizaron pruebas serológicas para la detección de anticuerpos IgG e IgM anti-HEV, y pruebas moleculares (RT-PCR) para la detección del marcador ORF-1 del genoma viral de HEV. Estos procedimientos se realizaron en 210 animales de 30 granjas porcícolas de Antioquia. La presencia de anticuerpos y análisis moleculares en los cerdos, se determinaron por frecuencias y se analizaron mediante el software R versión 2.15.2. El 100% de las muestras fueron positivas para anticuerpos IgG; mientras que para anticuerpos IgM, los positivos representaron el 57% de las muestras evaluadas. El análisis molecular determinó que el 26% de los cerdos presentó material genético de HEV en sus heces. Esta información demuestra la exposición y la circulación de HEV en cerdos de las granjas evaluadas en municipios de Antioquia.
Palabras clave: Anticuerpos, Heces, Porcinos, virus de Hepatitis E, Zoonosis.
Resumo
A hepatite E é uma doença produzida pelo vírus da hepatite E (HEV), considerado o agente virulento com maior produção de hepatites agudas ao redor do mundo. Tem se determinado quatro genótipos e 24 subtipos de HEV. A presença de cepas virais tanto em humanos quanto em outras espécies, tem sugerido que existem reservatórios animais para HEV, entre os quais o suíno tem grande importância. Em Antioquia tem se reportado um caso de hepatite E em humanos. Tendo de presente que este departamento é o principal produtor e consumidor de suínos na Colômbia, pesquisou-se a presença deste vírus em suínos de diferentes granjas suínas, com o fim de determinar anticorpos anti-HEV e RNA viral em fezes porcinas. Para lograr isto, realizaram-se testes serológicos para a detecção de anticorpos IgG e IgM anti-HEV e testes moleculares (RT-PCR) para a detecção do marcador ORF-1 do genoma viral de HEV. Estes procedimentos realizaram-se em 210 animais de 30 granjas suínas em Antioquia. A presença de anticorpos e as análises moleculares nos suínos, determinaram-se por frequências e se analisaram mediante o software R Versão 2.15.2. O 100% das amostras foram positivas para anticorpos IgG; enquanto que para anticorpos IgM os positivos representaram o 57% das amostras avaliadas. O analise molecular determinou que o 26% dos suínos apresentou material genético de HEV em suas fezes. Esta informação demonstra a exposição e circulação de HEV em suínos das granjas avaliadas em municípios de Antioquia, Colômbia.
Palavras-chave: Anticorpos, fezes, suínos, vírus da hepatite E, zoonose.
Introducción
La Hepatitis E es una enfermedad aguda producida por el Virus de la Hepatitis E (HEV). Se considera que el HEV es causante de más del 50% de las hepatitis agudas alrededor del mundo 22. Este virus perteneciente a la familia Hepeviridae, y único integrante del género Hepevirus, tiene genoma RNA de sentido positivo con 7.2 Kb aproximadamente; y codifica tanto proteínas estructurales como no estructurales partiendo de tres regiones codificantes ORF-1, ORF-2 y ORF-3 18. Se han descrito 4 genotipos en mamíferos (1, 2, 3 y 4) y 24 sub-genotipos 22, los cuales se distribuyen alrededor del mundo y pueden infectar tanto humanos como otras especies animales, incluyendo al cerdo doméstico (Sus scrofa ssp. domestica) 2. El HEV puede causar brotes epidémicos principalmente en lugares donde las condiciones sanitarias no son adecuadas, pero además, se han reportado casos esporádicos de infección por este virus en países donde se pensaba que no estaba presente; razón que ha sugerido la existencia de reservorios animales, donde el cerdo doméstico es uno de los principales, y aunado a que la enfermedad es una zoonosis 38. En Medellín se ha determinado un paciente positivo para HEV 34. En el Valle de Aburrá se determinó, positividad a anticuerpos anti-HEV en humanos que trabajan con cerdos en plantas de beneficio 7; sin embargo, la información aún no es disponible o poco se ha estudiado sobre la presentación de HEV en los porcinos de Antioquia. Aunado a esto, debe tenerse en cuenta que este es el departamento donde el volumen de producción (47.6%) y consumo por habitante (21,3 kg), es el mayor en todo el país 12. Razones que justifican plenamente la importancia de determinar la presencia de HEV en cerdos de granjas porcícolas en Antioquia.
Materiales y métodos
Consideraciones éticas
Este proyecto no implicó daños al medio ambiente y a la salud humana a corto, mediano o largo plazo. Los protocolos y procedimientos empleados en esta investigación contaron con la aprobación del Comité de Ética para la Experimentación Animal de la Universidad Nacional de Colombia, Sede Medellín (Acta No CEMED-226 del 14 de Octubre de 2010).
Tipo de estudio
Estudio descriptivo transversal.
Localización
Se seleccionaron un total de 30 granjas en 10 municipios, distribuidas en cuatro subregiones del departamento de Antioquia. Las granjas contaban con diferentes sistemas de producción (ciclo completo y por etapas). La selección de municipios y granjas, se basó en los resultados obtenidos sobre seropositividad de anticuerpos IgG/IgM e IgM específicos para HEV en cerdos procedentes de diferentes municipios de Antioquia, y faenados en 5 plantas de beneficio del departamento (Forero et al., 2013. Datos sin publicar).
Toma de muestras de cerdos en granja
Se evaluaron 210 cerdos a quienes se les tomó muestras de heces y de sangre (correspondientes al mismo animal), distribuidas en las 30 granjas evaluadas, teniendo un promedio de 7 cerdos por granja. En cada una de las porcícolas seleccionadas, se muestrearon cerdos en diferentes etapas de crecimiento, presentando edades desde uno hasta seis meses para los animales en Levante y Ceba, y desde 7 hasta 24 meses en los Reproductores. De cada cerdo se tomaron aproximadamente 5 ml de sangre en tubos sin anticoagulante directamente de la vena yugular mediante venopunción según la metodología descrita por Coll y Morrillo 10. Las muestras de heces se tomaron directamente del recto de cada uno de los porcinos, logrando obtener alrededor de 5 gramos por cada animal, estas heces se almacenaron en tubos plásticos estériles de manera individual, y se transportaron a 4 °C al laboratorio de Biotecnología Animal de la Universidad Nacional de Colombia sede Medellín. La sangre de los cerdos, fue centrifugada inmediatamente a 1500 rpm durante 8 minutos para la obtención del suero. Estos sueros al igual que las muestras de heces fueron almacenados a -80 °C hasta su procesamiento.
Detección de anticuerpos tipo IgG contra HEV
Para la detección de anticuerpos IgG e IgM anti-HEV se utilizó un estuche comercial de ELISA indirecto HEV IgG e HEV IgM respectivamente (DIA.PRO Diagnostic Bioprobes. Milán Italia). Comercialmente este kit se emplea para la detección de anticuerpos anti-HEV en humanos. Sin embargo, en este caso se reemplazó el conjugado anti-humano del estuche por un anticuerpo conjugado de cabra anti-IgG e IgM para reconocimiento de anticuerpos de cerdo (Thermo Scientific), en una dilución 1:5000 31, 32, 37. En cada uno de los ensayos se utilizó un control negativo porcino (CNP) proveniente de un cerdo neonato que no había consumido calostro. Como control positivo porcino (CPP), se utilizó una muestra de campo que en repetidos ensayos cumplió los parámetros de positividad 37. Se realizaron las mediciones utilizando un espectrofotómetro (Biotek ELx800) a 450nm.
El punto de corte (Cut Off: CO) para determinar las muestras positivas a los anticuerpos tipo IgG e IgM, se fijó con base en la Desigualdad de Chebyshev, la cual establece que para cualquier distribución, no más de (1/k2)% de los datos pueden alejarse en más de k desviaciones estándar de la media, siendo este el promedio de las densidades ópticas a 450nm (DO 450) de los controles negativos (CN) + 7 desviaciones estándar de la media 31, 32, 37. Los resultados se interpretaron como la relación entre la DO 450 de la muestra y el CO (M/CO). Los puntos de corte establecidos fueron 0,220 para IgG y 0,545 para IgM.
Extracción de RNA a partir de heces
De cada cerdo se tomó un gramo de heces y se resuspendió en 10 ml de PBS (suspensión al 10%). Después de homogenizar las heces se centrifugaron a 4.500 rpm durante 10 minutos, según lo descrito 21. A partir de este sobrenadante (280 µl) se realizó la extracción de RNA. Para este procedimiento se utilizó el estuche comercial QIAamp® Viral RNA Mini kit (Qiagen Germany) siguiendo las recomendaciones dadas por el fabricante y apoyados en el protocolo reportado 21. La calidad y concentración del RNA se evaluó midiendo las densidades ópticas (DO260 y DO280) en un Nanodrop 2000 (Thermo Scientific) y se verificó por electroforesis horizontal en gel de agarosa al 0.8%.
RT-nPCR. El RNA obtenido de cada una de las muestras se sometió a transcripción reversa para la obtención de cDNA, utilizando Reverse Transcriptases RevertAid™ Enzyme Mix (Fermentas®) 0,1U/µl, 4µl de RT buffer 5X, 2 µl de dNTPs 10mM, 1 µl de hexámeros de cebadores 100 µM, RNA 5 µl, y agua desinonizada hasta completar un volumen final de 25 µl, bajo recomendaciones del fabricante. Se utilizó el siguiente perfil de temperaturas: un periodo inicial de 10 minutos a 25 °C, 60 minutos a 43,5 °C, y un periodo final de 5 minutos a 72 °C. La detección del genoma viral se realizó mediante PCR anidada, empleando cebadores capaces de amplificar una región específica del ORF-1 del HEV 20. La técnica empleada sufrió modificaciones a lo reportado 20, a saber: en la primera ronda de PCR se empleó un volumen final de 25 µl, que contenía: 2,5 µl de Buffer 10X (Bioline), 2 µl de MgCl2 50 mM, 1 µl de dNTPs (10µM) de cada dNTP, 2 µl de cada uno de los cebadores (ORF-1 F; ORF-1 R), 0,2 µl de Taq DNA polimerasa (1U/µl), 3 µl de cDNA y agua desionizada hasta completar los 25 µl. El perfil de temperatura para esta PCR constó de una desnaturalización inicial a 94 °C por 3 minutos, y para cada ciclo una desnaturalización a 94 °C por 38 segundos, alineamiento por 45 segundos a 51 °C, extensión por 60 segundos a 72 °C, con una repetición de 39 ciclos. Esta PCR amplificó un fragmento de 348 pares de bases. Los cebadores utilizados fueron: Forward CCAYCAGTTYATHAAGGCTCC, reverse TACCAVCGCTGRACRTC, Forward nested CTCCTGGCRTYACWACTGC y reverse nested GGRTGRTTCCAIARVACYTC, siendo los mismos que reportó Fogeda et al., 2009 20.
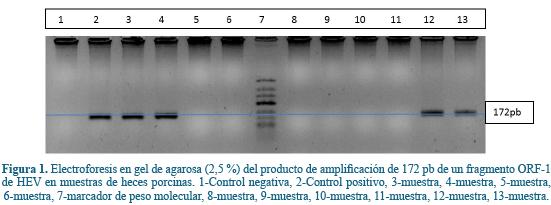
La detección del genoma viral se realizó a partir del producto de PCR obtenido de la primera ronda, usando una amplificación anidada con cebadores degenerados 20. Esta PCR anidada se realizó utilizando 3 µl de producto de la PCR 1 y los cebadores FN (Forward Nested) y RN (Reverse Nested), además de un volumen igual al de la PCR1 para el resto de los reactivos. El perfil de temperatura para la segunda ronda de la PCR anidada fue: desnaturalización inicial a 95 °C por 3 minutos y para cada ciclo una desnaturalización a 94 °C por 35 segundos, alineamiento por 48 segundos a 48 °C, extensión por 60 segundos a 72 °C, repitiéndose este ciclo por 35 veces. Estos cebadores amplifican fragmentos presentes en el ORF1 del genoma viral para obtener un producto final de amplificación de 172 pares de bases. Los fragmentos amplificados fueron verificados en gel de agarosa al 2.5% (70V por 40 min) usando EZ-Vision como agente intercalante. Siempre para los ensayos se utilizó un control positivo (muestras amplificadas previamente) y un control negativo (sin cDNA).
Análisis estadístico
Toda la información se recolectó en una base de datos de Excel y los análisis estadísticos de comparación de medias se desarrollaron usando la prueba t con P<0.05 usando el programa R versión 2.15.2
Resultados
Prueba de ELISA indirecta para anticuerpos IgG e IgM anti-HEV utilizando anticuerpo secundario anti-cerdo
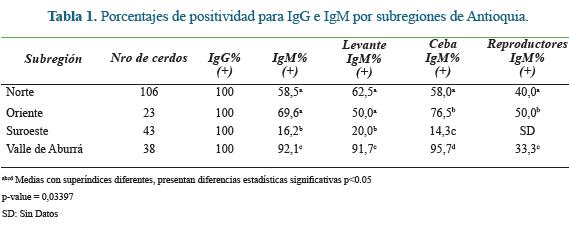
Se realizaron ensayos para la detección de anticuerpos específicos anti-HEV en muestras de suero porcino, usando los anticuerpos secundarios IgG e IgM anti-cerdo (Thermo Scientific). Además, se comprobaron los controles de calidad del kit, teniendo en cada uno de los ensayos los controles negativos (C-) y positivos (C+), el calibrador (Cal) y el conjugado propios del estuche comercial. Al evaluar el anticuerpo secundario porcino frente a sueros de otras especies (Bovino, Equino y Humano), se pudo observar que no se presentó reacción alguna en estas muestras (datos no mostrados). Utilizando los puntos de corte establecidos, se obtuvo que el 100% de muestras de suero porcino eran positivas para anticuerpos IgG contra HEV (Tabla 1). Para el caso de anticuerpos IgM se presentó una positividad del 57% en los sueros evaluados, hallándose fluctuaciones de positividad entre 16,2% y 92% en los cerdos de las granjas (Tabla 1).
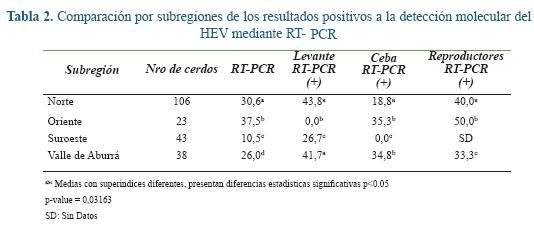
Detección molecular del HEV en heces. El 26% de las muestras de heces porcinas evaluadas fueron positivas para un fragmento del ORF-1 (Figura 1).
El número de animales es diferente en cada una de las subregiones, esto reflejan el comportamiento en los volúmenes de producción de cerdos (mayores en el Norte y menores en el Oriente, en las subregiones evaluadas).
Al igual que se muestra previamente para la seropositividad, los resultados de detección molecular se distribuyeron por subregiones de Antioquia en los municipios donde se realizó el muestreo (Tabla 2).
Comparación de las técnicas utilizadas
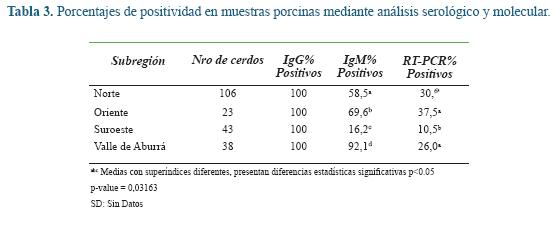
En la tabla 3 se pueden apreciar los porcentajes de positividad obtenidos de la evaluación de IgG, IgM y RT-nPCR en sueros y heces de cerdos evaluados. Estos resultados no muestran una concordancia entre la técnica de ELISA y la detección molecular de HEV.
Discusión
En esta investigación se pudo determinar la presencia de anticuerpos IgG e IgM y del genoma de HEV en cerdos de Antioquia. Los resultados obtenidos en este estudio, demuestran que los porcinos evaluados han estado en exposición previa en alguna etapa de su vida o excretan material genético de HEV al momento de la detección.
Prueba de ELISA indirecta para anticuerpos IgG e IgM anti-HEV utilizando anticuerpo secundario anti-cerdo
El kit comercial para ELISA utilizado en esta investigación, es utilizado generalmente para detección de anticuerpos anti-HEV en humanos, pero se ha determinado que independiente de la especie en que se utilice, se puede reemplazar el anticuerpo secundario propio del kit por alguno que reconozca anticuerpos específicos contra HEV en otra especie animal 31, 32, 37.
Diferentes investigaciones han detectado anticuerpos IgG e IgM anti-HEV y RNA de este virus en cerdos y otras especies animales 1, 26, 31; sin embargo, en ellos no se presenta ningún tipo de sintomatología ni algún signo conocido producido por HEV, como si sucede en humanos 27.
En Alemania se halló un porcentaje de positividad de 46,9% para anticuerpos IgG anti-HEV en 1.036 cerdos evaluados en granjas porcinas 29, este porcentaje representa un valor menor al hallado en el presente estudio, lo cual puede sugerir que los sistemas de producción y las metodologías de manejo de los cerdos podrían jugar un papel importante en la presentación del HEV, teniendo en cuenta que en Europa las producciones porcícolas son a gran escala y con mayores estándares tecnológicos, mientras que en Colombia se presenta mayor producción de pequeños y medianos productores, aspecto que es necesario investigar a profundidad en las condiciones colombianas.
En el caso de anticuerpos IgM se observa una tendencia a presentarse mayores porcentajes de positividad entre las etapas de Levante y Ceba al compararlas con los Reproductores, medida que ha sido descrita por otros investigadores 4, 25. Sin embargo, sería recomendable evaluar una mayor cantidad de granjas o de animales, con el fin de establecer claramente estas diferencias entre etapas de crecimiento con respectos a los anticuerpos IgM anti-HEV.
Aunado a esto, se puede observar como en la subregión del Suroeste se presentaron los menores porcentajes a IgM en todas las etapas productivas de cerdos, aspecto que lleva a pensar en las diferencias en los sistemas productivos y de manejo que se pueden presentar en las porcícolas entre las subregiones de Antioquia. Además, es necesario tener en cuenta que las granjas evaluadas en esta subregión se ubican más alejadas que las granjas de las demás subregiones como conjunto, lo que hace pensar que la procedencia de los porcinos también podría jugar un papel importante en la seropositividad a HEV 29, aspecto que es indispensable investigar a profundidad.
En Latinoamérica se han detectado anticuerpos anti-HEV en porcinos de diferentes países como Argentina 31, Bolivia 14, Brasil 15 y Chile 24, entre otros. De manera similar, se han realizado estudios en Brasil con otras especies animales encontrando anticuerpos IgG anti-HEV en bovinos, perros, pollos, y roedores salvajes, con tasas de prevalencia que van desde 1,4 a 50%. Esta información demuestra que HEV se encuentra distribuido en diferentes países de Latinoamérica, donde el virus no se consideraba endémico, por tanto, no es de sorprender los resultados obtenidos en el presente estudio.
Varios estudios han mostrado que a la edad de beneficio (entre 20-25 semanas) los porcentajes de positividad para anticuerpos anti-HEV en cerdos pueden oscilar entre el 20 y el 100% 13, 16, 17. En una granja convencional existe una elevada proporción de animales adultos seropositivos y los lechones en lactancia tienen anticuerpos IgG anti-HEV adquiridos de forma pasiva 13. La durabilidad de estos anticuerpos en los animales varía según la cantidad de anticuerpos maternales transferidos 30, de tal manera que los lechones se pueden infectar alrededor de las semanas 13 y 14 de vida, momento en que declinan los anticuerpos maternos.
En este periodo, aparecen primero los anticuerpos IgM anti-HEV y una semana después aparecen los IgG anti-HEV. Los anticuerpos IgM pueden detectarse durante un periodo de entre 5 y 7 semanas, mientras que los anticuerpos IgG duran hasta la edad del sacrificio 13, 30. La actividad de los anticuerpos (valores de DO450) es similar a los porcentajes de animales positivos, y las DO450 para IgM son significativamente más altas en los animales que presentan viremia 13, lo que significa que este tipo de anticuerpo es indicativo de la fase aguda de la infección.
Los altos títulos de anticuerpos transferidos al lechón 13 y una baja presión de infección 35, en las primeras semanas de vida, reducen la probabilidad de infección temprana y consecuentemente podrían prolongar el periodo entre exposición e infección 8, elevando así, la edad de infección. Una vez infectados, las altas tasas de trasmisión de HEV entre cerdos aumentan el porcentaje de cerdos infectados, lo que podría explicar los altos porcentajes de cerdos positivos IgM en la edad de sacrificio 9.
Detección molecular de HEV en heces. En esta investigación se pudo determinar que de las 210 muestras de heces de cerdo evaluadas, el 26% fueron positivas para el fragmento del ORF-1 de HEV. Los resultados obtenidos en esta investigación son más altos que los encontrados por Berto et al., 5, donde se determinó una positividad para HEV en heces de cerdos del 4,3% y 3,5% en España y República Checa respectivamente. No obstante, estos investigadores concluyen que el HEV es endémico para sus producciones porcícolas, debido a que se realizó la evaluación en animales de diferentes etapas de producción (desde lechones hasta ceba). En Portugal, este mismo grupo de investigadores detectaron RNA de HEV en heces de cerdo variando desde 10 a 30% 6. Por su parte, en Brasil, se detectó RNA de HEV en el 62,5% de las granjas porcícolas y el 15,3% de las muestras de heces porcinas evaluadas 23. En Argentina se detectó el genoma de HEV en cerdos de granjas comerciales en cinco provincias 31, con una frecuencia de positividad que osciló entre el 4 y el 98%. Lo anterior, demuestra que los presentes datos en las porcícolas Antioqueñas no difieren en gran medida de estos hallazgos.
La presencia de RNA de HEV en las heces de animales salvajes y domésticos (incluyendo a los porcinos), se considera la fuente principal para la transmisión zoonótica del virus 19, en el caso de los porcinos, debido al contacto directo con otros cerdos, otras especies animales y humanos; además de la posible contaminación de fuentes de agua y la diseminación en los potreros aledaños al realizar riego y fertilización con estos residuos, aspectos que deben ser estudiados a profundidad.
En humanos se conoce que el RNA de HEV no persiste por mucho tiempo circulando en sangre, llegando a ser indetectable cerca de tres semanas después de la aparición de los síntomas. El virus se elimina en las heces de una a dos semanas más 11, situación que difiere en los porcinos, donde la sintomatología por HEV es desconocida, siendo necesario realizar la detección serológica o molecular para su determinación.
Comparación de técnicas utilizadas
En la tabla 3 se resumen los resultados obtenidos en las pruebas realizadas. Algunos animales en estudio fueron positivos para IgG más no lo fueron para IgM, sugiriendo esto, que los cerdos estuvieron expuestos al virus en alguna etapa de su vida, o que los cerdos más jóvenes pudieron haber recibido anticuerpos IgG anti-HEV en el calostro ofrecido por su madre durante los primeros días de vida. Independientemente de esto, se demuestra que en los animales que se observó esta situación, no se presentó una exposición reciente. A pesar de que se obtuvieron muestras de cerdos positivas para IgM, (sugiere una exposición reciente al virus), algunas de estas fueron negativas a la detección molecular del virus, situación por la cual, se sospecha que las muestras se tomaron en el lapso de tiempo posterior a la excreción del virus en heces. Es necesario tener en cuenta que se puede presentar la excreción de HEV en heces alrededor de dos semanas antes de que se puedan detectar anticuerpos IgM 33. Una situación similar se pudo haber presentado en cerdos que fueron positivos en la detección molecular, pero negativos para anticuerpos IgG e IgM contra HEV. De igual forma, se determinó que no necesariamente había una concordancia entre los resultados serológicos y los moleculares 36, lo que queda demostrado en este estudio, donde 3 de 7 muestras que fueron negativas para la detección molecular en heces, fueron positivas por ELISA IgM anti-HEV.
Al hacer este tipo de comparaciones con HEV en humanos, se ha reportado la detección de IgM anti-HEV en muestras no detectables por PCR, así como la detección de viremia en ausencia de respuesta IgM en pacientes con hepatitis E aguda, sugiriendo que no solo pueden existir problemas de especificidad, sino además de sensibilidad en el diagnóstico de la infección aguda por HEV 28.
Al analizar los resultados por subregiones del departamento, se puede observar como en el Suroeste se presentaron los menores porcentajes tanto para IgM como para la detección molecular al HEV. Teniendo en cuenta que se estableció que con al menos un cerdo positivo para cualquiera de las pruebas realizadas, la granja se daba como positiva, se pudo determinar que el 25% de las granjas de esta subregión fueron negativas a anticuerpos IgM, evidenciando granjas libres de IgM anti-HEV en Antioquia; además en esta subregión se presentó el porcentaje más bajo en la detección molecular del virus. Para el caso de Oriente se observó que a pesar que presentó los porcentajes más altos de IgM, se estableció que también había una granja libre de IgM, demostrando que aunque las granjas se ubiquen en la misma subregión se presentan grandes diferencias con respecto a la positividad para HEV.
En el Norte se encuentra la mayor cantidad de granjas porcícolas del departamento, teniendo gran cantidad de sistemas de producción tecnificados. No obstante, los resultados muestran porcentajes de positividad para HEV que no son extremos y se mantienen en el promedio, situación similar en el Valle de Aburrá pero que puede tener influencia por los mismos aspecto productivos como lo demuestra Casas et al., 2011.
Conclusiones
Esta investigación pudo determinar la circulación de anticuerpos tanto IgG como IgM anti-HEV en cerdos de diferentes etapas productivas en granjas porcícolas de Antioquia. La determinación del material genético de HEV en heces porcinas demuestra que este virus circula en las granjas evaluadas. Es necesario profundizar y realizar estudios de HEV en Antioquia y Colombia, que conlleven a establecer su dinámica de transmisión en cerdos y humanos, y de esta manera establecer medidas preventivas, de control y erradicación de HEV en el país.
Referencias
1. Aggarwal R, Kamili S, Spelbring J, Krawczynski K. Experimental studies on subclinical hepatitis E virus infection in cynomolgus macaques. J Infect Dis.2001; 184:1380-1385. [ Links ]
2. Ahmad I, Holla RP, Jameel S. Molecular virology of hepatitis E virus. Virus Research. 2011; 161: 47-58. [ Links ]
3. Arends J, Ghisetti V, Irving W, Dalton H, Izopet J, Hoepelman A, Salmon D. Hepatitis E: An emerging infection in high income countries. J Clin Virol, 2014; 59(2):81-8. [ Links ]
4. Baechlein C, Schielke A, Johne R, Ulrich RG, Baumgaertner W, Grummer B. Prevalence of Hepatitis E virus-specific antibodies in sera of German domestic pigs estimated by using different assays. Vet Microbiol. 2010; 144: 187-91. [ Links ]
5. Berto A, Baker J, Mesquita J, Nascimento M, Banks M, Martelli F, Ostanello F, Angeloni G, Ruggeri F, Bartolo I, Vasickova P, Valcarce M, Hernandez M, Rodriguez-Lazaro D, van der Poel W. Prevalence and transmission of hepatitis E virus in domestic swine populations in different European countries. BMC Research Notes 2012a, 5:190. [ Links ]
6. Berto A, Mesquita J, Hakze-van der Honing R, Nascimento M and van der Poel w. Detection and Characterization of Hepatitis E Virus in Domestic Pigs of Different Ages in Portugal. Zoonoses and Public Health, 2012b, 59, 477-481. [ Links ]
7. Betancur C, Mejía M, Portillo S. Seroprevalencia de hepatitis E en trabajadores de fincas porcícolas del Valle de Aburrá 2011-2012. Acta Médica Colombiana. 2013; 38:68-70. [ Links ]
8. Bouwknegt M, Teunis PF, Frankena K, de Jong MC, de Roda Husman AM. Estimation of the likelihood of fecal-oral HEV transmission among pigs. Risk Anal. 2011 Jun; 31(6):940-50. [ Links ]
9. Casas M, Cortés R, Pina S, Peralta B, Allepuz A, Cortey M, Casal J, Martín M. Longitudinal study of hepatitis E virus infection in Spanish farrow-to-finish swine herds. Vet Microbiol. 2011 Feb 24; 148(1):27-34 [ Links ]
10. Coll T, Morrillo A. Extracción de sangre en cerdas, cerdos de cebo y lechones en maternidad. 2008. SUIS Nº 19 - 55 [ Links ]
11. Chauhan A, Jameel S, Dilawari JB, Chawla YK, Kaur U, Ganguly NK. Hepatitis E virus transmission to a volunteer. Lancet 1993; 341: 149-50. [ Links ]
12. DANE y Asoporcicultores 2013, separata revista SEMANA, Marzo de 2014 [ Links ]
13. De Deus N. Casas M. Peralta B. Nofrarías M. Pina S. Martín M. Segalés J. Hepatitis E virus infection dynamics and organic distribution in naturally infected pigs in a farrow-to-finish farm.Vet Microbiol. 2008 Nov 25;132(1-2):19-28 [ Links ]
14. Dell'Amico, M.C., Cavallo, A., Gonzales, J.L., Bonelli, S.I., Valda, Y., Pieri, A., Segund, H., Ibañez, R., Mantella, A., Bartalesi, F., Tolari, F., Bartolini, A., 2011. Hepatitis E Virus Genotype 3 in Humans and Swine, Bolivia. Emerg. Infect. Dis. 17, 1488-1490. [ Links ]
15. De Souza AJ. Gomes-Gouvêa MS. Soares Mdo C. Pinho JR. Malheiros AP. Carneiro LA. dos Santos DR. Pereira WL.HEV infection in swine from Eastern Brazilian Amazon: evidence of co-infection by different subtypes.Comp Immunol Microbiol Infect Dis. 2012 Sep;35(5):477-85. [ Links ]
16. Di Bartolo I. Ponterio E. Castellini L. Ostanello F. Ruggeri FM.Viral and antibody HEV prevalence in swine at slaughterhouse in Italy.Vet Microbiol. 2011 May 5; 149(3-4):330-338. [ Links ]
17. Dos Santos DR, Vitral CL, de Paula VS, Marchevsky RS, Lopes JF, Gaspar AM, Saddi TM, Júnior NC, Guimarães Fde R, Júnior JG, Ximenes LL, Souto FJ, Pinto MA. Serological and molecular evidence of hepatitis E virus in swine in Brazil. Vet J. 2009 Dec;182 (3):474-80 [ Links ]
18. Emerson SU, Purcell RH. Hepatitis E virus. Rev Med Virol. 2003; 13: 145-54. [ Links ]
19. Echaverría JM. González JE. Lewis-Ximenez LL. Dos Santos DR. Munné MS. Pinto MA. Pujol FH. Rodríguez-Lay LA.Hepatitis E virus infection in Latin America: a review. J Med Virol. 2013 Jun;85 (6):1037-45 [ Links ]
20. Fogeda M, Avello A, Cilla CG, Echevarría JM. Imported and Autochthonous Hepatitis E Virus Strains in Spain. Journal of Medical Virology. 2009; 81:1743-1749. [ Links ]
21. Forgách, P., Nowontny, N., Erdélyi, K., Boncz, A., Zentai, J., Szucs, G., Reuter, G., Bakonyi, T., 2010. Detection of Hepatitis E virus in samples of animal origin collected in Hungary. Veterinary Microbiology. 143, 106-116. [ Links ]
22. Galiana C, Fernández-Barredo S, Pérez-Gracia M. Prevalencia del virus de la hepatitis E (HEV) y factores de riesgo en trabajadores de explotaciones porcinas y donantes voluntarios. Enferm InfeccMicrobiolClin.2010; 28(9):602-607. [ Links ]
23. Gardinali NR, Barry AF, Silva PFN, Valente CS, Alfieri AF, Alfieri AA. 2012a. Molecular detection and characterization of hepatitis E virus in naturally infected pigs from Brazilian herds. Res Vet Sci 93:1515-1519. [ Links ]
24. Ibarra H, Riedemann S, Reinhardt G, Frieck P, Siegel F, Toledo C, et al. Prevalence of hepatitis E virus antibodies in blood donors and other population groups in southern Chile. Rev Med Chil. 1997 Mar; 125(3):275-8. [ Links ]
25. Jiménez de Oya N, de Blas I, Blázquez A, Martín-Acebes M, Halaihel N, Gironés O, Saiz J and Escribano-Romero E. Widespread distribution of hepatitis E virus in Spanish pig herds. BMC Research Notes 2011, 4:412. [ Links ]
26. Kabrane-Lazizi Y, Fine JB, Elm J, Glass GE, Higa H, Diwan A, Gibbs CJ Jr, Meng XJ, Emerson SU, Purcell RH. Evidence for widespread infection of wild rats with hepatitis E virus in the United States. Am J Trop Med Hyg. 1999;61:331-335 [ Links ]
27. Kasorndorkbua C, Thacker BJ, Halbur PG, Guenette DK, Buitenwef RM, Royer RL, Meng XJ. Experimental infection of pregnant gilts with swine hepatitis E virus. Can J Vet Res.2003; 67:303-306. [ Links ]
28. Khudyakov Y, Kamili S. Serological diagnostics of hepatitis E virus infection. Virus Res 2011; 161:84-92. [ Links ]
29. Krumbholz A, Joel S, Neubert A, Dremsek P, Dürrwald R, Johne R, Hlinak A, Walther M, Lange J, Wutzler P, Sauerbrei A, Ulrich RG, Zell R. Age-related and regional differences in the prevalence of hepatitis E virus-specific antibodies in pigs in Germany. Vet Microbiol. 2013 Dec 27; 167 (3-4):394-402. [ Links ]
30. Meng XJ. Purcell RH. Halbur PG. Lehman JR. Webb DM. Tsareva TS. Haynes JS. Thacker BJ. Emerson SU.A novel virus in swine is closely related to the human hepatitis E virus.Proc Natl Acad Sci U S A. 1997 Sep 2; 94(18):9860-5. [ Links ]
31. Munné MS, Vladimirsky S, Otegui L, Castro R, Brajterman L, Soto S et al. Identification of the first strain of swine hepatitis E virus in South America and prevalence of anti-HEV antibodies in swine in Argentina. J Med Virol 2006; 78: 1579-83. [ Links ]
32. Obriadina A, Meng J, Ulanova T, Trinta K, Burkov A, Fields H, Khudyakov Y. A new enzyme immunoassay for the detection of antibody to hepatitis E virus. J Gastroenterol Hepatol. 2002 Dec; 17 Suppl 3:S360-4. [ Links ]
33. Pavio N, Meng XJ, Renou C. Zoonotic hepatitis E: animal reservoirs and emerging risks. Vet. Res. (2010) 41:46. [ Links ]
34. Rendón JC, Navas MC, Hoyos MC, Cortés FM, Correa G, Sepúlveda ME, et al. Evidencia serológica y molecular de la circulación del virus de la Hepatitis E en Medellín. Infectio. 2010; 14:34. [ Links ]
35. Satou K, Nishiura H. Transmission dynamics of hepatitis E among swine: potential impact upon human infection. BMC Vet Res. 2007 May 10; 3:9. [ Links ]
36. Seo DJ, Tahk H, Lee KB, Lee MH, Son NR, Seo S, Cheon DS, Lee BH, Choi C. Detecting hepatitis E virus with a reverse transcription polymerase chain reaction enzyme-linked immunosorbent assay. Food Environ Virol. 2012 Mar; 4(1):14-20. [ Links ]
37. Yoo D, Willson P, Pei P, Hayes M, Deckert A, Dewey C, Friendship R, Yoon Y, Gottschalk M, Yason C, Giulivi A. Prevalence of Hepatitis E Virus Antibodies in Canadian Swine Herds and Identification of a Novel Variant of Swine Hepatitis E Virus. Clin. Diagn. Lab. Immunol. 2001, 8(6):1213 [ Links ]
38. Zwettler D, Fink M, Revilla-Fernändez S, Steinrigl A, Winter P, Köfer J. First detection of hepatitis E virus in Austrian pigs by RT-qPCR. Berl Munch Tierarztl Wochenschr. 2012. 125 (7-8):281-9. [ Links ]