Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina Veterinaria y Zootecnia
On-line version ISSN 1900-9607
Ces. Med. Vet. Zootec. vol.9 no.2 Medellín July/Dec. 2014
Toxicity of trichlorfon exposure using an experimentally induced model with Silver Pacu (Piaractus brachypomus)¤
Efectos toxicológicos generados por la exposición a triclorfón en un modelo inducido experimentalmente en cachama blanca (Piaractus brachypomus)
Efeitos toxicológicos no peixe Pirapitinga (Piaractus brachypomus) gerado pela exposição a triclorfon em um modelo induzido experimentalmente
Gira Alejandra Marín Méndez1*, MVZ; Roberto Andrés Chacón Novoa1, MVZ; Ángel Enrique Céspedes Rubio1, MVZ, MSc, PhD; Iang Schroniltgen Rondón Barragán1, MVZ, MSc.
¤Para citar este artículo: Marín Méndez GA, Chacón Novoa RA, Céspedes Rubio AE, Rondón Barragán IS. Efectos toxicológicos generados por la exposición a triclorfón en un modelo inducido experimentalmente en cachama blanca (Piaractus brachypomus). Rev CES Med Zootec. 2014; Vol 9(2): 190-202.
*Autor para correspondencia: Gira Alejandra Marín Méndez. Facultad de Medicina Veterinaria y Zootecnia, Universidad del Tolima. Laboratorios de toxicología, diagnóstico veterinario y patología, Barrio Santa Helena parte alta, Ibagué, Colombia. *Email: marinmendezgira@gmail.com
1 Grupo de Enfermedades Neurodegenerativas - END, línea Inmunotoxicología, Departamento de Sanidad Animal, Facultad de Medicina Veterinaria y Zootecnia, Universidad del Tolima. Laboratorios de toxicología, diagnóstico veterinario y patología, Barrio Santa Helena parte alta, Ibagué, Colombia.
* Email: marinmendezgira@gmail.com
(Recibido: 4 de octubre, 2014; aceptado: 28 de noviembre, 2014)
Abstract
The trichlorfon (TCF) is an organophosphate insecticide widely used in agricultural systems and livestock production. However, its indiscriminate use has generated serious problems affecting organisms in aquatic ecosystems that are not direct targets of the chemical. Therefore, the aim of this study was to assess acute toxicity (LC50) and chronic subletal of TCF in cachama blanca fingerlings (Piaractus brachypomus). Acute toxicity was evaluated at 96 hours, using four concentrations of TCF (0.01, 0.1, 0.25, 0.5 mg/L) and a control group, each group consisted of 8 animals (2.5 ± 0.5 g). The LC50 value calculated using the Trimmed Spearman-Karber software was 0.18 mg/L (p<0,05). The evaluation of the effect of chronic exposure to sublethal TCF on the immune response of P. brachypomus was performed by testing respiratory burst, showing significant increase in animals exposed to 0.029 mg / L during the first 10 days of exposure compared to control. Likewise, the plasma bactericidal capacity was evaluated in TCF exposed fish using Aeromonas hydrophila, finding greater of colony forming units on day 20 and 30 of exposure to the concentration 0.018 mg/L as opposed to the control. In addition, a histopathological study was performed, finding gill lesions compatible with epithelial cell hypertrophy and lamellar detachment in fish exposed to 0,05 mg/L on day 30 of exposure. This work showed the cachama blanca as a biomarker in contaminations associated with these xenobiotics.
Key words: Fish, organophosphate, pesticide, toxicity, trichlorfon.
Resumen
El Triclorfón (TCF) es un insecticida organofosforado ampliamente utilizado en sistemas de producción agrícola y pecuario; sin embargo, su uso indiscriminado ha generado serios problemas en ecosistemas acuáticos afectando organismos que no son blanco directo del compuesto químico. Por este motivo, el presente estudio tuvo como objetivos evaluar la toxicidad aguda (CL50) y crónica subletal del TCF en alevinos de cachama blanca (Piaractus brachypomus). La toxicidad aguda se evaluó a 96 horas, empleando cuatro concentraciones de TCF (0,01, 0,1, 0,25, 0,5 mg/L) y un grupo control, cada grupo consto de 8 animales (2,5 ± 0,5 g). El valor de CL50 calculado mediante el software Trimmed Spearman-Karber fue 0,18 mg/L (p<0,05). La evaluación del efecto de la exposición crónica subletal a TCF sobre la respuesta inmune de P. brachypomus se realizó mediante el ensayo de explosión respiratoria, evidenciándose aumento significativo en animales sometidos a 0,029 mg/L durante los primeros 10 días de exposición en comparación con el control. Asimismo, se evalúo la capacidad bactericida del plasma de los peces expuestos a TCF frente Aeromonas hydrophila, presentándose mayor conteo de unidades formadoras de colonia para el día 20 y 30 de exposición a la concentración de 0,018 mg/L a diferencia del control. Aunado a esto, se realizó estudio histopatológico, hallándose lesiones branquiales compatibles con hipertrofia de células epiteliales y desprendimiento lamelar en los peces expuestos a 0,05 mg/L para el día 30 de exposición. Este trabajo demuestra que la cachama blanca se constituye en un bioindicador de contaminación asociado a estos xenobióticos.
Palabras clave: Organofosforado, peces, pesticida, toxicidad, triclorfón.
Resumo
O triclorfom (TCF) é um inseticida organofosforado amplamente utilizado em sistemas de produção agrícola e pecuária; no entanto, seu uso indiscriminado tem levado a sérios problemas que afetam os organismos nos ecossistemas aquáticos que não são alvos diretos da substância química. Portanto, o presente estudo teve como objetivo avaliar a toxicidade aguda (CL50) e crônica subletal de TCF em alevinos de cachama blanca (Piaractus brachypomus). A toxicidade aguda foi avaliada em 96 horas, usando quatro concentrações de TCF, com um grupo control, cada grupo com 8 animais (2,5 ± 0,5 g). O valor de CL50 calculado com o software de Spearman-Karber foi de 0,18 mg/L (p<0,05). A avaliação do efeito da exposição crônica a concentrações subletais de TCF na resposta imune de P. brachypomus foi realizada pelo teste de explosão respiratória, mostrando um aumento significativo nesta, em animais expostos a 0,029 mg/L, durante os primeiros 10 dias de exposição. Também, a capacidade bactericida do plasma dos peixes expostos a TCF foi avaliada frente a Aeromonas hydrophila, os quais apresentaraõ maior unidades formadoras de colônias no dia 20 e 30 de exposição a concentração de 0,018 mg/L, ao contrario do controle. Alem disso, um estudo histopatológico foi realizado, emcontrando lesões de brânquia compatíveis com hipertrofia e desprendimento de células epiteliais nas lamelas de peixes expostos a 0,05 mg/L no dia 30 de exposição. este trabalho mostra ao cachama blanca como um biomarcador de contaminação asociado com estes xenobióticos.
Palavras-chave: Organofosforado, peixe, pesticida, toxicidade, triclorfom.
Introducción
Los sistemas de producción agrícola y pecuario emplean de manera rutinaria compuestos químicos en diferentes procesos productivos, incluyendo control de plagas, maduración de frutos, eliminación de malezas, control de vectores, entre otros8. La mayoría de xenobióticos finalmente terminan acumulándose en ecosistemas acuáticos por medio de diferentes procesos de escorrentía y lixiviación40, afectando así organismos no blancos de su acción41.
Dentro del grupo de los pesticidas sintéticos más empleados se destacan los organofosforados31, siendo el Triclorfón (TCF) uno de los organofosforados (OPs) más utilizados en agricultura para el control de plagas en los diferentes cultivos y como ectoparasiticida en ganadería10 y acuicultura22. Recientemente, el TCF ha sido empleado en medicina humana para el tratamiento de esquistosomiasis17 y fue usado como alternativa terapéutica en enfermedades de tipo neurodegenerativo como el Alzhéimer15, 17.
El TCF conocido comercialmente como Neguvon, Clorofos, Dipteres o Metrifonato, es un potente inhibidor de la actividad Acetilcolinesterasa (AChE), e induce la producción de radicales libres y daños del sistema antioxidante46, generando así estrés oxidativo y peroxidación lipídica42. Algunos autores han descrito que el TCF también puede inhibir la esterasa blanco de neuropatía (NET), produciendo así el síndrome de neurotoxicidad retardada35. Asimismo, se ha descrito que el uso inadecuado e indiscriminado de esta sustancia genera intoxicaciones agudas caracterizadas por síndrome colinérgico y hemólisis1, 25.
De la misma manera, se ha propuesto que la exposición a este xenobiótico puede generar efectos teratogénicos y mutagénicos en diferentes modelos animales incluyendo al hombre37, 39. Adicionalmente, se han reportado alteraciones en la respuesta inmune en animales domésticos sometidos a la exposición aguda y crónica de forma experimental12.
Así, el presente trabajo tuvo como fin evaluar la toxicidad aguda a 96 horas del TCF en cachama blanca y determinar el efecto de la exposición crónica subletal de este OP sobre la respuesta inmune innata (explosión respiratoria y actividad bactericida del plasma) de esta especie nativa durante un período de 30 días; así como evaluar las alteraciones histopatológicas pos-exposición.
Materiales y métodos
El presente estudio se desarrolló en dos fases experimentales: exposición aguda y exposición crónica subletal a TCF en alevinos de cachama blanca.
Exposición aguda a TCF
El objetivo durante esta primera fase experimental fue la determinación de la Concentración Letal 50 (CL50) de TCF a 96 horas en alevinos de cachama blanca.
Animales. Se utilizaron alevinos de cachama blanca (Piaractus brachypomus) (n=40) de 4,5 ± 0,5 g, clínicamente sanos, obtenidos de la estación piscícola El Carmen, criados en estanques en tierra y provenientes de un mismo desove.
Condiciones experimentales. El trabajo fue realizado en el Laboratorio de Toxicología y el Laboratorio de Diagnóstico Veterinario, adscritos a la Facultad de Medicina Veterinaria y Zootecnia de la Universidad del Tolima, ubicada en la cuidad de Ibagué (Tolima-Colombia) a una altitud de 1.248 m.s.n.m., con una temperatura promedio de 28 °C.
Los experimentos fueron realizados de acuerdo a los lineamientos descritos por la OECD28 y contaron con la aprobación del Comité de Bioética adscrito a la oficina de Investigaciones y desarrollo científico de la Universidad del Tolima (Acta N0 23-150 del proyecto N0 370111). Inicialmente los animales fueron sometidos a un baño con cloruro de sodio (NaCl) al 0,3% con el fin de eliminar ectoparásitos11 y posteriormente, fueron distribuidos en acuarios de vidrio con una capacidad de 40 L, manejando una densidad ≤1 g/L. Se empleó agua madurada con una temperatura de 28 ± 0,5 °C y un pH de 7,1 ± 0,2, realizando diariamente el monitoreo de dichas variables. Durante el experimento se manejó un sistema semi-estático (recambio diario del 25% del volumen de agua y la sustancia experimental) con calefacción y aireación constante sin filtro. Diariamente durante el período de aclimatación correspondiente a 15 días, los animales fueron alimentados con concentrado comercial (32% de proteína) a una ración correspondiente al 2% de la biomasa total de cada acuario. La alimentación fue suspendida 24 horas antes del inicio del experimento así como durante las 96 horas experimentales.
Sustancia experimental. Se empleó triclorfón en polvo con un 97% de pureza. Dada su característica hidrosoluble se creó una solución stock (9,7 mg/L) utilizando agua destilada, dicha solución fue adicionada a cada unidad experimental de acuerdo a las concentraciones manejadas en cada tratamiento.
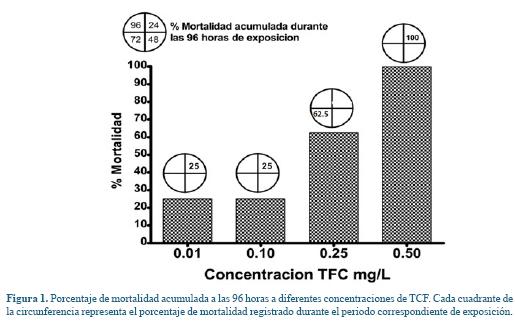
Concentración Letal 50 (CL50) a 96 horas. Inicialmente se realizaron ensayos preliminares de toxicidad aguda del TCF para determinar las concentraciones a evaluar en la CL50. En el primer ensayo se evaluaron concentraciones de: 7,5, 15, 22,5 y 30 mg/L de TCF de acuerdo a los valores reportados en otras especies de peces como Danio rerio6 y Cyprinus carpio3 puesto que no se contaban con estudios de este OP en cachama blanca. A las 3 horas pos exposición se presentó una mortalidad del 100%, por lo cual, se planteó un segundo ensayo con concentraciones de: 0,75, 1,5, 3 y 6 mg/L en base a lo reportado para bagre de canal (Ictalurus punctatus), trucha arcoíris (Oncorhynchus mykiss) y trucha de arroyo (Salvelinus fontinalis)3, registrándose una mortalidad del 100% siete horas después de la exposición. Finalmente, para la CL50 se evaluaron cuatro concentraciones correspondientes a: 0,01, 0,1, 0,25 y 0,5 mg/L de TCF y un grupo control que no contenía la sustancia experimental, cada tratamiento consto de 8 animales. La mortalidad de los alevinos fue registrada a las 24, 48, 72 y 96 horas de exposición.
Análisis estadístico. Para la determinación de la CL50 se utilizó el programa Trimmed Spearman Karber (TSK) versión 4.1, analizando la mortalidad acumulada a las 96 horas, basado en el algoritmo descrito por Hamilton16 con un nivel de confianza de p<0,05. La gráfica de mortalidad acumulada se realizó mediante el software SPSS Statistics versión 20 para Windows (IBM, USA).
Exposición crónica subletal a TCF
Durante esta segunda fase se determinó el efecto de la exposición crónica subletal a TCF sobre algunos parámetros de respuesta inmune en alevinos de cachama blanca a través del ensayo de explosión respiratoria y capacidad bactericida del plasma, adicionalmente se realizó evaluación histopatológica. Las condiciones experimentales fueron similares a las descritas anteriormente en el ensayo toxicidad aguda.
Animales. Alevinos de cachama blanca (n=120), provenientes de un mismo desove, clínicamente sanos, de un peso promedio de 8 ± 0,5 g, previamente aclimatados.
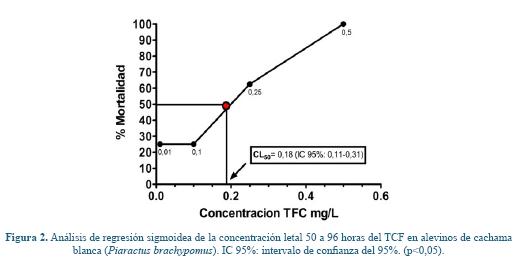
Diseño experimental. Con base en los resultados obtenidos previamente de toxicidad aguda se empleó la décima parte del valor de CL50 del TCF en cachama blanca a 96 horas (0,18 mg/L) para estimar las concentraciones subletales a utilizar en cada tratamiento, correspondientes a: 0,018 mg/L (T1), 0,029 mg/L (T2), 0,041 mg/L (T3), 0,050 mg/L de TCF (T4) y un grupo control. Se emplearon 20 animales por tratamiento. La exposición al OP tuvo una duración de 30 días y se realizaron tres muestreos a los días 10, 20 y 30; durante esta fase, los peces fueron alimentados dos veces al día29. En cada muestreo, se tomaron al azar cinco peces de cada tratamiento para la obtención de muestras de sangre mediante venopunción de la vena caudal27, con el fin de evaluar explosión respiratoria y actividad bactericida del plasma y posteriormente se realizó necropsia de los peces y toma de tejido para estudio histopatológico.
Explosión respiratoria. El ensayo de explosión respiratoria se realizó mediante el método de reducción del Nitroblue-tetrazolium (NBT) por espectrofotometría descrito por Mohanty y Sahoo26. Brevemente, se depositaron 0,1 mL de sangre en una placa multipozos de ELISA (fondo en U) junto con 0,1 mL de solución de NBT (Sigma® Chemicals, Germany) al 0,2%. La mezcla fue incubada a 25 oC por 30 minutos, posteriormente se tomaron 0,05 mL de la suspensión y se adicionaron a un vial que contenía 1 mL de N,N dimetil formamida, esta solución fue centrifugada (2000 g x 5 minutos) y transferida a una placa multipozos de ELISA para lectura de densidad óptica a 620 nm en espectrofotómetro (ELx-800-Biotek® Instruments, Inc., USA). Los cambios en la densidad óptica fueron relacionados con cambio en la actividad oxidativa de los fagocitos.
Ensayo de actividad bactericida del plasma frente a Aeromonas hydrophila. Se realizó en base al protocolo descrito por Rainger y Rowley30. Brevemente, se formaron pools de plasma de los animales de cada tratamiento por muestreo. Adicionalmente y de forma separada, se realizó una suspensión bacteriana de Aeromonas hydrophila en solución salina ajustando dicha suspensión al tubo cero de la escala de McFarland con una densidad óptica de 0,075 a 560 nm. A continuación, se incubaron 100 µL de plasma (de cada tratamiento) + 100 µL de dilución bacteriana en una vial durante 1 hora a 37 °C. Posteriormente, la suspensión fue centrifugada y lavada en tres ocasiones con agua destilada y el pellet fue resuspendido (200 µL) en solución salina estéril y sembrado de manera masiva en Agar Tripticasa Soya (TSA) e incubado a 37 °C por 24 horas. Finalmente, se realizó el conteo de unidades formadoras de colonias (UFC) en cada uno de los tratamientos para cada muestreo.
Histopatología. Finalizado el período experimental se tomaron muestras de branquias, hígado, riñón, bazo y cerebro, de acuerdo a los protocolos de necropsia descritos por Yanong44 y Meyers24; los animales, fueron previamente anestesiados con eugenol (40 mg/L). Los tejidos fueron fijados en formalina buferada al 3,7% y la tinción empleada fue hematoxilina & eosina (H&E). La evaluación histopatológica fue realizada en microscopio óptico Olympus CX 31 (Olympus, USA). Finalmente la captura de las imágenes se realizó mediante la cámara Moticam® 580-5.0 M.P (Motic, China) y el software Motic Images Plus, versión 2.0 (Motic, China).
Análisis estadístico. Se utilizó un diseño experimental completamente aleatorizado efecto fijo balanceado con la técnica de ANOVA donde las variables respuesta correspondieron a: densidad óptica (explosión respiratoria) y número de colonias (actividad bactericida del plasma). El modelo se ajustó de acuerdo al siguiente diagrama:
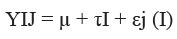
Donde µ es la media, τI el efecto tratamiento, y εj (I) el error experimental.
Se realizó un análisis de Kruskall-Wallis seguido del Test de comparación múltiple de Dunn. Se validaron los supuestos del modelo y se empleó un análisis descriptivo exploratorio unidimensional para hallar la media, desviación estándar y coeficiente de variación. Los datos obtenidos fueron analizados estadísticamente mediante el software GraphPad Prism versión 5.01 para Windows (GraphPad Software, Inc. 2007 California, USA).
Resultados
Concentración letal 50 (CL50)
Durante la fase de aclimatación no se presentó mortalidad, ni se evidenciaron alteraciones clínicas compatibles con signos de enfermedad. Para las primeras 24 horas de exposición se registró una mortalidad del 100% a la concentración de 0,5 mg/L y del 25% para los grupos de 0,01 y 0,1 mg/L, mientras que a las 72 horas se reportó una mortalidad acumulada del 62,5% para la concentración de 0,25 mg/L (Figura 1).
La CL50 a las 96 h del TCF para alevinos de cachama blanca fue de 0,18 mg/L (p<0,05) como se puede apreciar en la figura 2.
Exposición crónica subletal
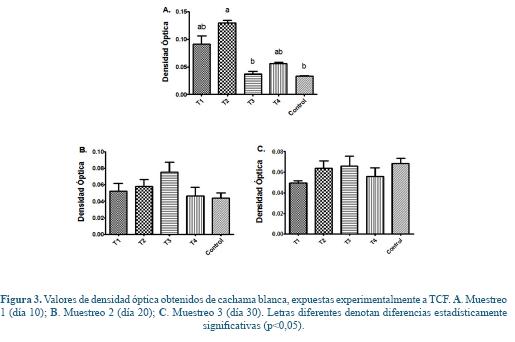
Explosión respiratoria. Para el primer muestreo realizado al día diez de exposición se evidenció un aumento estadísticamente significativo de la explosión respiratoria en el T2 (0,029 mg/L de TCF) con respecto al control como se aprecia en la Figura 3A. Sin embargo, para el segundo y tercer muestreo no se hallaron diferencias estadísticas significativas (Figura 3B y 3C).
Actividad bactericida del plasma.
Para el primer muestreo no se presentaron diferencias estadísticamente significativas en el conteo de UFC (Figura 4A), no obstante para el muestreo 2 y 3 se halló una disminución significativa de la actividad bactericida del plasma reflejada en un aumento del número de UFC en el T1 (0,018 mg/L de TCF) con respecto al grupo control (Figura 4B y 4C).
Histopatología
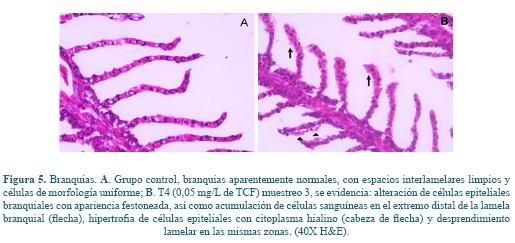
El análisis histopatológico de hígado, cerebro, bazo y riñón no reveló ninguna alteración significativa evidente (datos no mostrados), tan solo se observaron lesiones de leves a moderadas a nivel del epitelio branquial en los animales del T4 (0,05 mg/L) muestreados al día 30 como se puede apreciar en la figura 5B.
Discusión
Concentración letal 50
Estudios de toxicidad aguda del TCF han sido realizados en diferentes especies de organismos acuáticos: vertebrados e invertebrados. En Lepomis macrochirus se ha descrito una CL50 a 96 h del TCF de 0,26 mg/L y de 0,88 mg/L para Ictalurus punctatus3, esto cercano al valor hallado en el presente trabajo para alevinos de cachama blanca (Piaractus brachypomus) con una CL50 a 96 horas de 0,18 mg/L; mientras que para trucha arcoíris (Oncorhynchus mykiss) y trucha de arroyo (Salvelinus fontinalis) se reportan valores de 1,4 y 2,5 mg/L respectivamente3. Sin embargo, mayores niveles de tolerancia se registran para el pez cebra (Danio rerio) con una CL50 de 25,4 mg/L y 28,8 mg/L, en etapas juveniles y adultos, respectivamente6 y para carpa común (Cyprinus carpio) de 27,5 mg/L en adultos y 100 mg/L en jóvenes7, 20.
Pese a los diversos reportes de toxicidad del TCF en diferentes especies de organismos acuáticos, algunos autores recomiendan emplear concentraciones de TCF que van desde 0,1 a 1 mg/L para el tratamiento contra ectoparásitos en peces5,19. Sin embargo estas concentraciones son cercanas a los valores letales reportados en algunos peces, de allí la importancia de evaluar la sensibilidad de las diferentes especies frente a estos OPs.
Explosión respiratoria
El sistema inmune es sensible a los compuestos xenobióticos y reacciona más rápidamente que cualquier otro sistema, incluso a concentraciones más bajas que las requeridas o necesarias para generar una respuesta tóxica sistémica aguda33, similar a lo observado en el presente estudio en los animales expuestos a concentraciones de 0,029 mg/L de TCF con cambios significativos en la explosión respiratoria, evento que no se registró en los animales expuestos a las mayores concentraciones, ni durante mayores tiempos de exposición.
Estudios realizados en Oreochromis niloticus frente a exposiciones al OP diazinon, revelan un aumento en la explosión respiratoria13, así como fue evidente en el presente trabajo; sin embargo, esto contrasta con lo reportado con los ensayos realizados en C. carpio sometida a exposiciones de 0,5 mg/L de Malation, presentándose una disminución en la explosión respiratoria45. Otro tipo de organismos acuáticos muestran mayor sensibilidad ante exposiciones a TCF, así como lo reportan Chang5 para Macrobrachium rosembergi en el cual se evidenció un incremento significativo del índice de explosión respiratoria en hematocitos, a diferencia de lo encontrado en C. carpio expuesta a 20.000 ppm de TCF durante 15 minutos donde se presentó una disminución en la explosión respiratoria7.
En el presente estudio, no se evidenciaron cambios significativos en la actividad oxidativa durante los últimos 20 días de exposición al TCF, probablemente debido a una respuesta de tipo adaptativa ante la exposición crónica subletal a dicho xenobiótico, similar a la respuesta adaptativa desarrollada por Leporinus obtusidens ante exposiciones crónicas a glifosato, lo cual fue evidenciado por cambios en los niveles de cortisol durante el tiempo de exposición34. Los niveles estables en los índices de explosión respiratoria para los últimos 20 días de exposición (M2 y M3) también pueden estar asociados con una disminución en la actividad de la NADPH oxidasa como lo ha sugerido Chang4 de acuerdo a lo hallado en fagocitos de M. rosembergii expuestos a TCF, donde se sugieren efectos deletéreos de especies reactivas de oxígeno (ROS) sobre el ensamblaje y funcionamiento enzimático de la NADPH oxidasa, lo cual a su vez puede desencadenar supresión de la producción de ROS y por lo tanto presentarse una disminución en las actividad de explosión respiratoria.
Del mismo modo, otro de los mecanismos propuestos de inmunotoxicidad asociada al uso de inhibidores de la AChE corresponde al incremento en los niveles de ACh que de forma indirecta causan la inhibición del Factor Nuclear kappa B (NF-kB) por medio del Receptor de acetilcolina nicotínico subunidad alfa 7 (α7nAChR), produciendo la inhibición en la producción de citoquinas32.
Asimismo, se ha demostrado en peces teleósteos que los niveles de ROS producidos durante la exposición a TCF alteran la capacidad de defensa de sistemas antioxidantes tales como SOD, CAT y GST38 generando asi estrés oxidativo.
Actividad bactericida del plasma
Las alteraciones a nivel del sistema inmune inducidas por la exposición a xenobióticos afectan la respuesta frente a procesos de enfermedad que a su vez pueden llevar a la extinción de una especie2. Por este motivo en el presente estudio se llevó a cabo la evaluación de la actividad bactericida del plasma de los peces expuestos a TCF ante Aeromonas hydrophila, un patógeno de tipo bacteriano que afecta comúnmente a los peces. En este trabajo se evidencio un aumento significativo de numero de UFC a la concentración de 0,018 mg/L durante el muestreo 2 y 3 con respecto al grupo control, indicándose así una disminución de la actividad bactericida del plasma a dicha concentración y por ende un incremento en la susceptibilidad a patógenos bacterianos, posiblemente por alteraciones en el complemento o en la actividad de la lisozima y/o anticuerpos. También se demostró en C. carpio expuesta a 20.000 ppm de TCF durante 15 minutos, una disminución significativa en la actividad de la lisozima plasmática7. Una respuesta similar se presentó cuando esta misma especie fue expuesta a 75 µg/L de clorpirifos, evidenciándose una marcada disminución de la actividad de la lisozima sérica del día 3 al 7 post-exposición21. Así mismo, en C. carpio exposiciones de 30 mg/L de TCF durante un periodo de 30 minutos producen una leve disminución en la actividad de lisozima sérica siete días post-exposición36.
La disminución de la actividad bactericida del plasma en P. brachypomus expuestos a TCF además de lo anteriormente mencionado, también podría estar asociado a una disminución en los niveles de anticuerpos que actúan frente una infección por A. hydrophila, como se describe en C. carpio expuestas a clorpirifos con disminuciones en los niveles de inmunoglobulina M (IgM) 21.
Histopatología
En el presente estudio se evidenciaron lesiones a nivel branquial correspondientes a hipertrofia de células epiteliales con citoplasma hialino, posiblemente atribuido a cambios hidrópicos leves, así como desprendimiento lamelar en los peces expuestos a 0,05 mg/L de TCF para el día 30 de exposición. Similares hallazgos han sido reportados en Piaractus mesopotamicus ante exposiciones de 0,05 mg/L de TCF con presencia de hiperplasia de lamelas primarias y secundarias; sin embargo, a concentraciones de 0,1 mg/L en esta misma especie se presentó marcada tumefacción de los sinusoides sanguíneos (telangiectasia), edema subepitelial, fusión lamelar y algunos focos de congestión sanguínea23. Estas alteraciones branquiales pueden estar asociadas al efecto directo de los xenobióticos sobre el sistema respiratorio y la regulación acido-base iónica en el mantenimiento de la homeostasis, junto con la necesidad de disminuir la superficie de contacto branquial con los polutantes9.
Fortaleciendo la hipótesis de que las lesiones histopatológicas y su gravedad pueden estar relacionadas con el tiempo de exposición o con la concentración del xenobiótico, aunado a la sensibilidad o resistencia intrínseca de los diferentes organismos acuáticos expuestos a este polutante, se ha demostrado en Oreochromis niloticus expuesto a 0,25 mg/L de TCF la presencia de edema, fusión lamelar y proliferación celular a nivel branquial durante las primeras 8 horas de exposición; a las 72 horas, tan solo se halló edema y congestión, mientras que a las 96 horas no se observó ningún cambio inflamatorio14. También existen reportes en guppies (Poecilia reticulata) sometidos a exposiciones subagudas de TCF de 1,1 mg/L, en las cuales no se presentó ninguna alteración en el tejido branquial ni renal18, similar a lo ocurrido en cachama blanca, pero esto difiere de lo hallado en P. mesopotamicus23, Prochilodus lineatus31 y Carassius auratus gibelio43 frente a exposiciones a TCF, en las cuales se observan múltiples alteraciones renales y hepáticas. Sin embargo, debe tenerse bajo consideración que las dosis evaluadas de TCF en el presente estudio son extremadamente bajas en contraste con las concentraciones ambientalmente esperadas.
Conclusiones
En el presente trabajo se determinó una CL50 a 96 horas del TCF en alevinos de cachama blanca de 0,18 mg/L, estableciendo así el margen de seguridad de dicho OP para esta especie que presenta una alta sensibilidad. Asimismo, la exposición crónica subletal a TCF bajo condiciones de laboratorio induce alteraciones de tipo oxidativo para el primer muestreo, sin embargo entre los días 20 y 30 de exposición se observa un comportamiento adaptativo sin cambios en la explosión respiratoria, adicionalmente se presentan leves cambios histopatológicos a nivel branquial y disminución en la capacidad bactericida del plasma. Finalmente, a través del este trabajo se demuestra que la cachama blanca se constituye en un biomarcador sensible de contaminación asociado a este tipo de compuestos OPs, haciéndose necesario evaluar el uso de estos xenobióticos y su posible impacto como contaminante de los cuerpos de agua y organismos acuáticos en exposiciones crónicas subletales ya que la mayoría de los ensayos de toxicidad son de carácter agudo y evalúan generalmente mortalidad y no efectos subletales.
Agradecimientos
A los integrantes del Grupo de Enfermedades Neurodegenerativas (END) y del Grupo de Inmunología y Fisiopatología Animal (IFA) por el apoyo en la ejecución en la fase experimental de este trabajo, especialmente a Fabián Uribe, Julieth Vargas y Luisa Fernanda Vargas, al personal del Laboratorio de Toxicología y del Laboratorio de Diagnóstico Veterinario de la Universidad del Tolima por permitir el establecimiento del experimento y el apoyo constante de este. Al Comité Central de Investigaciones de la Universidad del Tolima por la financiación del proyecto.
Referencias
1. Arao T, Fuke C, Takaesu H, Morinaga Y, Miyazaki T. A case of fatal trichlorfon and methidathion poisoning. Leg Med 2002; 4(3): 182-186. [ Links ]
2. Bols NC, Brubacher JL, Ganassin RC, Lee LEJ. Ecotoxicology and innate immunity in fish. Dev Comp Inmunol 2001; 25(8-9): 853- 73. [ Links ]
3. Canadian Council of Ministers of the Environment. Canadian water quality guidelines for the protection of aquatic life: Trichlorfon. Canadian environment quality. 2012 : 1- 8. [ Links ]
4. Chang CC, Lee PP, Liu CH, Cheng W. Trichlorfon, an organophosphorus insecticide, depresses the immune responses and resistance to Lactococcus garvieae of the giant freshwater prawn Macrobrachium rosenbergii. Fish Shellfish Immunol 2006; 20(4): 574- 585. [ Links ]
5. Chang CC, Rahmawaty A, Chang ZW. Molecular and immunological responses of the giant freshwater prawn, Macrobrachium rosenbergii, to the organophosphorus insecticide, trichlorfon. Aquat Toxicol 2013; 130-131: 18- 26. [ Links ]
6. Coelho S, Oliveira R, Pereira S, Musso C, Domingues I, Bhujel RC, et al. Assessing lethal and sub-lethal effects of trichlorfon on different trophic levels. Aquat Toxicol 2011; 103(3-4): 191- 8. [ Links ]
7. Cossarini-Dunier M, Demael A, Siwicki AK. In vivo effect of the organophosphorus insecticide trichlorphon on the immune response of carp (Cyprinus carpio). I. Effect of contamination on antibody production in relation to residue level in organs. Ecotoxicol Environ Saf 1990; 19(1): 93 -98. [ Links ]
8. De Moraes FD, Venturini FP, Cortella LR, Rossi P, Moraes G. Acute toxicity of pyrethroid-based insecticides in the Neotropical freshwater fish Brycon amazonicus. Ecotoxicol Environ Contam 2013; 8(2): 59-64. [ Links ]
9. Evans DH, Piermarini PM, Choe KP. The Multifunctional Fish Gill: Dominant Site of Gas Exchange, Osmoregulation, Acid-Base Regulation, and Excretion of Nitrogenous Waste. Physiol Rev 2005; 85(1): 97- 177. [ Links ]
10. EXTOXNET. Extension Toxicology Network. Trichlorfon. EXTOXNET 1996; [acceso: 27 de febrero de 2014]. URL: http://pmep.cce.cornell.edu/profiles/extoxnet/pyrethrins-ziram/trichlorfon-ext.html. [ Links ]
11. Floyd R. The use of salt in aquaculture. Univesity of Florida. Institute of food and agricultural sciences 1995; [acceso: 20 de enero de 2014]. URL: http://edis.ifas.ufl.edu/pdffiles/VM/VM00700.pdf. [ Links ]
12. Fulton MH, Key PB, Delorenzo ME. Insecticide toxicity in fish. En: Tierney K, Farrell A, Brauner C: Fish Physiology Organic Chemical Toxicology of Fishes Volume 33. 1ra ed. Londres: Academic Press; 2014. p. 306-368. [ Links ]
13. Girón-Pérez MI, Velázquez-Fernández J, Díaz-Resendiz K, Díaz-Salas F, Canto-Montero C, Medina-Díaz I, et al. Immunologic parameters evaluations in Nile tilapia (Oreochromis niloticus) exposed to sublethal concentrations of diazinon. Fish Shellfish Immunol 2009; 27(2): 383- 385. [ Links ]
14. Guimarães TB, Silva de Assis HC, Boeger W. The effect of trichlorfon on acetylcholinesterase activity and histopathology of cultivated fish Oreochromis niloticus. Ecotoxicol Environ Saf 2007; 68(1): 57- 62. [ Links ]
15. Gupta R, editor. Toxicology of Organophosphate & Carbamate Compounds. Burlington MA; Elsevier Academic press; 2005. [ Links ]
16. Hamilton MA, Russo RC, Thurston RV. Trimmed Spearman-Karber method for estimating median lethal concentrations in toxicity bioassays. Environ Sci Technol 1977; 11(1): 714 - 719. [ Links ]
17. Harder A. Chemotherapeutic approaches to schistosomes: current knowledge and outlook. Parasitol Res 2002; 88(5): 395-397. [ Links ]
18. Heo G, Shin G. Acute and subacute toxicity of trichlorfon in guppies (Poecilia reticulata). Korean J Vet Res 2009; 49(3): 253- 256. [ Links ]
19. Herwig N. Handbook of Drugs and Chemicals Used in Treatment of Fish Diseases: A Manual of Fish Pharmacology and Material Medica. USA: Thomas Publishers; 1979. [ Links ]
20. Hoffman G, Meyer F. Parasites of Freshwater Fishes: A Review of Their Control and Treatment. 1ra ed. USA: T.F.H. Publications; 1974. [ Links ]
21. Li X, Liu L, Zhang Y, Fang Q, Li Y, Li Y. Toxic effects of chlorpyrifos on lysozyme activities, the contents of complement C3 and IgM, and IgM and complement C3 expressions in common carp (Cyprinus carpio L.). Chemosphere 2013; 93(2): 428- 433. [ Links ]
22. Lopes RB, Paraiba LC, Ceccarelli PS, Tornisielo VL. Bioconcentration of trichlorfon insecticide in pacu (Piaractus mesopotamicus). Chemosphere 2006; 64(1): 56-62. [ Links ]
23. Mataqueiro MI, Satiko Okada L, De Souza JP, Da Cruz C, De Oliveira GH, Urbinati EC. Histopathological changes in the gill, liver and kidney of pacu (Piaractus mesopotamicus, Holmberg, 1887) exposed to various concentrations of trichlorfon. J Appl Ichthyol 2009; 25(1): 124- 127. [ Links ]
24. Meyers TR. (2004). Standard Necropsy Procedures for Finfish. En: Aquatic handbook. 2a ed;2004. p. 1-10. [ Links ]
25. Ming WL, Deng JF. Acute Hemolysis Caused by Incidental Trichlorfon Exposure J Chin Med Assoc 2009; 72(4): 214-218. [ Links ]
26. Mohanty BR, Sahoo PK. Immune responses and expression profiles of some immune-related genes in Indian major carp, Labeo rohita to Edwardsiella tarda infection. Fish Shellfish Immunol 2010; 28(4): 613-21. [ Links ]
27. Noga E. The clinical workup. En: Noga E. Fish Disease: Diagnosis and Treatment. 2a ed. Iowa: Wiley-Blackwell; 2010. p. 32 - 36. [ Links ]
28. OECD. OECD Guideline for testing of chemicals 203: Fish Acute toxicity test 1992; [acceso: 20 de marzo de 2012]. URL: http://www.oecd.org/chemicalsafety/risk-assessment/1948241.pdf. [ Links ]
29. OECD. OECD Guideline for testing of chemicals 204: Fish, prolonged toxicity test 14-day study 1984; [acceso: 20 de marzo de 2012]. URL: http://www.oecd.org/env/ehs/testing/E204_Fish_Prolonged_Toxicity_Test.pdf. [ Links ]
30. Rainger G, Rowley A. Antibacterial activity in the serum and mucus of rainbow trout, Oncorhynchus mykiss, following immunization with Aeromonas salmonicida. Fish Shellfish Immunol 1993; 3(1): 475 - 82. [ Links ]
31. Rodrigues ED, Ranzani-paiva MJ, Juliano F. Histopathologic lesions in the liver of Prochilodus lineatus (Pisces, Prochilodontidae) exposed to a sublethal concentration of the organophosphate insecticide Dipterex 500® (Trichlorfon). Acta Scientiarum 2001; 23(2): 503-505. [ Links ]
32. Rondón IS, Pardo D, Eslava PR. Efecto de los herbicidas sobre el sistema inmune: una aproximación en peces. Rev Complut Ciencias Vet 2010; 4(1): 1- 22. [ Links ]
33. Salazar-Lugo R, Estrella A, Oliveros A, Rojas-Villaroel E,Villalobos de BL, Lemus M. Paraquat and temperature affect nonspecific immune response of Colossoma macropomum. Environ Toxicol Pharmacol 2009; 27(1): 321- 6. [ Links ]
34. Salbego J, Pretto A, Gioda CR, De Menezes CC, Lazzari R, Radünz Neto J, et al. Herbicide formulation with glyphosate affects growth, acetylcholinesterase activity, and metabolic and hematological parameters in piava (Leporinus obtusidens). Arch Environ Contam Toxicol 2010; 58(3): 740- 5. [ Links ]
35. Sinha AK, Vanparys C, De Boeck G, Kestemont P, Wang N, Nguyen PT, Robbens J. Expression characteristics of potential biomarker genes in Tra catfish, Pangasianodon hypophthalmus, exposed to trichlorfon. Comp Biochem Physiol Part D Genomics Proteomics 2010; 5(3): 207-216. [ Links ]
36. Siwicki AK, Cossarini-Dunier M, Studnicka M, Demael A. In vivo effect of the organophosphorus insecticide trichlorphon on immune response of carp (Cyprinus carpio). II. Effect of hign doses of trichlorphon on nonspecific immune response. Ecotoxicol Environ Saf 1990; 19(1): 99- 105. [ Links ]
37. Sun F, Betzendahl I, Wemmel K, Cortvrindt R, Smitz J, Pacchierotti F. Trichlorfon-induced polyploidy and nondisjunction in mouse oocytes from preantral follicle culture. Mutat Res 2008; 651(1): 114-124. [ Links ]
38. Thomaz JM, Martins ND, Monteiro DA, Rantin FT, Kalinin AL. Cardio-respiratory function and oxidative stress biomarkers in Nile tilapia exposed to the organophosphate insecticide trichlorfon (NEGUVON). Ecotoxicol Environ Saf 2009; 72(5): 1413- 1424. [ Links ]
39. Tian Y, Zhou S, Gao Y, Zhou, Y, Shi R, Heiger-Bernays W, et al. Effects of repeated maternal oral exposure to low levels of trichlorfon on development and cytogenetic toxicity in 3-day mouse embryos. Food Chem Toxicol 2011; 49(10): 2655-2659. [ Links ]
40. Vryzas Z, Vassiliou G, Alexoudis C, Papadopoulou-Mourkidou E. Spatial and temporal distribution of pesticide residues in surface waters in northeastern Greece. Water Res 2009; 43(1): 1-10. [ Links ]
41. Whitehead A, Kuivila KM, Orlando JL, Kotelevtsev S, Anderson SL. Genotoxicity in native fish associated with agricultural runoff events. Environ Toxicol Chem 2004; 23(12): 2868-77. [ Links ]
42. WHO. World Health Organization. Environmental Health Criteria 132: Trichlorfon. International program on chemical safety (IPCS)1992, 14. [ Links ]
43. Xu W, Liu W, Shao X, Jiang G, Li X. Effect of trichlorfon on hepatic lipid accumulation in crucian carp Carassius auratus gibelio. J Aquat Anim Health 2012; 24(3): 185- 94 [ Links ]
44. Yanong RP. Necropsy techniques for fish. En: Seminars in Avian and Exotic Pet Medicine. 2003.p. 89-105. [ Links ]
45. Yonar SM, Ural MS, Silici S, Yonar ME. Malathion-induced changes in the haematological profile, the immune response, and the oxidative antioxidant status of Cyprinus carpio: protective role of propolis. Ecotoxicol Environ Saf 2014; 102(1): 202- 209. [ Links ]
46. Zhou J, Zhou W, Luo Y, Chen H. Oxidative stress and free radical damage in patients with acute dipterex poisoning. Biomed Environ Sci 2004; 17(1): 223-233. [ Links ]