Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina Veterinaria y Zootecnia
On-line version ISSN 1900-9607
Ces. Med. Vet. Zootec. vol.9 no.2 Medellín July/Dec. 2014
Canine transmissible venereal tumor: expression of MDR-1, and TP53 and BCL-2 family genes and its implications in biological and therapeutic behavior¤
Tumor venéreo transmissível canino: expressão dos genes MDR-1, TP53 e da família Bcl-2 e suas implicações no comportamento biológico e terapêutico
Tumor venéreo transmisible canino: expresión de los genes MDR-1, TP53 y de la familia Bcl-2 y sus implicaciones en el comportamiento biológico y terapéutico
Luis Mauricio Montoya Floréz1, MSc; Haline Ballestero Fêo2, MSc; Noeme Sousa Rocha3, PhD.
¤Para citar este artículo: Montoya Flórez LM, Ballestero Fêo H, Sousa Rocha N. Tumor venéreo transmissível canino: expressão dos genes MDR-1, TP53 e da família Bcl-2 e suas implicações no comportamento biológico e terapêutico . Rev CES Med Zootec. 2014; Vol 9(2): 281-294.
*Autor para correspondencia: Luis Mauricio Montoya Floréz. Universidad de Caldas. maomontoya53@yahoo.es
1Mestrado na Universidade de Caldas, Manizales, Colombia. Grupo de pesquisa em Patologia Veterinária, Departamento de Clínica Veterinária, FMVZ, Universidade Estadual Paulista, Botucatu, São Paulo, Brasil.
2 Mestrado na Universidade Estadual de Campinas. Grupo de pesquisa em Patologia Veterinária, Departamento de Clínica Veterinária, FMVZ, Universidade Estadual Paulista, Botucatu, São Paulo, Brasil.
3 Doutorado e livre-docência na Universidade Estadual Paulista Julio de Mesquita Filho. Grupo de pesquisa em Patologia Veterinária, Departamento de Clínica Veterinária, FMVZ, Universidade Estadual Paulista, Botucatu, São Paulo, Brasil.
(Recibido: 13 de mayo, 2014; aceptado: 18 de septiembre, 2014)
Abstract
Transmissible venereal tumor (TVT) is a neoplasm of round cells with plasmocytoid or lymphocytoid appearance. The tumor presents several particularities, which have been the subject of numerous studies; however there still have investigations that need to be done. For example, a progressive increase of highly aggressive tumors with varying response to chemotherapy -including resistance- has been evidenced in recent years. There is scientific interest to understand these differences, allowing predicting possible clinical outcomes in affected dogs and increasingly searching adequate and individualized therapy. This review focuses on presenting possible implications of the expression of MDR-1 (P-glycoprotein), TP53, BCL-2, and BAX genes, regarding resistance to chemotherapy and/or the biologic behavior of TVT.
Key words: Cytology, chemotherapy, radiotherapy, vincristine.
Resumo
O tumor venéreo transmissível (TVT) é uma neoplasia de células redondas de aspecto plasmocitóide ou linfocitóide. O tumor apresenta várias particularidades que tem sido objeto de numerosas investigações e apesar disso, ainda existem lacunas que necessitam de maiores estudos. Por exemplo, nos últimos anos, tem-se evidenciado um aumento progressivo de tumores que apresentam elevados porcentuais de agressividade e variável resposta à quimioterapia, inclusive resistência. Desta forma, atualmente há interesses científicos com relação a compreender melhor estas diferenças, permitindo predizer uma possível evolução clínica entre cães acometidos pelo tumor e buscando cada vez mais uma conduta terapêutica adequada e individualizada. Assim, a revisão de literatura, centra-se em apresentar possíveis implicações da expressão dos genes MDR-1 (glicoproteína-p), TP53, BCL-2, BAX, quanto à resistência à quimioterapia, e/ou comportamento biológico do TVT.
Palavras-chave: Citologia, quimioterapia, radioterapia, vincristina.
Resumen
El tumor venéreo transmisible (TVT) es una neoplasia de células redondas de aspecto plasmocitoide o linfocitoide. El tumor presenta varias particularidades que han sido objeto de numerosas investigaciones y a pesar de eso, aún existen algunos vacíos en su conocimiento que requieren mayores estudios. Por ejemplo, en los últimos años, se ha evidenciado un aumento progresivo de tumores que presentan elevados porcentajes de agresividad y una respuesta variable a la quimioterapia, inclusive alguna resistencia. En este sentido, actualmente hay intereses científicos con relación a comprender mejor estas diferencias, permitiendo predecir una posible evolución clínica entre perros afectados por el tumor y buscando cada vez más una conducta terapéutica adecuada e individualizada. Así, la revisión de literatura, se centra en presentar posibles implicaciones de la expresión de los genes MDR-1 (glicoproteína-p), TP53, BCL-2, BAX, en cuanto a la resistencia a la quimioterapia, y/o el comportamiento biológico del TVT.
Palabras clave: Citología, quimioterapia, radioterapia, vincristina.
Introdução
O tumor venéreo transmissível (TVT) é uma neoplasia de origem incerta. No entanto, quanto à morfologia, o tumor é classificado como uma neoplasia de células redondas com aspecto plasmocitóide ou linfocitóide 4. O seu relato na literatura especializada diz que o TVT emergiu faz dez mil anos 48, 58 e sua distribuição é mundial 3, 19, 54.
O tumor apresenta algumas particularidades, como o acometimento da espécie canina 21, 49, 50 e uma agressividade questionável, pois dificilmente esta se correlaciona com o óbito do paciente 58.
O TVT implanta-se pelo contato de suas células viáveis com as mucosas que perderam sua integridade, sendo a transmissão venérea a mais frequente 21, 50. Quando implantado, o tumor reduz o mecanismo de defesa do animal, apresenta-se de forma única ou múltipla e localiza-se preferencialmente na mucosa da genitália externa, além das narinas, da cavidade oral, ocular e da pele. Em casos menos frequentes pode invadir tecidos distantes do sítio primário, como mama, pulmão, baço, encéfalo e outros órgãos 19, 21, 30.
A neoplasia geralmente se apresenta em forma de massas com consistência friável que sangram facilmente 21, 56. O diagnóstico é feito com base no histórico do animal, no exame clínico, além dos exames complementares de citologia e de histopatologia 15, 21. O exame de citologia, seja por punção ou esfoliação, é o mais utilizado para o diagnóstico, além de permitir classifica-lo em tumor de células redondas, do tipo linfocitóide, plasmocitóide ou misto 4, 42.
Nos casos de dificuldade no diagnóstico, podem ser realizadas análises cromossômicas e de imunofenotipagem 70. Nesse caso, o TVT pode ser identificado pela presença de lisozima e alfa antitripsina (ATT), que se encontram expressas respectivamente em 40% e 52% dos tumores em cães 44. Além disso, pode-se se identificar o tumor ainda pela expressão da vimentina e pelo MAC1, que é um marcador de macrófagos 35.
No protocolo terapêutico estabelecido para o TVT, utiliza-se o sulfato de vincristina como agente único, em aplicações semanais (quatro a oito aplicações via intravenosa), sendo esse protocolo o mais utilizado para a regressão do tumor 17, 21, 50. Dessa forma, cerca de 90% dos cães submetidos a esse tratamento respondem satisfatoriamente, embora apresentem sinais sugestivos de efeitos colaterais graves, o que leva à interrupção do tratamento 6.
Apenas um pequeno percentual de tumores é resistente à vincristina 53, 55. Nesse caso, os fármacos de escolha são a doxorrubicina ou ciclofosfamina 53 e com menor frequência a vimblastina, metrotexate, prednisolona ou suas combinações 28, 64. Portanto, atualmente, a terapia para o TVT restringe-se a um escasso número de drogas que às vezes acabam não sendo suficientes, pois existem tumores que apresentam resistência a essas drogas 5, 6, 61.
Em pesquisas desenvolvidas, no Laboratório de Patologia Veterinária Comparada da UNESP-Botucatu, tem-se evidenciado um aumento progressivo de tumores que apresentam elevados porcentuais de agressividade e variável resposta à quimioterapia, inclusive resistência. Isso em parte ocorre devido à elevada expressão de glicoproteína-p pelas células tumorais o que acarreta expulsão do quimioterápico 24. Assim, há uma elevação em relação aos custos do tratamento, além dos efeitos colaterais tais como: anorexia, mielosupressão e nefrotoxicidade.
Em pesquisas têm-se observado padrões morfológicos e moleculares que são próprios de tumores mais agressivos 2, 43, porém precisa-se conhecer ainda a associação destes padrões com o comportamento biológico, ou seja com a agressividade, num possível prognóstico, assim como com a resistência ao tratamento.
A resistência à terapia e o comportamento biológico variável nos tumores são fenômenos multifatoriais. Dentre alguns fenômenos que geralmente regulam esses processos, podemos citar genes pro e antiapoptóticos da família BCL-2, mecanismos de detoxificação intracelular e super-expressão de moléculas que transportam as drogas para fora da célula ou para outros compartimentos celulares, como a glicoproteína-p (produto do gene MDR-1); além de sistemas de reparo do DNA associados com a família do TP53.
Dessa forma, considerando a importância em aprofundar a compressão da evolução e patogenicidade do TVT, a revisão visa descrever as possíveis implicações da expressão dos genes MDR-1 (glicoproteína-p), TP53, BCL-2, BAX, quanto à resistência à quimioterapia, ou ao comportamento biológico do TVT.
Resistência mediada pelo gene MDR1 (glicoproteína-p)
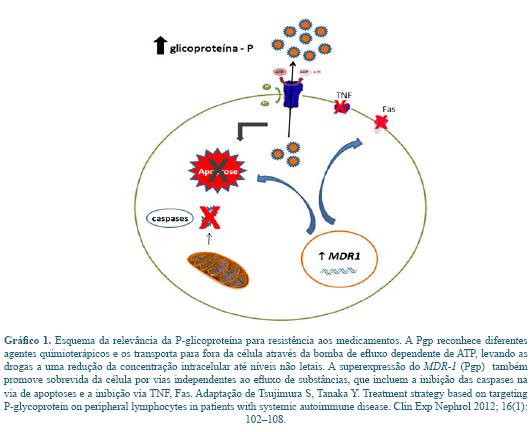
Normalmente, a resistência à quimioterapia é um grande obstáculo para os pacientes com câncer. Para sua explicação, muitos mecanismos têm sido propostos, porém, o principal processo envolvido na resistência clínica à quimioterapia, é a super-expressão da glicoproteína-p (Pgp) na membrana da célula. A Pgp reconhece diferentes agentes quimioterápicos e os transporta para fora da célula, levando as drogas a uma redução da concentração intracelular, até níveis não letais 9, 27, 69.
Quanto ao TVT, nos últimos anos se tem registrado um crescente percentual de animais resistentes à quimioterapia,6,23,24 com severas implicações, principalmente porque à terapia atualmente restringe-se a um escasso número de drogas 53, 55. Desta forma, na procura de explicações sobre a variável resposta terapêutica, foi sugerido que alterações na expressão da Pgp em células do tumor, tinham associação com resistência à vincristina, droga de principal escolha para o tratamento do TVT.
Em nossos estudos, quando analisamos os resultados da marcação com o anticorpo antiglicoproteína-p, verificamos que TVTs com morfologia plasmocitóide apresentaram uma imunorreatividade significativamente maior em relação com a morfologia linfocitóide. Portanto, podemos considerar que o primeiro subtipo apresenta um potencial para expressar resistência à droga (Tabela 1) 22.
Analisando as respostas clínicas à quimioterapia, observou-se que TVTs plasmocitóides foram menos sensível à quimioterapia em relação aos grupos linfocitóide, mostrando diferença significativa. Quando esta resposta foi comparada com a expressão de glicoproteína-p, observou-se uma relação direta da resposta parcial a quimioterapia com uma forte expressão de glicoproteína-p no grupo plasmocitóide 22. Pode-se inferir portanto, que casos clínicos de TVT do tipo plasmocitóide tendem a apresentar resposta clínica parcial à quimioterapia, possivelmente pela forte expressão de glicoproteína-p. Da mesma forma, tumores do tipo linfocitóide têm resposta completa à quimioterapia, provavelmente pela baixa expressão de glicoproteína-p (Tabela 2) 22.
De forma geral, a expressão imunoistoquímica da Pgp é variável no TVT, e descreve-se maior resistência à quimioterapia em tumores com superexpressão dessa proteína 22, 23, 24, resultado em concordância com o já descrito em tumores de humanos.
A Pgp, também conhecida como ABCB1 é o produto do gene MDR-1. Trata-se de uma proteína de 170 kDa, com 12 domínios trans-membrana e dois sítios de união ao ATP. A Pgp pertence a família das proteínas ABC (ATP- binding cassette), que são proteínas canais de membrana dependentes de energia e estão envolvidos na transferência de moléculas biológicas através da membrana contra um gradiente de concentração, com alta expressão em tecidos tumorais previamente expostos a fármacos 27, 39, 59. A Pgp pode ainda induzir multirresistência a drogas 66.
Essa proteína é expressa em células normais das adrenais, rins, fígado, cólon, cérebro, pulmões, sangue periférico e na medula óssea 67. A Pgp funciona como bomba de efluxo dependente de energia, gerada pela hidrólise do ATP 36, 67. Em condições normais, atua defendendo a célula contra agentes citotóxicos e transportando drogas para o seu exterior, como a doxorrubicina, dianorrubicina, epirrubicina, vincristina, vimblastina, vinorelbina, otoposide, opotecan, entre outras 59, reduzindo as concentrações a níveis não letais 67, 36.
Apesar do mecanismo protetor, a sua super-expressão leva à multirresistência a drogas 69. Além disso, a Pgp também transporta substâncias que atuam no crescimento da célula 66, e há observações que sustentam a possibilidade da Pgp promover sobrevida da célula por vias independentes ao efluxo de substâncias, que incluem a inibição das caspases na via de apoptoses 74.
Em associação, quando existe superexpressão do MDR-1, observa se também, expressiva influência nos mecanismos de apoptose nas células tumorais. Esse mecanismo é aceito como de prevenção, onde consequentemente o número de células são mantidas 73. Outros pesquisadores que investigam o fenômeno, acreditam que o MDR-1 atua por meio de uma variedade de estímulos, dentre eles a inibição via TNF, Fas e irradiação gama 9, 34 (Gráfico 1).
Em oncologia médica, a importância clínica da resistência a multidrogas é demonstrada pelos níveis elevados de expressão de Pgp. Como consequência, há ausência de resposta à quimioterapia 39, prognóstico ruim e reduzido tempo de sobrevida 9. Maia e Rumjanek 36 descreveram que um número significativo de pacientes que apresentavam resistência à quimioterapia, expressavam altas quantidades de Pgp.
Entretanto, estudos desenvolvidos por Mochida et al. 41, demostraram que a ausência da Pgp, suprimiu o aparecimento de neoplasia intestinal em camundongo. Porém, a ausência da expressão da Pgp é controversa, pois a alteração dos mecanismos mediados pela glicoproteína podem conduzir a maior exposição a agentes tóxicos, levando a incrementar o risco para desenvolver vários tipos de câncer de diferentes malignidades, de forma que essa relação casual ainda tem que ser melhor estudada 73.
Apesar desses estudos não serem atuais, eles trazem informações relevantes para a compreensão de resistência a quimioterápicos, em especial no estabelecimento do protocolo para o TVT, visto que, são escassos os estudos para esse fim. De acordo com Mealey et al. 37, a Pgp em cães com linfoma funciona de forma similar ao homem. Nesse caso, os autores demonstraram nas suas pesquisas que os níveis de Pgp tiveram maiores expressões na recidiva, do que até mesmo no momento do diagnóstico primário. De fato, há correlação entre a expressão da Pgp e o comportamento do tumor, visto que há interferência na remissão e no tempo de sobrevida 8.
Lee et al. 33 demonstraram que a expressão inicial de Pgp nos linfomas de cão é menor do que após a recidiva do tumor. Concluiu-se dessa forma, que a expressão da Pgp antes do início do tratamento é um fator preditivo independente e negativo de sobrevivência.
Diante do exposto, a extrapolação do estudo da expressão da Pgp e sua relação com uma possível resistência à quimioterapia pode trazer benefícios para o animal acometido com o TVT. Além do mais, ajudariam com informações relevantes para a compreensão de mecanismos de resistência do tumor, além de estimular pesquisas para uma possível modulação da expressão do gene MDR-1 em caninos.
Resistência e agressividade tumoral mediada pela expressão do gene TP53
O TP53 é um dos genes que mais frequentemente sofrem mutação no câncer de humanos. Têm-se relatado que aproximadamente a metade de todos os tumores tem alteração do TP53 60; além de haver evidências de que a expressão de MDR-1, ou seja Pgp, é regulada por certos mutantes da proteína p53, sugerindo que a resposta à quimioterapia ou radioterapia pode depender em parte ao estado do TP53 antes do tratamento 45.
O gene TP53 localiza-se no braço curto do cromossomo humano 17 (17p13) e contém 11 exons que compreendem a 20 Kb 51. O gene codifica a formação do p53, uma fosfoproteína nuclear de 53 KDa composta por 393 aminoácido. Esta proteína foi descoberta na década de 1970, em preparados de células SV40 e têm implicações no ciclo celular, no reparo e síntese de DNA, diferenciação celular, plasticidade genômica e no programa de morte celular 25, 65.
A mutação do TP53 foi descrita em cães 29 na presença do TVT. Choi e Kim 14 descreveram os primeiros relatos de mutação do gene. Achados corroboraram em estudos posteriores, desenvolvidos por Servín et al. 57. Porém, apesar das evidências de mutação do gene no tumor, se desconhece se esta particularidade gera alguma troca na função da proteína 71.
De acordo com Servín et al. 57, ainda é preciso estabelecer a função que pode desempenhar os polimorfismos do TP53 na patogêneses e resposta à quimioterapia no TVT. Stockmann et al. 62, assim como Sérvin et al. 57, enfatizam a necessidade de avaliar os efeitos da expressão da proteína, e dos membros de sua família nas células do TVT, relacionando os achados com o prognóstico e possíveis alternativas terapêuticas. Além disso, é preciso determinar a influencia do hospedeiro sobre esta expressão.
Em trabalhos desenvolvidos pelo nosso grupo, nos que foram utilizadas culturas primárias de células de TVT, constatou-se que células que recebiam tratamento com vincristina, apresentavam baixa taxa de expressão do p53, quando comparadas com células que não recebiam. Neste caso sugeriu-se, como uma possível explicação, uma regulação da expressão da proteína pelo tumor, promovendo sua diminuição como possível forma de se proteger da entrada em apoptose (dados ainda não publicados).
Em regra, em tecidos normais, o nível de expressão do TP53 é extremamente baixo. Em resposta a múltiplos fatores que podem afetar a célula, como a ativação de oncogenes, hipóxia, desregulação de nucleotídeos e danos oxidativos, o p53 é rapidamente acumulado no núcleo por modificações químicas como fosforilação e acetilação, exercendo sua função pró-apotótica e removendo assim, células com sérios danos no DNA 51 (Gráfico 2).
Neste caso, a p53 ativa alvos pró-apotóticos como a Bax, PUMA, NOXA e p53APA1 que, em conjunto, contribuem para à desestabilização do potencial de membrana mitocondrial que é um passo crítico da via da apoptose 12, 32. Assim, o p53 é um importante regulador da apoptose. Ele interage com proteínas pró e antiapoptóticas como a Bcl-2 40, 65, 68, e como foi dito com o Bax51, 65, além de existir evidências de que ela também regule a apoptose independente da transcrição mitocondrial mediante os membros da família Bcl-2 11, 20. Da mesma forma, o p53 pode transativar genes como BAX, resultando em um alto potencial para induzir apoptoses em células tumorais 38.
Porém, a p53 não só induz apoptoses, mas também participa nas demais fases do ciclo celular. Na fase G1, a p53 participa através da transativação do p21, enquanto que na fase G2/M ela bloqueia a entrada da célula à mitose. O mecanismo dual da p53 no comportamento protetor e indutor da apoptose, indicam que o gene pode atuar como promotor de tumor, pois a p53 pode levar a maior sobrevida de células com alguma lesão e incrementar a possibilidade de transformação maligna 65.
Do ponto de vista clínico, a inativação ou mutação do gene TP53 é um evento molecular frequente e grave para a maioria dos tumores; pois existem formas mutantes do TP53 que exibem tempos de vida média mais longa, com potencial oncogênico e efeitos negativos sobre os tipos originais levando à quimioresistência 51. Algumas inclusive, ocasionam transativação de genes como EGFR, C-MYC e o MDR-1 10 demonstrando diferentes ações das formas mutantes da TP53 47, 72.
Em situação de heterozigose, no qual os tipos de p53 normais e mutantes estão presentes, a inativação do p53 por expressão de mutantes, pode conceder as células vantagens para seu crescimento e sobrevida. Isso se dá de forma a incrementar a sua proliferação e evitar apoptose, gerando quimioresistência. A expressão de mutantes de p53, favorecem ainda, processos como a angiogênese, migração, invasão e metástase do tumor 52.
Em estudos prévios, desenvolvidos em camundongos com perda do p53 nativo, foi observado que apesar deles apresentarem com maior frequência tumores, estes exibiam uma proporção baixa de metástase e crescimento invasivo (7), quando comparado com camundongos que tinham formas mutantes do p53 26. Em estudos "in vitro", com comportamento similar do p53, observou-se a mesma condição 1, 46.
Considerando a análise dos aspectos descritos anteriormente e do ponto de vista da oncologia comparada, é possível que no TVT, as mutações no gene também possam impactar de forma direta o seu comportamento clínico, além da agressividade, resistência e potencial de metástases, como é observado em outros tumores.
Resistência e agressividade tumoral mediada pela expressão dos gene da família BCL-2
Proteínas da família Bcl-2 foram identificadas em TVT. Stockmann et al. 62 demonstraram que no tumor, a superexpressão do Bcl-2 é independente do seu estagio de desenvolvimento. Anteriormente, Frenzel et al. 20 sugeriram que a superexpressão da proteína Bcl-2 promoveria a aquisição de funções no tumor associadas à progressão e a sobrevida. Da mesma forma, Amaral et al. 2 destacam que TVT menos agressivos têm alto índice de apoptose e podem até apresentar melhor prognóstico.
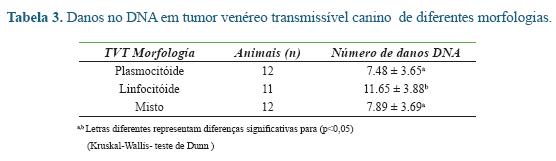
Considerando que danos no DNA estimulam a ativação de diversos genes nas vias apoptóticas, entre eles os da família BCL-2, o nosso grupo utilizou o ensaio do cometa a fim de investigar o nível destes danos em células de TVT. Os resultados da pesquisa evidenciaram que tumores em estádios iniciais de desenvolvimento denominados de morfologia linfocitóide, apresentaram mais lesões no DNA, que foram estatisticamente diferentes, quando comparados com estádios mais tardios de TVTs (plasmocitóides) (Tabela 3) 2. Assim, estes resultados sugerem comportamento variável do tumor, sendo que, morfologias do tipo plasmocitóide podem apresentar alta agressividade e proliferação, levando a menores taxas de apoptoses, portanto, possivelmente menor expressão de genes próapototicos 2.
Os genes BAX e BCL-2 pertencem a uma mesma família. Há cerca de 25 genes que codificam proteínas que regulam a permeabilidade da membrana externa da mitocôndria e subdividem-se conforme a sua função e seu domínio. As proteínas podem ser pró-apoptóticas (Bax, Bad, Bak, Bok, entre outras), anti-apoptóticas (Bcl-2 propriamente dito, Bcl-xL e Bcl-w), entre outras 12, 13, 39.
A regulação das proteinas da família Bcl-2 e as interações com outros membros da sua família estão bem definidos, assim como muitos dos mecanismos de participação em processos fisiológicos e patológicos. Foi relatado inclusive, que membros desta familia participam em diferentes processos que levam a apoptose. Apesar disso, o seu controle por membros de outras familias, como por exemplo a BH3, ainda é insuficientemente determinado 12.
Os membros da família Bcl-2 são expressos em uma grande variedade de tecidos fetais, porém em adultos, está restrito a células que estão em processo de divisão rápida e diferenciação. O BCL-2 inibe a via de apoptose preservando principalmente a membrana mitocondrial e inibindo a oligomerização de Bax/Bak que, ao contrário, liberariam moléculas apoptóticas 31. Entretanto, Bax por si só, é proapoptótico 12
Desde a sua identificação em neoplasias de células B, a superexpressão do BCL-2 vem sendo observada em diferentes tipos de tumores e linhagens celulares, tanto no homem, quanto em animais 16, 18, 75, de forma que o envolvimento dos membros da família Bcl-2 no câncer tem sido plenamente estabelecido. A associação da expressão de BCL-2 com a sobrevivência tumoral sugere que a superexpressão desta proteína promove a aquisição de funções associadas a progressão tumoral 63. Além disso, sua superexpressão e a ausência de regulação foram observadas em diferentes tipos de tumores 45.
Entretanto, os relatos sobre a sua participação na carcinogênese, bem como a dos membros de sua família, são heterogêneos. Por um lado, a superexpressão confere a muitos tipos de células resistência a diversos estímulos apoptóticos 12, atribuindo a células tumorais resistência aos fármacos e radioterapia 75, além de acelerar a gênese do tumor pela desregulação do MYC e outros oncogênes 16. Por outro lado, a superexpressão também têm-se relacionado com fenótipos de baixa malignidade e prognóstico favorável 63 em camundongos transgênicos. A superexpressão de BCL-2 promoveu baixa incidência de linfomas. No entanto, a perda de alguns dos membros pro-apoptóticos como o Bax, também acelera o desenvolvimento do tumor 12 (Gráfico 3).
Na atualidade, os pesquisadores baseiam-se nestes e em outros achados para propor estratégias terapêuticas em diversos tumores. Por exemplo, os recentes progressos na compreensão da forma de ativação de Bax/Bak, pode facilitar o desenvolvimento de compostos que regulem a sua atividade, promovendo a sua ativação para o tratamento de câncer, ou inibindo em caso de aumento na taxa de apoptoses 12.
Da mesma maneira, é possivel tentar modular a terapia baseado em modificações pós-traslacionais, como fosforilação e ubiquitinação, que os membros da familia Bcl-2 acabam sofrendo. Em regra, a fosforilação do Bcl-2, altera a sua conformação e incrementa a união do Bcl-2 ao BAK e BID, tornando as células mais refratárias à quimioterapia 12.
Desta forma, pesquisar a expressão de genes e proteínas desta família no TVT, poderá trazer informações importantes para a abordagem clínica do tumor, assim como promover subsídio para novas pesquisas, tanto para este tumor como para os outros tipos de neoplasias.
Considerações finais
No intuito de identificar melhor o perfil de expressão dos genes MDR-1 (glicoproteína-p), TP53, BCL-2, BAX, entre outros, há uma necessidade de aprofundar nas pesquisas sobre o TVT. Da mesma maneira, torna-se necessário se obter informações relevantes para identificar possíveis relações com a expressão desses genes, buscando aprimorar o tipo de prognóstico, terapia e compreender o comportamento biológico da neoplasia, auxiliando consequentemente no estabelecimento de um protocolo terapêutico adequado para tumores com diferentes graus de agressividade.
Referências
1. Adorno M, Cordenonsi M, Montagner M, Wong C, Hann B, et al. A Mutant-p53/Smad complex opposes p63 to empower TGFbeta-induced metastasis. Cell 2009; 137(1): 87- 98. [ Links ]
2. Amaral AS, Ferreira I, Colodel MM, fávero Dm, rocha ns. DNA damage in canine transmissible venereal tumor. Rev Lus Ciên Med Vet 2011; 4: 1- 5. [ Links ]
3. Amaral AS, Gaspar LF, Bassini-Silva S, Rocha NS. Cytological diagnostic of transmissible venereal tumor in the Botucatu region, Brazil (descriptive study: 1994-2003). Rev Port Ciên Vet 2004; 99(551): 167-171. [ Links ]
4. Amaral AS, Bassani-Silva S, Ferreira I, Fonseca LS, Andrade FH, et al. Cytomorphological characterization of transmissible canine venereal tumor. Rev Port Ciên Vet 2007; 103: 563-564. [ Links ]
5. Andrade SMF. Antineoplasicos. In: Andrade SMF. Manual de terapêutica veterinária.3ª ed. São Paulo: ROCA, 2008. p. 206-209. [ Links ]
6. Athanasius EC, Kene RO, Anyanwu HC. Comparative efficacy of surgery, vincristine sulphate and combined therapy of levamisole and Bacille Calmette Guerin vaccine in the treatment of transmissible venereal tumour-infected dogs. Comp Clin Pathol 2013; p.1-5. [ Links ]
7. Attardi LD, Jacks T. The role of p53 in tumour suppression: lessons from mouse models. Cell Mol Life Sci 1999; 55(1): 48-63. [ Links ]
8. Bergman PJ, Ogilve GK, Powers BE. Monoclonalantibody C219 immunochemistry against P-glycoprotein: sequential analysis and predictive ability in dogs with lymphoma. J Vet Inter Med 1996; 10(6): 354-359. [ Links ]
9. Binkhathlan Z, Lavasanifar A. P-glycoprotein inhibition as a therapeutic approach for overcoming multidrug resistance in cancer: Current status and future perspectives. Curr Cancer Drug Targets 2013; 13(3): 326-346. [ Links ]
10. Cadwel C, Zambetti GP. Effects of wild-types p53 tumour suppressor activity and mutant p53 gain-of function on cell grown. Gene 2001; 277(1-2): 15-30. [ Links ]
11. Cory S, Adams JM. The Bcl2 family: regulators of the cellular life-or-death switch. Nat Rev Cancer 2002; 2(9): 647-656. [ Links ]
12. Czabotar PE, Lessene G, Strasser A, Adams MJ. Control of apoptosis by the BCL‑2 protein family: implications for physiology and therapy. Nat Rev Mol Cell Biol 2014; 15(1): 49-63. [ Links ]
13. Chao DT, Korsmeyer SJ. BCL-2 family: regulators of cell death - Review. Annu Rev Immunol 1998; 16:395-419. [ Links ]
14. Choi YK, Kim CJ. Sequence analysis of canine LINE-1 elements and p53 in canine transmissible venereal tumor. J Vet Sci 2002; 3(4): 285-292. [ Links ]
15. Das U, Das AK. Review of canine transmissible venereal sarcoma. Vet Res Commun 2000; 24(8): 545-556. [ Links ]
16. Delfino AB. O envolvimento de genes e proteínas na regulação da apoptose - carcinogênese. Rev Bras Cancerol 1997; 43(3): 173-186. [ Links ]
17. Erünal-Maral N, Findik M, Asalan S. Use of exfoliative cytology for diagnosis of transmissible venereal tumour and controlling the recovery period in the bitch. Dtsch Tierärztl Wochenschr 2000; 107(5): 175-180. [ Links ]
18. Fett-Conte A, Salles AB. A importância do gene p53 na carcinogênes humana. Rev Bras Hematol Hemoter 2002; 24(2): 85-89. [ Links ]
19. Ferreira AJ, Jaggy A, Varejão AP, Ferreira ML, Correia, JM, et al. Brain and ocular metastases from a transmisible venereal tumour in a dog. J Small Anim Pract 2000; 41(4): 165-168. [ Links ]
20. Frenzel A, Grespi F, Chmelewskij W, Villunger A. Bcl2 family proteins in carcinogénesis and the treatment of cancer. Apoptosis 2009; 14(4): 584-596. [ Links ]
21. Ganguly B, Das U, Das K. Canine transmissible venereal tumour: a review. Vet Comp Onc 2013; 11(4): 1-12. [ Links ]
22. Gaspar LF. Caracterização citomorfológica do tumor venéreo transmissível canino correlacionada com danos citogenéticos, taxa de proliferação e resposta clínica à quimioterapia. Tese de doutorado, Faculdade de Medicina Veterinária e Zootecnia, Universidade Estadual Paulista, Botucatu, 2005. 143 p. [ Links ]
23. Gaspar LF, Amaral AS, Bassani-Silva S, Rocha NS. Imunorreatividade à glicoproteína-p nos diferentes tipos citomorfológicos de tumor venéreo transmissível canino. Vet em Foco 2009; 6(2): 140-146. [ Links ]
24. Gaspar LF, Ferreira I, Colodel MM, Brandão CV, Rocha NS. Spontaneus canine transmissible venereal tumor: cell morphology and influence on p-glycoprotein expression. Turk J Vet Anim Sci 2010; 34(5): 447-454. [ Links ]
25. Harris C, Hollstein M. Clinical implications of the p53 tumor-suppressor gene. N Engl J Med 1993; 329(18): 1318-1327. [ Links ]
26. Heinlein C, Krepulat F, Lohler J, Speidel D, Deppert W, et al. Mutant p53(R270H) gain of function phenotype in a mouse model for oncogene-induced mammary carcinogenesis. Int J Cancer 2008; 122(8), 1701-1709. [ Links ]
27. Hodges LM, Markova SM, Chinn LW, Gow JM, Kroetz DL, et al. Very important pharmacogene summary: ABCB1 (MDR1, Pglycoprotein). Pharmacogenet. Genomics 2011; 21(3): 152-161. [ Links ]
28. Kunakornsawat S, Yippaditr W, Jamjan N, Bootcah R, Netramai S, et al. Surgical correction of transmissible venereal tumor with vincristineresistance using episiotomy and vulvo vagino plasty in female and subtotal penile amputation and scrotal ablation in male dogs. In Proceeding of 48th Kasetsart University Annual Conference: Veterinary Medicine. 2010; Feb 3-5, Bangkok, Thailand, 191-200. [ Links ]
29. Kanayan N, Okuda N, Toyama N, Oikawa T, Inokuma H, et al. Detection of the anti-P53 antibodies in dogs with tumors. J Vet Med Sci 2002; 64(11): 973-979. [ Links ]
30. Kirchoff N, Nohr B. Spinal metastasis of a canine transmissible venereal tumor. Kleintierpraxis 1994; 39(11): 797-798. [ Links ]
31. Kirkin V, Joof S, Zorning M. The role of Bcl-2 family members in tumorigenesis. Biochem Bioph Act 2003; 16(44): 229-249. [ Links ]
32. Lacroix M, Toillon RA, Leclercq, G. p53 and breast cancer, an update. Endocr Relat Cancer 2006; 13(2): 293-325. [ Links ]
33. Lee JJ, Hughes CS, Fine RL, Page RL. P-glycoprotein expression in canine lymphoma. Cancer 1996; 77(9): 1892-1898. [ Links ]
34. Macleod RJ. MDR-1, Bcl-xL, H. pylori, and Wnt/b-catenin signalling in the adult stomach: how much is too much?. Laboratory Investigation 2012; 92(12): 1670-1673. [ Links ]
35. Marchal T, Chabanne L, Kaplanski C, Rigal D, Magnol JP. Immunophenotype of the canine transmissible venereal tumour. Vet Immunol Immunop 1997; 57(1-2):1-11. [ Links ]
36. Maia RC, Rumjanek VM. Mecanismos moleculares de resistência a múltiplas drogas. In: Ferreira CG, Rocha JC. Oncologia molecular. São Paulo: Atheneu; 2004. p. 113-122. [ Links ]
37. Mealey KL, Barhoumi R, Rogers K, Kochevar DT. Doxorubicin induced expression of P-glycoprotein in a canine osteosarcoma cell line. Cancer Let 1998; 126(2): 187-192. [ Links ]
38. Menendez D, Inga A, Resnick MA. The biological impact of the human master regulator p53 can be altered by mutations that change the spectrum and expression of its target genes. Mol Cell Biol 2006; 26(6): 2297-308. [ Links ]
39. Mendelsohn J, Howley I, Thompson G. The molecular basis of cancer. 3rd ed. Saunders, 2008. [ Links ]
40. Mihara M, Erster S, Zaika A, Petrenko O, Chittenden T, et al. p53 has a direct apoptogenic role at the mitochondria. Mol. Cell., v.11, p. 577-590, 2003. [ Links ]
41. Mochida Y, Taguchi K, Taniguchi S, Tsuneyoshi M, Kuwano H, et al. The role of P-glycoprotein in intestinal tumorigenesis: disruption of mdr1 a suppresses polyp formation in Apc (Min/+) mice. Carcinogenesis 2003; 24(7): 1219-1224. [ Links ]
42. Montoya FL, Pedraza FJ, Grandi F, Rocha N. Cytologic subtypes of canine transmissible venereal tumor. Vet Clin Pathol 2012; 41(1): 4-5. [ Links ]
43. Montoya FL, Pedraza FJ, Monteiro S, Brandão CV, Rocha NS. Cytological and clinical staging of transmissible venereal tumour at the Veterinary Hospital of Botucatu. Rev Vet Zoot 2014; in press. [ Links ]
44. Mozos E, Méndez A, Gómez-Villamandos JC, Martín de las mulas J, Pérez J. lmmunohistochemical characterization of canine transmissible venereal tumor. Vet Path 1996; 33(3): 257-263. [ Links ]
45. Moro JV, Tinucci-Costa M, Silveira AC, Gerardi DG, Alessi AC. Reactivity of p53 protein in canine transmissible venereal tumor. Arq Bras Med Vet Zootec 2010; 62(2): 318-323. [ Links ]
46. Muller PA, Caswell PT, Doyle B, Iwanicki M, Tan E, et al. Mutant p53 drives invasion by promoting integrin recycling. Cell 2009; 139(7): 1327-1341. [ Links ]
47. Muller PA, Vousden KH, Norman JC. p53 and its mutants in tumor cell migration and invasion. J Cell Biol 2011; 192(2): 209-218. [ Links ]
48. Murchison PE, Wedge DC, Alexandrov LB, Fu B, Martincorena I, et al. Transmissable Dog Cancer Genome Reveals the Origin and History of an Ancient Cell Lineage. Science 2014; 343( 6169): 437-440. [ Links ]
49. Nielsen SW, Kennedy PC. Tumors of the genital systems. In: Moulton JE. Tumors in domestic animals. 3ª ed. Los Angeles: London; 2000. p. 479-517. [ Links ]
50. Oliveira DK, Quessada AM, Medeiros SM, Lima CF, Dos Santos LS, et al. Transmissible Venereal Tumor Treated with Autohemotherapy. Acta Scientiae Veterinariae 2013; 41:1107. [ Links ]
51. Ozaki T, Nakagawara A. p53: The Attractive Tumor Suppressor in the Cancer Research Field. J Biomed Biotechnol 2011; [acesso: 14 fevereiro de 2014]. http://www.hindawi.com/journals/bmri/2011/603925/ [ Links ]
52. Rivlin N, Brosh R, Oren M, Rotter V. Mutations in the p53 Tumor Suppressor Gene: Important Milestones at the Various Steps of Tumorigenesis. Genes Cancer 2011; 2(4): 466-474. [ Links ]
53. Rogers KS. Transmissible venereal tumour. Compend Contin Educ Pract Vet 1997; 19(9): 1036-1045. [ Links ]
54. Rogers KS, Walker MA, Dillon HB. Transmissible venereal tumor: a retrospective study of 29 cases. J Am Anim Hosp Assoc 1998; 34(6): 463- 470. [ Links ]
55. Said RA, Silva LF, Albuquerque A, Sousa- Neta, EM, Lavinsky MO. Efficacy and side effects of vincristine sulfate treatment on canine transmissible venereal tumor. In Proceeding of the 34th World Small Animal Veterinary Association, Sao Paulo, 2009. [acesso: 10 de Fevereiro de 2014]. http://s.plx?CID =WSAVA2009&Category=&PID=5379 4&0=Generic. [ Links ]
56. Santos FG, Vasconcelos AC, Nunes JE, Cassali GD, Paixão TA, Moro L. O tumor venéreo transmissível canino - aspectos gerais e abordagens moleculares (revisão de literatura). Bioscience J 2005; 21(3): 41- 53. [ Links ]
57. Servín SA, Martínez S, Alarcon EC, Fajardo R. TP53 Polymorphisms allow for genetic sub-grouping of the canine transmissible venereal tumor. J Vet Sci 2009; 10(4): 353- 355. [ Links ]
58. Siddle HV, Kaufman J. A tale of two tumours: Comparison of the immune escape strategies of contagious cancers. Mol Immunol 2013; 55(2): 190-193. [ Links ]
59. Soto CV. Caracterización del efecto anticanceroso e identificación de dianas moleculares de principios activos procedentes de serrata marcescens. Tesis de doctoral, Universidad de Barcelona, Barcelona, España, 2007. 252 p. [ Links ]
60. Soussi T, Beroud C. "Assessing TP53 status in human tumours to evaluate clinical outcome. Nat Rev Can 2001; 1(3): 233-240. [ Links ]
61. Sousa J, Saito V, Nardi B, Rodaski S, Guerios S, Bacila M. Características e incidência do tumor venéreo transmissível (TVT) em cães e eficiência da quimioterapia e outros tratamentos. Arch Vet Sci Curitiba 2000; 5: 41- 48. [ Links ]
62. Stockmann D, Ferrari H, Andrade A, Cardoso T, Luvizotto M. Detection of the tumour suppressor gene TP53 and expression of p53, Bcl-2 and p63 proteins in canine transmissible venereal tumor. Vet Comp Oncol 2011a; 9(4): 1- 9. [ Links ]
63. Stockmann D, Ferrari H, Andrade A, Lopes A, Cardoso T, Luvizotto M. Canine Transmissible Venereal Tumors: Aspects Related to Programmed Cell Death. Braz J Vet Pathol 2011b; 4(1): 67- 75. [ Links ]
64. Sudjaidee P, Theewasutrakul P, Techarungchaikul S, Ponglowhapanl S, Chatdarong K. Treatment of canine transmissible venereal tumor using vincristine sulfate combined with l-asparaginase in clinical vincristine-resistant cases: a case report. Thai J Vet Med 2012; 42(1): 117- 122. [ Links ]
65. Suzuki K, Matsubara H. Recent Advances in p53 Research and Cancer Treatment. J Biomed Biotechnol 2011; 2-7. [ Links ]
66. Szakács G, Paterson J, Ludwig J, Booth-genthe C, Gottesman MM. Targeting multidrug resistance in cancer. Nat rev 2006; 5(3): 219- 234. [ Links ]
67. Thomas H, Coley H. Overcoming multidrug resistance in cancer: An update on the clinical strategy of inhibiting p -glycoprotein. Canc Cont 2003; 10(2): 159- 165. [ Links ]
68. Tomita Y, Marchenko N, Erster S, Nemajerova A, Dehner A, et al. WT p53, but not tumor-derived mutants, bind to Bcl2 via the DNA binding domain and induce mitochondrial permeabilization. J Biol Chem 2006; 281(13): 8600-8606. [ Links ]
69. Tsujimura S, Tanaka Y. Treatment strategy based on targeting P-glycoprotein on peripheral lymphocytes in patients with systemic autoimmune disease. Clin Exp Nephrol 2012; 16(1): 102-108. [ Links ]
70. Varaschin M, Wouters V, Soares T, Tokura V, Dias M. Tumor venéreo transmissível canino na região de Alfenas, Minas Gerais: formas de apresentação clínicopatológicas. Rev Clín Vet 2001; 32: 40- 48. [ Links ]
71. Vázquez M, Martínez S, Alarcón C, lagunes L, Fajardo R. The T963C mutation of TP53 gene does not participate in the clonal origin of canine TVT. Vet Res Commun 2008; 32(2): 187-191. [ Links ]
72. Walerych D, Napoli M, Collavin L, Del Sal G. The rebel angel: mutant p53 as the driving oncogene in breast cancer. Carcinogenesis 2012; 33(11): 2007- 2017. [ Links ]
73. Wang L, Song Y, Zheng W, Jiang L, Ma L. The association between polymorphisms in the MDR1 gene and risk of cancer: a systematic review and pooled analysis of 52 case-control studies. Cancer Cell International 2013; 13(1): 46 . [ Links ]
74. Warr JR, Bamford A, Quinn DM. The preferential induction of apoptosis in multidrug resistant B cells by 5-fluouracil. Cancer Lett 2002; 175: 39-44. [ Links ]
75. Zhou H, Chen J, Meagher J, Yang C, Aguilar A, et al. Design of Bcl-2 and Bcl-xL Inhibitors with Subnanomolar Binding Affinities Based upon a New Scaffold. J Med Chem 2012; 55(10): 4664-4682. [ Links ]
76. Vazquez A, Bond EE, Levine AJ, Bond GL. The genetics of the p53 pathway, apoptosis and cancer therapy Nature 2008; 7: 979-987. [ Links ]