Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina Veterinaria y Zootecnia
On-line version ISSN 1900-9607
Ces. Med. Vet. Zootec. vol.10 no.2 Medellín July/Dec. 2015
Effect of lovastatin on in vitro methane production and dry matter digestibility of kikuyu grass (Cenchrus clandestinus)¤
Efecto de la lovastatina sobre la producción de metano y la digestibilidad de la materia seca in vitro del pasto kikuyo (Cenchrus clandestinus)
Efeito da lovastatina na produção de metano e digestibilidade da matéria seca in vitro do capim kikuyu (Cenchrus clandestinus)
John Fredy Ramírez1, Zoot, MSc; Sandra Posada Ochoa1*, Zoot, PhD; Ricardo Rosero Noguera1, Zoot, PhD
¤ Para citar este artículo: Ramírez JF, Posada Ochoa SL, Rosero Noguera R. Efecto de la lovastatina sobre la producción de metano y la digestibilidad de la materia seca in vitro del pasto kikuyo (Cenchrus clandestinus) . Rev CES Med Zootec. 2015; Vol 10 (2): 111-121.
* Autor para correspondencia: Facultad de Ciencias Agrarias, Universidad de Antioquia, Escuela de Producción Agropecuaria. Carrera 75 No. 65 87 Medellín. E-mail: sandra. posada@udea.edu.co
1 Grupo de Investigación en Ciencias Agrarias (GRICA), Facultad de Ciencias Agrarias, Escuela de Producción Agropecuaria, Universidad de Antioquia, AA 1226, Medellín, Colombia
(Recibido: 31 de julio, 2015; aceptado: 20 de noviembre, 2015)
Abstract
Emissions of methane (CH4), from cattle rumen fermentation, have a negative impact on the environment and energy balance of animals, increasing global warming and reducing the energy retained, respectively. There is evidence that lovastatin inhibits methanogens growth without affecting other rumen microbial populations. The aim of this study was to determine the effect of increasing levels of lovastatin on in vitro CH4 production and dry matter digestibility (DMD) of kikuyu grass (Cenchrus clandestinus). It was used the in vitro gas production technique, incubing kikuyu grass of 45 days old with four levels of lovastatin (0, 0.01, 0.05, 0.10 mg/ml). At the end of 24 hours, gas and CH4 productions, DMD and fermentation profile was evaluated. A completely randomized design was used for data analysis, through the PROC MIXED SAS procedure. The highest level of lovastatin significantly reduced (p <0.05) the gas and CH4 productions and the DMD. The fermentation profile showed a tendency not defined in terms of levels evaluated, finding a higher concentration of VFA in the treatment 0.05 mg/ml. Although the lovastatin significantly reduces CH4 production, without affecting the DMD equally, this effect was evidenced with higher level than the reported in the literature. Perhaps the answer is conditioned to use of rumen fluid, contrasting with pure cultures of methanogens used in other studies.
Keywords: Global warming, isoprenoids, Methanobrevibacter, ruminal fermentation, statins. (Fuente: CAB).
Resumen
Las emisiones de metano (CH4), provenientes de la fermentación ruminal del ganado, tienen un impacto negativo sobre el ambiente y el balance energético de los animales, aumentando el calentamiento global y disminuyendo la energía retenida, respectivamente. Existe evidencia que la lovastatina inhibe el crecimiento de metanógenos sin afectar otras poblaciones microbianas del rumen. El objetivo de este trabajo fue determinar el efecto de niveles crecientes de lovastatina sobre la producción de CH4 y la digestibilidad de la materia seca (DMS) in vitro del pasto kikuyo (Cenchrus clandestinus). Fue empleada la técnica in vitro de producción de gas, incubando pasto kikuyo de 45 días de edad con cuatro niveles de lovastatina (0, 0.01, 0.05, 0.10 mg/ml). Al término de 24 horas se evaluó la producción de gas y de CH4, la DMS y el perfil de fermentación. Un diseño completamente aleatorizado fue utilizado para el análisis de los datos, a través del procedimiento PROC MIXED de SAS. El mayor nivel de lovastatina redujo significativamente (p<0,05) la DMS y la producción de gas y CH4. El perfil de fermentación no presentó una tendencia definida en función de los niveles evaluados, encontrando una mayor concentración de AGV en el tratamiento 0.05 mg/ml. Aunque se confirma que la utilización de lovastatina reduce significativamente la producción de CH4, sin afectar en igual medida la DMS, este efecto se evidenció con un nivel mayor al reportado por la literatura. Posiblemente la respuesta está condicionada a la utilización de líquido ruminal, contrastando con los cultivos puros de metanógenos empleados en otros estudios.
Palabras clave: Calentamiento global, estatinas, fermentación ruminal, isoprenoides, Methanobrevibacter (Fuente: CAB).
Resumo
As emissões de metano (CH4), produzido na fermentação ruminal do gado, tem um impacto negativo sobre o meio ambiente e o balanço energético dos animais, aumentando o aquecimento global e reduzindo a energia retida, respectivamente. Há evidências do que a lovastatina inibe o crescimento de metanógenos, sem afetar outras populações microbianas ruminais. O objetivo deste estudo foi determinar o efeito de níveis crescentes de lovastatina sobre a produção de CH4 e a digestibilidade da matéria seca (DMS) in vitro do capim kikuyu (Cenchrus clandestinus). Foi empregada a técnica in vitro de produção de gás, incubando capim kikuyu de 45 dias de idade com quatro níveis de lovastatina (0, 0.01, 0.05, 0.10 mg/ml). Depois de 24 horas, a produção de gás e de CH4, a DMS e o perfil de fermentação foi avaliado. Um delineamento inteiramente casualizado foi utilizado para a análise dos dados, através do procedimento PROC MIXED de SAS. O nível mais elevado de lovastatina reduziu significativamente (p<0,05) a DMS e a produção de gás e de CH4. O perfil de fermentação não mostrou uma tendência definida em função dos níveis avaliados, encontrando uma maior concentração de AGV no tratamento 0,05 mg/ml. Embora confirma-se que a utilização de lovastatina reduz significativamente a produção de CH4, sem afectar em igual medida a DMS, este efeito foi evidenciado a um nível maior do que o relatado na literatura. Talvez a resposta seja condicionada à utilização de líquido ruminal, contrastando com as culturas puras de methanogens utilizados em outros estudos.
Palavras chave: Aquecimento global, estatinas, fermentação ruminal, isoprenóides, Methanobrevibacter (Fuente: CAB).
Introducción
Desde la década de 1860, más de 500 billones de toneladas de gases de efecto invernadero (GEI) generados por la actividad humana han sido emitidos hacia la atmósfera, éstos incrementan la retención de energía proveniente del sol y conducen al aumento de la temperatura global4. De acuerdo con Lashof y Ahuja27, gases traza como el metano (CH4), óxido nitroso (N2O) y clorofluorocarbonos absorben más radiación infrarroja por molécula que el dióxido de carbono (CO2). Específicamente, el CH4 tiene un potencial de calentamiento global25 veces mayor que el CO2 43. Las emisiones globales de CH4 generadas por los rumiantes se estiman en 80 millones de toneladas/año 28, correspondientes aproximadamente al 25% de las emisiones totales de este gas a partir de la actividad humana 38. A nivel mundial, la agricultura representa el 20% del efecto invernadero antropogénico y produce alrededor del 50% de las emisiones de CH4, principalmente desde la fermentación entérica y la producción de arroz 20. Para el año 2005, la agricultura fue responsable del 10-12% de las emisiones globales de GEI diferentes al CO2, entre las cuales el CH4 entérico representó el 32%. Para el año 2030, se estima que las emisiones de CH4 derivadas de la actividad ganadera incrementarán 60%, en proporción directa al aumento proyectado en el número de animales 9.
Además de las consideraciones ambientales, el CH4producido en el rumen constituye una pérdida importante de la energía consumida por los rumiantes, estimada entre el 2 al 12% 19, lo que afecta adversamente el desempeño animal. Sin embargo, a pesar de los impactos negativos sobre la temperatura global y el balance energético del animal, la producción de CH4 es el principal mecanismo para mantener una baja presión de hidrogeno (H2) en el rumen y con ello, favorecer el proceso fermentativo 18, lo cual fue demostrado por Hino et al. 11. Los autores evidenciaron que Ruminococcus albus, un organismo productor de H2, aumentó la degradación de la celulosa cuando fue co-cultivado con metanógenos.
Existen varias estrategias para reducir las emisiones entéricas de CH4 33. Una forma efectiva consiste en el aumento del nivel productivo de los animales, particularmente en aquellas zonas del mundo donde la mayoría de las dietas tienen un alto contenido de fibra 21. También la utilización de lípidos 7 y de ionóforos 40 permiten alcanzar este propósito; sin embargo, estos compuestos tienden a deprimir la digestión de la fibra mediante la inhibición de la actividad de bacterias celulolíticas como Ruminococcus albus y Ruminococcus flavefaciens 11. Lo anterior supone la necesidad de evaluar otras estrategias que reduzcan la producción de CH4 sin afectar negativamente la degradación de la fibra.
Alternativamente, Miller y Wolin 32 propusieron mitigar la producción ruminal de CH4 con la adición de inhibidores de la enzima 3-hidroxi-3-metilglutaril coenzima A (HMG-CoA) reductasa. Entre los inhibidores se encuentran las estatinas, medicamentos utilizados para disminuir los niveles de colesterol en humanos 6. La enzima HMG-CoA reductasa cataliza la conversión de HMG-CoA a mevalonato, en uno de los pasos para la síntesis de colesterol y otros isoprenoides, reacción que es competitivamente inhibida por las estatinas debido a su similitud estructural con la HMG-CoA 8. Miller y Wolin 32 descubrieron que los inhibidores de la enzima HMG-CoA reductasa, mevastatina y lovastatina, inhiben el crecimiento in vitro de cepas de Metanobrevibacter al provocar lesiones en la membrana que afectan la eficiencia en la síntesis de ATP en estos microrganismos 35. Esto se debe a que la composición de la membrana celular de los metanógenos difiere sustancialmente de la membrana de las bacterias 23; mientras la membrana de los metanógenos está constituida por isoprenoides, la de las bacterias está construida por ácidos grasos, de allí que las estatinas no afectan negativamente a las bacterias ruminales 47.
Los trabajos iniciales con estatinas fueron realizados in vitro con formas puras del inhibidor y cultivos puros de cepas metanogénicas y eubacterias del rumen 32, 47, encontrando que dosis muy pequeñas (4 mg/L) resultaron efectivas para reducir el crecimiento de microorganismos metanogénicos. A partir de allí se suscitaron varias inquietudes relacionadas con su efectividad en un ecosistema compuesto por una compleja comunidad anaeróbica y otras formas de suministro del inhibidor que resultarán más económicas, tales como el tratamiento de paja de arroz con Aspergillus terreus y Monascus ruber, reconocidos hongos productores de lovastatina 25.
En el trabajo de Soliva et al. 41, usando fluido ruminal y RUSITEC, el empleo de 150 mg/L de lovastatina disminuyó la producción de CH4 un 42%. Usando la técnica in vitro de producción de gas, Jahromi et al. 17 evaluaron el tratamiento de paja de arroz con Aspergillus terreus, encontrando que la tasa de producción de CH4(mL/h) se redujo entre 14.7 y 29.4% en función del nivel de lovastatina incorporado. En experimentos in vivo, Morgavi et al. 34 evaluaron el potencial del arroz fermentado con Monascus sp. en ovejas, hallando que la producción de CH4 se redujo 30% y se mantuvo durante el período de suministro. Contrariamente, Ramírez-Restrepo et al. 39 encontraron que si bien el consumo de arroz fermentado con Monascus sp. disminuyó la producción de CH4 al inicio del estudio, el efecto fue temporal y posiblemente asociado con la adaptación ruminal. Igualmente Klevenhusen et al. 22 encontraron que la lovastatina (80 mg/kg de materia seca (MS) de la dieta) no redujo la producción diaria de CH4 en ovejas.
Se observa que la investigación sobre los inhibidores específicos, categoría en la cual se encuentran las estatinas, es relativamente reciente, existiendo la necesidad de continuar evaluando las dosis que efectivamente reducen la metanogénesis ruminal (eficiencia biológica) sin alterar la digestibilidad de la MS, tomando en consideración los resultados contrastantes reportados en la literatura. Este aspecto, sumado al estudio de efectos adversos sobre la salud animal e impacto económico, serán la base para proponer el empleo de estos inhibidores en el desarrollo de novedosos aditivos alimenticios 29. Este trabajo es uno de los pocos que utiliza fluido ruminal (diversidad microbiana) en lugar de cultivos puros y que además emplea como sustrato para la incubación un pasto de trópico de altura, que presenta mayor calidad nutricional que los sustratos empleados en otros estudios. Por tanto, el objetivo del presente trabajo fue determinar el efecto de la utilización de lovastatina sobre la metanogénesis y la digestibilidad de la MS in vitro del pasto kikuyo (Cenchrus clandestinus).
Materiales y métodos
Localización
El experimento se realizó en el Laboratorio de Investigación en Nutrición y Alimentación Animal (NUTRILAB), adscrito al Grupo de Investigación en Ciencias Agrarias (GRICA). Este laboratorio se encuentra ubicado en la Sede de Investigación Universitaria (SIU) de la Universidad de Antioquia (U de A), Medellín - Colombia, a 1540 msnm y presenta una temperatura controlada de 24 ºC.
Sustrato incubado y análisis químico
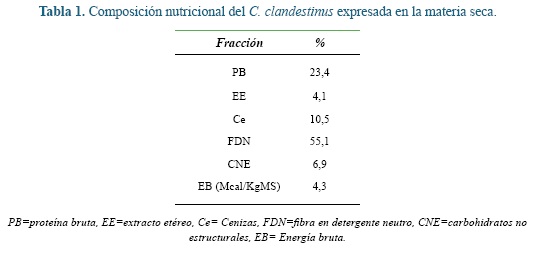
Como sustrato para el proceso de fermentación in vitro se utilizó C. clandestinus. Este material fue cosechado a los 45 días de rebrote en la hacienda La Montaña, propiedad de la Universidad de Antioquia, que se encuentra ubicada en el municipio de San Pedro de los Milagros (Antioquia, Colombia) en una zona de vida bosque húmedo montano bajo (bh-MB) 12. El pasto fue secado en estufa de ventilación forzada a 65°C por 48 horas y posteriormente molido a 1 mm para su análisis químico, que incluyó MS, proteína bruta (PB), extracto etéreo (EE), cenizas (Ce) 2, fibra en detergente neutro (FDN) 46 y energía bruta (EB) con bomba calorimétrica 14. Los carbohidratos no estructurales (CNE) fueron obtenidos por la ecuación CNE= 100-(%PB+%EE+%Cenizas+%FDN)5. La descripción nutricional del pasto se presenta en la tabla 1.
Técnica de Producción de gases
La técnica de producción de gases fue realizada siguiendo los protocolos de Posada et al. 36. La incubación se realizó en frascos de vidrio con capacidad de 100 ml. En cada frasco se adicionó 0,5 g de pasto seco y molido a 1 mm.
Tres inóculos ruminales fueron obtenidos de vacas Holstein Friesian adultas, no gestantes, no lactantes, pertenecientes a la hacienda La Montaña de la Universidad de Antioquia. La dieta de los animales donadores fue C. clandestinus, sal mineralizada y agua a voluntad. Los inóculos se colectaron en la mañana (6 horas) y su transporte hasta el laboratorio se realizó en termos precalentados con agua a 38 ºC. En el laboratorio, los inóculos fueron filtrados a través de mallas de algodón, gaseados con CO2 y conservados en baño maría durante el proceso de inoculación.
La solución tampón (buffer) se preparó de acuerdo con las recomendaciones de McDougall 31 y en los frascos se mezcló con el inóculo ruminal en proporción 9/1, respectivamente (45/5, ml/ml). Conjuntamente con la inoculación, en cada frasco de incubación se adicionaron 0.4 ml de una solución lovastatina-etanol, que se preparó de acuerdo con los requerimientos de cada tratamiento experimental (solución 1, 2 o 3, que se describen en el aparte tratamientos experimentales). Para el tratamiento sin adición de lovastatina solamente se incluyeron 0.4 ml de una solución de etanol al 95%. Seguidamente, los frascos fueron cerrados con tapones de caucho, sellados con agrafe de aluminio y almacenados en estufa de ventilación forzada a 39 ºC durante 24 h.
En total se incubaron 102 frascos; 96 con sustrato e inóculo (4 tratamientos * 3 inóculos * 8 réplicas/ inóculo) y 6 correspondientes a los blancos (3 inóculos * 2 réplicas), que contenían solución tampón e inóculo pero no sustrato, con el propósito de corregir los datos de degradación de la MS y de presión de gas a partir de los valores generados por el inóculo 44.
Tratamientos experimentales
Se evaluaron cuatro tratamientos experimentales, correspondientes a diferentes concentraciones de lovastatina, a saber: 0, 0,01, 0,05 y 0,10 mg/ml de la mezcla buffer-inóculo. Las concentraciones fueron definidas a partir de los trabajos reportados por Soliva et al. 41 y Jahromi et al. 16. Cada tratamiento contó con tres (3) repeticiones, correspondientes a tres (3) diferentes fuentes de inóculo.
Como fuente de lovastatina fue empleado un producto comercial que garantiza 20 mg de principio activo por unidad (comprimido). Para obtener la solución de mayor concentración de lovastatina (solución 1), correspondiente al tratamiento con 5 mg/50 ml de mezcla buffer-inóculo (cantidad de mezcla presente en cada frasco de incubación), 15,5 comprimidos fueron finamente pulverizados antes de ser diluidos en 25 ml de etanol al 95% (vol/vol). Para preparar la solución 2, correspondiente al tratamiento de concentración intermedia de lovastatina (2,5 mg/50 ml mezcla) se diluyeron 12,5 ml de solución 1 en 12,5 ml de etanol. Finalmente, para lograr la menor concentración de lovastatina (0,5 mg/50 ml mezcla), 5 ml de solución 2 se mezclaron con 20 ml de etanol, obteniendo la solución 3. En la preparación de las soluciones 1, 2 y 3 se empleó balón volumétrico.
Determinación de la producción de gas y de CH4
La producción total de gas y de CH4 fue determinada luego de 24 h de incubación. La presión generada en los frascos de incubación se midió con un transductor digital (Ashcroft 2089QG - Precision Digital Test Gauges, USA) y el valor obtenido (psi) fue transformado a volumen (ml) con la ecuación: Y = -0,1833 + 5,2098X + 0,0598X2 36. Luego de la lectura de presión, la totalidad del gas generado en los frascos de incubación fue retirado con una jeringa plástica y almacenado en bolsas plásticas herméticamente selladas para posterior análisis de CH4por cromatografía gaseosa. Para tal efecto, muestras de 100 µl del gas fueron inyectadas manualmente en un cromatógrafo de gases Thermo Trace GC Ultra (Thermo Scientific, USA) adaptado con un detector de ionización de llama (FID). Las condiciones cromatográficas fueron adaptadas de Apráez et al. 1 y correspondieron a una columna apolar de 30 m, 0,32 mm y 0,25 μm, temperatura del puerto de inyección 200 °C, modo de inyección split 50:1, temperatura del detector 250 °C, temperatura del horno 30 °C (5 min) hasta completar 200 °C (30 °C/min) y helio como gas de arrastre (1 ml/min). Los datos de concentración de CH4 fueron procesados de acuerdo con la descripción de López y Newbold 30.
La producción de CH4 (ml) fue calculada a partir del volumen total de gas (ml) y la concentración de CH4. La producción de gas y de CH4 (ml) se expresó por gramo de MS incubada (MSi) y por gramo de MS degradada (MSd). Adicionalmente, la producción de CH4 se presentó como porcentaje de la EB incubada (EBi) y como porcentaje de la energía digestible incubada (EDi). La EDi se obtuvo al multiplicar la EBi por el porcentaje de digestibilidad de la MS, en tanto la pérdida energética a través del CH4se estimó multiplicando la producción de este gas por su calor de combustión, reportado en 9,45 kcal/L por Islam et al. 15.
Determinación de la digestibilidad de la materia seca
Transcurridas las 24 horas de incubación, se determinó la digestibilidad de la materia seca (DMS) por gravimetría. Para esto, el contenido de los frascos de incubación se filtró utilizando crisoles de vidrio (porosidad 1, 100 - 160 μm) con ayuda de bomba de vacío. El conjunto crisol-residuo fue secado en estufa de ventilación forzada a 60ºC por 48 horas y posteriormente pesado. La MS degradada se calculó como: (1-((MS - MS)/residuoblanco)) x 100, donde MSresiduo es la MS no degradada MSoriginal a las 24 horas, MSblanco es la MS no degradada de los frascos blanco en ese mismo tiempo y MS es la MSoriginal incubada.
Determinación del perfil de fermentación
La concentración de ácidos grasos volátiles (AGV), acético, propiónico y butírico, se determinó en el líquido resultante de la filtración. Este líquido se preservó mediante la adición de ácido sulfúrico (98% v/v) hasta alcanzar un pH≈ 2 y luego se centrifugó varias veces a 4000 rpm hasta no observar presencia de residuos en el sobrenadante. Para la determinación de AGV, muestras de 1 μl de líquido se inyectaron en un cromatógrafo de gases Thermo Trace GC Ultra (Thermo Scientific, USA) equipado con un detector FID y una columna de 30 m, 0,32 mm y 0,25 μm. Las temperaturas del inyector y del detector fueron 210 °C y 300 °C, respectivamente; para el horno, la temperatura inicial fue de 68 °C (1 min), luego aumentó 10 °C/min hasta alcanzar 140 °C (1 min), y posteriormente 40 °C/min hasta alcanzar 200 °C (1 min). El modo de inyección fue split y como gas de arrastre se utilizó helio (2,5 ml/min). La concentración de AGV (mmol/L) fue calculada a partir de la concentración (ppm) determinada por cromatografía y asumiendo una masa molar de 60,05, 74,08 y 88,11 g/mol para el ácido acético, propiónico y butírico, respectivamente.
Análisis estadístico
Un análisis completamente aleatorizado fue realizado a través del procedimiento PROC MIXED del paquete estadístico SAS 42. El efecto fijo en el modelo correspondió al tratamiento experimental (cuatro niveles de lovastatina) y el efecto aleatorio al inóculo ruminal.
Las medias de tratamientos fueron comparadas con ayuda del procedimiento PROC LSMEANS del paquete estadístico SAS 42. El nivel significancia fue del 5%.
Resultados
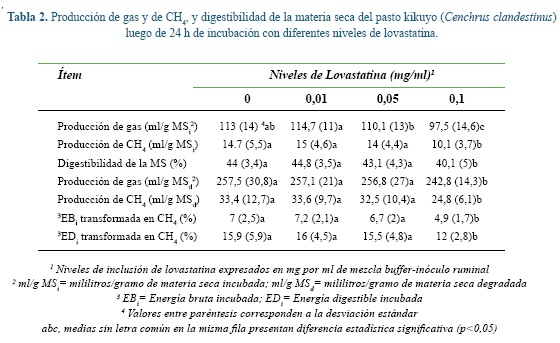
En la tabla 2 se presenta el efecto de diferentes niveles de lovastatina sobre la producción de gas y de CH4 y sobre la DMS. Se observa que sólo uno de los niveles de adición de lovastatina (0,1 mg/ml) redujo significativamente (p<0,05) la DMS (%), la producción de gas (ml/g MSd) y de CH4 (ml/g MSi, ml/g MSd) y la proporción de EBi y EDi que se transformó en CH4. La única excepción a este comportamiento se registró en la producción de gas respecto la MSi, donde además de la inferioridad registrada para el mayor nivel de lovastatina, los tratamientos correspondientes a 0,05 y 0,01 mg lovastatina/ml también difirieron estadísticamente entre ellos.
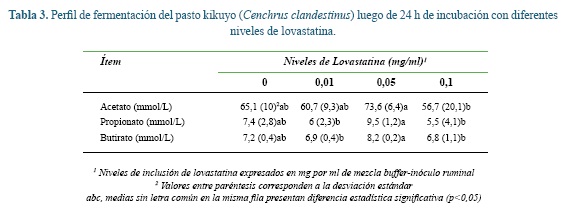
En la tabla 3 se presenta el perfil de fermentación
del pasto C. clandestinus incubado en un medio con concentraciones variables de lovastatina. Para los tres AGV, el nivel de inclusión de lovastatina de 0,05 mg/ ml fue estadísticamente superior a 0,1 mg/ml. Sólo se registró diferencia en la concentración de propionato y butirato entre los niveles 0,01 y 0,05 mg/ml, nuevamente a favor del último tratamiento.
Discusión
Lam y Doolittle 26 indicaron que la enzima HMG-CoA reductasa presente en los metanógenos es inhibida por la lovastatina, sustancia que afecta la producción de isoprenoides necesarios para la formación de la membrana celular en estos microrganismos, inhibiendo su crecimiento y metanogénesis. En el presente estudio, la utilización de una dosis de lovastatina equivalente a 0.1 mg/ml redujo la producción de CH4 por unidad de MSiy MSd (30,8 y 25,3%, respectivamente), posiblemente como consecuencia del efecto tóxico que tiene este medicamento sobre las poblaciones metanogénicas. Soliva et al. 41, evaluando una dosis de 0,15 mg/ml, encontraron una reducción de 42% en la producción de CH4 (mmol/d).
La concentración intermedia utilizada en el presente trabajo (0,05 mg/ml) no mostró reducciones en la producción de CH4. Existen evidencias del efecto de la lovastatina sobre los metanógenos y la producción de CH4 a dosis próximas e inferiores a 0,01 mg/ml, que correspondió a la menor concentración evaluada en este trabajo. Miller y Wolin 32 lograron inhibición completa del crecimiento de metanógenos utilizando mevastatina y lovastatina a niveles de 0,004 mg/ml. Jahromi et al. 16 reportaron reducción en el crecimiento de metanógenos y en la producción de CH4 desde un nivel de 0,001 mg/ ml de lovastatina. Nováková et al. 35 encontraron una reducción del 83% en el crecimiento de metanógenos y del 43,9% en la producción de CH4 en presencia de pravastatina a un nivel de 0,02 mg/ml. La contradicción entre los resultados experimentales de estos trabajos y los obtenidos en el presente estudio, aun empleando dosis más elevadas de lovastatina, puede estar dada por diferencias en las condiciones experimentales, ya que los autores que reportan efectos con bajos niveles de estatinas realizaron sus evaluaciones en cultivos puros de metanógenos, mientras que en el presente trabajo, la producción de CH4 fue evaluada en un cultivo mixto usando liquido ruminal como fuente de inóculo. Esto también fue reportado por Busquet et al. 3, quienes no encontraron efectos de la utilización de una dosis de 0,005 mg/ml de lovastatina sobre la producción de CH4en incubación con líquido ruminal. En pruebas in vivo realizadas por Klevenhusen et al. 22 no se encontró efecto de la lovastatina sobre la producción CH4, lo que hace suponer la existencia de un mecanismo a través del cual las poblaciones microbianas no-metanogénicas pueden reducir la efectividad de las estatinas.
Se ha reportado que las estatinas no afectan negativamente a las bacterias ruminales porque las membranas celulares de éstas se componen por ácidos grasos y no por isoprenoides, como las membranas de los metanógenos 47, esto hace suponer que la adición de estas sustancias no debe afectar la DMS. No obstante, en el presente trabajo se observó que la adición de lovastatina a un nivel de 0,1 mg/ml redujo significativamente la DMS, lo cual podría estar relacionado con la disminución en la producción de CH4 por gramo de MSi y MSd. No obstante, mientras la producción de CH4 por gramo de MSd se redujo 25,3% en el tratamiento con 0,10 mg/ml, respecto los demás niveles evaluados, la DMS sólo se redujo 8,8%. Esto indica que la disminución en la producción de CH4 observada en el presente trabajo no puede ser totalmente atribuida a la reducción en la DMS, sino al efecto que tienen las estatinas sobre el crecimiento de los metanógenos. De otra parte, en el trabajo de Jahromi et al. 17 se evidenció un aumento en la digestibilidad in vitro de la MS cuando el sustrato incubado fue previamente fermentado con hongos productores de lovastatina, respecto el sustrato sin fermentar. Ese efecto puede ser explicado porque el hongo A. terreus es productor de enzimas celulolíticas, complementando la degradación de la lignocelulosa 16.
Debido a su capacidad para afectar selectivamente los metanógenos, los inhibidores de la enzima HMG-CoA reductasa tienen un excelente potencial para modificar la fermentación ruminal, pues los electrones producidos durante la fermentación de los polisacáridos y que terminan en la formación de CH4, podrían estar disponibles para la formación de productos reducidos como propionato o butirato 32. La generación de estos productos reducidos, no gaseosos, conservaría entre 6% a 13% de la energía que pierde el animal como CH4 y aumentaría la eficiencia de la utilización del alimento 47. En el presente estudio fue evidente la reducción de la pérdida energética en forma de CH4 respecto la EBi y la EDi. En el tratamiento con 0,1 mg/ml, la pérdida de EBi en forma de CH4 se redujo 29,6%, en tanto la pérdida de EDifue 24,1% inferior. La extensión en la cual la energía del alimento es convertida en CH4 se denota como Ym y de acuerdo con el IPCC 13 corresponde a 6,5%. Los valores de Ym en el presente trabajo estuvieron ligeramente por encima de este valor (entre 6,7% y 7,2%), excepto para el tratamiento con mayor inclusión de lovastatina, donde fue 4,9%. Con respecto a la EDi, las pérdidas energéticas a través del CH4 fluctuaron entre 12% y 16%, estando por encima del rango descrito por Van Soest 45, entre el 5% y 12%.
En cuanto al efecto de la lovastatina sobre el perfil de fermentación, Morgavi et al. 34 encontraron que el extracto del hongo M. ruber, el cual contiene estatinas, incrementó la proporción de propionato y butirato y redujo la de acetato, lo cual estuvo asociado con la reducción en la producción de CH4. Estos resultados contrastan con los reportados por Busquet et al. 3 y Soliva et al. 41. Los primeros autores no evidenciaron efecto de la adición de lovastatina sobre el perfil de fermentación; los segundos, encontraron que la lovastatina aumentó la proporción de acetato (7,3%) y disminuyó la de propionato (24,1%), mientras la proporción de butirato permaneció constante. Jahromi et al. 17 también encontraron que el extracto de la paja de arroz fermentada por hongos produjo más AGV que el control, principalmente acetato. En el presente trabajo no se observó un patrón claro de respuesta en el perfil de fermentación en función de los niveles de lovastatina evaluados. El incremento en la producción de acetato, observado en aquellos estudios donde se reduce la metanogénesis, puede ser explicado por el aumento en el flujo de electrones hacia el CO2 para la formación de este AGV, proceso en el cual participan bacterias acetogénicas (reductoras de CO2) presentes en el rumen10, 37.
Si se tiene en cuenta que el valor comercial de la lovastatina , peso molecular 404.55 g/mol) producida por (C24H36O5 la industria farmacéutica (99% pureza) fluctúa entre USD$200 y 250/kg, la dosis diaria efectiva de 0,1 mg/ ml (100 mg/L) obtenida en este trabajo correspondería a 7 g -en un bovino con 70 L de contenido ruminal 32-y un costo entre USD$1,4 y 1,75 USD. En este sentido la utilización de lovastatina pura no es una alternativa económicamente viable para reducir las emisiones de CH4y debe ser sustituida por la administración de lovastatina a partir de sustratos fermentados por hongos17, 24, 25. Con respecto a la utilización de estos sustratos, Morgavi et al. 34 observaron que las emisiones de CH4 disminuyeron significativamente (30%) sin afectar la fermentación ruminal. Estos investigadores también encontraron una reducción del número de metanógenos ruminales en animales que recibieron alimentos fermentados por M. ruber, sin efectos negativos sobre las poblaciones de bacterias y protozoos. Jahromi et al. 17 reportaron que la paja de arroz fermentada por A. terreus redujo la producción de CH4 in vitro en comparación con la paja del arroz sin fermentar, resultado contrastante con el obtenido por Ramírez-Restrepo et al. 39 in vivo, quienes encontraron que el consumo del sustrato fermentado con Monascus sp. sólo fue efectivo al inicio del estudio. Si bien la literatura plantea la posibilidad de usar la lovastatina como estrategia para reducir las emisiones de CH4, es necesario realizar más investigaciones in vitro que permitan dilucidar cuáles son los niveles que consistentemente presentan un efecto positivo con diferentes sustratos alimenticios, antes de extrapolar su utilización en alimentación animal. El empleo de sustratos fermentados por hongos productores de lovastatina no solamente se muestra como una alternativa económicamente viable, sino que además puede mejorar la digestibilidad de la fibra gracias a la producción de enzimas celulolíticas por parte de estos microorganismos, lo que refuerza la importancia de profundizar en esta línea de investigación con miras a su escalamiento a nivel tecnológico y comercial.
En el presente trabajo, la producción de CH4 y la DMS sólo fueron afectadas con un nivel de inclusión de lovastatina de 0,1 mg/ml, que es mayor a otros niveles reportados en la literatura. Posiblemente la respuesta está condicionada a la diversidad microbiana asociada con la utilización de líquido ruminal (cultivo mixto) en el sistema in vitro, contrastando con los cultivos puros de metanógenos empleados en otros trabajos. Esto demanda la realización de estudios tendientes a comprender cuales son los mecanismos que reducen la efectividad de las estatinas cuando se utilizan en cultivos microbianos mixtos. Igualmente, más estudios in vitro son necesarios para encontrar una dosis que consistentemente reduzca la emisión de CH4 con diferentes sustratos alimenticios antes de evaluar su efecto in vivo.
La efectividad biológica no es el único criterio para escalar el uso de compuestos antimetanogénicos en la alimentación animal. El impacto económico de la suplementación también deber ser valorado frente a la utilización de otros compuestos que actualmente representan tecnologías aceptadas en la industria de alimentos para rumiantes. Si un aditivo es económico, el grado de variabilidad en la respuesta antimetanogénica será el principal limitante para su utilización. No obstante, la lovastatina, como tecnología costosa, deberá presentar un elevado grado de consistencia en la respuesta animal. Toda vez que la administración del principio puro es costosa, se hace necesario profundizar en la efectividad del suministro a través de sustratos fermentados por hongos, lo cual adicionalmente puede mejorar la DMS gracias a la producción de enzimas celulolíticas por parte de estos microorganismos.
Agradecimientos
Los autores agradecen a la Estrategia de Sostenibilidad 2016-2017 (CODI, Universidad de Antioquia, Colombia).
Referencias
1. Apráez JE, Delgado JM, Narváez JP. Composición nutricional, degradación in vitro y potencial de producción de gas, de herbáceas, arbóreas y arbustivas encontradas en el trópico alto de Nariño. Livest Res Rural Dev 2012; 24(3); [acceso: 20 de mayo de 2014]. URL: http://www.lrrd.org/lrrd24/3/apra24044.htm. [ Links ]
2. Association of Official Analytical Chemist-AOAC. Official Methods of Analysis. 15 ed. Arlington, Virginia. 1990. 1141 p. [ Links ]
3. Busquet M, Calsamiglia S, Ferret A, Carro MD, Kamel C. Effect of garlic oil and four of its compounds on rumen microbial fermentation. J Dairy Sci 2005; 88(12): 4393-4404. [ Links ]
4. Cuomo CJ. Climate change, vulnerability, and responsibility. Hypatia 2011; 26(4): 690-714. [ Links ]
5. Detmann E, Valadares Filho SC. On the estimation of non-fibrous carbohydrates in feeds and diets. Arq Bras Med Vet Zootec 2010; 62(4): 980-984. [ Links ]
6. Endo A. The origin of the statins. Atheroscler Suppl 2004; 5(3): 125-130. [ Links ]
7. Eugene M, Massé D, Chiquette J, Benchaar C. Metaanalysis on the effects of lipid supplementation on methane production in lactating dairy cows. Can J Anim Sci 2008; 88(2): 331-337. [ Links ]
8. Friesen JA, Rodwell VW. The 3-hydroxy-3methylglutaryl coenzyme-A (HMG-CoA) reductases. Genome Biol 2004; 5(11): 248. [ Links ]
9. Grainger C, Beauchemin KA. Can enteric methane emissions from ruminants be lowered without lowering their production?. Anim Feed Sci Technol 2011; 166-167: 308-320. [ Links ]
10. Greening RC, Leedle JAZ. Enrichment and isolation of Acetitomaculum ruminis, gen. nov, sp. nov: acetogenic bacteria from the bovine rumen. Arch Microbiol 1989; 151(5): 399-406. [ Links ]
11. Hino T, Miwa T, Saitoh H, Esaki H, Takagi S, et al. Effect of methane production on plant fiber digestion by rumen microorganisms. Bull Agric Meiji Univ 1995; 106: 27-33. [ Links ]
12. Holdridge LR. Life Zone Ecology. 1a. ed. Costa Rica: Tropical Science Center; 1967; [acceso: 16 de enero de 2015]. URL: http://www.fs.fed.us/psw/topics/ecosystem_processes/tropical/restoration/lifezone/holdridge_triangle/holdridge_pub.pdf.
13. Intergovernmental Panel on Climate Change-IPCC. Guidelines for National Greenhouse Gas Inventories. 2006; [acceso: 27 de septiembre de 2015]. URL: http://www.ipcc-nggip.iges.or.jp/public/2006gl/vol4. [ Links ]
14. International Standards Organization-ISO. ISO Norms. Determination of gross caloric value: bomb calorimeter method (9831). Switzerland: ISO; 1998.
15. Islam M, Abe H, Hayashi Y, Terada F. Effects of feeding Italian ryegrass with corn on rumen environment, nutrient digestibility, methane emission, and energy and nitrogen utilization at two intake levels by goats. Small Ruminant Res 2000; 38(2): 165-174. [ Links ]
16. Jahromi MF, Liang JB, Ho YW, Mohamad R, Goh YM, et al. Lovastatin in Aspergillus terreus: Fermented rice straw extracts interferes with methane production and gene expression in Methanobrevibacter smithii. Biomed Res Int 2013a; [acceso: 27 de enero de 2014]. URL: http://dx.doi.org/10.1155/2013/604721. [ Links ]
17. Jahromi MF, Liang JB, Mohamad R, Goh YM, Shokryazdan P, et al. Lovastatin-enriched rice straw enhances biomass quality and suppresses ruminal methanogenesis. Biomed Res Int 2013b; [acceso: 12 octubre de 2014]. URL: http://dx.doi.org/10.1155/2013/397934. [ Links ]
18. Janssen PH. Influence of hydrogen on rumen methane formation and fermentation balances through microbial growth kinetics and fermentation thermodynamics. Anim Feed Sci Technol 2010; 160(1): 1-22. [ Links ]
19. Johnson DE, Hill TM, Ward GM, Johnson KA, Branine ME, et al. Principle factors varying methane emissions from ruminants and other animals. In: Khalil MAK. Atmospheric Methane: Sources, sinks, and role in global change. Germany: Springer-Verlag; 1993. p.199-229.
20. Kebreab E, Clark K, Wagner-Riddle C, France J. Methane and nitrous oxide emissions from Canadian animal agriculture: a review. Can J Anim Sci; 2006; 86, 135-158. [ Links ]
21. Kirchgessner M, Windisch W, Müller HL. Nutritiona factors for the quantification of methane production. In: Engelhardt WV, Leonhard-Marek S, Breves G, Giesecke D. Ruminant physiology: digestion, metabolism, growth and reproduction. Proceedings 8th International Symposium on Ruminant Physiology; 1995. p. 333-348. [ Links ]
22. Klevenhusen F, Duval S, Zeitz JO, Kreuzer M, Soliva CR. Diallyl disulphide and lovastatin: effects on energy and protein utilisation in, as well as methane emission from, sheep. Arch Anim Nutr 2011; 65(4): 255-266. [ Links ]
23. Koga Y, Morii H. Recent advances in structural research on ether lipids from archaea including comparative and physiological aspects. Biosci Biotechnol Biochem 2005; 69(11): 2019-2034. [ Links ]
24. Lai LST, Pan CC, Tzeng BK. The influence of medium design on lovastatin production and pellet formation with a high-producing mutant of Aspergillus terreus in submerged cultures. Process Biochem 2003; 38(9): 1317-1326. [ Links ]
25. Lai LST, Tsai TH, Wang TC, Cheng TY. The influence of culturing environments on lovastatin production by Aspergillus terreus in submerged cultures. Enzyme Microb Technol 2005; 36: 737-748. [ Links ]
26. Lam WL, Doolittle WF. Mevinolin-resistant mutations identify a promoter and the gene for a eukaryote-like 3-hydroxy-3-methylglutaryl-coenzyme A reductase in the archaebacterium Haloferax volcanii. J Biol Chem 1992; 267(9): 5829-5834. [ Links ]
27. Lashof DA, Ahuja DR. Relative contributions of greenhouse gas emissions to global warming. Nature 1990; 344: 529 - 531. [ Links ]
28. Lima MA. Emissão de Gases de Efeito Estufa. Biotecnologia Ciênc Desenvolv 2000; 3(17): 38-43. [ Links ]
29. Liu H, Wang J, Wang A, Chen J. Chemical inhibitors of methanogenesis and putative applications. Appl Microbiol Biotechnol 2011; 89:1333-1340. [ Links ]
30. López S, Newbold CJ. Analysis of Methane. In: Makkar HPS, Vercoe PE. Measuring methane production from ruminants. Austria: International Atomic Energy Agency; 2007. p 1-13.
31. McDougall EI. Studies on ruminant saliva. 1. The composition and output of sheep's saliva. Biochem J 1948; 43(1): 99-109. [ Links ]
32. Miller TL, Wolin MJ. Inhibition of growth of methaneproducing bacteria of the ruminant forestomach by hydroxymethylflutaryl-SCoA reductase inhibitors. J Dairy Sci 2001; 84: 1445-1448. [ Links ]
33. Mitsumori M, Sun W. Control of rumen microbial fermentation for mitigating methane emissions from the rumen. Asian-Aust J Anim Sci 2008; 21(1): 144-154. [ Links ]
34. Morgavi DP, Martin C, Boudra H. Fungal secondary metabolites from Monascus spp. reduce rumen methane production in vitro and in vivo. J Anim Sci 2013; 91(2): 848-860. [ Links ]
35. Nováková Z, Blaško J, Hapala I, Šmigáň P. Effects of 3-hydroxy-3-methylglutaryl-coenzyme a reductase inhibitor pravastatin on membrane lipids and membrane associated functions of Methanothermobacter thermautotrophicus. Folia Microbiol 2010; 55(4): 359-362.
36. Posada SL, Noguera R, Bolívar D. Relación entre presión y volumen para la implementación de la técnica in vitro de producción de gases. Rev Colomb Cienc Pec 2006; 19(4): 407-414. [ Links ]
37. Ragsdale SW, Pierce E. Acetogenesis and the Wood-Ljungdahl pathway of CO2 fixation. Biochim Biophys Acta 2008; 1784(12): 1873-1898. [ Links ]
38. Ramin M, Huhtanen P. Development of equations for predicting methane emissions from ruminants. J. Dairy Sci 2013; 96(4):2476-2493. [ Links ]
39. Ramírez-Restrepo CA, O´Neill CJ, López-Villalobos N, Padmanabha J, McSweeney C. Tropical cattle methane emissions: the role of natural statins supplementation. Anim Prod Sci 2014; 54(9): 12941299. [ Links ]
40. Russell JB, Strobel HJ. Effect of ionophores on ruminal fermentation. Appl Environ Microbiol 1989; 55(1): 1-6. [ Links ]
41. Soliva CR, Amelchanka SL, Duval SM, Kreuzer M. Ruminal methane inhibition potential of various pure compounds in comparison with garlic oil as determined with a rumen simulation technique (Rusitec). Br J Nutr 2011; 106(1): 114-122. [ Links ]
42. Statistical Analysis System - SAS. SAS® University Edition. USA: SAS Institute Inc, 2015 [acceso: 16 de enero de 2015]. URL: http://www.sas.com/en_us/software/university-edition.html.
43. Storm IM, Hellwing AL, Nielsen NI, Madsen J. Methods for measuring and estimating methane emission from ruminants. Animals 2012; 2: 160-183. [ Links ]
44. Theodorou MK, Williams BA, Dhanoa MS, McAllan AB, France J. A simple gas production method using a pressure transducer to determine the fermentation kinetics of ruminant feeds. Anim Feed Sci Technol 1994; 48(3-4): 185-197. [ Links ]
45. Van Soest PJ. Nutritional ecology of the ruminant. USA: Cornell University Press; 1994.
46. Van Soest PJ, Robertson JB, Lewis BA. Methods for dietary fiber, neutral detergent fiber and non-starch polysaccharide in relation to animal nutrition. J Dairy Sci 1991; (74): 3583-3597. [ Links ]
47. Wolin MJ, Miller TL. Control of rumen methanogenesis by inhibiting the growth and activity of methanogens with hydroxymethylglutaryl-SCoA inhibitors. Int Congr Ser 2006; 1293: 131-137. [ Links ]