Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina Veterinaria y Zootecnia
On-line version ISSN 1900-9607
Ces. Med. Vet. Zootec. vol.10 no.2 Medellín July/Dec. 2015
Adding probiotic strains modulates intestinal mucin secretion in growing pigs ileum
La adición de cepas probióticas modula la secreción de mucinas intestinales en íleon de cerdos en crecimiento
Adição de estirpes probióticas modula a secreção de mucinas intestinais em íleo de suínos em crescimento
Johana Andrea Ciro Galeano*1, Zoot, MSc, PhD (c); Albeiro López Herrera2, MV, Zoot, MSc, DrSci; Jaime Parra Suescún2, Zoot, MSc, PhD.
¤ Para citar este artículo: Ciro Galeano JA, López Herrera A, Parra Suescún J. La adición de cepas probióticas modula la secreción de mucinas intestinales en íleon de cerdos en crecimiento. Rev CES Med Zootec. 2015; Vol 10 (2): 150-159.
* Autor para correspondencia: Johana Andrea Ciro Galeano. Johana.ciro@uam.edu.co
1 Grupo GIsCA, Facultad de Medicina Veterinaria y Zootecnia, Fundación Universitaria Autónoma de las Américas, Medellín, Colombia. Circular 73 No 35 - 04 Laureles.
2 Grupo Biodiversidad y Genética Molecular BIOGEM, Departamento de Producción Animal, Facultad de Ciencias Agrarias, Universidad Nacional de Colombia, Medellín, Colombia. Calle 59A No 63 - 20 Autopista norte. Bloque 50, Oficina 310.
(Recibido: 11 de junio, 2015; aceptado: 20 de noviembre, 2015)
Abstract
Mucin represents the most important barrier of the gastrointestinal tract against pathogens that generate enteric diseases. Therefore, arises the need to implement nutritional strategies that promote intestinal mucin production and health, and in turn, the decline in the use of antibiotics to mitigate the diseases of this stage comes. Therefore, the effect of adding different probiotic strains (Lactobacillus casei, Lactobacillus acidophilus and Enterococcus faecium) on the production of Sulfated Acid Mucins (MAS), Non- Sulfated Acid Mucins (MANS) and Neutral Mucins (MN) in newly weaned piglets was assessed. 35 days 1 piglets (21 days old), 15 and 30 weaned humane euthanasia was performed, and were extracted the ileum to evaluate the production of intestinal mucins different. They were offered the animals a commercial diet with added antibiotics and one without addition of antibiotic; and different probiotics are added in the drinking water. The experimental design was randomized block in split plot arrangement. A significant increase (P <0.01) in the production of MAS, MN MANS and on day 30 after weaning in those animals fed E. faecium, compared to those who ate the diet with added antibiotics was observed. E. faecium in the diet of weaned piglets promotes the production and secretion of mucin, which could be reflected in the intestinal health of themselves and their time, clinical, health and productive parameters of the animals.
Keywords: Intestinal health, mucus, piglets, probiotics, small intestine.
Resumen
La mucina representa la barrera de protección más importante del tracto gastrointestinal contra los patógenos que generan enfermedades entéricas. Debido a lo anterior, surge la necesidad de implementar estrategias nutricionales que mejoren la producción de mucinas y salud intestinal, y a su vez, la disminución en el uso de antibióticos para mitigar las enfermedades propias de la etapa de levante. Por tanto, se evaluó el efecto de la adición de diferentes cepas probióticas (Lactobacillus casei, Lactobacillus acidophilus o Enterococcus faecium) sobre la producción de Mucinas Ácidas Sulfatadas (MAS), Mucinas Ácidas no Sulfatadas (MANS) y Mucinas Neutras (MN) en lechones recién destetos. Se realizó eutanasia humanitaria a 35 lechones los días 1 (21 días de edad), 15 y 30 posdetete, y se les extrajo la porción del íleon para evaluar la producción de las diferentes mucinas intestinales. Se les suministró a los animales una dieta comercial con adición de antibióticos y otra sin adición de antibiótico a la cual se le adicionaron los diferentes probióticos en el agua de bebida. El diseño estadístico utilizado fue de bloques al azar en un arreglo de parcelas divididas. Se observó un aumento significativo (P<0,01) en la producción de MAS, MANS y MN en el día 30 posdestete en aquellos animales que consumieron E. faecium, frente a aquellos que consumieron la dieta con adición de antibiótico. E. faecium en la dieta de lechones destetos promueve la producción y secreción de mucinas, que puede verse reflejado en la salud intestinal de los mismos y a su vez, en los parámetros clínicos, sanitarios y productivos de los animales.
Palabras clave: Intestino delgado, lechones, moco, probióticos, salud intestinal.
Resumo
A mucina representa a barreira de proteção mais importante do trato gastrointestinal em contra dos patógenos geradores de doenças entéricas. Portanto, surge a necesidade de implementar estratégias nutricionais para promover a produção de mucinas e saúde intestinal e, por sua vez, a disminuição no uso de antibióticos para mitigar as doenças. Portanto, foi evaluado o efeito da adição de diferentes cepas probióticas (Lactobacillus casei, Lactobacillus acidophilus e Enterococcus faecium) sobre a produção de Mucina Ácida Sulfatada (MAS), Mucinas Ácido não Sulfatado (MANS) e Mucinas neutras (MN) em leitões recém-desmamados. Foi realizada a eutanásia humanitária a 35 leitões nos dias 1, 15 e 30 após o desmame, e extraiu-se o íleo para avaliar a produção de diferentes mucinas intestinais. Eles fornecem uma dieta comercial de animais com adição de antibióticos e sem adição de um antibiótico; e diferentes probióticos são adicionados na água de beber. O Delineamento enteramente casualizado em parcelas subdivididas. Foi observado um aumento significativo (P<0,01) na produção de MAS, MANS e MN no dia 30 após o desmame nesses animais alimentados com E. faecium, em comparação com aqueles que comiam a dieta adicionada com antibiótico. E. faecium na dieta de leitões desmamados promove a produção e secreção de mucina, o que poderia ser refletido na saúde intestinal e, por sua vez, nos parâmetros clínicos, de saúde e produtivos dos animais.
Palavras chave: Intestino delgado, leitões, muco, probiótico, saúde intestinal.
Introducción
En la industria porcina, el destete no solo se constituye en una etapa crítica, sino además en el momento crucial sobre el crecimiento postnatal y el metabolismo de nutrientes en los lechones 27. Este periodo se caracteriza por la reducción de la actividad metabólica, disminución de la absorción de nutrientes y aumento en la susceptibilidad a enfermedades entéricas ocasionadas por E. coli Enterotoxigénica (ETEC), salmonella spp, clostridium perfringes y rotavirus 8 como consecuencia de la separación abrupta de la cerda antes de unirse a otras camadas en un ambiente diferente. Debido a esto, en el periodo de transición se da un cambio alimenticio de sustrato líquido (leche) a alimento sólido lo que ocasiona un aumento de estrés en los lechones 4, provocandocambios desfavorables en la fisiología del intestino y así mismo en la mucosa del mismo 1,3.
La arquitectura del epitelio de la mucosa intestinal tiene varias barreras que tratan de evitar o impedir la infección por bacterias patógenas. Los mecanismos de protección, son empleados por todas estas barreras con el fin de mantener la integridad de la monocapa de células epiteliales y limitar el daño asociado con la inflamación18. El moco es una de las principales líneas de defensa del cuerpo contra los patógenos, toxinas y partículas extrañas, al mismo tiempo que lubrica y reduce la fricción. El moco está constituido principalmente por agua (95%), colesterol, lípidos, inmunoglobulinas, sales, proteínas y mucinas, siendo estas últimas, mucinas unidas a la membrana y mucinas secretadas 9.
Las mucinas son glicoproteínas epiteliales involucradas en la protección de la integridad de la mucosa a través de la preservación de la función de la barrera epitelial, consideradas como los principales componentes estructurales del sistema de transporte mucociliar, atrapando a los patógenos en un capa de gel de mucina 11. Estas mucinas son secretadas por las células caliciformes que permite al hospedero inhibir el acceso de patógenos a la mucosa subyacente5,10 y que bioquímicamente pueden clasificarse en mucinas neutras y ácidas (sulfatadas y no sulfatadas), cuyas proporciones pueden variar dependiendo de diversos factores ambientales y clínicos (enfermedades de tipo entérico) 24.
Diversos estudios de investigación se han centrado en las interacciones de los factores de la dieta con la actividad secretora de las células caliciformes12, por lo que el objetivo de estudio fue determinar el efecto de la adición de diferentes cepas probióticas (L. casei, L. acidophilus o E. faecium) sobre la producción de mucinas intestinales en cerdos en etapa de crecimiento.
Materiales y métodos
Consideraciones éticas
Todos los procedimientos experimentales fueron llevados a cabo de acuerdo a las guías propuestas por “The International Guiding Principles for Biomedical Research Involving Animals” 7. Esta investigación fue avalada por El Comité de Ética en la Experimentación Animal de la Universidad Nacional de Colombia, Sede Medellín (CEMED-03 del 07 de mayo del 2012).
Localización
El trabajo de campo se realizó en el Centro San Pablo, perteneciente a la Universidad Nacional de Colombia, Sede Medellín, ubicado en el municipio de Rionegro, paraje “El Tablacito”, localizado a 2100 msnm, con una temperatura entre 12 y 18 ºC, correspondiendo a una zona de vida bosque muy húmedo Montano Bajo (bmh-MB).
Animales
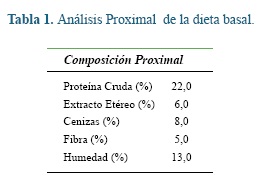
Se utilizaron 35 lechones (hembras y machos) del cruce duroc x pietrain, destetados exactamente a los 21 días de edad, con un peso aproximado de 6 ± 0,5 kg, los cuales fueron alojados en grupos de 8 animales durante el período de levante. Cada una de las instalaciones o corrales estaba provista de comederos de canoa y agua a voluntad, se tenía temperatura controlada (26 ± 3 °C) por termometro digital. La dieta comercial ofrecida a los animales tuvo como componente leche y algunos de sus derivados, además, fue enriquecida con vitaminas, minerales y lisina HCL. Las dietas se balancearon para cumplir con todos los mínimos nutricionales requeridos y propuestos por el NRC 17 (Tabla 1). La cantidad de alimento ofrecido a los lechones por corral fue administrada de acuerdo a la tabla dietaría que corresponde para la etapa productiva (levante). Así mismo, el agua de bebida que contenía las cepas probióticas se ofreció diariamente desde el día 1 del destete hasta el sacrificio, el cual se realizó de manera secuencial o escalonada durante los primeros 30 días de la fase de levante. Durante la lactancia no se suministró alimento sólido a los lechones.
Dietas
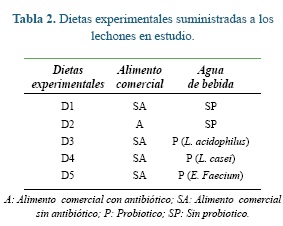
Los animales fueron alimentados con dos dietas: dieta comercial con y sin la adición de antibiótico. Los diferentes probióticos (L. casei, L. acidophilus o E. faecium) se suministraron en el agua de bebida de los animales que consumieron la dieta comercial sin antibiótico (Tabla 2).
La cantidad del probiótico adicionado (relación v/p) fue del 20% con respecto al peso de la ración utilizada, siguiendo las instrucciones para su preparación y adición según lo recomendado por el fabricante. La inclusión de los probióticos en el agua de bebida se realizó por mezclado directo de un litro de agua con 30 gramos de azúcar comercial para garantizar poblaciones mínimas de 108 UFC con una viabilidad adecuada; luego este litro fue adicionado a un tanque de 50 lts y evaluado por medio de análisis microbiológicos semanales. El alimento utilizado en este estudio estuvo libre de antibióticos (excepto la dieta D2), ya que no fue de interés modificar la dieta, sino la incorporación de los probióticos como una alternativa al uso de antibióticos. Las dietas experimentales se proporcionaron durante 30 días a partir del día del destete (día 21 de vida).
Toma de muestras de tejido intestinal
Durante la fase experimental se realizaron eutanasias humanitarias a 35 lechones de la siguiente forma: el día inicial, o día 1 (día del destete), se sacrificaron 5 animales, que representaron el grupo de referencia para verificar el estado general de salud y la evaluación macroscópica del estado de los órganos de los animales antes de suministrar las dietas, y las unidades experimentales para cada uno de los tratamientos. Los días 15 y 30 posdestete fueron sacrificados 3 lechones de cada tratamiento. Estos, se sedaron con un neuroléptico stresnil® (Azaperona) vía intramuscular, posteriormente se sometieron a inhalación con Nitrox® y se sacrificaron 2.5 horas después de su última comida.
Después del sacrificio, los lechones se pusieron en posición decúbito dorsal, se diseccionó la región abdominal y se extrajo completamente el intestino delgado desde la unión pilórica hasta la válvula íleo-cecal22. La longitud intestinal se midió separando manualmente el tejido conectivo. En este experimento, el duodeno se tomó a partir del píloro hasta terminar el ángulo de treitz; el yeyuno fue el segmento proximal del intestino delgado restante; y el íleon fue el segmento proximal (10 cm) antes de la unión ileocecal. Aproximadamente 1 cm de las secciones transversales de tejido intestinal se eliminaron y se tomaron 5 cm desde el comienzo de cada uno de los segmentos: duodeno, yeyuno e íleon para cada animal. Una vez cortadas las porciones, la digesta contenida en cada una de ellas se removió mediante lavado por infusión con solución salina fría según lo descrito previamente16,20, y se fijó únicamente la sección ileal en formalina al 10% para su posterior análisis en el laboratorio.
Análisis morfométricos del intestino delgado
Procesamiento histotécnico. Transcurrido 48 horas después de la colecta, las muestras de las diferentes secciones del intestino almacenadas en formalina al 10% 4, fueron enviadas al laboratorio de Histopatología Animal de la Universidad de Antioquia (Facultad de Ciencias Agrarias) para su analisis respectivo.
Los tejidos ileales recolectados se sometieron a un metodo histotécnico con inclusión en parafina y se cortaron a 4µm de espesor. Luego se montaron 3 placas para someter los tejidos a tinciones histoquímicas e identificar así, los diferentes tipos de mucinas según las técnicas descritas por el Instituto de patología de las Fuerzas Armadas de los EEUU (AFIP) 19:
Coloración Azul alcián pH 1.0: para mucinas ácidas intensamente sulfatadas.
Coloración Azul de alcián pH 2.5: para identificar mucinas ácidas no sulfatadas.
Coloración de PAS (Periodic Acid Schiff): para identificar mucinas neutras.
Evaluación microscópica y análisis morfométricos de imágenes
Para evaluación cuantitativa de los cortes histológicos, se empleó un microscopio óptico Leica DMLB (Meyer Instruments, Houston,TX, USA), para la identificación de las zonas tisulares, luego con la cámara de microscopia digital instantánea Leica EC3 (Leica microsystems, Heerbrugg, Switzerland) con resolución de tres megapíxeles, en aumentos de 200x, se capturaron las imágenes de la mucosa; posteriormente, dichas imágenes se analizaron con el programa para tratamiento de imágenes ZEN (blue edition, Carl Zeiss, 2011), identificando un área circular de medida con un diámetro de 200µm y se realizaron seis mediciones por pliegue circular de la mucosa en varias zonas, así: dos en el vértice, dos en cada lado y dos en el fondo; para cada zona, la primera medición en la porción de la vellosidad y la segunda en la glándula de la mucosa intestinal con el fin de valorar su distribución. Finalmente, se realizó un conteo semiautomático de las células caliciformes positivas a cada una de las tinciones28.
Diseño estadístico
El experimento se realizó según un diseño bloques al azar en un arreglo de parcelas divididas. Para la conformación de los bloques se tomó en consideración el peso inicial de los animales. A cada animal le fue asignado uno de los 15 tratamientos: 5 dietas (alimento sin adición de probióticos ni antibióticos, con adición de antibióticos sin probióticos; y con adición de L. casei, L. acidophilus o Enterococcus faecium) y tres periodos de medición. Cada tratamiento tuvo un total de 3 repeticiones. El análisis estadístico se realizó según el procedimiento GLM (Modelos Lineales Generales) del SAS21. Las diferencias entre las medias de los tratamientos fueron determinadas por mínimos cuadrados y analizadas por ANOVA. Para realizar la comparación de los promedios entre tratamientos se utilizó una prueba de Duncan (P< 0,05).
Resultados
Los cerdos que consumieron las dietas experimentales, en general, no presentaron ningún signo de enfermedad que causara su retiro del experimento o su sacrificio inmediato. Así mismo, el nivel en el cual se ofreció el suministro diario de alimento y agua no generó sobrantes en ningún momento del periodo experimental.
En este experimento no se encontró interacción estadística entre las diferentes dietas experimentales dentro de cada período de evaluación para ninguna de las variables en estudio, por lo que no fue necesario analizar y desglosar dichos factores de manera independiente.
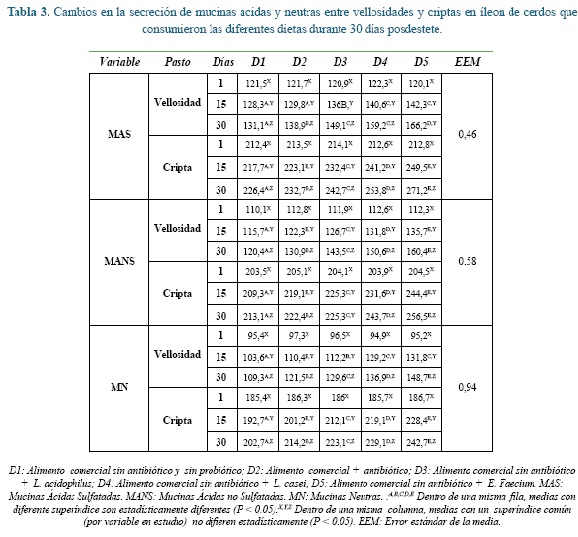
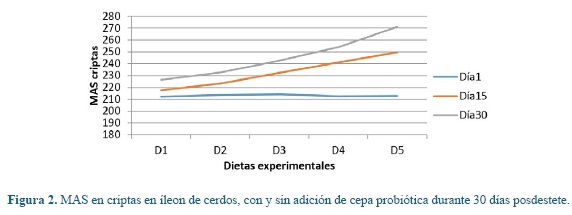
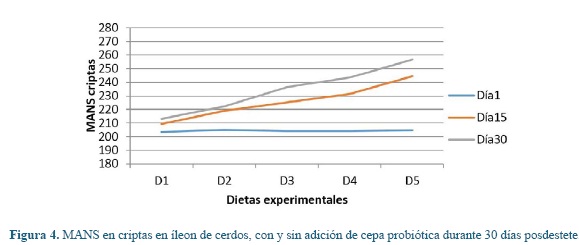
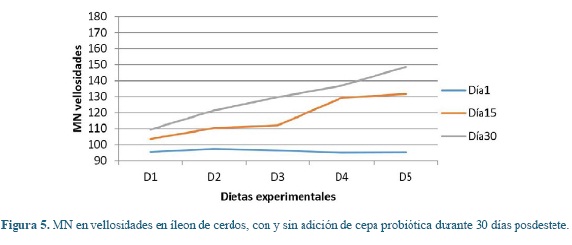
Los cambios intestinales de las poblaciones de mucinas estudiadas en vellosidades y criptas (Lieberkühn) entre cada una de las dietas y periodos de exposición, se pueden observar en la tabla 3. Se presentó un aumento estadístico significativo (P<0,01) para cada una de las mucinas entre la diferentes dietas evaluadas dentro de cada período de evaluación, donde D1 obtuvo valores menores respecto a D2 y frente a las dietas con probióticos, donde los animales en D5 reportaron los valores mayores tanto a nivel de vellosidades como de criptas.
Para las mismas variables en estudio, se presentaron diferencias significativas estadísticas entre los diferentes días de muestreo dentro de cada una de las dietas (P<0,05), donde en el día 30 se presentaron los mayores valores para cada dieta en estudio.
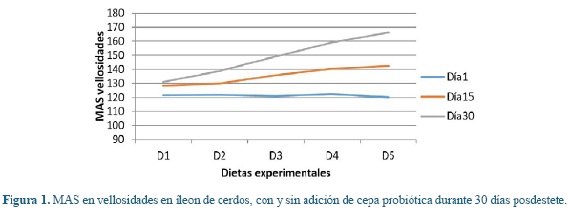
En las figuras 1, 2, 3, 4, 5 y 6 se puede observar la expresión de MAS, MANS y MN respectivamente, en vellosidades y criptas de cerdos que consumieron dietas con y sin la adición de cepa probiótica por 30 días posdestete. Se puede observar que aquellos animales que consumieron D1 presentaron los valores más bajos respecto a D2, pero estos últimos no igualaron los valores registrados por las dietas que tenían adición de probióticos, donde los animales en D5 registraron los valores más altos de MANS.
Discusión
La mucina actúa como una barrera entre el lumen y el epitelio, protegiendo la superficie epitelial del intestino delgado de enzimas digestivas y de la abrasión debido a partículas de alimento y patógenos. La integridad de las uniones estrechas y las proteínas de la membrana plasmática extracelular, dependen de la estrategia de protección que proporciona las mucinas6. Sin embrago, estas superficies mucosas son colonizadas por un gran número de especies bacterianas que crean una relación simbiótica con la mucina y ejercen una influencia importante en el desarrollo, la inmunidad y la nutrición26.
Según los datos generados en este trabajo, los animales que consumieron las dietas con adición de probióticos (D3, D4 y D5, Bacterias acido lácticas) favorecieron la producción de mucinas en vellosidades y criptas de íleon, coincidiendo con los datos reportados por Wang et al.25, quienes a partir de células colónicas en ratones adicionadas con Lactobacillus rhamnosus GG inhibieron la adherencia de Escherichia coli enteropatógena a las células epiteliales intestinales a través de la producción de mucinas, demostrado que la expresión de genes Muc2 en las células epiteliales es inducida por el probiótico, lo que favorece la producción de mucina.
Diversos estudios han reportado información sobre la presencia de mucinas acidas sulfatadas y no sulfatadas, las cuales podrían constituirse como una estrategia de protección frente a enfermedades entéricas en cerdos2,23, así mismo, una disminución de las células caliciformes, encargadas de secretar las diferentes mucinas intestinales, podría tener implicaciones negativas respecto a la protección de la mucosa, promoviendo posteriormente lesiones en el epitelio intestinal e infecciones entéricas14.
Por tanto, aquellos animales que no tienen ningún mecanismo que favorezca la protección del epitelio intestinal, como la adición de probióticos en la dieta, son animales que no cuentan con ningún tipo de barrera que pueda proteger al epitelio intestinal contra la digestión enzimática6, y a su vez a la presencia de agentes patógenos, como lo reporto Liu et al.13, donde la presencia de rotavirus desarrollaba los signos de la enfermedad (diarrea) y cambios patológicos intestinales que limitaban la gastroenteritis, debido probablemente, a la ausencia del efecto protector que ejercía la mucina, mientras que aquellos animales que consumieron cepas probióticas estimularon la producción de mucina, reduciendo así el daño en el epitelio del íleon.
Luki´c et al.15, reportaron los beneficios que brindaba las bacterias ácido lácticas, ya que no solo favorecen la producción de mucinas a nivel intestinal, sino que además, promovían la expresión de proteínas de unión a mucina (MucBP), la cual inhibe a su vez, la adherencia de bacterias patógenas a la mucosa intestinal. Por tanto, aquellos animales que consumieron D3, D4 y D5 aparte de favorecer la expresión de mucinas, también podría promover la salud intestinal al evitar la colonización de patógenos en el epitelio intestinal.
La capa de moco formada por la mucina presente en el tracto gastrointestinal, se constituye como la primera barrera física contra patógenos, inhibiendo su adhesión y posteriormente su colonización. La producción de mucina es de vital importancia en la etapa de crecimiento de los lechones para minimizar la presencia de enfermedades entéricas que conlleva a grandes pérdidas en el sector porcícola.
E. faecium es un probiótico que al ser adicionado en la dieta de lechones destetos promueve la producción y secreción de mucinas, lo que podría verse reflejado en la salud intestinal de los mismos y a su vez, en los parámetros clínicos, sanitarios y productivos de los animales. Estos hallazgos respaldan la necesidad de realizar futuras investigaciones, que permitan comprender los mecanismos involucrados que regulan la secreción de las mucinas intestinales. Este conocimiento podría ayudar a diseñar estrategias de prevención y control de las enfermedades asociadas con este periodo crítico de la producción porcina.
Referencias
1. Alain B, Pajarillo E, Chae JP, Balolong M, Bum Kim H, Kang DK. Assessment of fecal bacterial diversity among healthy piglets during the weaning transition. J Gen Appl Microbiol. 2014; 60(4):140-6. [ Links ]
2. Betscher S, et al. “Effects of diet's physical form (grinding intensity; meal/pellets) on morphological and histological parameters (eg ratio of neutral to acid mucins) of the gastrointestinal tract in weaned piglets. Livestock Science 2010; 134.1: 149-151.
3. Campbell JM, Crenshaw JD, Polo J. The biological stress of early weaned piglets. J Anim Sci Biotechnol. 2013; 4(1):19. [ Links ]
4. Ciro JA, López HA, Parra JE. Expresión molecular de la vilina en yeyuno de lechones posdestete que consumieron LPS de E. coli. Rev CES Med Zootec. 2013; vol 8, No 2. [ Links ]
5. Chaim FM, Sato DT, Rodrigues MR, Dias AM, Silveira Júnior PP, Pereira JA, Martinez CA. Evaluation of the application of enemas containing sucralfate in tissue content of neutral and acid mucins in experimental model of diversion colitis. Acta Cir Bras. 2014; 29(9):544-52. [ Links ]
6. Chang M, Alsaigh T, Kistler EB, Schmid-Schönbein GW. Breakdown of mucin as barrier to digestive enzymes in the ischemic rat small intestine. PLoS One. 2012; 7(6):e40087. [ Links ]
7. CIOMS International Guiding Principles for Biomedical Research Involving Animals. Altern Lab Anim. 1985; 12(4):ii. [ Links ]
8. Farzan A, Kircanski J, DeLay J, Soltes G, Songer JG, Friendship R, Prescott JF. An investigation into the association between cpb2-encoding Clostridium perfringens type A and diarrhea in neonatal piglets. Can J Vet Res. 2013; 77(1):45-53. [ Links ]
9. Georgiades P, Pudney PD, Rogers S, Thornton DJ, Waigh TA. Tea derived galloylated polyphenols cross-link purified gastrointestinal mucins. PLoS One. 2014; 9(8):e105302. [ Links ]
10. Gopal A, Iyer SC, Gopal U, Devaraj N, Halagowder D. Shigella dysenteriae Modulates BMP Pathway to Induce Mucin Gene Expression In Vivo and In Vitro. PLoS One. 2014; 9(11):e111408. [ Links ]
11. Hensel KO, Boland V, Postberg J, Zilbauer M, Heuschkel R, Vogel S, Gödde D, Wirth S, Jenke AC. Differential expression of mucosal trefoil factors and mucins in pediatric inflammatory bowel diseases. Sci Rep. 2014; 4:7343. [ Links ]
12. Hino S, Sonoyama K, Bito H, Kawagishi H, Aoe S, Morita T. Low-methoxyl pectin stimulates small intestinal mucin secretion irrespective of goblet cell proliferation and is characterized by jejunum Muc2 upregulation in rats. J Nutr. 2013; 143(1):34-40. [ Links ]
13. Liu F, Li G, Wen K, Wu S, Zhang Y, Bui T, Yang X, Kocher J, Sun J, Jortner B, Yuan L. Lactobacillus rhamnosus GG on rotavirus-induced injury of ileal epithelium in gnotobiotic pigs. J Pediatr Gastroenterol Nutr. 2013; 57(6):750-8. [ Links ]
14. Looft TP. The swine intestinal microbiota: localized adaptations and responses to in-feed antibiotics. Graduate Theses and Dissertations. 2012. Tomado de: http://lib.dr.iastate.edu/etd/12390. [ Links ]
15. Lukić J, Strahinić I, Jovčić B, Filipić B, Topisirović L, Kojić M, Begović J. Different roles for lactococcal aggregation factor and mucin binding protein in adhesion to gastrointestinal mucosa. Appl Environ Microbiol. 2012; 78(22):7993-8000. [ Links ]
16. Makkink CA, Berntsen PJM, op den Kamp BML, Kemp B, Verstegen WA. Gastric protein breakdown and pancreatic enzyme activities in response to two different dietary protein sources in newly weaned pigs. J Anim Sci. 1994; 72: 2843-2850. [ Links ]
17. NRC. National Research Council. The Nutrient Requirements of Swine. 8th rev. ed. Washington, DC, USA: National Academy Press. 1998.
18. Patel S, McCormick BA. Mucosal Inflammatory Response to Salmonella typhimurium Infection. Front Immunol. 2014; 5:311. [ Links ]
19. Prophet EB, Mills B, Arrington JB, Sobin LH. Métodos histotecnológicos. Instituto de Patología de las Fuerzas Armadas de los Estados Unidos (AFIP), 1995. [ Links ]
20. Reis STC, Guerrero CMJ, Aguilera BA, Mariscal LG. Efecto de diferentes cereales sobre la morfología intestinal de lechones recién destetados. Téc Pecu Mex. 2005; 43: 309-321. [ Links ]
21. SAS®. SAS/STAT User's Guide. Institute Inc. Statistical Analysis Systems Institute. Version 9.1th Ed. Cary, NC: SAS Institute Inc. 2006. [ Links ]
22. Segalés J, Domingo M. La necropsia en el ganado porcino, diagnóstico anatomopatológico y toma de muestras, Madrid (España), Boehringer Ingelheim. 2003. 10-14. [ Links ]
23. Strous GJ, Dekker J. Mucin-type glycoproteins. Crit. Rev. Biochem. Mol. Biol 1992; 27:57-92. [ Links ]
24. Voynow JA, Rubin BK. Mucins, mucus, and sputum. Chest. 2009; 135(2):505-12. [ Links ]
25. Wang L, Cao H, Liu L, Wang B, Walker WA, Acra SA, Yan F. Activation of epidermal growth factor receptor mediates mucin production stimulated by p40, a Lactobacillus rhamnosus GG-derived protein. J Biol Chem. 2014; 289(29):20234-44. [ Links ]
26. Wickström C, Chávez de Paz L, Davies JR, Svensäter G. Surface-associated MUC5B mucins promote protease activity in Lactobacillus fermentum biofilms. BMC Oral Health. 2013 Sep 8;13:43. [ Links ]
27. Xiao YP, Wu TX, Hong QH, Sun JM, Chen AG, Yang CM, Li XY. Response to weaning and dietary L-glutamine supplementation: metabolomic analysis in piglets by gas chromatography/mass spectrometry. J Zhejiang Univ Sci B. 2012; 13(7):567-78. [ Links ]
28. Zapata D, Rodríguez B, Ramírez M, López A, Parra J. Escherichia coli lipopolysaccharide affects intestinal mucin secretion in weaned pigs. Revista Colombiana de Ciencias Pecuarias 2015; 28:209-217. [ Links ]