Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina Veterinaria y Zootecnia
On-line version ISSN 1900-9607
Ces. Med. Vet. Zootec. vol.10 no.2 Medellín July/Dec. 2015
Effect of inclusion of L-carnitine fumarate on dry matter intake in Holstein cows during the period of transition to lactation
Efecto de la inclusión de fumarato de L-carnitina sobre el consumo de materia seca, en vacas Holstein durante el periodo de transición a la lactancia
Efeito da inclusão de L-carnitina fumarato no consumo de matéria seca em vacas holandesas durante a transição para lactação
Liset Valentina Madrid Calderón1, Ingeniera Agropecuaria, MSc; Héctor Jairo Correa Cardona 2, PhD; Rubén Darío Galvis Góez 3, cDrSc.
¤ Para citar este artículo: Madrid Calderón LV, Correa Cardona HJ, Galvis Góez RD. Efecto de la inclusión de fumarato de L-carnitina sobre el consumo de materia seca, en vacas Holstein durante el periodo de transición a la lactancia. Rev CES Med Zootec. 2015; Vol 10 (2): 193-202.
* Autor para correspondencia: Rubén Darío Galvis Góez. rdgalvis@unal.edu.co
1 Estudiante de Maestría en Ciencias Agrarias. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. Grupo de Investigación: Interacciones Nutricionales, Metabólicas y Reproductivas en Bovinos. A.A. 1779. Medellín, Colombia. lvmadridc@unal.edu.co
2 Profesor Asociado. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. Grupo de Investigación: Interacciones Nutricionales, Metabólicas y Reproductivas en Bovinos. A.A. 1779. Medellín, Colombia
3 Profesor Asociado. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. Grupo de Investigación: Interacciones Nutricionales, Metabólicas y Reproductivas en Bovinos. A.A. 1779. Medellín, Colombia. rdgalvis@unal.edu.co
(Recibido: 12 de junio, 2015; aceptado: 20 de noviembre, 2015)
Abstract
L-carnitine participates in the transport of fatty acids through the mitochondrial membrane; this facilitate the β-oxidation of fatty acids for the energy producction in the liver. L- carnitine could promote the lipid metabolism during the transition period getting a better energy status in the cows. Purpose of this study was to evaluate the effect of the inclusion of L-carnitine fumarate on the dry matter intake (DMI) in Holstein cows during that period. 21 Holstein cows between second and sixth calving and finishing the last gestation third, were assigned to three treatments with different levels of inclusion of fumarate of L-carnitine: (0.0, 100.0 y 200.0 g/cow/d). Forage, food supplement and faeces samples were collected to estimate DMI of the forage (DMIf), of the supplement (DMIs) and total (DMIt). Data were evaluated through a completely at random statistical design of repeated measures in the time using the PROC MIXED SAS 8.0. Significatively statistical changes were found for DMIfp<0.06, DMIs p<0.001 and DMIt p<0.05 in relation to sample days, but not in relation to the inclusión levels of L-carnitine of fumarate.
Keywords: Intake regulation, dairy cows, peripartal period.
Resumen
La L-carnitina hace parte del transporte de ácidos grasos a través de la membrana mitocondrial facilitando la β-oxidación de los ácidos grasos para la producción de energía en el hígado. La L- carnitina puede favorecer el metabolismo lipídico durante el periodo de transición a la lactancia mejorando el estado energético de las vacas. El objetivo fue evaluar el efecto de la inclusión de fumarato de L-carnitina sobre el consumo de materia seca (CMS) en vacas Holstein durante periodo de transición a la lactancia. Se emplearon 21 vacas que se hallaban entre el segundo y sexto parto y se encontraban finalizando el último tercio de gestación. Estas fueron asignadas al azar a tres tratamientos con diferentes niveles de inclusión en la dieta de fumarato de L-carnitina: 0,0, 100,0 y 200,0 g/ vaca/día. Se tomaron muestras de forraje, suplemento alimenticio y heces para estimar CMS del forraje (CMSf), del suplemento (CMSs) y total (CMSt) a los 270 días de gestación y a los 10 y 20, días posparto. Los datos se evaluaron mediante diseño estadístico completamente al azar con medidas repetidas en el tiempo utilizando PROC MIXED SAS 8.0. Se encontraron cambios significativos para CMSs (p<0,001) y para CMSt (p<0,05) y una tendencia en cuanto al CMSf (p<0,06), en función de los días de muestreo, sin embargo no se encontraron cambios significativos cuando se evaluó el consumo con respecto a los niveles de inclusión de fumarato de L-carnitina.
Palabras clave: Periparto, regulación del consumo, vacas lecheras.
Resumo
A L-carnitina é parte do transporte de ácidos gordos através da membrana mitocondrial facilitar a β-oxidação de ácidos gordos para produção de energia no fígado. A L-carnitina pode promover o metabolismo lipídico durante a transição para a lactação melhorar o estado de energia das vacas. O objetivo foi avaliar o efeito da inclusão de L-carnitina fumarato no consumo de matéria seca (CMS) em vacas da raça Holandesa, durante o período de transição do lactação. 21 vacas estavam entre o segundo eo sexto parto foram utilizados o último terço da gestação. Eles foram divididos aleatoriamente em três tratamentos com diferentes níveis de inclusão na dieta de L-carnitina: 0,0, 100,0 e 200,0 g / vaca / dia. Amostras de ração, suplemento alimentar e fezes, foram analisados para estimar CMS forrageiras (CMSF), suplemento (CMSs) e total (CMST) em 270 dias de gestação,10 e 20 días pós-parto. Os dados foram avaliados usando delineamento experimental inteiramente casualizado com medidas repetidas no tempo utilizando PROC MIXED SAS 8.0. Diferenças significativas para CMS (p <0,001) e CMST (p <0,05) e uma tendência no CMSF (p <0,06), foram encontradas entre os dias de amostragem. Não foram encontradas diferenças significativas em CMST entre tratamentos.
Palavras chave: Periparto, regulação consumo, vacas leiteiras.
Introducción
El consumo de materia seca (CMS) es fundamental ya que establece la cantidad de nutrientes disponibles para el animal25. El CMS durante las últimas dos a tres semanas antes del parto está bien documentada 4,14 y se ha estimado que puede disminuir entre un 10 y un 50% 4,17,25. Sin embargo, las razones por las cuales se presenta esta disminución no son claras 17,20 aunque se han asociado a factores físicos tales como el crecimiento del feto en las últimas semanas, lo que puede resultar en limitaciones de espacio y restringir el volumen ruminal12; aunque también se ha señalado que la capacidad física del rumen no es la causa de la disminución del CMS, ya que se presenta una compensación debida al incremento en la tasa de pasaje ruminal del alimento16. Por lo tanto, es posible que otros factores distintos a la disminución en la capacidad del rumen, deben estar involucrados en la regulación del CMS durante el periodo de transición. Los cambios en las concentraciones en sangre de las hormonas esteroideas preparto son más consistentes con los cambios en el CMS. La alta cantidad de estrógenos circulantes puede ser un factor que contribuye en la disminución del CMS antes y después del parto 15,17.
Un importante regulador del CMS en vacas de leche, es el estado de energía hepático 1,2. Este es impulsado principalmente por el propionato derivado de la fermentación ruminal y por los ácidos grasos no esterificados (AGNES), que se incrementan en la sangre debido a la movilización de tejido adiposo durante períodos de balance energético negativo (BEN). Después del parto, la síntesis de leche aumenta rápidamente al igual que la producción, lo que genera una alta demanda de glucosa para la síntesis de lactosa de la leche, en un momento donde el CMS no ha alcanzado su máximo 10, por lo que la producción de glucosa por el hígado se incrementa dramáticamente 31.
Debido a los cambios homehorreticos generados durante el periodo de transición a la lactancia las vacas experimentan resistencia a la insulina (RI), mecanismo que se presenta para asegurar un mayor flujo de glucosa directamente hacia la glándula mamaria. Debido a la RI los receptores de la hormona del crecimiento (rGH) en el hígado se encuentran disminuidos, a su vez los niveles hepáticos del factor de crecimiento insulinoide tipo 1 (IGF-1) se encuentran bajos, por lo tanto se incrementan las concentraciones de la hormona del crecimiento (GH) ejerciendo en el hígado un mayor estímulo para realizar gluconeogénesis; los bajos niveles de insulina en este periodo ejercen un efecto contrario en el tejido adiposo donde hay un mayor incremento de rGH y por ende una mayor estimulo de GH lo que conlleva a la lipolisis, por lo tanto se cree que la resistencia a la insulina en el tejido adiposo puede contribuir al aumento de las concentraciones circulantes de AGNES y la disminución del CMS en vacas que se acercan al parto28. Algunos autores han sugerido que el aumento en las concentraciones circulantes de AGNES al final de la gestación y posterior oxidación de estos por el hígado, es la causa de la disminución del CMS en vacas cercanas al parto1. El Aumento en la resistencia del tejido adiposo a la insulina predispone a la vaca para movilizar AGNES, pudiendo crear un círculo vicioso de la movilización de AGNES y la reducción del CMS durante el último período preparto. Esto también ayudaría a explicar por qué metabólicamente la alta condición corporal (C.C) en vacas, tienen menores CMS y descensos más rápidos en CMS durante el período preparto que en vacas que tienen CC moderada o baja 14.
A medida que las concentraciones de AGNES aumentan en sangre alrededor del parto y en la lactancia temprana, más AGNES son captados por el hígado 11,31. En el hígado, los AGNES pueden ser completamente oxidados para proporcionar energía al hígado, oxidados parcialmente para producir cuerpos cetónicos que se liberan en la sangre y pueden servir como combustibles para otros tejidos o reconvertirlos a triglicéridos (TG). Los rumiantes tienen una capacidad inherentemente baja para la síntesis y secreción de lipoproteínas de muy baja densidad (VLDL) para exportar TG desde el hígado 11,17 desencadenando así una lipidosis hepática debido a la acumulación de TG.
La L-carnitina hace parte del transporte de ácidos grasos a través de la membrana mitocondrial, lo que facilita la β-oxidación de los ácidos grasos para la producción de energía39 a la vez que decrece la acumulación de TG en el hígado mejorando la funcionalidad hepática5 y ha sido demostrado que la L-carnitina aumenta la producción hepática de glucosa mediante la estimulación del flujo de metabolitos a través de la piruvato carboxilasa 29,36 lo que, eventualmente, podría afectar el nivel de glicemia del animal y su CMS.
El objetivo de este trabajo fue evaluar el efecto de la inclusión de 0, 100 y 200 g/vaca/día de fumarato de L-carnitina sobre el consumo de materia seca de vacas Holstein durante el periodo de transición a la lactancia.
Materiales y métodos
Localización
El trabajo de campo se realizó en el centro agropecuario Paysandú de la Universidad Nacional de Colombia, sede Medellín, ubicado a 2300 m.s.n.m., con una temperatura promedio de 14°C, precipitación promedio de 2400mm, una humedad relativa promedio de 80%, en una formación ecológica de bh-MB, según la clasificación de 19.
El procesamiento de las muestras de pasto, suplemento alimenticio y heces se realizaron en el laboratorio de análisis químico y bromatológico, de la Universidad Nacional de Colombia, sede Medellín.
Animales experimentales
Se seleccionaron 21 vacas Holstein que se hallaran dentro del segundo y sexto parto, y que se encontraran finalizando el último tercio de gestación (260 días de gestación).
Tratamientos experimentales
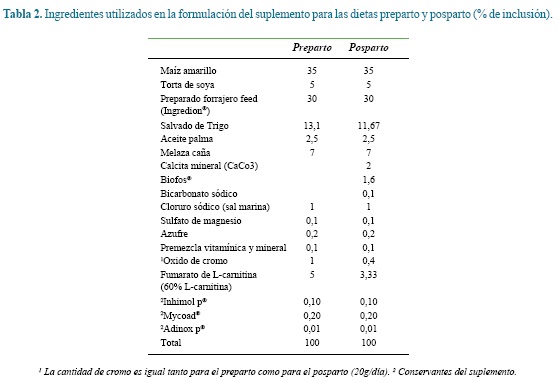
Se emplearon tres tratamientos basados en el nivel de inclusión de fumarato de L-carnitina (SUZHOU VITAJOY BIO-TECH CO., LD): 0.0, 100.0 y 200.0 g/ vaca/día. A cada tratamiento se le asignaron siete vacas al azar. Los tratamientos se suministraron desde el día 260 de gestación hasta el día 20 posparto, dos veces al día mezclados con el suplemento alimenticio.
Dieta
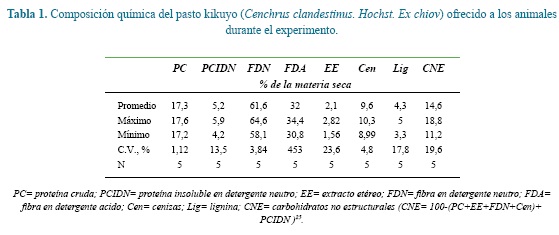
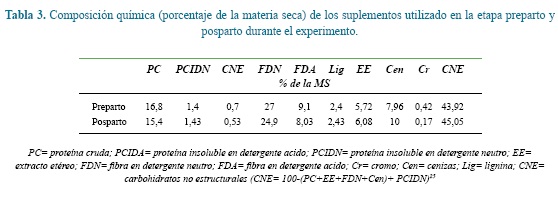
Los animales experimentales pastaron permanentemente praderas constituidas principalmente por pasto kikuyo (Cenchrus clandestinus. Hochst. Ex chiov). Desde el día 260 de gestación y hasta el parto recibieron 2.0 kg/d de un suplemento alimenticio que carecía de Carbonato de Ca, Bicarbonato de Na y Biofos® (Tabla 1) para reducir los riesgos de hipocalcemia. Luego del parto y hasta el día 20 de lactancia las vacas recibieron el mismo suplemento alimenticio de la etapa preparto pero adicionándole Carbonato de Ca, Bicarbonato de Na y Biofos® en las proporciones que aparecen en la tabla 1. La cantidad suministrada se estimó en función del nivel de producción de leche8 a razón de 1 kg de suplemento alimenticio por cada cuatro litros de leche producidos por día repartido en partes iguales durante los dos ordeños. Los suplementos utilizados en este experimento fueron elaborados en el Laboratorio de Alimentos para Animales de la Universidad Nacional de Colombia, sede Medellín, a los que se les incluyó oxido de cromo como marcador externo para la estimación del consumo de materia seca23.
Fase experimental y toma de muestras
Los días 257, 258 y 259 de gestación antes de iniciar la suplementación con Fumarato de L-carnitina se colectaron muestras de heces, directamente del recto de cada vaca dos veces al día, las cuales se mezclaron para obtener una única muestra/vaca y se conservaron congeladas a -20 oC hasta los análisis químicos. Los días 268, 269 y 270 se tomaron nuevamente muestras de heces así como los días 8, 9 y 10 y los días 18, 19 y 20 posparto. Durante cada periodo de muestreo, igualmente, las muestras de heces se mezclaron para obtener una única muestra/vaca y se conservaron congeladas a -20 oC hasta los análisis químicos. Además se tomaron muestras de forraje de aproximadamente 2.0 kg (n=5) por el método hand-pluck41 y muestras del suplemento alimenticio aproximadamente 0.5 kg (n=7) las cuales se conservaron congeladas hasta los análisis químicos.
Análisis químicos
En las muestras de heces se determinó el contenido de materia seca (MS) y cromo (Cr) el cual fue estimado mediante la técnica de Espectrofotometría de absorción atómica, y en las muestras de forraje y del suplemento alimenticio se determinó el contenido de fibra en detergente neutro (FDN) (2002,04), fibra en detergente ácido (FDA) (973,18) y cenizas (Cen) (942,05) mediante los procedimientos descritos por la3. La proteína cruda (PC) (NTC 4657), extracto etéreo (EE) (NTC 668) y la lignina (Lig) se determinó por el procedimiento descrito por Sunvold y Chrocan 38. En los residuos de la FDN y FDA se determinó el contenido de proteína para obtener la proteína cruda insoluble en detergente neutro (PCIDN) y la proteína cruda insoluble en detergente ácido (PCIDA), respectivamente. Por diferencia se estimó el contenido de carbohidratos no estructurales (CNE) 25.
Estimación del consumo de materia seca del forraje (CMSf) y materia seca del suplemento (CMSs)
El consumo de materia seca del forraje (CMSf) se estimó mediante la técnica de los marcadores 23 en la que el óxido de cromo se utilizó como marcador externo y la fibra detergente ácido indigerible in situ (FDAiis) como marcador 37 para estimar la producción de heces (H) y la digestibilidad de la MS (DMS), respectivamente.
El consumo de materia seca del suplemento (CMSs) se estimó mediante la medición del concentrado ofrecido menos el consumido por el animal.
Estimación de la excreción de heces
La excreción de las heces (H) se calculó utilizando la siguiente ecuación23:

La tasa de recuperación del marcador se asumió como 79.4%7. La concentración del marcador en las heces durante el periodo de recolección se corrigió por el contenido del marcador en las heces durante el periodo pre-experimental, cuando las vacas no recibían óxido de cromo.
Determinación de la FDAiis.
La digestibilidad de la materia seca (DMS) se estimó utilizando la fibra en detergente ácido indigerible determinado por incubación in situ (FDAiis) como marcador interno. Para ello se tomaron aproximadamente 3.0 g de cada muestra de forraje, suplemento alimenticio y de heces de cada uno de los animales experimentales y se empacaron en bolsas de nailon de 4 x 12 cm (cuatro repeticiones/muestra para las muestras de heces y 17 repeticiones para las muestras de forraje y suplemento alimenticio) las cuales se fijaron a una cadena de hierro galvanizado mediante cordeles de cáñamo de 10 cm de longitud. La bolsas ya sujetas a la cadena se remojaron tres veces en un tanque con agua limpia y luego se introdujeron hasta el fondo del rumen de tres vacas Holstein canuladas donde permanecieron durante 144 h, al final de las cuales las bolsas fueron retiradas y se lavaron con agua limpia. Las bolsas se secaron a 60 ºC durante 24 h, se retiraron los residuos correspondientes a las repeticiones de cada muestra, se mezclaron y se conservaron hasta la realización del análisis de la FDA. La FDAiis se calculó a partir de la concentración de la FDA en la materia seca de los residuos.
Estimación de la digestibilidad de la MS
La DMS a partir de la FDAiis se calculó así:
DMS = 100 - 100 x (% de marcador en la MS del alimento) x (tasa de recuperación del marcador en las heces) / (% del marcador en la MS de las heces).
Se asumió que la tasa de recuperación de la FDAiis en las heces fue del 80%37.
Estimación del consumo de materia seca del forraje (CMSf) y total (CMSt).
Para estimar el CMS proveniente del forraje (CMSf) se utilizó la ecuación propuesta por13 utilizando los datos de la excreción de H y los de la FDAi obtenidas por el método in situ (FDAiis):
CMSf kg/vaca/día= ([FDAih]*H/0.8 - [FDAis]*CMSs)/ [FDAif]
Donde FDAih es el porcentaje de FDAi en las heces, 0.8 es la recuperación de la FDAi en las heces, FDAis es el porcentaje de FDAi en el suplemento y FDAif es el porcentaje de FDAi en el forraje.
El CMS total (CMSt) se calculó como la suma del CMSf y el CMSs:
CMSt = CMSf + CMSs
Análisis estadístico
Las variables de respuesta se sometieron a un análisis de un diseño completamente al azar con medidas repetidas en el tiempo según el siguiente modelo:
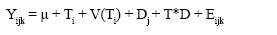
donde Yijk es la variable de respuesta; Ti es la medía
experimental; Ti es el efecto de i-ésimo tratamiento;
V(Ti) es el error asociado a la vaca anidado en el i-ésimo tratamiento; Dj es el efecto del j- ésimo día; T*D es el efecto de la interacción entre el tratamiento y el día; y Eijk es el error residual experimental asociado a la k- ésimo observación.
Para ello se utilizó la estructura de covarianza Autorregresiva de primer orden24 y se utilizó como error para analizar el efecto del tiempo, la repetición (V(Ti)). Así mismo se evaluaron la producción de leche de la lactancia anterior ajustada a 305 días, el grado de condición corporal y el número de partos como covariables. Para este análisis se utilizó el PROC MIXED del programa estadístico SAS33.
Resultados
Consumo de materia seca
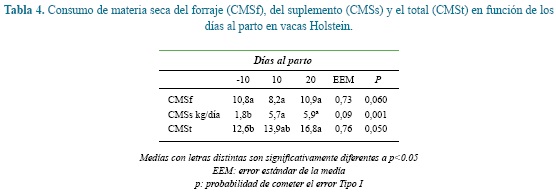
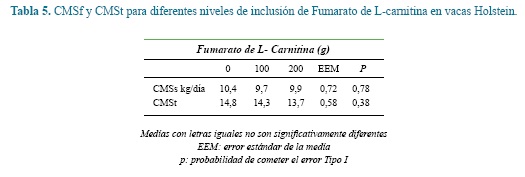
El consumo de materia seca (CMS) del forraje (CMSf), el suplemento (CMSs) y total (CMSt) no fueron afectadas por la interacción entre el día de muestreo y la adición del fumarato de L-carnitina. El CMSs y CMSt fueron El CMSf y CMSt no fueron afectados por los diferentes afectados por los días de muestreo como se muestra en la niveles de inclusión de fumarato de L-carnitina como se tabla 4. CMSf tendió a ser más bajo al día 10 posparto. muestra en la tabla 5.
Discusión
El CMSf tendió a ser menor el día 10 posparto sin que hubiese diferencia entre los días -10 y 20 posparto. Pocos son los trabajos que han registrado el CMSf en pastoreo alrededor del parto. En un trabajo realizado en el mismo centro agropecuario Paysandú se estimó que el consumo de pasto kikuyo en vacas Holstein fue más bajo a los tres días posparto luego del retiro de las crías pero fue similar el día 7 pre- y posparto27. El CMSf reportado por este autor (8,5 kg/de MS/vaca/d) fue más bajo que el hallado en este trabajo el día 7 pre y posparto. Otros autores, sin embargo, han reportado CMSf más altos que los hallados aquí pero trabajado con vacas en estabulación y con raciones completamente mezcladas (RCM). Así, se ha reportado que el CMSt de vacas Holstein consumiendo una ración a base de ensilaje de maíz y alfalfa y heno de gramínea, fue de 14,0 kg/vaca el día -11 y de 18,0 kg/ vaca el día 11 posparto mientras que el día 21 fue de 20,8 kg/vaca de MS, valores más altos que los encontrados en este trabajo35. A su vez se ha encontrado que el CMSt de vacas Holstein consumiendo heno de pasto bermuda y ensilaje de maíz como base forrajera, mostraron un CMSt el día -10 de 11,5 kg/vaca, el día 10 posparto de 14,0 kg/vaca mientras que el día 20 posparto fue de 18,5 kg/vaca, valores ligeramente más altos que los hallados en este trabajo18. Otros autores evaluaron el CMSt en dietas a base de forraje variando la cantidad de inclusión, encontrando que el CMSt el día -10 fue de 16,0 kg/vaca para la dieta con menor porcentaje (77%) de inclusión de forraje y de 14,5 kg/vaca en la dieta que contenía un mayor porcentaje (87%) de inclusión40. Los valores encontrados en el presente trabajo son un poco bajos en comparación con estos autores, aunque los porcentajes de forraje en la dieta tanto de estos autores como los de este trabajo son semejantes; así mismo, el valor de CMSt al día 10 posparto para estos autores fue similar en ambos experimentos encontrando un valor de 19,7 kg/ vaca, el cual es alto comparado con los valores posparto obtenidos en el presente trabajo. El bajo CMSt en este trabajo pudo ser debido al mayor contenido de FDN en el forraje de pasto kikuyo (61,6%), comparado con el de las dietas ofrecidas a las vacas en el (41,3%) por estos autores40.
Los resultados encontrados en cuanto al CMSf y CMSt (Tabla 5) coinciden con los reportados cuando se evaluaron diferentes niveles de inclusión de L-carnitina (hasta 100g/ vaca/día), en vacas estabuladas entre el día -14 antes y 21 posparto5. Otros autores tampoco encontraron diferencias significativas en el CMSt cuando suministraron diferentes niveles de inclusión de L-carnitina tanto por infusión abomasal como suministrada en el alimento a vacas lactantes durante periodos de muestreo de hasta 21 días 6,21,22. Este tipo de respuesta frente a la L-Carnitina no es exclusiva de rumiantes ya que se han reportado trabajos donde se suministraron diferentes niveles de inclusión de L-carnitina en no rumiantes en diferentes etapas productivas, sin que se observe efecto de este compuesto sobre el consumo de alimento 42,30,32. Se ha propuesto que la L-carnitina asociada al mecanismo de transporte de los ácidos grasos, podría asociarse con el consumo a través de su papel en la oxidación de lípidos en el hipotálamo modulando el balance energético. Ellos encontraron que al disminuir la actividad de transporte se redujo el consumo de alimento así como la producción endógena de glucosa26. Se ha encontrado que cerdos con 35 días de edad suplementados con 50mg/kg de MS de L-carnitina incrementaron el CMS. Sin embargo estos autores no logran explicar esta respuesta aunque postulan que en cerdos recién destetados la síntesis endógena de L-carnitina puede ser insuficiente para cubrir las demandas metabólicas9. Autores señalan que en el caso de las vacas durante el posparto temprano se presentan una serie de ajustes metabólicos que determinan, entre otras respuestas, el incremento en la síntesis de novo de L-Carnitina que podría cubrir las demandas metabólicas asociadas al transporte de ácidos grasos al interior de la mitocondria lo que podría explicar la falta de efecto que en algunos trabajos se ha observado ante la suplementación con este compuesto34.
Bajo las condiciones experimentales en las que se realizó la investigación el suministró de Fumarato de L-carnitina durante el periodo de transición a lactancia no afectó el consumo de materia seca debido a que no se indujeron cambios significativos en sus mecanismos fisiológicos reguladores, esto fue confirmado a través de la variación fisiológica observada en el consumo de mataría seca durante este periodo, la cual es debida a los cambios hormonales y en la capacidad digestiva propios del periodo de transición.
Agradecimientos
Este trabajo está enmarcado dentro del proyecto titulado: Desarrollo y Validación de un Protocolo de Suministro de Factores Lipotrópicos a Vacas Lecheras Durante el Periodo de Transición a la Lactancia. Financiado por Colciencias en su convocatoria 521 y cofinanciado por la Universidad Nacional de Colombia, Sede Medellín.
Referencias
1. Allen MS, Bradford BJ, Harvatine KJ. 2005. The Cow as a Model to Study Food Intake Regulation. Annual Review of Nutrition; 25: 523-47. [ Links ]
2. Allen MS, Bradford BJ, Oba M. 2009. BOARD INVITED REVIEW: The Hepatic Oxidation Theory of the Control of Feed Intake and its Application to Ruminants. Journal of Animal Science; 87:3317-3334. [ Links ]
3. AOAC. 2005. Association of Official Analytical Chemists International (AOAC). Official methods of analysis of AOAC International. 18th edition. Maryland, [ Links ] USA.
4. Bell, AW. 1995. Regulation of organic nutrient metabolism during transition from late pregnancy to early lactation. Journal of animal science; 73:28042819. [ Links ]
5. Carlson DB, McFadden JW, D'Angelo A, Woodworth JC, y Drackley JK. 2007. Dietary l-Carnitine Affects Periparturient Nutrient Metabolism and Lactation in Multiparous Cows. Journal of dairy science; 90:3422-3441. [ Links ]
6. Carlson, DB, Litherland NB, Dann HM, Woodworth JC, y Drackley JK. 2006. Metabolic effects of abomasal L-carnitine infusion and feed restriction in lactating Holstein cows. Journal of dairy science; 89 (12): 4819-34. [ Links ]
7. Correa HJ, Pabón ML y Carulla JE. 2009. Estimación del consumo de materia seca en vacas Holstein bajo pastoreo en el trópico alto de Antioquia. Livestock Research for Rural Development. Volumeb 21, Articulo #59. [acceso: septiembre 18 de 2014]. URL: http://www.lrrd.org/lrrd21/4/corr21059.htm. [ Links ]
8. Cuellar A. 1998. Plan de alimentación centro Paysandú. Tesis de pregrado. Universidad Nacional de Colombia, Sede Medellín. [ Links ]
9. Defa L, Qiao Q, Johnson EW, Jiang J, Wang F, Blum R, Allee G.1999. Effect of L-Carnitine and Source of Dietary Fat on Growth Performance and Serum Biochemical Parameters of Piglets Weaned at 35 Days of Age. Asian-Australasian Journal of Animal Sciences; 12(8): 1263-1272. [ Links ]
10. Drackley JK, Dann HM, Douglas GN, Janovick NA, Litherland NB.
11. 2005. Physiological and pathological adaptations in dairy cows that may increase susceptibility to periparturient diseases and disorders. Italian Journal of Animal Science; Volumen 4: 323-344.
12. Emery RS, James SL, Thomas HH. 1992. Metabolism of Long Chain Fatty Acids by Ruminant Liver. Journal of Nutrition; Volumen 122 (Suppl. 3): 832 -837. [ Links ]
13. Forbes, JM. 1977. Interrelationships between physical and metabolic control of voluntary food intake in fattening, pregnant and lactating mature sheep: a model. Animal Science; Volumen 24: 91-101. [ Links ]
14. Geerken, C.M., Calzadilla, D. y González, R. 1987. Aplicación de la técnica de dos marcadores para medir el consumo de pasto y la digestibilidad de la ración de vacas en pastoreo suplementadas con concentrado. Pastos y forrajes, 10: 266-273. [ Links ]
15. Grummer RR, Mashek DG, Hayirli A. 2004. Dry matter intake and energy balance in the transition period. The Veterinary Clinics of North America. Food Animal Practice; 20(3):447-470. [ Links ]
16. Grummer, R R. 1993. Etiology of Lipid-Related Metabolic Disorders in Periparturient Dairy Cows. Journal of Dairy Science; 76 (12): 3882-3896. [ Links ]
17. Gunter SA, Judkins MB, Krysl LJ, Broesder JT, Barton RK, et al. 1990. Digesta kinetics, ruminal fermentation characteristics and serum metabolites of pregnant and lactating ewes fed chopped alfalfa hay. Journal of Animal Science 68 (11): 3821-3831. [ Links ]
18. Hayirli A, Grummer RR, Nordheim EV, Crump PM. 2002. Animal and Dietary Factors Affecting Feed Intake During the Prefresh Transition Period in Holsteins. Journal of Dairy Science 85 (12): 3430-43. [ Links ]
19. Holcomb CS, Van Horn HH, Head HH, Hall MB, Wilcox CJ. 2001. Effects of prepartum dry matter intake and forage percentage on postpartum performance of lactating dairy cows. Journal of Dairy Science 84 (9): 2051-58. [ Links ]
20. Holdridge LR.1978. Ecología basada en zonas de vida. San José, Costa Rica: Instituto Interamericano de Ciencias Agrícolas.
21. Ingvartsen KL, Andersen JB. 2000. Integration of Metabolism and Intake Regulation: A Review Focusing on Periparturient Animals. Journal of Dairy Science 83 (7): 1573-97. [ Links ]
22. LaCount DW, Drackley JK, Weigel DJ. 1995. Responses of Dairy Cows During Early Lactation to Ruminal or Abomasal Administration of L-Carnitine. Journal of Dairy Science 78 (8): 1824-36. [ Links ]
23. Lacount DW, Emmert LS, Drackley JK. 1996. Dose Response of Dairy Cows to Abomasal Administration of Four Amounts of L-Carnitine. Journal of Dairy Science 79 (4): 591-602. [ Links ]
24. Lippke H. 2002. Estimation of forage intake by ruminants on pasture. Crop Science Society of America. 42 (3): 869-872. [ Links ]
25. Littell RC, Henry PR, Ammerman CB. 1998. Statistical Analysis of Repeated Measures Data Using SAS Procedures. Journal of Animal Science 76 (4): 1216-1231. [ Links ]
26. Nutrient Requirements of Dairy Cattle. 2001. National Academies Press. pp 405. [acceso: septiembre 20 de 2014]. URL: http://site.ebrary.com/id/10032374. [ Links ]
27. Obici S, Feng Z, Arduini A, Conti R, Rossetti L. 2003. Inhibition of hypothalamic carnitine palmitoyltransferase-1 decreases food intake and glucose production. Nature Medicine 9 (6): 756-761. [ Links ]
28. Orrego CD. 2014. Estimación del consumo de forraje en vacas Holstein durante el periparto temprano y su relación con el metabolismo energético, proteico y mineral. Tesis de posgrado. Universidad Nacional de Colombia- Sede Medellín. pag. [ Links ]
29. Overton TR. 2012. Managing energy metabolism in transition dairy cows. Four-State Dairy Nutrition and Management Conference, Junio 13-14,Dubuque, Iowa, pp: 86-91. [acceso: septiembre 23 de 2014]. URL: http://livestocktrail.illinois.edu/uploads/dairynet/papers/Managing%20Energy%20Overton.pdf. [ Links ]
30. Owen KQ, Jit H, Maxwell CV, Nelssen JL, Goodband RD, et al. 2001. Dietary L-Carnitine Suppresses Mitochondrial Branched-Chain Keto Acid Dehydrogenase Activity and Enhances Protein Accretion and Carcass Characteristics of Swine. Journal of Animal Science 79 (12): 3104-3112. [ Links ]
31. Parizadían B, Ahangari YJ, Shargh MS, Sardarzade A. 2011. Effects of Different Levels of L-carnitine Supplementation on Egg Quality and Blood Parameters of Laying Japanese Quail. International Journal of Poultry Science 10 (8): 621-625. [ Links ]
32. Reynolds CK, Aikman PC, Lupoli B, Humphries DJ, Beever DE. 2003. Splanchnic Metabolism of Dairy Cows During the Transition From Late Gestation Through Early Lactation. Journal of Dairy Science 86 (4): 1201-1217. [ Links ]
33. Sarica S, Corduk M, Kilinc K. 2005. The Effect of Dietary L-Carnitine Supplementation on Growth Performance, Carcass Traits, and Composition of Edible Meat in Japanese Quail (Coturnix Coturnix Japonica). The Journal of Applied Poultry Research 14 (4): 709-715. [ Links ]
34. SAS Institute. 1998. SAS User's Guide: Statistics (Version 8). Cary NC: the Institute. [ Links ]
35. Schlegel G, Keller J, Hirche F, Geißler S, Schwarz FJ, et al. 2012. Expression of genes involved in hepatic carnitine synthesis and uptake in dairy cows in the transition period and at different stages of lactation. BMC Veterinary Research 2012, 8:28. [acceso: octubre 15 de 2014]. URL: http://www.biomedcentral.com/1746-6148/8/28. [ Links ]
36. Smith KL, Waldron MR, Drackley JK, Socha MT, Overton TR. 2005. Performance of dairy cows as affected by prepartum dietary carbohydrate source and supplementation with chromium throughout the transition period. Journal of dairy science 88 (1): 255-263. [ Links ]
37. Spaniol M, Kaufmann P, Beier K, Wüthrich J, Török M, et al. 2003. Mechanisms of liver steatosis in rats with systemic carnitine deficiency due to treatment with trimethylhydraziniumpropionate. Journal of Lipid Research 44 (1): 144-153. [ Links ]
38. Sunvold GD, Cochran RC. 1991. Technical note: evaluation of acid detergent lignin, alkaline peroxide lignin, acid insoluble ash, and indigestible acid detergent fiber as internal markers for prediction of alfalfa, bromegrass, and prairie hay digestibility by beef steers. Journal of animal science 69 (12): 4951-4955. [ Links ]
39. Van Soest P J, Robertson J. 1985. Analysis of forages and fibrous of the feeds. Cornell University, Ithaca, New York. Laboratory manual for animal science.
40. Vaz FM, Wanders RJ. 2002. Carnitine Biosynthesis in Mammals. The Biochemical Journal 361(3): 417-29. [ Links ]
41. Vickers LA, Weary DM, Veira DM, Von Keyserlingk MA. 2013. Feeding a Higher Forage Diet Prepartum Decreases Incidences of Subclinical Ketosis in Transition Dairy Cows. Journal of Animal Science 91 (2): 886-894. [ Links ]
42. Wallis De Vries MF. 1995. Estimating Forage Intake and Quality in Grazing Cattle: A Reconsideration of the Hand-Plucking Method. Journal of Range Management; Vol. 48, No. 4, pp. 370-375. [acceso: septiembre 20 de 2014]. URL: http://www.jstor.org/stable/4002491. [ Links ]
43. Weeden TL, Hansen JA, Fitzner GE, Li DF, Blum SA, et al. 1990. Effect of L-carnitine on starter pig performance and fat utilization. Conference: Swine Day, Manhattan. Kansas State University. Agricultural Experiment Station and Cooperative Extension Service. pp: 56-61. [acceso: octubre 01 de 2014] URL: http://krex.k-state.edu/dspace/handle/2097/3642. [ Links ]