Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Medicina Veterinaria y Zootecnia
On-line version ISSN 1900-9607
Ces. Med. Vet. Zootec. vol.11 no.1 Medellín Jan./June 2016
Artículos originales de investigación
Extraction, quantification and distribution of the major lipid fractions in small liver biopsies of cows in transition period¤
Extracción, cuantificación y distribución de las principales fracciones lipídicas en pequeñas biopsias de hígado de vacas en el periodo de transición
Extracão, quantificação e distribuição das principais frações lipídicas em pequenas biópsias de fígado de vacas em período de transição
Rubén Darío Galvis Góez1*, Z, MSc, cDrSc; Nicolás Fernando Ramírez Vásquez2, MV, MSc, cDrSc; Ángel Giraldo Mejía1 , Z, MSc, DrSc.
¤Para citar este artículo: Galvis Góez RD, Ramírez Vásquez NF, Giraldo Mejía A. Extracción, cuantificación y distribución de las principales fracciones lipídicas en pequeñas biopsias de hígado de vacas en el periodo de transición. Rev. CES Med. Zootec. 2016; Vol 11 (1): 26-38..
*Autor para correspondencia: Rubén D. Galvis Góez. Universidad Nacional de Colombia, Sede Medellín, Calle 59a No 63-20 Bloque 50 Oficina 202. Medellín, Colombia. Email: rdgalvis@unal.edu.co
1 Grupo de Investigación en Interacciones Nutricionales, Metabólicas y Reproductivas en Bovinos. Departamento de Producción Animal, Universidad Nacional de Colombia - Sede Medellín
2 Grupo Centauro, Escuela de Medicina Veterinaria, Facultad de Ciencias Agrarias, Universidad de Antioquia
(Recibido: 30 de noviembre, 2015; aceptado: 15 de abril, 2016)
Abstract
There are difficulties in understanding changes in the distribution of the major lipid fractions in the liver of dairy cows due to the need for invasive techniques for sampling and relatively large quantities of sample needed for analysis. The objective of this research was to integrate a method for extracting total lipid (TL) with the enzymatic determination of its fractions in small biopsies. Liver biopsies from 60 Holstein cows in the transition period (between day 270 of gestation and 20 postpartum) underwent TL extraction using Hexane-Isopropanol mixture. TL obtained was dissolved in hexane, several aliquots of different volumes were used for the enzymatic determination of: triglycerides (TG), phospholipids (PL), total cholesterol (TC) and free fatty acids (FFA). The amount of liver sample used was 49.6 mg ± 18.45mg (Mean ± Standar Deviation). The average was 7.20% TL. The average coefficient of variation (CV) in TL extraction was 7.62%. TL. TG, PL, TC and FFA represented 52.5%; 18.30%; 19.30% and 0.41% respectively of the TL. CV for enzimatic determinations of TG, PL, TC and FFA were: 5.2%; 9.9%; 6.1% and 4.0% respectively, indicating that this method is suitable for determination of lipid fractions in small liver samples. High correlation coefficient was observed between TL and TG (0.96); while for TL and PL was -0.42; and for TL and TC -0.62; It is indicating that the increase in hepatic lipid occurred mainly in the TG fraction and consequently showed a relative decrease in the fractions PL and TC.
Key words: Hepatic lipidosis, liver composition, methods, peripartum.
Resumen
Existen dificultades para conocer los cambios en la distribución de las principales fracciones lipídicas en el hígado de las vacas lecheras debido a la necesidad de técnicas invasivas para su muestreo y de cantidades relativamente grandes de muestra para su análisis. El objetivo de esta investigación fue integrar un método para la extracción de lípidos totales (LT) con la determinación enzimática de sus diferentes fracciones en pequeñas biopsias. Biopsias hepáticas provenientes de 60 vacas Holstein en el periodo de transición (entre el día 270 de gestación y 20 posparto) fueron sometidas a la extracción de LT utilizando una mezcla Hexano-Isopropanol. Los LT obtenidos fueron disueltos en hexano, varias alícuotas de diferentes volúmenes fueron utilizados para la determinación enzimática de: triglicéridos (TG), fosfolípidos (FL), Colesterol total (CT) y Ácidos Grasos Libres (AGL). La cantidad de muestra hepática utilizada fue 49.6 mg ±18.45mg (Media ± Desviación estándar). El promedio de LT fue 7.20%. El coeficiente promedio de variación (CV) en la extracción de LT fue 7,62%. Los TG, FL, CT y AGL representaron el: 52,5%; 18,30%; 19,30% y 0.41% de los LT respectivamente. Los CV para las determinaciones enzimáticas de TG, FL, CT y AGL fueron: 5,2%; 9,9%; 6,1% y 4,0% respectivamente, indicando que la determinación de las principales fracciones lipídicas en pequeñas biopsias de hígado se puede realizar de manera confiable a partir de una única muestra. Se observó un coeficiente de correlación alto entre: LT y TG (0,96); mientras que para LT y FL fue de -0,42; y para LT y CT de -0,62; lo que indicó que el aumento en los lípidos hepáticos ocurrió principalmente en la fracción TG, y en consecuencia presentó una disminución relativa en la fracciones FL y CT.
Palabras clave: Composición hepática, lipidosis hepática, métodos, periparto.
Resumo
Há dificuldades para compreender mudanças na distribuição das principais frações lipídicas no fígado de vacas leiteiras, devido à necessidade de técnicas invasivas para a amostragem e quantidades relativamente grandes de amostra necessárias para análise. O objetivo desta pesquisa foi o de integrar um método para extrair lipídios totais (LT) com a determinação enzimática de suas frações em pequenas biopsias de fígado. As biópsias do fígado de 60 vacas da raça Holandesa no período de transição (entre o dia 270 de gestação e 20 pós-parto) foram submetidos a extração de LT usando mistura hexano-isopropanol. LT obtido foi dissolvido em hexano, foram usadas várias aliquotas de volumes diferentes para a determinação enzimática de: triglicéridos (TG), fosfolipidos (FL), colesterol total (CT) e os ácidos gordos livres (AGL). A quantidade de amostra utilizada fígado foi de 49,6 mg ±18.45mg (Média ± desvio padrão). A média dé % de LT foi de 7,20. O coeficiente médio de variação (CV) na extração de LT foi 7,62%. TG, FL, CT e AGL representou 52,5%; 18,30%; 19,30% e 0,41%, respectivamente, da LT. CV para determinação enzimática de TG, FL, CT e AGL foram: 5,2%; 9,9%; 6,1% e 4,0%, respectivamente, indicando que este método é adequado para a determinação das fracções de lipídios em pequenas amostras de fígado. Foram observados altos coeficientes de correlação entre LT e TG (0,96); ao passo que para LT e FL foi -0,42; e para LT e CT foi -0,62; indicando que o aumento no lipídio hepático ocorre principalmente na fracção de TG e, consequentemente se apresentou uma diminuição relativa nas fracções FL e CT
Palavras-chave: Fígado composição, lipidose hepática, métodos, periparto.
Introducción
La caracterización, distribución y cuantificación de las fracciones constituyentes de los lípidos hepáticos tiene importancia significativa en el estudio de los desórdenes metabólicos de las vacas lecheras. Una dificultad a su aproximación radica en la consecución de muestras de hígado representativas y en cantidades adecuadas sin afectar la salud, bienestar y desempeño normal de los animales.
Anterior a Hara y Radin (1978)9 los métodos de extracción de lípidos de tejidos animales requerían complejos pasos y utilizaban solventes muy tóxicos y nocivos para el medio ambiente. Pese a las grandes ventajas del método de Hara y Radin (1978)9, este fue desarrollado utilizando cantidades relativamente grandes de muestra, lo que dificultaba su aplicación en pequeñas biopsias hepáticas. Posteriormente Rodriguez y Peinado (2005)17 adaptaron el método para pequeñas muestras de hígado de ratón, indicando buenos resultados en la extracción de los lípidos totales (LT) pero con resultados muy variables en la cuantificación enzimática de triglicéridos (TG) debido a interferencias con el detergente utilizado.
Starke et al. (2010)20, realizaron pequeñas modificaciones al método de Hara y Radin (1978)19, lo utilizaron en pequeñas muestras de hígado bovino (100 mg), cambiaron el detergente utilizado en la solubilización del extracto lipídico y obtuvieron coeficientes de variación mínimos en la cuantificación de triglicéridos. Sin embargo estos resultados probablemente no son replicables en pequeñas muestras de hígado completadas a partir de biopsias transcútaneas muy pequeñas, pues estos autores obtuvieron las muestras a partir de grandes cortes hepáticos (1g) obtenidos por cirugía.
Varios investigadores han reportado la concentración de algunas fracciones lipídicas en el hígado de bovinos, todos los casos se han enfocado en los TG, muy pocos de ellos también hacen relación a los fosfolípidos (FL) o al colesterol total (CT) y ninguno de ellos a los ácidos grasos libres (AGL). Sin embargo el conocimiento de la distribución de las diferentes fracciones en los LT y sus cambios relativos según el grado de lipidosis, u otros factores de interés (metabolitos sanguíneos, suministro de nutrientes, etapa fisiológica, entre otros) podrían arrojar información útil para la comprensión, prevención y tratamiento de los desórdenes metabólicos de las vacas lecheras.
El principal objetivo de esta investigación fue determinar si era posible realizar la extracción de los lípidos totales y la cuantificación enzimática de sus principales fracciones (TG, CT, FL y AGL) con exactitud y precisión a partir de una única muestra muy pequeña de hígado bovino (50 mg) colectada a partir de biopsias transcutáneas muy pequeñas (15 mg). El objetivo secundario fue determinar la distribución relativa de las diferentes fracciones en un grupo de muestras de hígado provenientes de vacas lecheras en el periodo de transición.
Materiales y métodos
Biopsia hepática
Esta investigación fue aprobada por el comité de ética en investigación de la Universidad Nacional, sede Medellín, en su comunicado CEMED 200.
Fueron utilizadas 60 vacas Holstein en el periodo de transición a la lactancia (entre el día 270 de gestación y 20 posparto), que pastoreaban praderas kikuyo (Cenchrus clandestinus) y recibían suplementación alimenticia y mineral con base en suplementos comerciales. Se les extrajeron biopsias de hígado utilizando una técnica descrita previamente1. Para esto se utilizó una aguja para biopsia (17 G x 200 mm (Tru-cut®, Care Fusion UK), la cual se introduce entre el 11avo espacio intercostal a nivel del trocánter mayor. Luego de que ésta área es rasurada, desinfectada y anestesiada (10 ml de lidocaína 20 mg/ml) se realiza una incisión por la cual se introduce la aguja en dirección perpendicular al hígado; cuando la aguja se introduce en el hígado, esta se retrae sobre su eje, extrayendo el tejido hepático; se conduce hacia afuera y se separa de la muestra sumergiendo la punta de la aguja en viales de 2 ml conteniendo 1,5 ml de solución Hartmann estéril. Se obtuvieron muestras de aproximadamente 15 mg de tejido hepático en cada punción, realizando hasta 9 punciones por sección de muestreo. Todas las muestras se almacenaron a -10 ºC para su transporte y a - 72 ºC hasta su análisis. Los animales (n=60) fueron observados en los días 30 días posteriores a las biopsias, sin que ninguno presentara complicaciones asociadas al procedimiento.
Obtención del extracto lipídico
Los viales de solución Hartmann conteniendo las muestras de hígado se descongelaron a temperatura ambiente, con una pinza se extrajo el tejido hepático y se colocó sobre papel absorbente por 10 segundos para retirar el exceso de humedad y los restos de fibrina. Posteriormente la muestra se colocó en un tubo de tubo fondo redondo, tapa rosca 13 x 100 mm, vidrio (7,5 ml) previamente rotulado y pesado (los tubos fueron secados a 60 °C por 3 horas, rotulados y pesados en una balanza analítica, sensibilidad = 0.1 mg). Seguidamente se procedió a homogenizar manualmente la muestra utilizando un embolo de acero inoxidable. Una vez obtenido el homogenado se pesó nuevamente el tubo. Se sustrajo el peso del tubo vacío y se obtuvo el peso del homogenado fresco de hígado. La extracción de los lípidos totales se basó en la técnica descrita por Starke et al (2010)20 pero con modificaciones introducidas en la presente investigación respecto al método de evaporación de los solventes, las cuales se describen más adelante.
Al tubo conteniendo el homogenado de hígado se le adicionaron 2 ml de una mezcla 3:2 de hexano al 95% e isopropanol. Se verificó el cierre hermético de los tubos y se colocaron en un rotador vertical Bio RS-24 (Boeco, Germany) a 30 rpm y a temperatura ambiente por 24 Horas. Seguidamente a cada tubo se le adicionó 1 ml de una solución (0.455 mmol/l) de sulfato de sodio (Na2 SO4 ). Los tubos fueron llevados al vortex y se evaluó el efecto de su centrifugaron a 1000, 1500 y 2000 g por 10 minutos a temperatura ambiente. Con la centrifugación a gravedades inferiores a 2000 g no se consiguió un precipitado estable. El sobrenadante constituye los solventes con los lípidos disueltos.
El sobrenadante fue traspasado a un tubo similar previamente rotulado y pesado. Para garantizar el enjuague completo del residuo de la muestra 1 ml de hexano fue adicionado de nuevo al precipitado, se llevó al vortex y se centrifugó a 2000 g por 10 minutos a temperatura ambiente, el sobrenadante fue removido y adicionado al sobrenadante previamente traspasado. Para la eliminación total de los solventes cada tubo fue llevado a rota evaporación en un equipo marca IKA modelo MVP 015-2 con sistema de calentamiento por inmersión en baño de agua y control de temperatura a una presión de vacío de 745 mbar, temperatura de calentamiento de 60 °C y velocidad de rotación de 80 rpm.
Con el objeto de eliminar la humedad residual los tubos fueron colocados a 35 °C y 230 mbar por 10 minutos en una estufa de vacío VD 53-UL (Binder, Germany), una vez estabilizada la temperatura de los tubos con la temperatura ambiente cada tubo fue pesado. El peso de los lípidos totales extraídos se calculó por sustracción del peso del tubo vacío. El contenido total de lípidos se calculó gravimétricamente en mg de lípidos totales por gramo de tejido hepático, considerando la cantidad inicial de homogenado hepático utilizado.
Los tubos conteniendo el extracto lipídico fueron tapados y refrigerados hasta la cuantificación de TG, FL, CT y AGL.
Cuantificación de las diferentes fracciones lipídicas en el extracto
De acuerdo con los rangos esperados de concentración para las diferentes fracciones y según los rangos de linealidad en su determinación reportada para los kit comerciales utilizados, se construyeron curvas de calibración con estándares; de igual modo se construyeron curvas de cantidad de extracto lipídico vs absorbancia y de este modo se determinó el grado de sensibilidad de la técnica y su linealidad, a través del coeficiente de regresión lineal. En la presentación de los resultados para la fracción triglicéridos se detalla la construcción de las curvas de respuesta a las diferentes cantidades de muestras ensayada. Para no ser repetitivo, en la presentación de las metodologías de las demás fracciones (FL; CT y AGL) solo se hará referencia al rango de cantidad de extracto lipídico en los que la técnica exhibe sensibilidad y linealidad, indicando su respectivo coeficiente de regresión lineal. Una vez determinada la cantidad optima de extracto lipídico a utilizar para el análisis de cada fracción, un numero variable de muestras seleccionadas al azar (dependiendo del análisis, ver resultados) fueron procesadas por duplicado.
Determinación de la cantidad de extracto lipídico a utilizar.
A los tubos conteniendo el extracto lipídico que en promedio fue de 3.4 mg (+/-1.12 mg) (min=1,6, max=7,5, n=173), se les adicionó 500 µl de hexano (95%), esto con el fin de conseguir suficiente volumen para las determinaciones de triglicéridos, fosfolípidos AGL y colesterol total, y para conseguir diluir los lípidos totales en el intervalo de concentración compatible con estas mismas determinaciones.
Se realizó suficiente vortex en el extracto lipídico diluido y en tubos de reacción de 2 ml se colocaron diferentes cantidades de extracto lipídico de una misma muestra según la fracción a cuantificar. Los tubos de reacción fueron llevados a 35 °C y 230 mbar por 10 minutos en una estufa de vacío VD 53-UL (Binder, Germany), de este modo el hexano fue removido por evaporación y en el tubo de reacción quedaron adheridas las fracciones lipídicas. A cada tubo de reacción se le adicionó una cantidad de solución buffer equivalente al extracto lipídico recibido. La solución buffer contenía 48.1 mmol/l de Difosfato de sodio (Na2 HPO4 ), a pH 7 (ajustada con 5 M de HCl) y 1 μmol/l de Polietilen glicol hexadecil eter, Polioxietilen (20) cetil-eter (Brij58®, Sigma) como detergente no iónico. Posteriormente se aplicó la metodología de cuantificación enzimática respectiva para cada fracción.
TG. Se utilizó un método descrito previamente20 con modificaciones necesarias debido a la menor cantidad de homogenado de hígado procesado y en consecuencia a una menor cantidad de lípidos totales extractados. Se utilizó el kit TRO 100 (sigma, USA) producido para la determinación de triglicéridos en suero. Una lipasa de origen microbiano convierte los triglicéridos en ácidos grasos y glicerol. Este kit acopla una serie de reacciones enzimáticas que a partir del glicerol generan H2 O2 y partir de éste quinoneimina, un compuesto que muestra una absorbancia máxima a 540nm. De este modo el incremento en la absorbancia a 540 nm es directamente proporcional a la concentración de triglicéridos en la muestra.
Lipolisis enzimática
A cada tubo de reacción se le adicionó una cantidad de solución buffer equivalente al extracto lipídico recibido (10, 20, 40, 60 y 80 µl), seguidamente se adicionó agua destilada hasta completar 500 µl y se hizo vortex por 5 segundos. Luego a cada tubo de reacción se le adicionaron 100 µl Triglyceride reagent® (microbial lipase, Sigma T2449) y se llevaron a incubación a 37 °C por mínimo 16 horas (16 a 18 horas). Al cabo de este tiempo se obtuvo la conversión (lipolisis) de los triglicéridos hasta ácidos grasos y glicerol.
Determinación de la cantidad de muestra producto de la lipolisis a analizar
Según con el rango de linealidad reportado para el kit TRO 100 se construyeron curvas de calibración con seis estándares de glicerol equivalentes a un rango de concentración de triestearina entre 0,30 a 10 mg/ ml. Se realizó vortex a los tubos de reacción donde ocurrió la lipolisis enzimática y de cada uno de ellos se extrajeron cinco diferentes cantidades: 10, 20, 40, 80 y 160 µl, se colocaron en tubos de reacción de 2ml, se completó su volumen parcial a 200 µl con agua destilada, posteriormente se adicionaron 800 µl de la mezcla de reactivos para determinar glicerol libre (Free Glycerol Reagent®, F 6428. Sigma. USA), se hizo vortex y se incubó a 37 °C por 5 minutos. Se transfirió el contenido de cada tubo a celdas de cuarzo con paso de luz de 10 mm y se leyó la absorbancia a 540 nm en un espectrofotómetro Genesys 10S UV-Vis (ThermoScientific, USA). Las lecturas de absorbancia permanecieron estables por al menos dos horas.
Fosfolípidos
Se utilizó el kit Phospholipids C® (Wako, USA) producido para la determinación de fosfolípidos en suero. En este método los fosfolípidos presentes en la muestra (lecitina, lisolecitina, esfingomielina) son hidrolizados liberando colina, la cual es oxidada generando H2 O2. El H2 O2 produce la condensación oxidativa de 4-aminoantipirina y DAOS (N-Etil-N-(2-hidroxi-3-sulfopropil)-3,5-dimetoxianilina) formándose un compuesto que expresa máxima absorbancia a 600nm. La absorbancia allí generada es directamente proporcional a la cantidad de H2 O2.
Según el rango de concentración esperado y la linealidad reportada para el kit se construyeron curvas de calibración con cinco estándares de cloruro de colina equivalentes a un rango de concentración de fosfolípidos entre 0,375 a 5,96 mg/ml.
A cada tubo de reacción se le adicionó una cantidad de solución buffer equivalente al extracto lipídico recibido (2,5; 5,0; 10, 20 y 40 µl), seguidamente se adicionó agua destilada hasta completar 40 µl y se hizo vórtex por 5 segundos. Seguidamente se adicionó 1,5 ml de la mezcla de reactivos, se incubo a 37 °C por 5 minutos y se leyó la absorbancia a 600 nm.
Ácidos Grasos Libres
Se utilizó el kit NEFA (Randox UK) producido para la determinación de AGL en suero y plasma. En este método los AGL presentes en la muestra son activados con Coenzima A y luego oxidados, esta oxidación produce H2 O2, El H2 O2 produce la condensación de 4-aminoantipirina y TOOS N-Etil-N-(2-hidroxi-3-sulfopropil)-m-toluidina, formándose un compuesto que expresa máxima absorbancia a 550 nm. La absorbancia allí generada es directamente proporcional a la cantidad AGL.
Acorde con el rango de concentración esperado y la linealidad reportada para el kit se construyeron curvas de calibración con cuatro estándares de AGL en un rango de concentración de 0,25 a 2,0 mmol/L.
A cada tubo de reacción se le adicionó una cantidad de solución buffer equivalente al extracto lipídico recibido (2.0, 4.0, 8.0, 16 y 32 µl), seguidamente se adicionó agua destilada hasta completar 32 µl y se hizo vortex por 5 segundos. Posteriormente se adicionó 330 µl la mezcla reactiva 1 y se incubó a 37 °C por 10 minutos. Luego se adicionaron 660 µl de la mezcla reactiva 2, se llevó nuevamente a incubación a 37 °C por 10 minutos y se leyó la absorbancia a 550 nm.
Colesterol total
Se utilizó el kit Cholesterol® oxidasa/peroxidasa (BioSystems, Spain). En este el colesterol esterificado es hidrolizado a colesterol libre y ácido graso, el colesterol libre es oxidado generando H2 O2, El H2 O2 reacciona con 4-aminoantipirina y fenol produciendo quinoneimina, un compuesto que expresa máxima absorbancia a 500nm. La absorbancia allí generada es directamente proporcional a la cantidad de colesterol.
Acorde con el rango de concentración esperado y la linealidad reportada para el kit se construyeron curvas de calibración con cinco estándares de colesterol en un rango de concentración de 50 a 800 mg/dL.
A cada tubo de reacción se le adicionó una cantidad de solución buffer equivalente al extracto lipídico recibido (2.5, 5.0, 10, 20 y 40, 80 y 100 µl), seguidamente se adicionó agua destilada hasta completar 100 µl y se hizo vortex por 5 segundos. Posteriormente se adicionó 1 ml de la mezcla reactiva y se incubó a 37 °C por 5 minutos y se leyó la absorbancia a 500 nm.
Distribución de las fracciones lipídicas en el extracto lipídico
En un grupo de 20 muestras independientes se realizó la cuantificación completa de las fracciones TG, FL, AGL y CT, a partir de este último se estimó la concentración de colesterol libre (CL) y esterificado utilizando el valor (25:75) de las proporciones reportadas previamente para estas fracciones (Uchida et al., 1995, y Kessler et al., 2014)21, 11. La cantidad de éster de colesterol (EC) se estimó utilizando el peso molar de 625.062 g para el palmitato de colesterol (Sigma-Aldrich C78607).
Análisis estadísticos
La sensibilidad y linealidad en la determinación de cada fracción lipídica se determinó a través de análisis de regresión lineal simple. Para tal efecto se construyeron curvas de calibración en el rango de concentraciones esperadas para cada fracción. De igual modo se construyeron curvas de cantidad de extracto lipídico vs absorbancia.
La repetibilidad en la determinación de cada una de las fracciones se determinó a través del coeficiente de variación promedio de un grupo de muestras analizadas por duplicado.
Para el contenido de lípidos totales y para cada una de las fracciones contenidas en él, se realizó estadística descriptiva presentando el promedio, la desviación estándar, el valor máximo y el valor mínimo. La correlación entre las diferentes fracciones lipídicas se evalúo a través del coeficiente de correlación de Pearson. Todas las determinaciones estadísticas se realizaron con el programa SAS (SAS Institute Inc., Cary, NC, 1988)..
Resultados
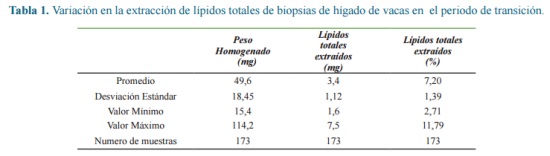
Obtención del extracto lipídico La tabla 1 presenta la variación en los lípidos totales extraídos de biopsias de hígado de vacas en el periodo de transición. El coeficiente promedio de variación en la extracción de lípidos totales para una misma muestra fue de 7,62 % (n=10). TG
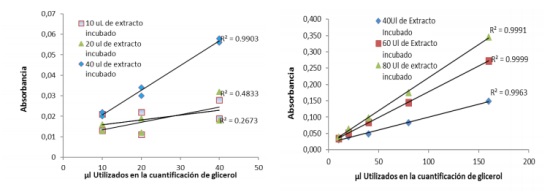
Determinación de la cantidad de extracto lipídico diluido a someter a lipolisis. Triplicados de 10, 20 y 40l de una misma muestra fueron sometidos a lipolisis, una vez completada, duplicados de 10, 20 y 40 µl fueron utilizados para cuantificar la concentración de glicerol libre. Las absorbancias obtenidas se presentan en la figura 1.
Debido a los bajos coeficientes de correlación con 10 y 20 µl de extracto y para confirmar el aceptable coeficiente de correlación obtenido con 40 µl de extracto lipídico, valores crecientes de: 40, 60 y 80 µl de extracto lipídico fueron sometidos a lipolisis. Una vez completada de cada uno se tomaron. 10, 20, 40, 80, 160 µl para cuantificar la concentración de glicerol libre. Las absorbancias obtenidas se presentan en la figura 2.
De las figuras 1 y 2 se concluye que no es confiable la determinación con cantidades inferiores a 40 µl para ser sometido a lipolisis, cantidades superiores a este valor presentaron coeficientes de regresión lineal altos (R² > 0,99). Respecto a la cantidad de muestra para la determinación de glicerol, se observa como valores superiores a 40 µl permiten una mayor diferenciación entre muestras con concentraciones muy cercanas entre sí. El coeficiente de variación promedio para la determinación de TG en el proceso de lipolisis fue de 5.2% (n=40) y en la cuantificación de glicerol fue de 4.1% (n=25). En cinco muestras que presentaron absorbancias muy altas se le cuantificó la concentración de glicerol libre previamente antes de ser sometidas a lipolisis, encontrando que en
promedio el glicerol libre presente en el extracto lipídico representó tan solo el 5,31 ± 2.37% del total cuantificado posterior a la lipolisis.
El porcentaje de TG en hígado fresco fue de 3.89 ± 1.25%, (n=173)
Fosfolípidos
Determinación de la cantidad de extracto lipídico a analizar. Una misma muestra de extracto lipídico se utilizó en dos ensayos independientes, en cada ensayo a cinco diferentes cantidades de extracto lipídico: 2,5; 5,0; 10, 20 y 40 µl, se les cuantifico la concentración de fosfolípidos por duplicado. Se obtuvo un coeficiente de regresión lineal de 0,9728, indicando buena sensibilidad y linealidad en el rango de extracto lipídico utilizado. Sin embargo, cantidades de extracto lipídico superiores a 10 µl incrementaron la variabilidad en la determinación de FL. Se obtuvo nuevamente el coeficiente de regresión lineal para los valores de 2,5; 5 y 10 µl, este ascendió a 0,99. Con base en estos resultados se determinó que una cantidad de 10 µl de extracto lipídico es la cantidad óptima para la determinación de fosfolípidos. Con este parámetro 100 muestras fueron analizadas en duplicado encontrando un coeficiente de variación promedio de 9,9% (n=100).
La concentración promedio de FL en hígado fresco fue de 1,31 ± 0,35%.
Ácidos Grasos Libres
En cinco diferentes cantidades de extracto lipídico de una misma muestra: 2,0; 4,0; 8,0; 16 y 32 µl se cuantificó la concentración de AGL. Se obtuvo un coeficiente de regresión lineal de 0,9932, indicando que el método tiene buena sensibilidad y linealidad en el rango de extracto lipídico utilizado. Se determinó que 16 µl de extracto lipídico como la cantidad óptima para la determinación de AGL. Con este parámetro 79 muestras diferentes fueron sometidas al análisis de AGL, de las cuales 10 fueron analizadas por duplicado encontrando un coeficiente de variación promedio de 4,0% (n=10).
El promedio de concentración de AGL en hígado fresco fue de 0,037 ± 0,019%.
Colesterol total
En siete diferentes cantidades de extracto lipídico de una misma muestra: 2,5; 5,0; 10, 20, 40, 80 y 100 µl se cuantificó la concentración de colesterol total. Se obtuvo un coeficiente de regresión lineal de 0,9959. Sin embargo en las cantidades menores de extracto lipídico se obtuvo valores muy bajos de absorbancia por lo que se determinó que 100 µl de extracto lipídico sería la cantidad a utilizar. Con este parámetro, 20 muestras fueron analizadas en duplicado, obteniendo un coeficiente de variación promedio de 6,1% (n=20).
El promedio de concentración de CT en hígado fresco fue de 1,35 ± 0,276%.
Distribución de las fracciones lipídicas cuantificadas en los extractos lipídicos de biopsias de hígado bovino
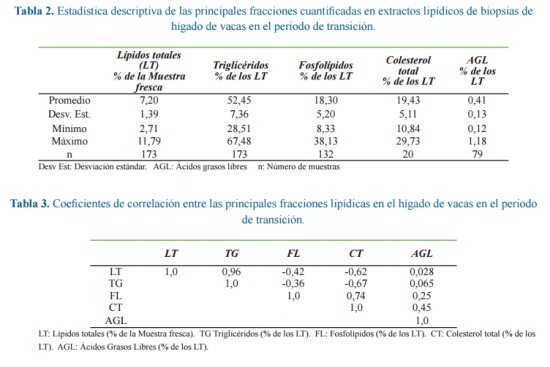
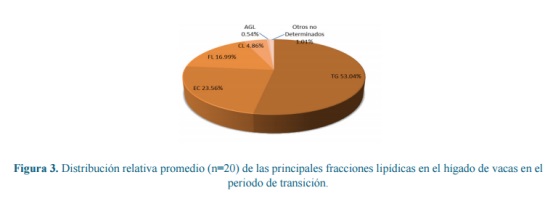
La distribución porcentual de las fracciones en el extracto lipídico para el total de muestras analizadas se presentan en la tabla 2. En la tabla 3 se presentan los coeficientes de correlación entre las fracciones del extracto lipídico para el total de muestras analizadas. Debido a que no todas las muestras fueron sometidas al fraccionamiento total de su extracto lipídico, la figura 3 presenta la distribución de las fracciones del extracto lipídico estimadas en un grupo de 20 muestras independientes
Discusión
Extracción de lípidos
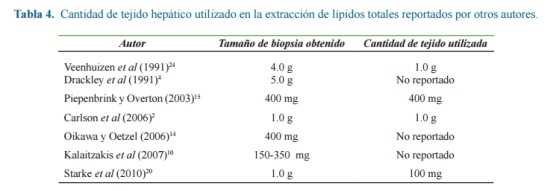
Las biopsias hepáticas utilizadas para la obtención del extracto lipídico fueron considerablemente de menor tamaño comparadas con las reportadas por otros autores (Tabla 3). Solo dos autores (Gross et al., 2013, Sejersen et al., 2012)7, 18 utilizaron entre 40 y 50 mg, sin embargo estos autores utilizaron varios pasos de extracción con cloroformo-tritonX-100 y con cloroformo-metanol respectivamente, los cuales no son deseables debido al riesgo para la salud y el medio ambiente ocasionado por la utilización de estos solventes. En esta investigación se siguió el método de extracción más simple reportado por Starke et al. (2010)20 quienes recomiendan un tamaño de biopsia de 100 mg y dos pasos de extracción con mezcla hexano-isopropanol y hexano respectivamente. No obstante, la menor cantidad de muestra hepática utilizada respecto a Starke et al. (2010)20, (49,6 ± 18,45mg), el procedimiento se realizó con variaciones menores, solo se modificó el proceso de evaporación de solventes.
El % LT obtenido se encuentran en los rangos reportados por Starke et al. (2010)20. Otros autores han realizado extracción de lípidos, sin embargo lo consideran solo un paso previo a la determinación de triglicéridos, por lo que no reportan nada al respecto. Starke et al. (2010)20 reportaron un coeficiente de variación (CV) muy bajo (2,2%, n=10) en la determinación de LT. En nuestra investigación se encontró un CV mayor para la determinación de LT (7,62%, n=10), esta mayor variabilidad pudo deberse a las condiciones en que fueron colectadas las muestras, pues cada muestra que se analizó fue la sumatoria de porciones de tejido obtenidas a través de al menos tres punciones independientes. Por el contrario, Starke et al. (2010)20 tomaron fragmentos de 10 g del lóbulo hepático caudal mediante técnicas quirúrgicas, seguidamente fueron fraccionados hasta 100 mg, los cuales fueron analizados. Como se puede esperar la homogeneidad de las muestras en nuestro trabajo es menor, máxime cuando en cada punción fue necesario cambiar el ángulo de la aguja para obtener el llenado eficaz de la misma, sin embargo esta condición de muestreo permite inferir acerca de la distribución de lípidos totales en una porción mayor del hígado. Al respecto, Starke et al. (2010)20, basados en Gaal y Husveth (1983)6, quienes reportaron que la distribución de grasa en el hígado es homogénea, indican que un único punto de muestreo no es limitante para la determinación exacta de los LT en hígado.
Triglicéridos
La concentración de TG obtenida estuvo en el rango de variación reportada por otros autores (Kalaitzakis et al., 2007, Starke et al., 2010, Gross et al., 2013)10, 20, 7. Debido a la menor cantidad de tejido hepático utilizada respecto a lo reportado por otros autores, la cantidad de extracto lipídico diluido para someter a lipolisis tuvo que ser determinada. Starke et al. (2010)20 reportaron que valores de 10, 20 y 40 µl de extracto lipídico diluido en 1 ml de hexano fueron adecuados cuando 12 µl de la mezcla de incubación fue utilizada para la cuantificación del glicerol liberado. En nuestra investigación con la utilización de 10 y 20 µl diluidos en 0.5 ml no se consiguió linealidad en la determinación, aun utilizando valores relativamente altos en la determinación colorimétrica de glicerol (10, 20 y 40 µl) (Figura 1). La determinación de TG alcanzo repetitividad y linealidad solo cuando se sometió a lipolisis valores superiores a 40 µl de extracto lipídico (Figura 2).
Para una muestra con valores promedio de concentración de LT y TG, con cantidades de extracto lipídico entre 40 y 80 µl se consiguió el rango de sensibilidad y de linealidad de la técnica, inclusive a un rango amplio de cantidad de mezcla de incubación utilizada en la determinación de glicerol libre (10 a 160 µl). Sin embargo se recomienda la utilización de volúmenes altos de muestra para la determinación de glicerol, lo que asegura su cuantificación en muestras con baja concentración y una buena diferenciación entre muestras con concentraciones similares. El coeficiente de variación (CV) promedio obtenido en la determinación de TG (5,2%, n=40) es aceptable. Starke et al (2010)20, utilizando un método de extracción y cuantificación similar al nuestro reportaron un CV promedio de 3,4% en solo 10 muestras de un tamaño considerablemente mayor (100 mg). Rodríguez y Peinado (2005)17, trabajaron con muestras de 50 mg de hígado de ratón y utilizaron un extracto lipídico obtenido de forma similar al nuestro, sin embargo reportaron CV muy alto (43%) en la determinación de TG. Estos autores atribuyeron estos resultados a la interferencia entre el detergente SDS y la lipasa utilizada, contrariamente en nuestra investigación fue utilizado el Brijj 58®, en reemplazo del SDS. En 2010 Starke et al.20 habían advertido al respecto y reportaron el funcionamiento adecuado de la técnica utilizando el detergente Lubrol®. Estos resultados ponen de manifiesto la importancia del detergente en el buffer de reacción de la lipólisis para garantizar la solubilización adecuada del extracto lipídico sin interferencia con la actividad de la lipasa.
Cabe resaltar que los kit disponibles para la determinación de triglicéridos están fabricados para muestras de suero sanguíneo, donde los lípidos se presentan emulsificados y en concentraciones relativamente bajas. Por esto para la cuantificación de triglicéridos en extractos lipídicos de hígado se requiere la incubación con buffers que emulsifiquen adecuadamente los lípidos y que permitan la actividad de las lipasas por largos periodos de tiempo (>10 horas) y así lograr la hidrólisis completa de los triglicéridos allí presentes. En nuestro estudio las muestras de extracto lipídico fueron refrigeradas hasta por 6 meses previo al análisis de triglicéridos, tiempo en el cual puede ocurrir lipolisis espontánea. Esto fue verificado y se encontró que en las muestras con valores extremos de concentración de TG el valor de glicerol libre fue de tan solo 5,31 % del glicerol cuantificado posterior a la lipolisis. Sin embargo, el almacenamiento por largos periodos de tiempo y la exposición al ambiente deben evitarse dado que la rancidez oxidativa y su consecuente generación de peróxidos pueden alterar significativamente la cuantificación de las fracciones lipídicas, pues las técnicas espectrofotométricas para su cuantificación se basan en la activación de compuestos coloreados a partir de peróxido de hidrógeno.
Fosfolípidos
La concentración promedio de FL fue similar a la reportada por otros autores (Bobe et al., 2003, Leplaix et al., 1996, Van den Top et al., 1995)1, 12, 22. El coeficiente de variación promedio en la determinación de FL en hígado no fue reportado por estos autores. El CV en la determinación de FL fue relativamente alto (9,9%) si se compara con el de la determinación de las otras fracciones lipídicas, sin embargo la adecuada respuesta a la variación en la cantidad de muestra (Figura 3) indican una adecuada sensibilidad de la técnica en los rangos de concentración esperados en extractos lipídicos de hígado. Un refinamiento adicional podría realizarse si se contará con la fosfolipasa D como componente aislado de los demás reactivos, de esta manera podría determinase el tiempo óptimo de incubación para lograr la hidrolisis completa de los FL en las muestras con mayor concentración, las cuales presentaron los mayores CV. Dado su sensibilidad, reproducibilidad y concordancia con los reportes de otros autores, la determinación enzimática de FL en extractos lipídicos en un solo paso, constituye una alternativa a los métodos tradicionales basados en la saponificación del extracto lipídico, neutralización y cuantificación de fosfato.
Colesterol total
La concentración de CT estuvo en el rango reportado por Fronk et al. (1980)5, y ligeramente más alta que la reportada Schlegel et al. (2012)19, sin embargo estos últimos advierten una elevación en el colesterol hepático en el periodo de transición a la lactancia, momento en el cual fueron tomadas las biopsias analizadas en esta investigación. No fue posible encontrar reportes acerca del CV en la determinación de CT en hígado bovino. Rodríguez y Peinado (2005)17, reportaron concentraciones de CT en hígado de ratón en un rango similar al de bovinos, sin embargo estos autores reportaron CV altos (27,7%) en su determinación. Las principales causas de esta alta variabilidad fue atribuida a la interferencia del detergente utilizado (SDS) en el buffer de reacción y las lipasas necesarias en las hidrolisis previas a la determinación colorimétrica, y a la alta volatilidad del hexano usado como solvente del extracto lipídico, lo cual origina aumentos aparentes en la concentración. En esta investigación también se usó hexano como solvente del extracto lipídico, sin embargo se extremaron las precauciones para evitar al máximo su volatilización, como fue efectuar siempre la dilución con hexano refrigerado y realizarla justo al momento de llevar la muestra al respectivo análisis. En nuestro caso es muy probable que se evitara la concentración aparente de la muestra por evaporación del solvente; esto se evidenció en un CV relativamente bajo (6,1%) en la cuantificación de CT.
La concentración de colesterol libre (CL) en hígado de vacas lecheras fue reportada por Bobe et al. (2003)1 en un intervalo entre 0,18 a 0,28% del hígado fresco, si bien estos autores determinaron CT, este valor no fue reportado. Según los valores de colesterol hallados y los reportados por otros autores5, 19, pareciera que se conserva una proporción entre colesterol esterificado y colesterol libre similar a la reportada para el plasma. Kessler et al. (2014)11 encontraron que el CL en el plasma de vacas lecheras en preparto y postparto constituyo entre el 25 y el 30% del CT. Uchida et al. (1995)21 reportaron que la relación colesterol libre a esterificado fue de 24,4%. La distribución similar de las diferentes fracciones de colesterol entre el plasma y el hígado puede explicarse debido a que la síntesis del colesterol y el ensamblaje en las lipoproteínas que lo solubilizan en el plasma son procesos originados en el hígado.
Cuantificación de Ácidos Grasos Libres
El CV promedio en la determinación de AGL fue aceptable (4,0%). No fue posible hallar reportes acerca de la distribución porcentual de los AGL en tejido hepático. Cristie (1981)3, reportó para un espécimen de hígado de bovino adulto que los AGL fueron hallados en la membranas nuclear y microsomal en un 14,8% y 5,9% como porcentaje de los lípidos componentes de cada membrana respectivamente. Reynolds et al. (1988)16 estimó que la captación de AGL por el hígado fue cercana al 9,3% del total de AGL circulantes en el plasma. La concentración de AGL en el hígado dependerá de sus concentraciones en el plasma y de la velocidad de utilización hacia oxidación o esterificación. En nuestra investigación, para cada biopsia hepática analizada también se analizó a la par una muestra de plasma para AGL, encontrando que el promedio fue de 0,15 mmoles/ litro, si se expresa esta concentración en porcentaje peso a peso (p/p) se obtendría un valor de 0,0037%. Este valor resulta ser 10 veces menor que el encontrado en hígado (0,037%), lo que es de esperarse dado que la sumatoria de las fracciones lipídicas en sangre puede oscilar entre 0,4 a 0,7%, lo cual coincide con un valor cercano a 10 veces menor a los lípidos totales reportados para hígado bovino (7,2% en nuestra investigación). Es decir, la concentración de AGL en hígado sigue un patrón de concentración similar al de la sangre. Sin embargo, concentraciones muy elevadas de AGL en sangre conducen a desbalances entre la captación y la oxidación de AGL por el tejido hepático, lo que incrementa la conversión de AGL a TG; de este modo el excedente de AGL que ingresa al hígado no conduce a aumentos proporcionales en la concentración de AGL, pero si en la de TG. Starke et al. (2010)20 reportaron que el aumento en LT en el hígado de vacas con desplazamiento de abomaso y cetosis fue mayoritariamente como TG. Esto puede ser una alternativa para mantener la concentración de AGL en valores aceptables con la función celular. Al respecto, Liu et al. (2014)13 reportaron un efecto negativo sobre la expresión de genes claves en el transporte de lípidos cuando se sometió a hepatocitos in vitro a concentraciones altas de AGL (0,5; 1,0 y 1,5 mM).
Distribución de las fracciones en el extracto lipídico
La fracción mayoritaria fueron los TG, estos ocupan cerca de la mitad de los LT del hígado de vacas lecheras. Si bien la mayoría de las investigaciones en lípidos hepáticos se enfoca en los TG, muy pocos trabajos han reportado su participación como componente de los LT. Starke et al. (2010)20, reportaron que los TG constituyen la fracción principal de los lípidos hepáticos de las vacas lecheras, estos autores estudiaron hígados con diferentes niveles de LT, encontrando que el aumento en los LT conduce a aumentos en la fracción de TG, estos advierten que la participación de los TG en los LT se hace mayor cuanto mayor sean los LT, indicando que la deposición adicional de grasa en el hígado es mayoritariamente por TG. El alto coeficiente de correlación (0,96) entre TG y LT obtenido en la presente investigación confirma este fenómeno. Esto tiene su explicación en la incorporación de los excedentes de AGL en la síntesis de triglicéridos. Este fenómeno ha sido bien descrito en las vacas lecheras. Grum et al. (1996)8 reportaron que la esterificación del palmitato en el tejido hepático se incrementó de 110 a 220 mmol/hora/g de tejido húmedo entre la tercera semana preparto y la primera semana posparto, el cual fue relacionado de manera directa con el nivel de los TG hepáticos. Al respecto Van Den Top et al. (1995)22 atribuyeron el aumento en la concentración hepática de TG al incremento en la captación hepática de AGL utilizados para la síntesis de TG debido al aumento significativo en la actividad de la diacilglicerol aciltransferasa al pasar entre la semana dos preparto y la semana posterior al parto de 0,4 a 1,0 mmol/min/mg de proteína.
El CT y los FL resultaron estar presentes en proporciones similares, juntos representaron casi el 40% de los LT. Ambas fracciones se correlacionaron estrechamente entre sí (0,74) y negativamente con LT y TG con coeficientes de correlación relativamente altos. Esto tiene explicación en el hecho de que los cambios importantes en los LT se dan por aumento de los TG y con muy poca variación en las demás fracciones, de este modo el aumento de los TG, induce aumento en los LT, debido a que los FL y CT no cambian significativamente, la proporción de estos en relación a TL y TG disminuye. Fronk et al. (1980)5 describieron este comportamiento en vacas sobrealimentadas durante el periodo preparto. Los autores revisados no reportaron correlaciones entre FL y CT en hígado, sin embargo Van den Top et al. (1996)23 reportaron un coeficiente de regresión lineal de 0,96 entre las concentraciones plasmáticas de estas fracciones. La estrecha relación entre FL y CT tiene su origen en que ambos hacen parte integral de las membranas y de las lipoproteínas y su función como constituyente de estas se basa en el mantenimiento de sus propiedades de fluidez y permeabilidad, las cuales dependen de que ambas fracciones se encuentren en proporciones adecuadas y sin variaciones significativas. Kalaitzakis et al. (2007)10, reportaron que la infiltración de triglicéridos en el hígado de vacas lecheras ocurre sin cambios en las membranas y su grado de deposición está relacionada con la cantidad y disposición de las vacuolas en el citoplasma, a bajas concentraciones solo pequeñas vacuolas se observan en el citoplasma alrededor del núcleo, conforme aumenta la cantidad de triglicéridos varias vacuolas se juntan ocupando grandes espacios y desplazando el núcleo a la periferia.
Los coeficientes de correlación entre AGL y las fracciones LT y TG fueron muy bajos (0,028 y 0,065), esto es debido a que los AGL captados por el hígado son rápidamente utilizados en la oxidación mitocondrial y en la formación de triglicéridos, de esta manera no hay una acumulación neta de AGL en el hígado, prueba de ello fue su baja concentración (0,41% de los LT). Es muy probable que la baja cantidad de AGL presentes en los LT estuviera adherido a los FL y al CL formando complejos lipídicos estabilizados a través de sus características anfipáticas comunes; esto lo sugieren los coeficientes de correlación entre AGL y las fracciones FL y CT (0,25 y 0,45, respectivamente), y los reportes de Cristie (1981)3 que indicaron su presencia en proporciones importantes en las membranas nuclear y microsomal de hepatocitos bovinos.
A modo de ilustración se presentó el promedio de la distribución de las fracciones lipídicas en 20 muestras (Figura 3). Cabe resaltar que en éstas, la sumatoria de las fracciones cuantificadas analíticamente fue el 90 % de los LT, este valor no incluye el porcentaje ocupado por los ácidos grasos esterificados al colesterol, el cual fue estimado a partir de las proporciones reportadas previamente, encontrando un valor de 8,99%. En Acuerdo con lo anterior, la fracción restante por determinar fue el 1,01% de los LT, esta fracción según Cristie (1981)3 deberá estar compuesta por las vitaminas liposolubles y sus esteres, además de otros lípidos componentes de las membranas.
Conclusiones
Los coeficientes de variación obtenidos en la extracción de los lípidos totales y en las determinaciones enzimáticas de las fracciones TG, FL, CT y AGL fueron aceptables, indicando que la determinación de las principales fracciones lipídicas en pequeñas biopsias de hígado se puede realizar de manera confiable a partir de una única muestra. Se encontraron coeficientes de correlación altos y positivos entre: LT y TG y coeficientes de correlación negativos entre LT y FL; y entre LT y CT, lo que indica que el aumento en los lípidos hepáticos en vacas durante el periodo de transición ocurre principalmente en la fracción TG y en consecuencia ocurre una disminución relativa en la fracciones FL y CT..
AgradecimientosEste trabajo fue Financiado por Colciencias en su convocatoria 521 y cofinanciado por la Universidad Nacional de Colombia, Sede Medellín.
Referencias
1. Bobe G, Ametaj BN, Young JW, Beitz DC. 2003. Effects of Exogenous Glucagon on Lipids in Lipoproteins and Liver of Lactating Dairy Cows. J Dairy Sci 86:2895-2903. [ Links ]
2. Carlson DB, Litherland NB, Dann HM, Woodworth JC, Drackley JK. 2006. Metabolic effects of L-carnitine infusion and feed restriction in lactating Holstein cows. J Dairy Sci 89:4819-4834. [ Links ]
3. Cristie, William W. Lipid Metabolism in Ruminants Animals. New York, USA. Pergamon 1981. Pag 98. [ Links ]
4. Drackley JK, Veenhuizen JJ, Richard MJ, Young JW. 1991. Metabolic changes in blood and liver of dairy cows during either feed restriction or administration of 1,3-butanediol. J Dairy Sci. 74:4254-4264. [ Links ]
5. Fronk TJ, Schultz LH, Hardie AR. 1980. Effect of Dry Period Overconditioning on Subsequent Metabolic Disorders and Performance of Dairy Cows. J Dairy Sci. 63:1080-1090. [ Links ]
6. Gaal T, Husveth UF. 1983. Comparison of the liver biopsy sample and the "whole liver" in respect of lipid content and fatty acid composition of lipids. Acta Vet. Hung. 31:51-56. [ Links ]
7. Gross J, Schwarz F, Eder K, Van Dorland A, Bruckmaier RM. 2013. Liver fat content and lipid metabolism in dairy cows during early lactation and during a mid-lactation feed restriction. J Dairy Sci. 96:5008-5017. [ Links ]
8. Grum DE, Drackley JK, Younker RS, LaCount DW, Veenhuizen JJ. 1996. Nutrition during the dry period and hepatic lipid metabolism of periparturient dairy cows. J Dairy Sci. 79:1850-1864. [ Links ]
9. Hara A, Radin NS. 1978. Lipid extraction of tissues with a low-toxicity solvent. Anal. Biochem. 90:420- 426. [ Links ]
10. Kalaitzakis E, Roubies N, Panousis N, Pourliotis K, Kaldrymidou E, et al., 2007. Clinicopathologic evaluation of hepatic lipidosis in periparturient dairy cattle. J Vet. Intern. Med. 21:835-845. [ Links ]
11. Kessler EC, Gross JJ, Bruckmaier RM, Albrecht C. 2014. Cholesterol metabolism, transport, and hepatic regulation in dairy cows during transition and early lactation. J Dairy Sci. 97:5481-5490. [ Links ]
12. Leplaix L, Durand D, Bauchart D. 1996. Effects of Diets Containing Tallow and Soybean Oil with and Without Cholesterol on Hepatic Metabolism of Lipids and Lipoproteins in the Preruminant Calf. J Dairy Sci 79:1826-35. [ Links ]
13. Liu Lei, Xinwei Li, Yu Li, Yuan Guan, Yuxiang Song, et al., 2014. Effects of nonesterified fatty acids on the synthesis and assembly of very low density lipoprotein in bovine hepatocytes in vitro. J Dairy Sci. 97:1328-1335. [ Links ]
14. Oikawa S, Oetzel GR. 2006. Decreased Insulin Response in Dairy Cows Following a Four-Day Fast to Induce Hepatic Lipidosis. J Dairy Sci. 89:2999- 3005. [ Links ]
15. Piepenbrink MS and Overton TR. 2003. Liver Metabolism and Production of Cows Fed Increasing Amounts of Rumen-Protected Choline During the Periparturient Period. J Dairy Sci. 86:1722-1733. [ Links ]
16. Reynolds CK, Huntington GB, Tyrrell HF, Reynolds PJ. 1988. Net metabolism of volatile fatty acids, B-hydroxybutyrate, nonesterified fatty acids, and blood gases by portal-drained viscera and liver of lactating Holstein cows. J Dairy Sci. 71:2395-2405. [ Links ]
17. Rodríguez SV, Peinado OJ. 2005. A procedure for measuring triaglyceride and cholesterol content using a small amount of tissue. Anal. Biochem. 343:277-282. [ Links ]
18. Sejersen H, Sørensen MT, Larsen T, Bendixen E, Ingvartsen KL. 2012. Liver protein expression in dairy cows with high liver triglycerides in early lactation. J Dairy Sci. 95:2409-2421. [ Links ]
19. Schlegel G, Ringseis R, Keller J, Schwarz FJ, Eder K. 2012. Changes in the expression of hepatic genes involved in cholesterol homeostasis in dairy cows in the transition period and at different stages of lactation. J Dairy Sci. 95:3826-3836. [ Links ]
20. Starke A, Haudum A, Busche R, Beyerbach M, Dänicke S, et al., 2010. Technical note: Analysis of total lipid and triacylglycerol content in small liver biopsy samples in cattle. J Anim Sci 88:2741-2750. [ Links ]
21. Uchida E, Katoh N, Takahashi K. 1995. He activity of lecithin:cholesterol acyltransferase in the serum of cows at parturition or with fatty liver. Vet research communications, 19:343-351. [ Links ]
22. Van den Top AM, Wensing TH, Geelen MJ, Wentink GH, Vant Klooster A, et al., 1995. Time trends of plasma lipids and hepatic triacilglicerol synthesizing enzymes during postpartum fatty liver develoment in dairy cows with unlimited access to feed during dry period. J Dairy Sci: 78:2208-2220. [ Links ]
23. Van den Top AM, Geelen MJ, Wensing T, Wentink GH, Van 't klooster A, et al., 1996. Higher Postpartum Hepatic Triacylglycerol Concentrations in Dairy Cows with Free rather than Restricted Access to Feed During the Dry Period Are Associated with Lower Activities of Hepatic Glycerolphosphate Acyltransferase. J Nut. 126:76-85. [ Links ]
24. Veenhuizen JJ, Drackley JK, Richard MJ, Sanderson TP, Miller LD, et al., 1991. Metabolic changes in blood and liver during development and early treatment of experimental fatty liver and ketosis in cows. J Dairy Sci. 74:4238-4253. [ Links ]














