Introducción
El linfoma es un tumor maligno que se origina de los linfonodos y tejido linfático, corresponde entre el 5 - 24% de las condiciones neoplásicas del perro 1,2,3.
Esta neoplasia se presenta en caninos, comúnmente entre los 6 a 12 años de edad, sin diferencias entre sexos 1,4,5, siendo la alteración linfoproliferativa de mayor incidencia en pequeños animales 6.
Las clasificaciones de los linfomas han sido diversas y han ido evolucionando en los últimos años. La mayoría de los esquemas han sido adaptados de linfomas humanos. La clasificación de la Kiel y Working Formulation, consideran únicamente los criterios morfológicos, como el crecimiento dentro del linfonódulo (nodular o difuso), y el tamaño de las células neoplásicas (pequeñas, grandes o mixtas) 7. La clasificación propuesta por la Organización Mundial de la Salud (OMS) en 2008 separa los linfomas desde su origen celular como célula precursora o célula madura y define cada tipo según características clínicas, morfológicas, inmunofenotípicas y genéticas 8,9,10 obteniendo como ventaja la caracterización de los linfomas extraganglionares, distinguiendo cada entidad histopatológica según la diferenciación, tamaño celular y la agresividad 9,10,11. La aplicación de la clasificación histológica de la OMS es un sistema práctico para patólogos veterinarios no especialistas en hematopatología 12,13 (Tabla 1, Figura 1).
Tabla 1 Clasificación de las neoplasias linfoides según la Organización Mundial de la Salud para el uso en animales. Fuente: Jubb, Kennedy, and Palmers (2016) 11, modificado de la OMS 12,14.

MALT, mucosa-associated lymphoid tissue; NK, natural killer.

Figura 1 Esquema de diagnóstico de los linfomas más comunes en caninos. Fuente: modificado de Jubb, Kennedy, and Palmers. 2016 11.
La localización más común corresponde a los linfonodos del cuello, y supraclaviculares. Según el sitio de su ocurrencia, el linfoma se puede dividir en: multicéntrico, gastrointestinal, cutáneo, del sistema nervioso central y nodo extra- linfático entre otros 1.
El linfoma multicéntrico corresponde a la presentación más frecuente; el linfoma de células B se presenta en un 60% a 70% y el originario de células T en un 30% a 40% de los casos (1,15,16. Un 7,5% de los casos corresponden a otros tipos de linfomas 5,7.
Los signos clínicos más típicos se manifiestan con agradamiento progresivo, cambios en consistencia y textura y dolor de los linfonodos; su presentación frecuentemente se asocia con un historial de enfermedad no definida, inapetencia con un curso de días o unas pocas semanas. La signología clínica presentada refleja la disfunción del tejido u órgano afectado como úlceras, vómito, ictericia, entre otros1,17. Las anormalidades en el laboratorio clínico son poco específicas a excepción de la presencia de hipercalcemia en un 20 a 40% de los linfomas de células T y la detección en sangre periférica de linfocitos anormales en un 10 a 20% de los casos de linfomas de células B 18,19.
El diagnóstico de neoplasias linfoides es un proceso que requiere de varias etapas que incluye el examen clínico, diagnóstico por imagen, citología, hematología, perfil bioquímico, histopatología y técnicas auxiliares como la citometría de flujo e inmunofenotificación 20).
La inmunofenotipificación puede realizarse mediante citometría de flujo y por inmunohistoquímica, la ventaja de la primera es que se pueden analizar muestras más pequeñas obtenidas mediante técnicas menos invasivas. En contraste, la inmunohistoquímica tiene como ventaja la identificación de los subconjuntos de células conservando la arquitectura de los nódulos linfáticos 21.
El diagnóstico de linfoma maligno se realiza por histopatología y citología, siendo la inmunohistoquímica, fundamental para los casos donde no se puede alcanzar una caracterización histológica precisa que permita establecer la línea celular involucrada e instaurar un protocolo terapéutico adecuado 1,10.
Una adecuada metodología de diagnóstico permite establecer una aproximación diagnóstica más precisa de las neoplasias derivadas del sistema linfoide. El objetivo del artículo consiste en reportar un caso de un Linfoma difuso de células grandes de células B rico en células T de bajo grado de comportamiento multicéntrico diagnosticado mediante evaluación histopatológica e inmunohistoquímica en un canino.
Descripción del caso
En febrero de 2016 se remite al área de cátedra y servicio de patología veterinaria de la Universidad de Nariño, Pasto, Colombia, un canino hembra mestiza de ocho años de edad y 19 kg de peso para realizar una biopsia por aspiración con aguja fina (BACAF) de masas submandibulares y linfonodos poplíteos.
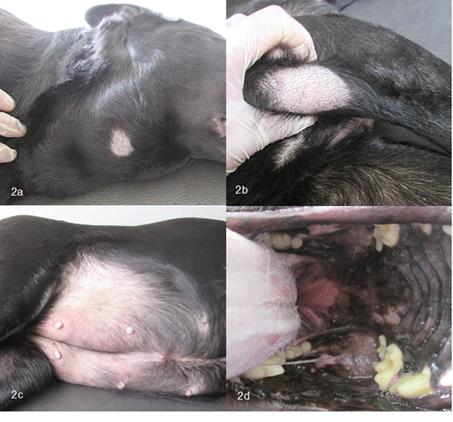
En los anamnésicos, el propietario reporta la presencia de dos masas en el cuello, decaimiento, anorexia y pérdida de peso, desconociendo el tiempo de evolución del problema. Al examen clínico se evidenciaron dos masas localizadas bilateralmente en la región mandibular de 8 cm de diámetro aproximadamente, de consistencia firme e indoloras a la palpación, linfonodos poplíteos e inguinales aumentados de tamaño, consistencia dura y móviles, tónsilas aumentadas de tamaño, mamas abdominales e inguinales con evidencia de proceso inflamatorio (Figura 2), adicionalmente, se observó alopecia bilateral simétrica en la zona perianal y región abdominal. En el hemograma se reportó eritrocitosis y leucocitosis con neutrofilia, linfocitosis, eosinofilia y monocitosis.
Fuente: Área de cátedra y servicio de patología veterinaria de la Universidad de Nariño.
Figura 2 (a) Masas en región submandibular. (b) Nódulos poplíteos aumentados de tamaño. (c) mamas aumentadas de tamaño y con cambios inflamatorios. (d) Tónsilas aumentadas de tamaño.
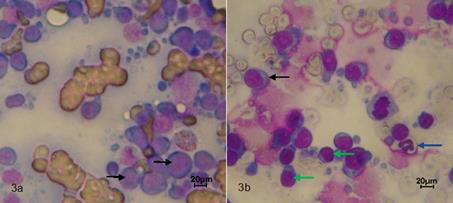
En la evaluación citológica de las masas submandibulares se evidenció proliferación neoplásica de células redondas de característica linfoide, de gran tamaño con evidente alteración morfológica tanto celular como nuclear (pleomorfismo celular y nuclear, anisocitosis y anisocariosis, megalocitosis y megalocariosis), cromatina de aspecto de grumos, nucléolos evidentes y figuras mitóticas normales y atípicas sugestivo de un linfoma (Figura 3a).
En la evaluación citológica de los linfonodos poplíteos adicionalmente se observó población celular heterogénea (macrófagos, células plasmáticas y linfocitos), gran cantidad de linfocitos reactivos, debido al aumento de su tamaño, basofilia del citoplasma y la irregularidad de la membrana (Figura 3b).
Fuente: Área de cátedra y servicio de patología veterinaria de la Universidad de Nariño.
Figura 3 Citología por BACAF, tinción de Giemsa. (a) Linfonodo Mandibular 40x, proliferación neoplásica de células redondas de característica linfoide, de gran tamaño con evidente alteración morfológica tanto celular como nuclear (pleomorfismo celular y nuclear, anisocitosis y anisocariosis, megalocitosis y megalocariosis) (flechas negras). (b) Linfonodo poplíteo 40x, población celular heterogénea: células plasmáticas (flecha negra), neutrófilos (flecha azul) y linfocitos (flechas verdes).
Debido a las características reportadas en la evaluación citológica, el propietario decidió realizar eutanasia y necropsia para evaluación macroscópica y microscópica.
Evaluación anatomopatológica
Descripción macroscópica
Apariencia externa. condición corporal 4/5, membranas mucosas oral y conjuntival moderadamente pálidas.
Piel y anexos. Presencia de gran cantidad de material acuoso de aspecto serosanguinolento en tejido subcutáneo, presencia de múltiples focos de hemorragia localizados en tejido subcutáneo de la región abdominal e inguinal.
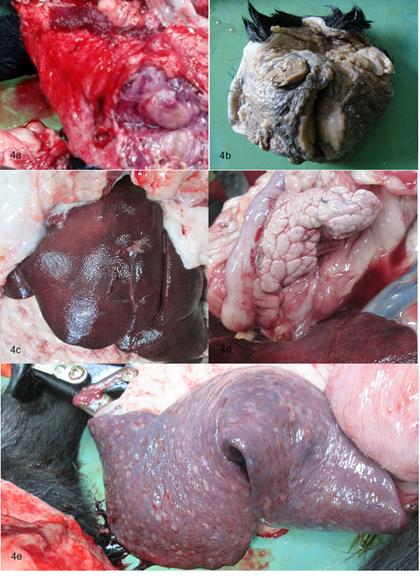
Sistema linfático. Nódulos linfáticos submandibulares, inguinales, cervicales, mesentéricos, mediastínicos, axilares, preescapulares, y mamarios severamente aumentados de tamaño con dimensiones que comprenden entre 3 cm hasta 8 cm de diámetro, coloración beige de consistencia semidura al corte (Figuras 4a y 4b). Bazo con severo aumento de tamaño, presencia de áreas de coloración blanquecina, de forma irregular de aproximadamente 1 cm de diámetro con distribución multifocal las cuales profundizan al corte (Figura 4e). Medula ósea de coloración rojiza y de aspecto hemorrágico.
Fuente: Área de cátedra y servicio de patología veterinaria de la Universidad de Nariño.
Figura 4 (a) nódulos linfáticos poplíteos con severo aumento de tamaño, consistencia semidura al corte, coloración beige entremezclada con áreas rojo-negruzco. (b) Masa de localización cervical correspondiente a los nódulos linfáticos cervicales. (c) Hígado, con moderado aumento del tamaño. (d) Páncreas de aspecto pálido y moderado aumento de tamaño. (e) Bazo con, bordes irregulares y múltiples focos blanquecinos en la superficie con distribución multifocal.
Sistema digestivo. Cavidad abdominal con gran cantidad de líquido acuoso de aspecto serosanguinolento. Estómago moderadamente distendido, mucosa con múltiples áreas de aspecto hemorrágico con distribución multifocal. Intestino: serosa con áreas hemorrágicas distribuidas sobre el borde mesentérico de yeyuno, íleon y colon. Mucosa con moderada cantidad de material de aspecto mucoide de coloración beige en duodeno y yeyuno y de color verde oscuro en íleon, ciego y colón. Hígado con moderado aumento en su tamaño y bordes ligeramente redondeados (Figura 4c). Páncreas moderadamente pálido y presencia de áreas de aspecto hemorrágico entremezcladas con focos blanquecinos de distribución multifocal (Figura 4d).
Sistema cardiorespiratorio. Cavidad torácica con gran cantidad de líquido de aspecto serosanguinolento, con presencia de flóculos y material de aspecto fibrinoso. Presencia de múltiples adherencias que comprometen pared torácica, diafragma corazón y pulmones. Árbol traqueobronquial con abundante cantidad de material de aspecto espumoso, pulmones severamente pálidos con presencia de múltiples áreas de forma irregular de tamaños variables de coloración blanquecina distribuidas al azar en el parénquima pulmonar. Saco pericárdico con moderada cantidad de material de aspecto acuoso. Corazón con moderado aumento de tamaño, de forma redondeada y septo moderadamente desviado.
Sistema genitourinario. Vejiga con múltiples focos de aspecto hemorrágico distribuidas al azar en serosa y mucosa de aspecto engrosado con áreas de aspecto hemorrágico de distribución multifocal. Riñones con moderada congestión en región corticomedular, se observa moderada dilatación de pelvis renal y los uréteres, mucho más acentuada en el uréter del lado derecho.
Sistema nervioso. aparentemente normal.
Diagnóstico de necropsia. Los hallazgos macroscópicos evidencian un proceso tumoral aparentemente neoplásico de origen linfoide, de comportamiento multicéntrico; adicionalmente las alteraciones observadas en tracto gastrointestinal sugieren una moderada enterocolitis catarral, y los hallazgos en el sistema genitourinario no descartan la participación de un proceso inflamatorio de tipo infeccioso secundario en vejiga ascendente a través de las vías urinarias.
De acuerdo a los resultados de la evaluación macroscópica se tomaron muestras de nódulos linfáticos, bazo, médula ósea, pulmones, riñón, músculo estriado, piel, glándula salival parótida y tejido adiposo. Se fijaron en formol bufferado al 10%, se cortaron y se procesaron mediante la técnica de inclusión en parafina y coloración de Hematoxilina - Eosina (H/E) para evaluación histopatológica.
Evaluación microscópica H/E
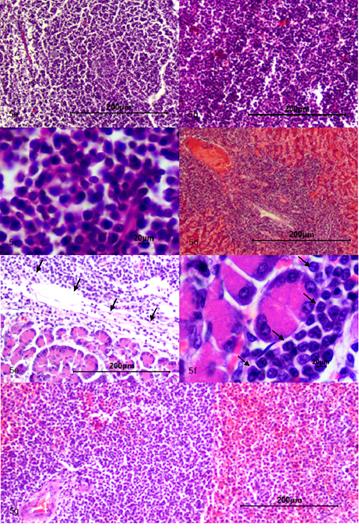
Nódulos linfáticos. Se evidencia proliferación celular neoplásica de origen linfoide la cual presenta un patrón de crecimiento infiltrativo que compromete la corteza y médula. Las células son de forma redondeada, de pequeño tamaño, basofílicas intensas, se distribuyen en forma de paquetes celulares densos pobremente delimitados por estroma de tejido conectivo, núcleo de gran tamaño y escaso citoplasma; se evidencia moderado pleomorfismo celular, moderada anisocitosis, y moderada megalocitosis. Se observa moderado pleomorfismo nuclear, moderada anisocariosis y severa megalocariosis. Se contabilizaron tres figuras mitóticas en diez campos al azar a 400x. Adicionalmente se evidenció presencia de células neoplásicas comprometiendo la pared de vasos linfáticos y células neoplásicas en el interior de los mismos (Figuras 5a, 5b, 5c).
Fuente: Área de cátedra y servicio de patología veterinaria de la Universidad de Nariño.
Figura 5 (a, b) Nódulo linfático 10x, con proliferación celular neoplásica de origen linfoide con un patrón de crecimiento infiltrativo que compromete corteza y medula. (c) Nódulo linfático 40x, nótese células neoplásicas correspondientes a linfocitos, de forma redondeada y tamaño pequeño. Se observa moderado pleomorfismo nuclear, moderada anisocariosis y severa megalocariosis. (d) Hígado 10x, nótese la presencia de células neoplásicas que infiltran el parénquima funcional de apariencia linfoide con característica similar a las reportadas en los demás tejidos. (e) Páncreas 10x, (f) Páncreas 40x, se evidencia foco de infiltrado de células neoplásicas de origen linfoide posiblemente asociado a una metástasis (fechas negras). (g) Bazo 10x, en la pulpa blanca se observa proliferación celular neoplásica de tipo linfoide con un patrón de crecimiento infiltrativo pobremente delimitado el cual se extiende al parénquima funcional (Pulpa roja).
Hígado. Moderados cambios microcirculatorios, focos de congestión y hemorragia con distribución multifocal y centrolobulillar, presencia de múltiples y extensas áreas de infiltrado de células neoplásicas de tipo linfoide con distribución predominantemente centrolobulillar y perilobulillar (Figura 5d).
Páncreas. Moderados cambios microcirculatorios, focos de congestión y hemorragia con distribución multifocal, se evidencia áreas de metástasis e infiltración de células neoplásicas correspondientes a células aparentemente de origen linfoide (Figura 5e, 5f).
Bazo. Moderados cambios microcirculatorios focos de congestión hemorragia enlodamiento y eritrofagocitosis. En pulpa blanca se evidencia proliferación celular neoplásica de tipo linfoide las cuales se organizan formando paquetes celulares densos pobremente delimitados, con un patrón de crecimiento infiltrativo que se extiende de forma difusa sobre la pulpa roja. Las células son de forma redondeada, de pequeño tamaño, basofílicas intensas con moderado pleomorfismo celular, moderada anisocitosis, y moderada megalocitosis. Se observó moderado pleomorfismo nuclear, moderada anisocariosis y severa megalocariosis. Se contabilizaron dos figuras mitóticas en diez campos al azar a 400x. Adicionalmente se evidenciaron múltiples áreas de linfocitólisis (Figura 5g).
Intestino delgado. Se evidencia severos cambios microcirculatorios, múltiples focos de congestión, hemorragia y enlodamiento con distribución multifocal en mucosa, submucosa, muscular. La luz con gran cantidad de detritos celulares, se evidencia focos con modera atrofia y fusión de las vellosidades, focos con cambios asociados a muerte celular en la punta de la vellosidad y escasos focos de hiperplasia del epitelio que recubre la mucosa, núcleos con picnosis, cariorrexis y cariolisis, moderado infiltrado inflamatorio linfoplasmocitario con distribución difusa, severo edema de la submucosa (Figura 6a).
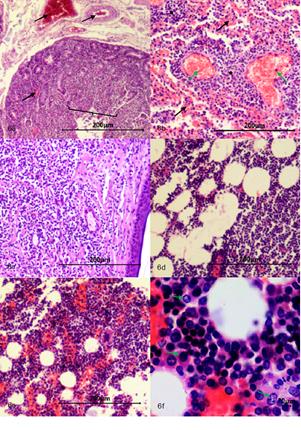
Fuente: Área de cátedra y servicio de patología veterinaria de la Universidad de Nariño.
Figura 6 (a) Intestino delgado 4x con cambios microcirculatorios, múltiples focos de congestión, hemorragia y enlodamiento con distribución multifocal en mucosa y submucosa (flechas negras), mucosa con atrofia y fusión de las vellosidades (llave). (b) Pulmón 10x con severos cambios microcirculatorios (múltiples focos de congestión (flechas verdes), hemorragia y enlodamiento (flechas negras) con distribución multifocal, presencia de múltiples focos correspondientes a células neoplásicas de origen linfoide las cuales corresponden a metástasis pulmonar (estrellas negras). (c) Piel 4x, dermis con evidencia de proliferación celular neoplásica de origen linfoide, se organiza a manera de paquetes celulares densos pobremente delimitados por estroma de tejido conectivo con un patrón de distribución infiltrativo. (d) Tejido adiposo 10x con presencia de células neoplásicas de origen linfoide. (e) Médula ósea 10x, (f) Médula ósea 40x, se evidencia aumento de la fracción celular con presencia de células neoplásicas de origen linfoide (flechas verdes).
Intestino grueso. Con similares cambios reportados en el Intestino delgado, pero con menor severidad.
Pulmones. Severos cambios microcirculatorios y múltiples y extensas áreas de congestión, hemorragia, enlodamiento y edema con distribución difusa, presencia de múltiples focos correspondientes a células neoplásicas de origen linfoide; adicionalmente en epitelio bronquiolar se evidencian focos con cambios asociados a muerte celular, áreas de moderada hiperplasia del mismo, moderada hiperplasia de células caliciformes, focos de aplanamiento del epitelio bronquiolar y severo infiltrado inflamatorio predominantemente mononuclear compuesto por macrófagos, células plasmáticas y escasos PMNs neutrófilos con distribución bronquiointersticial (Figura 6b).
Piel. Epidermis aparentemente normal, en la dermis se evidencia proliferación celular neoplásica de células origen linfoide la cual se organiza a manera de paquetes celulares densos y en algunos áreas se organizan en forma de cordones pobremente delimitados por estroma de tejido conectivo que compromete a dermis superficial, dermis profunda, y tejido subcutáneo y tejido muscular. Las células son de forma redondeada núcleos grandes muy escaso citoplasma con moderado pleomorfismo celular, moderada anisocitosis, y moderada megalocitosis. Se evidencia moderado pleomorfismo nuclear, moderada anisocariosis y severa megalocariosis. No se contabilizaron figuras mitóticas en diez campos al azar a 400X, adicionalmente se evidenció la presencia de células neoplásicas dentro de lumen de algunos vasos sanguíneos (Figura 6c).
Tejido adiposo. Presencia de extensas áreas correspondientes a proliferación de células neoplásicas de origen linfoide con características similares a las mencionadas en hígado y páncreas (Figura 6d).
Médula ósea. Se evidencia severo aumento de la fracción celular con presencia múltiples focos de células neoplásicas aparentemente de origen linfoide (Figuras 6e, 6f).
Riñón. Severos cambios microcirculatorios, focos de congestión, hemorragia, y enlodamiento con distribución multifocal. En la corteza se evidencia glomérulos con severa retracción glomerular y glomeruloesclerósis; Sin embargo, se observan algunos focos con presencia de glomérulos de aspecto tumefacto. Se observan áreas con moderado aumento en el espacio de bowman, presencia de material eosinofílico homogéneo y focos de obsolescencia glomerular. Medula: Epitelio tubular con áreas con cambios asociados a muerte celular. Núcleos con picnosis, cariorrexis y cariolisis. Túbulos con presencia de material eosinofílico compatible con proteína, cilindros hialinos y depósitos de mineral.
Músculo estriado. Presencia de infiltración de células neoplásicas de origen linfoide con características similares a las mencionadas en los demás tejidos como páncreas, pulmón, hígado, bazo.
Parótida. Moderados cambios microcirculatorios, múltiples focos de congestión y hemorragia con distribución multifocal y presencia de células neoplásicas las cuales infiltran el parénquima funcional aparentemente de origen linfoide con característica similar a las reportadas en los demás tejidos.
Diagnóstico H/E
Los hallazgos microscópicos corresponden a un linfoma difuso de células grandes de comportamiento multicéntrico.
Evaluación inmunohistoquímica
Con base en los resultados de la evaluación microscópica en H/E; se emplearon anticuerpos inmunohistoquímicos para CD45, (marcador de tumores de células redondas) DAKO®, CD3 (marcador de elección para tumores de linfocitos T) DAKO® y CD79a (marcador de elección para tumores derivados de linfocitos B) DAKO® dirigidos contra anticuerpos humanos obtenidos de cultivo celular de ratón y conejo (tabla 2). Los cuales se aplicaron a médula ósea, nódulos linfáticos y piel y fueron contrastados con hematoxilina de Meyer. El procedimiento se realizó en Inmunotech Laboratories SAS, Bogotá, Colombia.
Tabla 2 Resultados de la Inmunomarcación. Fuente: autores.
| Marcadores empleados para el análisis | Tipo | Origen | Tejido | Inmunomarcación |
|---|---|---|---|---|
| CD45 | Monoclonal | Ratón | Nódulo linfático, piel y médula ósea | + |
| CD3 | Policlonal | Conejo | Nódulo linfático, piel y médula ósea | ++ |
| CD79a | Monoclonal | Ratón | Nódulo linfático, piel y médula ósea | ++ |
+ Leve inmunomarcación, ++ moderada inmunomarcación
Se observó leve inmunomarcación para CD45 y una moderada inmunomarcación para CD3 y CD79a en las células neoplásicas de nódulo linfático, piel y médula ósea (Tabla 2). Sin embargo, la intensidad de la inmunomarcación varió en diferentes áreas del tejido; siendo fuerte en algunas regiones, moderada en otras y escasa en algunos focos (Figuras 7, 8, 9).
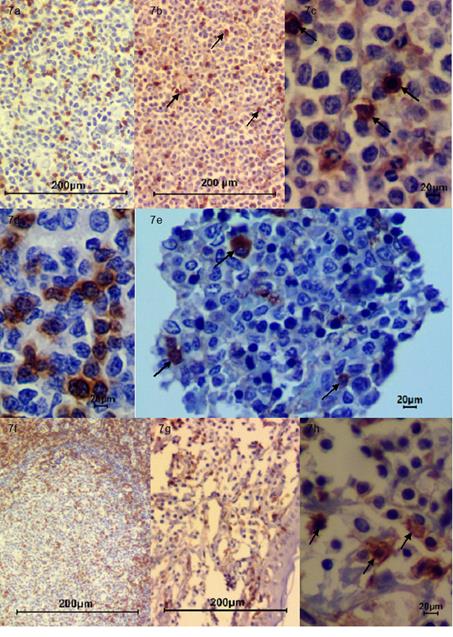
Fuente: Área de cátedra y servicio de patología veterinaria de la Universidad de Nariño.
Figura 7 Inmunohistoquímica. (a) Control CD3 Nódulo linfático 10x; (b) CD3 Nódulo linfático 10x, nótese moderada inmunomarcación (flechas negras); (c) CD3 Nódulo linfático 40x, se evidencia moderada inmunomarcación (flechas negras); (d) Control CD3 Nódulo Linfático 40X; (e) CD3 Médula Ósea 40x se evidencia moderada inmunomarcación (flechas negras).; (f) Control CD3 Nódulo linfático 4x; (g) CD3 Piel 10X, se evidencia moderada inmunomarcación; (h) CD3 Piel 40x se evidencia moderada inmunomarcación (flechas negras).
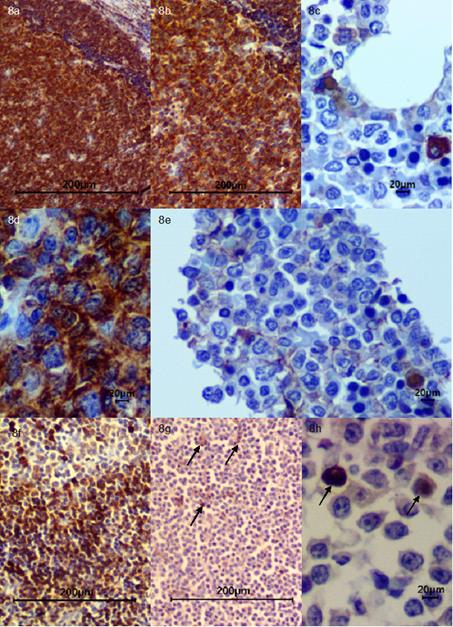
Fuente: Área de cátedra y servicio de patología veterinaria de la Universidad de Nariño.
Figura 8 Inmunohistoquímica. (a) Control CD45 Nódulo linfático 4x; (b) Control CD45 Nódulo linfático 10x; (c) CD45 Médula Ósea 40x, nótese leve inmunomarcación de células neoplásicas; (d) Control CD45 Nódulo linfático 40x; (e) CD45 Médula Ósea 40x, se observan células neoplásicas con leve inmunomarcación; (f) Control CD79a Nódulo Linfático 10x; (g) CD79a Nódulo Linfático 10x, nótese moderada inmunomarcación para linfocitos B (flechas negras); (h) CD79a Nódulo Linfático 40x, se evidencia áreas con moderada inmunomarcación para linfocitos B (flechas negras).
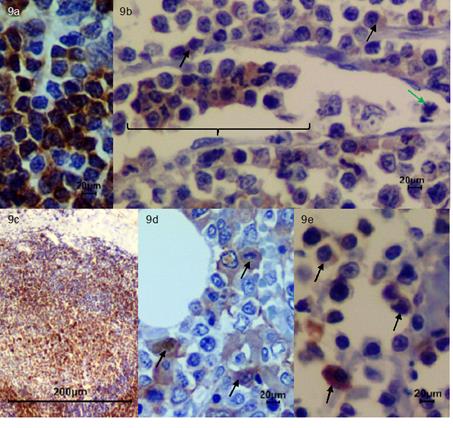
Fuente: Área de Cátedra y Servicio de Patología Veterinaria de la Universidad de Nariño.
Figura 9 Inmunohistoquímica. (a) Control CD79a Nódulo linfático 40x. (b) CD79a Nódulo linfático 40x. Nótese la moderada inmunomarcación (flechas negras) y presencia de células neoplásicas correspondientes a linfocitos B en el lumen de un vaso linfático (llave), presencia de figuras mitóticas aberrantes (flecha verde). (c)Control CD79a Nódulo linfático 4x. (d) CD79a Médula ósea 40x se evidencia moderada inmunomarcación (flechas negras). (e) CD79a Piel 40x dermis profunda, se evidencia áreas con moderada inmunomarcación (flechas negras).
Diagnóstico final
Los hallazgos evidenciados en las láminas de H/E y los resultados en la evaluación inmunohistoquímica corresponden a una neoplasia maligna de origen linfoide con presencia de células B y células de tipo T que de acuerdo a la clasificación de la OMS se cataloga como un linfoma difuso de células B rico en células T de bajo grado, de comportamiento multicéntrico con metástasis en páncreas, hígado, pulmón, intestino delgado, medula ósea y piel. Adicionalmente, se evidencia moderada enterocolitis necrótica de origen bacteriano y moderada bronconeumonía mononuclear bacteriana.
Discusión
El presente reporte constituye el primer intento de aproximación diagnóstica de neoplasias linfoides en perros empleando marcadores inmunohistoquímicos en el área de cátedra y servicio de patología veterinaria en la Universidad de Nariño.
Respecto a la forma de presentación del tumor, Sueiro et al. (2004) mencionan que el 74,5% de los casos corresponden a la forma multicéntrica lo cual coincide con este reporte; adicionalmente los mismos autores mencionan que de estos, el 72,7% corresponden a linfomas de células B y el 21,8 % representan neoplasias de células T 22.
Valli et al., basados en la clasificación de la OMS, catalogaron 992 casos de linfoma, encontrando que el linfoma difuso de células grandes B corresponde al 39,3% de los linfomas en caninos 13. En el presente caso se evidenció la manifestación multicéntrica de un linfoma de células B rico en células T de organización difusa, que, de acuerdo a la clasificación de la OMS, corresponde a lo descrito para los casos de linfoma difuso de células B rico en células T. Sin embargo, el reporte constituye una aproximación diagnóstica y para confirmarlo, se sugiere el empleo de un panel más completo de marcadores inmunohistoquímicos para tener mayor precisión diagnóstica.
En Colombia se presentan diagnósticos de tumores linfoides, pero la mayoría de estos se limitan al diagnóstico morfológico y características clínicas, debido a que el uso de marcadores inmunohistoquímicos en medicina veterinaria es de poco uso, es por eso que para este caso se empleó los marcadores y metodología que usualmente se utiliza en medicina humana. Se recomienda el empleo de CD34, el cual se expresa en células linfoproliferativas progenitoras, CD21 el cual inmunomarca para células B maduras, CD20 útil en la expresión de células B inmaduras, CD9 el cual permitiría descartar posibles leucemias linfocíticas de células B crónicas, y CD 20 útil para diferenciar células B5,15, lo cual permitiría tener mayor precisión diagnóstica, debido a que nos permiten descartar otras entidades neoplásicas de linfocitos B.
De igual forma Meuten (2002), Wilkerson et al. (2005) y Willman et al. (2009) afirman que inmunotipificación celular resulta ser el factor más importante asociado con el pronóstico en los linfomas; debido que esta técnica permite identificar un linaje o estado de diferenciación del linfocito, comprobándose que el linfoma de células T tiene un peor pronóstico que el linfoma de células B 5,21,23).
Wilkerson et al. (2005), Martini et al. (2015) y Pawlak (2014), proponen el siguiente panel para inmunofenotipificación de linfomas caninos: CD45, CD44, CD18 (Todos los leucocitos); CD3, CD5 (Linfocitos T); CD4 (Linfocitos T colaboradores); CD8 (Linfocitos T citotóxicos), CD21, IgG de superficie (linfocitos B maduros), IgM de superficie (linfocitos B inmaduros); CD14 (Monocitos); CD172a (Granulocitos/ monocitos); CD34 (Célula madre); CD79a (linfocitos B todas las etapas, es un marcador útil para distinguir Células B inmaduras de tumores de células plasmáticas) 21,24,25.
Por lo anteriormente expuesto el diagnóstico histopatológico e inmonohistoquímico tiene ventajas con respecto al diagnóstico citológico, ya que las características tisulares, como patrón, invasión de tejidos adyacentes, línea celular e infiltración neoplásica a nivel capsular son evaluadas en la histopatología y proporcionan información importante a la hora de establecer un protocolo terapéutico adecuado, de acuerdo a lo mencionado por Valli, Puicón, y Álvarez 8,10,26.
En cuanto al pronóstico de supervivencia Valli afirma que perros que padecían linfomas con un índice mitótico mayor de 20 mitosis/400x sobrevivían 33 días, mientras aquellos con índice mitótico menor de 20 mitosis / 400x sobrevivían 188 días en promedio 13. En este caso la presentación correspondió al de bajo grado.
Adicionalmente, para los casos en los cuales se empleen marcadores inmunohistoquímicos Chaves y colaboradores recomiendan que la presencia o ausencia de inmunomarcación siempre debe correlacionarse con los hallazgos en HE y hallazgos encontrados en la exploración clínica 27.
Finalmente, se sugiere que en la medida de lo posible cuando se realicen diagnósticos de remisión de biopsias, al clínico se le suministre información morfológica y se determine el tipo de celular presente (células T o B) para que este pueda establecer el protocolo terapéutico más adecuado para su paciente.
Conclusión
El presente reporte constituye el primer intento de confirmación diagnóstica con ayuda de marcadores inmunohistoquímicos en tumores linfoideos en el área de cátedra y servicio de patología de la Universidad de Nariño. El uso de marcadores inmunohistoquímicos demuestran ser una herramienta de gran utilidad para el diagnóstico oncológico de tumores linfoides al correlacionar la evaluación clínica y la evaluación histopatológica en H/E; Sin embargo, en casos de neoplasias altamente indiferenciadas se recomienda el empleo de un panel completo de marcadores para poder realizar un a mejor aproximación diagnóstica.














