Introducción
La producción in vitro de embriones (PIVE) bovinos es una herramienta biotecnológica de uso comercial que permite aumentar la eficiencia reproductiva en las hembras. Los reportes indican que el uso de la PIVE ha venido creciendo de manera considerable en los últimos años, según la International Embryo Technology Society (IETS) en su informe anual de datos recogidos a nivel mundial, durante el año 2015 reportó 630.202 embriones producidos in vitro y transferidos, en contraste a los resultados del año 2001 en donde se transfirieron 109.205 embriones. Lo que representa un incremento alrededor del 500%, evidenciando una mayor demanda de esta biotecnología 1-3.
A pesar de la gran acogida de esta técnica y a la optimización que se tiene hoy en día de la PIVE, solo alrededor del 20-30% de los oocitos recuperados de hembras bovinas pueden llegar a convertirse en embriones transferibles, lo que podría deberse en parte a la utilización de oocitos con una baja competencia 4-8. Se ha descrito que la calidad de los oocitos se ve afectada principalmente por sus propiedades intrínsecas, como la capacidad de almacenamiento de biomoléculas que permiten su desarrollo posterior 5-7, y parece además, que la evaluación de la morfología, la cuál ha sido comúnmente utilizada para la selección de los COC, no ha demostrado ser el método más exacto para predecir la capacidad de desarrollo. Por lo tanto, en la actualidad, es aún necesario el desarrollo de un método fiable y no invasivo que permita mejorar la selección de oocitos competentes, por ello sigue siendo un tema de gran importancia en las técnicas de reproducción asistida 9.
Del mismo modo, en los sistemas de PIVE se han implementado diferentes protocolos y metodologías con el propósito de mejorar los resultados obtenidos, pero aún los resultados siguen siendo variables 10. Por esto, una de las mayores dificultades para mejorar la eficiencia de los programas de fertilización in vitro ha sido la falta de un método objetivo que permita una mejor selección de los oocitos orientada a incrementar las tasas de producción de embriones transferibles 11.
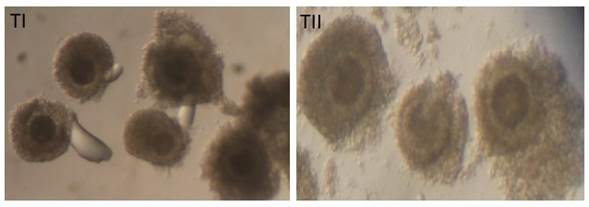
La técnica utilizada rutinariamente para la selección de los oocitos está basada en la evaluación de la apariencia morfológica y posterior clasificación de los COC 12,13. La metodología clásica ha definido cuatro tipos de COC dependiendo del número de capas de células del cúmulo y la homogeneidad del ooplasma (Tipo I: ˃ 4 capas y ooplasma homogéneo, Tipo II: 1-3 capas y/o ooplasma menos homogéneo, tipo III: desnudo y/o ooplasma no homogéneo, y Tipo IV: cúmulo expandido) 12. Los COC Tipo IV son considerados de baja competencia y en estado de degeneración ya que han mostrado no solo más baja capacidad de desarrollo 12 sino menor síntesis de RNAs y proteínas 14. Los oocitos Tipo III carecen de células alrededor de la zona pelúcida lo cual impide una buena capacidad de desarrollo ya que se ha demostrado que las células del cúmulo proveen al oocito de metabolitos como mRNA, microRNAs y moléculas de bajo peso que permiten su desarrollo normal 15.
Los oocitos con un cúmulo compacto compuesto de varias capas de células del cúmulo y un citoplasma homogéneo son consideran aptos; para la maduración y fertilización in vitro12. Algunos autores han examinado la capacidad de desarrollo de los oocitos bovinos con base a su morfología y han revelado que los COC que muestran signos tempranos de atresia (por ejemplo, ligera expansión del cúmulo y ligera granulación del citoplasma) tienen mayor potencial de desarrollo embrionario in vitro que los considerados como morfológicamente aptos 16,17, con tasas de blastocistos superiores para los COC con células del cúmulo expandidas (19%) comparado con aquellos completamente compactas (13.9%) 16.
Como se puede observar aún existe ambigüedad con relación a cuáles son los COC morfológicamente ideales para ser utilizados en la producción in vitro de embriones bovinos. Por ende, el objetivo del presente estudio fue evaluar el efecto de la morfología de los COC con signos de atresia temprana sobre las tasas de desarrollo embrionario in vitro en bovinos Bos indicus.
Materiales y métodos
Aval de ética
Para la realización de la presente investigación se cumplió con las normas nacionales e internacionales de bioética en la investigación con animales del Consejo de Organizaciones Internacionales de las Ciencias Médicas (CIOMS) y las normas de buenas prácticas en investigación con animales de laboratorio. Para el experimento se obtuvo el aval del comité de ética de la facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia, sede Bogotá, acta número CB-044 del 17 de junio del 2015.
Colección y selección de los COC
Se realizó un estudio con diseño experimental. En el cual se colectaron ovarios de hembras de faenado Bos indicus los cuales fueron puestos en solución salina estéril a una temperatura de 30 ºC, y transportados al laboratorio para la posterior obtención de oocitos para la PIVE 18.
Aquellos folículos de 3-8 mm fueron aspirados utilizando una jeringa de 10ml acoplada a una aguja calibre 18g, el aspirado folicular fue recogido en tubos cónicos de 50 ml, este contenido se dejó decantar por 10 min. Posteriormente, Los COC fueron colocados en una caja de Petri con ayuda de una pipeta Pasteur para su posterior localización y selección. Los ovarios y los COC fueron mantenidos durante el proceso de colección a 30 grados centígrados utilizando un baño de Maria19.
Los COC fueron seleccionados utilizando un estéreo microscopio de disección (Nikon SMZ445) con magnificación 200X y clasificados como oocitos Tipo I (≥ 4 capas de células del cúmulo y ooplasma homogéneo) y Tipo II (≥ 4 capas de células del cúmulo con expansión en las células más externas y ooplasma menos homogéneo, lo cual representa signos de atresia temprana) 20 (Figura 1). Para asegurar repetitividad de la clasificación de los oocitos se hicieron tres subgrupos de 20 oocitos por cada grupo de clasificación con cuatro replicas biológicas.
Producción de embriones in vitro
La metodología utilizada para la producción in vitro de embriones ha sido previamente descrita 18. Brevemente, los COC fueron lavados tres veces en medio TCM199/HEPES suplementado con gentamicina 50 μg/ml. Los subgrupos de 20 COC de cada categoría fueron sometidos a maduración in vitro en medio TCM199 suplementado con 10% de suero fetal bovino (SFB), 0,2 mM de piruvato de Na, 50 μg/ml de gentamicina, 0,5 μg/ml FSH y 5 µg/ml LH cubierto con aceite mineral e incubados en 5% CO2 y 90% de humedad y 38,2°C por 24 h. El medio de maduración fue gasificado en la incubadora (HERACell™ 150i) mínimo 2 h antes de su uso 21.
Veinticuatro horas después de la maduración los COC fueron lavados en medio de fertilización Fert-TALP suplementado con 0,6% de BSA (albúmina libre de ácidos grasos), 0,2 mM de piruvato de Na, 50 μg/ml de gentamicina, 30 μg/ml de heparina, PHE (2 mM Penicilamina, 1 mM hipotaurina y 250 mM epinefrina) previamente gasificado durante 2 h y transferidos a gotas de 50 µl cubiertas con aceite mineral 22. Para la fertilización, se utilizó semen congelado de un toro B. indicus con fertilidad probada para in vitro. Por sesión de fertilización, una pajilla fue descongelada en baño de maría a 37 ºC, luego los espermatozoides fueron centrifugados (Eppendorf 5810) en un gradiente de Percoll (90-45%) a 600 g por 15 min. El pellet fue reconstituido en medio de fertilización y centrifugado una vez más a 600 g por 5 min para retirar completamente el Percoll.
Después de la centrifugación de lavado, el pellet fue reconstituido nuevamente en medio Fert-TALP obteniendo una concentración de 1-2x106 espermatozoides por ml para la fertilización. Las gotas conteniendo 20 COC y espermatozoides fueron incubados por 18 h en un ambiente controlado de 5% CO2 y 90% de humedad y 38,2 °C 23. Posterior a las 18 h de coincubación, se retiraron los detritos celulares por medio de pipeteo manual dentro de la gota de fertilización y los presuntos cigotos fueron lavados tres veces en medio SOF modificado (mSOF) suplementado con 20 mM de HEPES y cultivados en gotas de 100 µl en medio mSOF suplementado con 50 µl de gentamicina y 5% de SFB sin HEPES, por siete días en 5% CO2, 5% de O2 y 90% de humedad Y 38,2 °C. La tasa de clivaje se determinó el tercer día del cultivo (fertilización considerado día 0) y el medio fue renovado en un 50% cada segundo día a partir del día tres de cultivo. Al séptimo día se determinó la tasa de blastocitos producida para cada grupo 23.
Evaluación de la calidad embrionaria
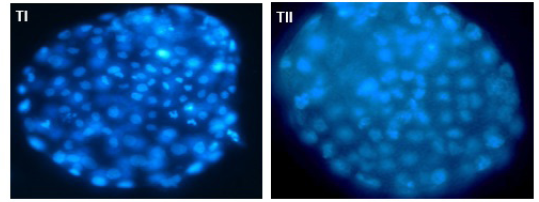
Un total de diez blastocistos en el día 7 de cultivo de cada grupo de oocitos tanto Tipo I como Tipo II fueron sometidos a la tinción fluorescente (Hoechst 33342) 20. Al día siete los blastocitos se colocaron en la solución de tinción Hoechst a una concentración de 1:200. Los embriones se incubaron durante 10 minutos en la solución de tinción y fueron protegidos de la luz, luego fueron retirados de la solución de tinción y lavados en PBS tres veces 24. Los blastocistos teñidos se montaron en porta objetos y se observaron al microscopio de fluorescencia (Nikon eclipse 80i) a una magnificación de 400X, de cada blastocisto se tomaron microfotografías para luego determinar el número de blastómeras utilizando el programa ImageJ v 1,45 25 para así determinar diferencias en la calidad embrionaria según el tipo de COC.
Análisis estadístico
Se realizó estadística descriptiva, determinándose las desviaciones estándar para la media de la tasa de clivaje, la tasa de blastocitos y el número de blastómeras por tipo de COC. La comparación de medias de ambos grupos de COC se analizó por medio de una prueba t de dos muestras utilizando SYSTAT v 13.1. Los datos se presentan como porcentajes (media ± EEP) todo valor p<0,05 fue considerado como estadísticamente significativo.
Resultados
Producción in vitro de embriones de COC Tipo I y Tipo II
Un total de n= 381 COC fueron utilizados para este estudio, los cuales según su morfología fueron divididos en dos grupos y clasificados como Tipo I y Tipo II. La tasa de clivaje fue de 88 ± 4% y 89 ± 8% y la tasa de blastocistos al día 7 de cultivo fue de 36 ± 7% y 33 ± 8% para los COC tipo I y tipo II respectivamente. En este estudio no se encontraron diferencias estadísticas entre las tasas de clivaje (p˃0,50) y desarrollo embrionario en ambos grupos (p>0,5), indicando que los tipos de COC seleccionados poseen una capacidad similar de desarrollo embrionario (Tabla 1).
Calidad embrionaria
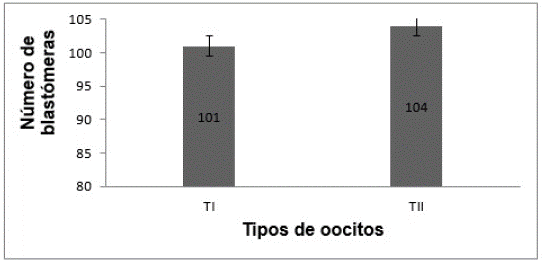
Los datos del conteo de las blastómeras para ambos grupos de embriones se pueden apreciar en la figura 2. Se contaron 101 blastomeras para los blastocistos provenientes de COC TI y 104 para los blastocitos de COC TII. No se observaron diferencias significativas (p>0,05) en el número de blastómeras de los embriones provenientes de los dos tipos de COC seleccionados en el estudio, indicando que el tipo de COC (TI y TII) no afecta el número de las blastómeras encontradas en los blastocitos.
En la figura 3 se muestran los embriones de ambos tipos de COC teñidos con fluorocromo Hoechst 33342 utilizada para evaluar la calidad embrionaria basado en el conteo de blastómeras totales del embrión.
Discusión
En los procesos de producción de embriones in vitro la competencia del oocito es generalmente definida como la capacidad que posee el gameto femenino de madurar, ser fertilizado, desarrollarse hasta el estado de blastocisto, para finalmente generar un descendiente normal y saludable 26. La morfología de los COC se ha utilizado como un parámetro de selección de calidad de los oocitos ya que parece existir una relación entre la morfología y el desarrollo competente 27.
Algunos estudios realizados en B. taurus, han mostrado que COC con signos de atresia temprana determinada por su aspecto morfológico (leve expansión de las células del cúmulo periféricas y ooplasma granulado) parecen tener la misma o mejor capacidad de desarrollo que los considerados morfológicamente normales 13,18,28, aunque actualmente el dogma y el proceder durante los procedimientos de PIVE consiste en incluir solamente los oocitos con cúmulo compacto y ooplasma homogeneo denominados como morfológicamente normales 29-31 dejando atrás posiblemente COC competentes que si fueran incluidos podrían aumentar el número de COC que entran a los programas de PIVE y por ende las posibilidades de mejorar las tasas de producción de blastocistos de dichos programas. El presente estudio permitió evaluar el efecto de la morfología de los COC con signos de atresia temprana sobre las tasas de desarrollo embrionario in vitro en bovinos B. indicus.
En este estudio se observó que los oocitos provenientes de los COC Tipo I (morfológicamente saludables) y Tipo II (con atresia temprana) no tuvieron diferencias estadísticas con relación a la tasa de clivaje, el desarrollo embrionario y el conteo de blastómeras determinado por medio de la tinción con Hoechst. Ambos tipos de COC poseen la misma capacidad de desarrollo para producir embriones. Estos hallazgos coinciden con otros reportes en donde se evidenció que los COC que muestran los signos de atresia temprana como una ligera expansión del cumulo y una ligera granulación del citoplasma tienen mayor o igual potencial de desarrollo que los que se consideran morfológicamente idóneos 9,17,21,28. Llegando a la conclusión de que existe una relación positiva entre la atresia temprana y la competencia del oocito ya que se ha evidenciado una mejor tasa de maduración y de blastocistos para COC con cúmulo con expansión temprana y ooplasma granular comparado con COC con cúmulo compacto y ooplasma homogéneo 13,32.
Nuestros resultados permiten avanzar en el conocimiento sobre la relación existente entre la morfología de los COC y la capacidad de su desarrollo in vitro. Aziz y colaboradores reportaron que la apoptosis temprana en CC de oocitos inmaduros bovinos está asociada a competencia oocitaria, ya que no encontraron diferencias en la capacidad de maduración in vitro entre COC con diferentes grados de apoptosis en las células del cumulo determinado por medio de tinción con connexina-V 32. En cuanto a la capacidad de desarrollo embrionario, Li y colaboradores clasificaron los COC en cuatro grupos según características morfológicas; las tasas de clivaje y de blastocistos fueron superiores para COC con ooplasma granular, comparado con los COC con ooplasma homogéneo 21. De manera similar, en otro estudio realizado por Bilodeau-Goeseels y Panich, también se reportaron mayores tasas de blastocistos para aquellos oocitos con signos de atresia temprana (granulación del ooplasma y expansión de las células del cúmulo) en comparación con aquellos compactos y con ooplasma homogéneo 17, de igual manera que lo reportaron Blondin y Sirard . Los hallazgos reportados en el presente estudio concuerdan con lo reportado por otros autores, indicando que quizá los signos de atresia temprana no reflejan menor competencia oocitaria como se había reportado 12. Puede ser que los signos de atresia temprana reflejan una expresión de genes y almacenamiento de biomoléculas necesarios para el posterior desarrollo embrionario que los hacen más competentes y por ende más idóneos para la PIVE; lo cual ratifica que los oocitos denominados Tipo II (con signos de atresia temprana) podrán ser utilizados para la producción in vitro de embriones ya que se obtienen resultados similares o quizá mejores que los obtenidos utilizando solamente los COC Tipo I (sin signos de atresia).
Como soporte de esta idea, Urrego y colaboradores, reportaron que los oocitos con signos de atresia temprana presentan una mayor competencia evidenciada en una tasa de producción de blastocitos mayor y una mayor expresión relativa del gen MATER, relacionado con competencia oocitaria 18. De igual manera, en un estudio reciente en humanos, donde se reportó una clasificación de competencia oocitaria (gestación vs. no gestación) según un perfil de expresión génica en las CC de COC obtenidos posterior a la inducción de ovulación, se encontró que había un aumento en la expresión de genes que codifican para apoptosis en COC que produjeron gestaciones saludables comparado con aquellos que no desarrollaron una gestación 33. De igual manera, en bovinos también se ha asociado una mayor competencia oocitaria con un perfil de expresión génica relacionado con hipoxia temprana, estrés oxidativo, apoptosis e inflamación inducido por protocolos conocidos como ¨coasting¨ con los cuales se realiza una estimulación con FSH seguidos de un periodo de inanición de la hormona 34. De esta manera se puede relacionar la atresia temprana, identificada molecularmente con perfiles de expresión génica de apoptosis, con una mayor competencia oocitaria.
Los resultados encontrados en este trabajo donde se utilizaron COC provenientes de hembras B. indicus, en conjunto con los resultados reportados por otros investigadores en Bos taurus sugieren que los COC Tipo II puede tener igual potencial de desarrollo in vitro basados en tasa de clivaje y de blastocistos, que los COC Tipo I, aquellos con ooplasma homogéneo y CC compactas.
De otro lado, en la calidad embrionaria evaluada a través de conteo de blastómeras en los blastocistos obtenidos de cada tipo de COC se encontró que no hay una diferencia estadística significativa en embriones provenientes de COC tipo I o tipo II. El número de blastómeras a los 7 días de cultivo, obtenidos en el presente trabajo fueron similares a los obtenidos por diferentes grupos de investigación que utilizaron el mismo tipo de tinción para evaluar calidad embrionaria. Bao y colaboradores, encontraron blastocistos con 116 blastómeras en su grupo control en cultivo in vitro con interferón tau 35, mientras que Santana y colaboradores reportaron 84.6 blastómeras para el grupo control de su experimento 36. En este experimento se reportaron blastocistos con 101 blastómeras para COC tipo I y 104 blastómeras para los tipo II los cuales son números de blastómeras reportados como normales para blastocitos bovinos 35.
Conclusión
En este estudio se evidenció que los COC con ligera expansión en las células del cúmulo y ooplasma menos homogéneo, con signos de atresia temprana (Tipo II), poseen la misma capacidad de desarrollo que los COC morfológicamente normales (Tipo I). Estos resultados pueden constituir una buena base para revisar los criterios para la selección de los oocitos B. indicus para la producción in vitro de embriones, permitiendo y fundamentando el usos de oocitos tipo II para producir embriones de similar calidad a los provenientes de oocitos tipo I.