Introducción
La palabra dimorfismo proveniente del griego significa di: dos; y morphe: forma. Se denomina dimorfismo sexual a la existencia de diferencias fenotípicas entre individuos de una misma especie pero de diferente sexo (Motani et al ., 2018). En la mayoría de los mamíferos superiores, las diferencias anatómicas entre sexos son un rasgo asociado a la acción de las hormonas sexuales y por lo tanto, a la maduración de las gónadas lo cual marca el comienzo de la diferenciación sexual (semana 6 en embriones bovinos) y el fin del periodo de indiferenciación sexual o pregonadal que le antecede (Camargo, 2012).
A menudo una de las diferencias más conspicuas en la morfología de machos y hembras adultos es el tamaño corporal (Serrano-Meneses, Reyes Hernández, Carrillo Muñoz, & Rivas, 2014). La existencia de dimorfismo sexual en tamaño (SSD por sus siglas en inglés) (Serrano-Meneses et al ., 2014) es una característica ampliamente distribuida en diferentes especies animales, siendo un fenómeno que, aunque ampliamente estudiado en algunos animales, aún permanece enigmático en cuanto a sus causas últimas, así como a sus relaciones alométricas con el tamaño corporal (hipótesis de Rensch) (Dale et al ., 2007; Bidau & Martinez, 2016).
Las implicaciones ecológicas y comportamentales que conllevan el SSD han sido ampliamente documentadas y discutidas debido a que la ausencia o presencia de estas características se consideran un correcto indicador del apareamiento (Owens & Hartley, 1998; Székely, Freckleton, & Reynolds, 2004; Rezić, Bošković, Lubinu, Piria, & Florijančić, 2017). Ello se explica porque la selección natural es más común en especies en que el apareamiento se basa en la poliginia, en que existe una mayor competencia entre los machos por las hembras (Khalatbari, 2018); sería el caso de los bovinos (Aracena, 2010; Fuentes-Mascorro et al ., 2011). Por lo contrario, las especies que son monógamas, o en que la competencia sexual es más reducida, este dimorfismo sexual puede ser casi inexistente. Como consecuencia, es la selección sexual la que origina el dimorfismo sexual, siendo el tamaño corporal la más destacada. En el caso de los bovinos, los machos suelen presentar medidas corporales mayores a las de las hembras, lo que determina un mayor volumen corporal. En esta especie, además, nos encontramos ante un increíble acerbo de tamaños corporales: desde los 145-185 kg de los machos de la raza Ghana -también denominada Shorthorn del Oeste Africano-, a los 1,200-1,500 kg (800-1,150 kg en hembras) de los toros Chianina, propios de la Toscana (Italia) (Porter, 1991).
Ahora bien, un problema con el que se encuentra la práctica etnológica es la inexistencia de un patrón universal de dimorfismo sexual en el bovino, puesto que cada raza podría expresar de forma diferente las diferencias entre sexos, fruto del sesgo que representa el medio y la propia selección artificial. En general, el estudio de las diferencias entre sexos se centran en el tamaño (Hood, 2000). Cuando el cuerpo es más grande y robusto puede ello explicarse debe en parte a la hipertrofia muscular de los hombres que implica un mayor desarrollo de las áreas de origen e inserción de la musculatura (Dale et al ., 2007; Damme, Entin, Vanhooydonck, & Herrel, 2008). Además, hay que tener en cuenta el desarrollo de otras estructuras óseas que se presentan agrandadas en los machos respecto a las hembras, como las presentes en el cráneo (Franco-Moreno et al ., 2015). . Pero la variabilidad de otros caracteres morfológicos que no fueran el tamaño corporal o regional podría ser otro factor que condicionase la discriminación sexual en caso de escaso o nulo SSD.
En Guatemala, desde hace cincuenta años la bondad del ganado criollo Barroso-Salmeco es reconocida y apreciada por los ganaderos a pesar que no estar aún oficializada como raza. Sin embargo, a nivel Iberoamericano es conocida como una raza bovina única y con riesgo de extinción en Guatemala (Jáuregui, Gutiérrez, Cordón, & Vásquez, 2014), siendo las referencias bibliográficas escasas (Melgar et al ., 1988) (Jáuregui et al ., 2014).
A fin de contribuir a un mejor conocimiento de esta raza, en esta investigación analizamos el dimorfismo sexual de 49 hembras y 5 toros mayores de 3 años, a partir de 23 variables morfoestructurales lineales y el peso vivo, y su estudio mediante técnicas de análisis multivariante, lo que va a permitir dilucidar si aparece únicamente SSD, dimorfismo por el tamaño, o bien el posible dimorfismo se expresa en otros caracteres. A destacar que caracteres merísticos, tales como pelaje, perfil cornual, etc. no han sido considerados en este estudio.
Materiales y métodos
El presente estudio se realizó en la finca “la Conda”, municipio de Chiquimulilla, del departamento de Santa Rosa, en el suroriente de Guatemala. La muestra incluyó 49 hembras (peso vivo 496,4 kg ± 80,3) y 5 toros (peso vivo 563,1 kg ± 171,6) mayores de tres años de edad, de los que se obtuvieron 23 medidas morfoestructurales lineales representativas de la morfología corporal: alzada a la grupa (ALG) y a la cruz (ALC); diámetros longitudinal (DL), bi-costal (DBC), y dorso-esternal (DD), longitudes de la cabeza (LCB), cráneo (LCR), cara (LCA) y grupa (LG); anchuras de la cabeza (ACB), cara (ACA), hombros (AH), grupa (ANG), inter-ilíaca (AII), longitudes de la cola (LCL), corporal (LC), miembro anterior (LMA) y posterior (LMP), y perímetros torácico (PTX), abdominal (PBD), caña anterior (PCA) y posterior (PCP). Se realizó un NPMANOVA (Non Parametric Multivariate ANalysis Of VAriance) con las distancias de Mahalanobis para todas las variables analizadas, y un Análisis de Componentes Principales (ACP) a partir de la matriz var-covar (Hammer, 2002). El dimorfismo sexual se estimó como la relación entre el valor medio de los machos y el valor medio de las hembras, expresado en porcentaje. De cada animal se obtuvo así mismo el peso vivo (que se interpreta como “tamaño”), que no se consideró dentro del análisis multivariante. Si las descargas en el CP1 son positivas, este componente puede interpretarse como una medida de tamaño (Sharifi, Farasat, & Vaissi, 2012). Las variables fueron analizadas independientemente mediante un test U de Mann-Whitney. Se trabajó con un nivel de significación del 5% con el paquete estadístico PAST v. 216c (Hammer, Harper, & Ryan, 2001).
Resultados
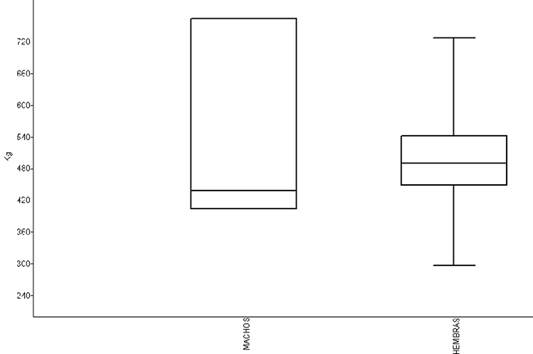
El NPMANOVA demostró la presencia de diferencias estadísticamente significativas entre sexos (F=1,78, p=0,0005) al considerar todas las 23 medidas morfoestructurales lineales. El ACP explicó el 54,28% la varianza total observada para los dos primeros componentes (CP1+CP2=32,30%+21,98%) (Figura 1), siendo las variables LMA, LC, PTX y PBD las que presentaron más contribución para el CP1 (valores >0,35); y PBD y PTX para el CP2 (valores >[0,35]) (Tabla 1). Esas diferencias oscilaron entre un 0,08% para el LMA a un 4,3% para la LC, a favor de los machos en todos los casos, pero en ningún caso con diferencias estadísticamente significativas (p>0,100). Todas las variables del CP1 contribuyeron a la variación positivamente (Figura 2). El peso vivo por sí solo, tampoco no se manifestó estadísticamente diferente entre sexos (U=84, p=0,256) (Figura 3), pero sí PCA y PCP (p=0,0001), presentando los toros cañas más gruesas, tanto en las extremidades anteriores como posteriores. Los valores de descarga de esos valores aparecieron, de todos modos, muy bajos en el CP1 (<0,04).
Tabla 1 Valores de descarga para los dos primeros componentes del Análisis de Componentes Principales (ACP). El ACP explicó un 54,28% la varianza total observada para los dos primeros componentes (CP1+CP2=32,30%+21,98%), siendo las variables LMA, LC, PTX y PBD las que presentaron más contribución para el CP1 (valores >0,35); y PBD y PTX para el CP2 (valores >[0,35]). Acrónimos en el texto.
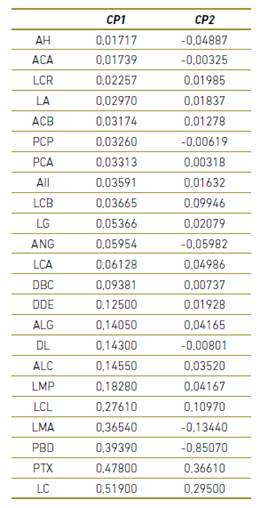
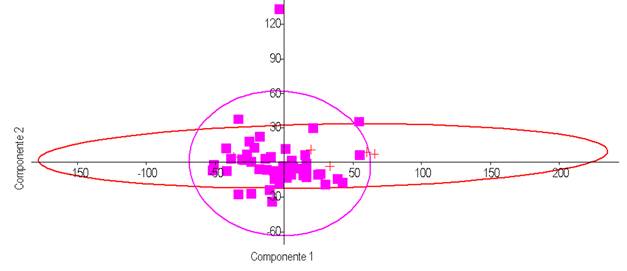
Figura 1 Análisis de Componentes Principales (ACP) a partir de la matriz varcovar para las 23 medidas morfoestructurales representativas de la morfología corporal en el bovino Barroso-Salmeco (49 hembras - representados por cuadrados rellenos- y 5 toros -representados por cruces-) mayores de tres años de edad. El ACP explicó un 54,28% la varianza total observada para los dos primeros componentes (CP1+CP2=32,30%+21,98%). Las elipses marcan el 95% de la muestra.
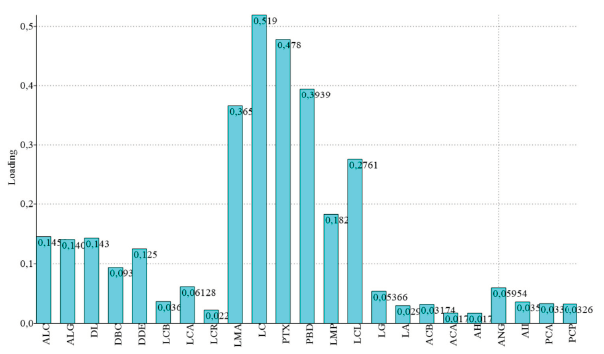
Figura 2 Valores de descarga para las 23 variables analizadas en el CP1. Todas las variables del CP1 contribuyeron a la variación positivamente, indicando pues el factor “tamaño” como discriminante principal para este componente. Las variables LMA, LC, PTX y PBD fueron las que presentaron más contribución a la variación total observada en este CP. Acrónimos en el texto.
Discusión
Existen tres ámbitos de la morfología que pueden diferir entre sexos: caracteres sexuales primarios, caracteres sexuales secundarios y caracteres no reproductivos (Motani et al., 2018). Los primarios se manifiestan en los caracteres sexuales primarios, órganos reproductivos. Los secundarios son aquellos que aparte de los órganos reproductivos ayudan el éxito reproductivo (Motani et al., 2018). Por último, algunas características no directamente relacionadas con la reproducción también pueden ser, en algunos casos, dimórficos (Motani et al., 2018).
Un dimorfismo sexual relacionado con el tamaño corporal (SSD) parece no confirmarse en la raza Barroso-Salmeco, al no mostrarse diferencias para el peso ni para las variables morfométricas consideradas en conjunto, que al presentar todas una descarga positiva en el CP1 pueden considerarse definitorias del “tamaño”. Así, los toros presentarían la misma tendencia ponderal, y similares proporción (submediolinidad), compacidad y conformación cefálica (dolicocefalia y mesoprosopia) que las hembras. Vacas y toros de la raza Barroso-Salmeco se diferenciarían entre ellos por otroos caracteres, no relacionados con el tamaño, y no reproductivos. Se trataría pues de un bajo dimorfismo sexual basado en unos pocos caracteres no de tipo sexual ni adaptativo, y que se centrarían únicamente en el grueso de las cañas. Las razones por las que únicamente la morfoestructura es sólo ligeramente más discriminadora de los sexos habría pues que buscarlas en puras diferencias anatómicas terciarias. Decir tiene que en las razas domésticas la selección artificial podría representar un sesgo hacia individuos poco dimórficos sexualmente (Parés-Casanova, 2013) (Parés-Casanova, 2015).
Aún así, los datos obtenidos contrastan con los de algunas razas bovinas criollas, como por ejemplo la de Oaxaca, en la que se detecta SSD a favor de las hembras (Fuentes-Ascorro et al., 2011), y ello a pesar de presentar unos valores ponderales muy por debajo de los del Barroso-Salmeco. El bovino Criollo Patagónico presenta, en cambio, un SSD a favor de los machos, aunque en este caso el peso corporal de los toros está muy por encima del Barroso-Salmeco (600-800 kg) (Aracena, 2010). Sería el caso igualmente del Limonero (Chirinos, Contreras, Zambrano, Molero, & Páez, 2011). Pero on otras razas criollas, como el Casanare, no se acusa dimorfismo sexual (Sastre, Rodero, Rodero, Herrera, & Peña, 2010). Como factor añadido que podría haber reforzado este escaso dimorfismo en la habría un escaso reemplazamiento y, por ende, escasa o nula incorporación y/o mezcla con otros animales o con otras razas, por lo que se supone el Barroso-Salmeco como una población geográficamente aislada y con un papel poco relevante en los aportes genéticos o poblacionales recibidos.
Por desgracia, son escasos los estudios sobre razas bovinas criollas que contemplan el peso corporal real (Salamanca-Carreño & Crosby-Granados, 2013) (Escobar, Villalobos, & Núñez, 2015) -aunque es algo totalmente justificable por la dificultad técnica de obtener estar variable en campo-, pero ello limita las comparaciones entre sexos por tamaño y forma separadamente para cada una -y entre ellas- de las razas criollas. Estos estudios permitirían evaluar la variación geográfica de peso corporal y su impacto sobre el SSD, así como poder comprender los mecanismos que lo modulan.
Conclusiones
Ambos sexos presentarían la misma tendencia ponderal, proporción, compacidad y conformación cefálica, lo que representa un monomorfismo sexual de tamaño.
Vacas y toros de la raza Barroso-Salmeco se diferenciarían entre ellos por unos pocos caracteres, no reproductivos, relacionados con el grueso de las cañas.