Introducción
Las pandemias usualmente son causadas por microorganismos zoonóticos, ya sea por el consumo de animales o la crianza de los mismos y son causadas en mayor frecuencia por un grupo de virus llamados coronavirus (CoV) que causan principalmente infecciones en aves y mamíferos 1. En las últimas décadas, su capacidad de infectar a los humanos, 2,3 como es el caso del Síndrome Respiratorio Agudo Grave (SARG) o Síndrome Respiratorio de Oriente Medio (MERS) 4 ha tomado gran relevancia. Los coronavirus causantes de SARS y MERS además de afectar a los humanos también causan enfermedades en mamíferos (ballenas, felinos, etc.), así como en las aves (incluidas las aves de corral como los pollos de engorde y los pavos) 5,6 que son de importancia económica y consumo global. Recientemente, en el año 2019, causaron una nueva epidemia llamada nuevo coronavirus 2019, se cree que comenzó en un mercado ubicado en Wuhan, China, diseminándose en todo el continente asiático y posteriormente a más de 180 países en el mundo, causando una pandemia 7.
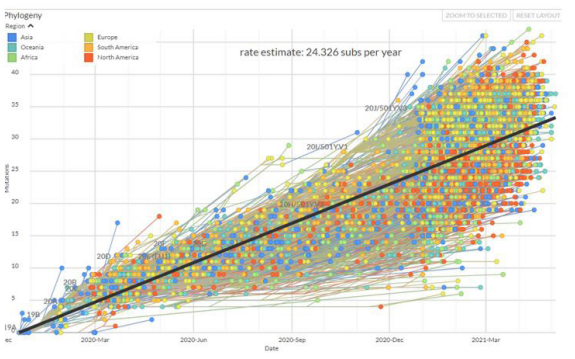
La COVID-19 es causada por un virus llamado SARS-CoV-2 8, mientras que en los pollos de corral los coronavirus causan Bronquitis Infecciosa Aviar 9. Los coronavirus están diseminados por el planeta y son sumamente infecciosos además de ser sumamente difíciles de controlar porque poseen características como: elevada diversidad genética en grandes extensiones territoriales, tiempo corto de multiplicación y una corta tasa de mutación (Figura 1) 10. Los coronavirus pueden ocasionar enfermedades en el tracto respiratorio en su mayoría, en el tracto gastroentérico y en algunos casos enfermedad en hígado y en sistema nervioso de una extensa variedad de animales y humanos 11. Los coronavirus asociados a los animales causan infecciones que cubren una amplia gama de sitios diana que incluyen respiratoria, entérica, neurológica, renal y hepática 11,12,13. Algunos de los coronavirus que infectan animales no humanos como a las aves están ubicados en el grupo Gammacoronavirus, como lo es el IBV no infectan ni causan enfermedades en humanos (14. El SARS-CoV-2 pertenece al grupo Betacoronavirus junto con SARS-CoV y MERS-CoV 15. Debido a que el virus causante de COVID-19 pertenece al mismo grupo de coronavirus que el SARS-CoV y usa el mismo receptor de células huésped ACE-2 16,17,18, en cambio IBV ingresa principalmente de la endocitosis mediada por clatrina y requiere un sistema endosómico / lisosómico clásico 19.
La bronquitis infecciosa (IB), causada por el IBV, es uno de los patógenos más contagiosos y contagiosos de los pollos en todo el mundo 21. IBV tiene un rango de hospedadores limitado 22 ya que algunos virus están estrechamente relacionados solo con las aves silvestres y domésticas como faisanes, patos, gansos, entre otros. Antes se creía que solamente los pollos eran el único huésped natural, sin embargo, también se ha demostrado que los faisanes son susceptibles a la infección por IBV (23. Esto nos hace pensar en si las aves son posibles reservorios del SARS-CoV-2 y poder transmitirlo a los humanos, en las últimas semanas se ha escuchado el miedo de parte de población en el consumo de carne de pollo, esta revisión dilucida algunos puntos clave en las diferencias en el SARS CoV-2 y el IBV.
Orígenes SARS-CoV-2 y del IBV
Al analizar la secuencia genómica de SARS-CoV-2 señala que éste surgió de un hospedero animal (murciélago o pangolín) 16,24. Los aislamientos virales provenientes de una variedad de animales en los alrededores de la provincia de Cantón, reportaron que SARS-CoV-2 tiene semejanzas con diferentes tipos de coronavirus, incluyendo coronavirus aviares y virus idénticos a SARS-CoV 25 procedentes distintos mamíferos (Figura 2) encontrados en diferentes mercados 26. Se cree que un virus semejante al SARS-CoV aislado de un murciélago es el progenitor del SARS-CoV-2 ya que no existen secuencias de los coronavirus de este animal, lo cual ha impedido elucidar el origen real del SARS-CoV-2 16. Se ha comprobado que la glicoproteína de la espícula viral tiene un alto grado de emparentamiento entre virus que infectan mamíferos y aves ya que es la encargada del contacto con el hospedero 25. Según análisis filogenéticos, se ha supuesto que el SARS-CoV-2 se desintegró del grupo 2 de coronavirus modernos, sugiriendo que evolucionó rápidamente (Figura 2) 27.
Es probable que el virus COVID-19 se originara en los murciélagos 16. Los murciélagos son ampliamente aceptados como el reservorio de los coronavirus de los mamíferos (Alfa y Beta) 28. Hay más de mil especies diferentes de murciélagos que albergan diferentes de coronavirus 29. Los coronavirus que infectan humanos debido a su alta variabilidad genética provienen de un reservorio de murciélagos, que infectaron a un huésped intermedio y luego al huésped final 8. Datos epidemiológicos moleculares muestran un emparentamiento cercano entre el coronavirus que infecta a los humanos y el de los murciélagos 23.
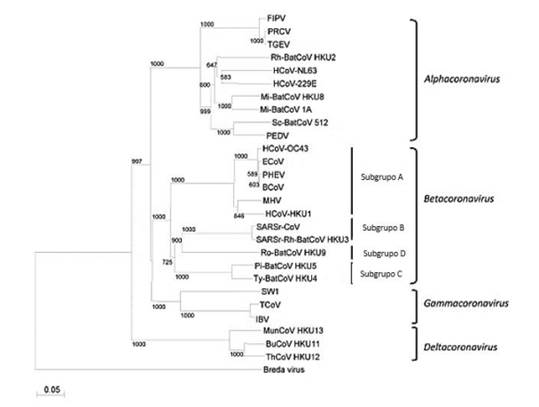
Figura 2 Análisis filogenético de ARN polimerasas (Pol) dependientes de ARN de coronavirus con secuencias completas del genoma disponibles. Adaptado de 30.
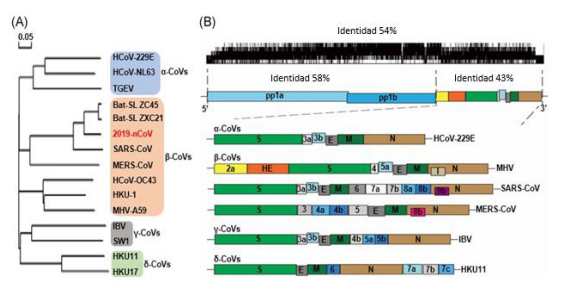
El IBV tiene tres proteínas estructurales codificadas por virus principales, que incluyen la glicoproteína de la espiga (S) (Figura 3), de la membrana (M) y de la nucleocápside (N). El pico de IBV se forma mediante la escisión postraduccional de dos componentes de polipéptidos separados, designados S1 y S2 9. De estos, la glucoproteína S1 está asociada con la unión del virus y es un objetivo principal de los anticuerpos neutralizantes en pollos, por lo que la evolución serotípica en el VBI se asocia principalmente con las secuencias de la glucoproteína S1 31,32. Por lo tanto, la caracterización molecular de IBV se basa principalmente en el análisis del gen S1 33,34. El coronavirus del pollo llamado también bronquitis infecciosa (IBV), se replica en el epitelio del tracto respiratorio superior e inferior y a lo largo del tracto digestivo así como también en el riñón, oviducto y testículos 21. Cada vez hay más pruebas de que el IBV puede infectar especies de aves distintas al pollo 35. Probablemente, la razón principal del alto perfil de IBV es la existencia de una gran cantidad de serotipos 21.
Patogénesis de SARS-CoV-2 y del IBV
Los virus causantes de SARS y MERS pueden infectar el tracto respiratorio inferior y causar un síndrome respiratorio grave en humanos 37,38. Algunos CoV pueden infectar ganado, aves, murciélagos, ratones, ballenas y muchos otros animales salvajes, y pueden causar grandes pérdidas económica 39,40. El nuevo CoV, 2019 - nCoV, que pertenece a los betacoronavirus basados en el análisis de secuencia, también puede infectar el tracto respiratorio inferior y causar neumonía en humanos, pero parece que los síntomas son más leves que el SARS y el MERS 15.
En el caso del IBV, al inhalarse, el virus se ligará a los receptores de glucoproteína que contienen ácido siálico en las células epitelio respiratorio 41. El dominio de unión al receptor de IBV (RBD) en la espiga S1 desempeña un papel importante en el acoplamiento del virus a las células 41,42. Por lo tanto, la variación en la glucoproteína S1 determina en parte el tropismo tisular y la virulencia 43. La replicación viral dará como resultado la pérdida de la función ciliar, acopiamiento de moco, necrosis y descamación, causando impedimento para respirar y asfixia 44. El IBV afecta la tráquea, los riñones y el tracto reproductivo a través de la interacción de las glucoproteínas S1 RBD (AA 19-69 en M41) con los receptores de ácido α-2,3-sialico en la superficie de las células 45,46. La replicación local del virus causará viremia y extenderá la infección a otros tejidos y órganos 44. Después de la unión viral, los cambios conformacionales que ocurren en la glucoproteína S1 median la actividad de fusión de la membrana del terminal de ácido carboxílico S2 de la glicoproteína espiga 21.
Posteriormente, el IBV ingresa a la célula y libera su nucleocápside en el citoplasma de la célula, lo que desencadena la replicación, la aparición de virus y la liberación 47. Los pollos de todas las edades y tipos de razas son susceptibles a la infección por IBV, pero el alcance y la gravedad de la enfermedad es pronunciada en pollos jóvenes, en comparación con los adultos 48. Por causa de la viremia, algunas cepas nefrotrópicas podrían afectar el epitelio renal, causando insuficiencia renal 49. En la evaluación general, los riñones pueden aparecer inflamados y pálidos con la presencia de uratos en los uréteres 44. En las gallinas, el IBV virémico también alcanzará el conducto ovárico, causando lesiones en el útero 44.
Probabilidad de que el COVID-19 cause enfermedades en aves de corral
En los análisis filogenéticos se indican que SARS-CoV-2 pertenece al mismo género de betacoronavirus que los virus causantes de SARS y MERS, sin embargo, SARS-CoV-2 tiene una mayor similitud de secuencia del genoma con varios beta coronavirus detectados en murciélagos ya que muestra más del 96% de identidad con un coronavirus de murciélago conocido, en comparación con el 79,5% de identidad con el virus causante de SARS 16,50 lo que indica claramente lo distintos que son los coronavirus que ocasionaron grandes brotes, por lo cual suponemos que las características clínicas serán también diferentes en algunos casos. A medida que hay más datos disponibles, también se revelan características de casos adicionales. Es evidente que el resultado de la neumonía por SARS-CoV-2 es enormemente destructivo, a pesar de tener una tasa de mortalidad inferior al 3 % (según los datos hasta el 8 de febrero de 2020 en China) 51 en comparación con el SARS-CoV (tasa de mortalidad del 9,6 %) y el MERSCoV (tasa de mortalidad de 9,6 % y 34 %) 52. Sin embargo, la propagación de la infección por SARS-CoV-2 es mucho más amplio que el SARS-CoV o MERS-CoV e involucra un mayor número de pacientes, además de que el tiempo medio estimado de incubación por SARS-CoV-2 hasta hace dos meses en Wuhan fue de 5,2 días 53, en comparación con el SARS-CoV (tiempo medio de incubación 4 días) 54 y MERS-CoV (rango de tiempo de incubación entre 4,5 y 5,2 días) 55, por lo tanto, observando la pandemia actual, podemos decir que un tiempo de incubación más prolongado puede conducir a una alta tasa de infección asintomática y subclínica entre individuos inmunocompetentes, lo cual podría explicar el gran aumento de número de casos confirmados del reciente brote por COVID-19.
El IBV, en cambio, pertenece al género Gammacoronavirus, el cual no ha reportado brotes en humanos sino en aves de corral. Los pollos de toda la edad son susceptibles a la infección por IBV, induciendo una enfermedad más grave en los pollos recién nacidos y la gravedad disminuye a medida que aumenta la edad. La infección por IBV también se registró en pavos reales y también en aves no galliformes, por ejemplo, la cerceta 56, en cuanto al período de incubación del IBV es muy corto comparado con SARS-CoV-2, que es de 18 a 36 horas y depende de la dosis de infección del virus, y los signos clínicos van apareciendo dentro de las 24 y 48 horas de la exposición al virus 57. El SARS-CoV se originó a partir de murciélagos de la familia Hipposideridae, aunque esto es dudoso ya que los estos animales estaban en hibernación mientras se desarrollaba el brote 58, utilizan a los mamíferos denominados como civeta de palmeras, muy comunes en los países como China y Tailandia, como huéspedes intermediarios 59 y además se encontró este virus en distintas muestras de hurones, frecuentemente hallados en América del Norte y Asia 60, conociéndose al menos las especies que contienen al virus por un determinado tiempo para después infectar al humano. Se ha evidenciado que otras vías para la propagación del virus las cuales son estrechar la mano a una persona infectada, tocar un objeto o superficie infectada, tocar la nariz o la boca con frecuencia o entrar en contacto con la excreta del paciente y otra vía es a través de la “transmisión oculta”, en la cual los individuos o portadores asintomáticos transmiten el virus a contactos desprevenidos sin saberlo 61; aunque estas vías son menos comunes que el de transmisión por gotitas, le dan al virus una capacidad mayor de propagación. Las similitudes de la secuencia del receptor que se une a SARS-CoV-2 entre humanos y animales sugieren una baja barrera de especies para la transmisión del virus a los animales de granja 58 lo cual es muy importante para que los médicos veterinarios tomen acciones preventivas y hagan una correcta vigilancia no solo en animales de granja o domésticos sino también silvestres. En un estudió se observó que la variación genómica de los virus conocidos de la especie coronavirus relacionados con el síndrome respiratorio agudo es menor en comparación con la de otras especies comparativamente bien muestreadas, por ejemplo, aquellas prototipadas por MERS-CoV e IBV 62, lo que indica que genéticamente ambos virus están alejados. Otra diferencia entre ambos es el sitio de acción ya que en los nuevos coronavirus causantes de COVID-19 es la enzima convertidora de angiotensina 2 (ACE2) netamente de humanos 63, mientras que el sitio diana para el IBV son los receptores tipo toll 3 (TLR3) y (TLR21) de células innatas inmunes de pollos 64, lo cual demuestra claramente que el IBV no podría causar infecciones en humanos.
Conclusiones
El virus de COVID-19 se transmite principalmente entre las personas a través de gotitas respiratorias que contienen el virus, y las infecciones se producen por la nariz, los ojos y la boca. Es muy poco probable que el virus de COVID-19 infecte o cause enfermedades en las aves de corral 65. Se debe prestar atención a los coronavirus debido a que mutan de manera muy rápida y sus abundantes recombinaciones genéticas, semejantes a una tasa similar a la de los virus de influenza. No es sorprendente que el cambio de hospedero y la zoonosis que conlleva a enfermedades epidémicas hayan sucedido entre coronavirus 66,67. Es probable que el nuevo coronavirus todavía esté circulando en reservorios animales silvestres ya que estos tienen el potencial de emerger muy rápido y provocar una nueva epidemia, sobre todo por los hábitos de consumo humano y sus interrelaciones con la naturaleza. Es por ello por lo que no solo profesionales biólogos o médicos deben ocuparse de este tipo de casos, sino también los médicos veterinarios que poseen la capacidad investigadora en relación a infecciones en animales de granja y silvestres. En cuanto a la infección de COVID-19 en pollos sería casi improbable debido a más que todo a la incompatibilidad de los receptores de células que no reconocerían al mismo tipo de virus.