Introducción
La enfermedad renal aguda es progresiva y reversible a diferencia de la crónica que es progresiva e irreversible. La detección y el tratamiento temprano son de gran importancia y pueden aumentar la mediana del tiempo de supervivencia al prevenir o retrasar el daño renal adicional. La enfermedad renal crónica (ERC) en caninos oscila entre el 0,5 y 7 % y tiene una tendencia a incrementar a 15% en caninos mayores de 10 años 1.
La medición directa de la tasa de filtración glomerular (TFG) se considera el mejor índice general para evaluar la función renal. Sin embargo, este procedimiento requiere mucho trabajo y mucho tiempo, por lo que es un método de uso rutinario en la práctica diaria. La medición de biomarcadores alternativos en el diagnóstico y pronóstico de la enfermedad renal resulta eficiente para el médico veterinario, no solo por la oportunidad en el diagnóstico temprano sino por ejercicio preventivo. En la enfermedad renal aguda (ERA) la implementación de biomarcadores urinarios puede generar importantes aportes para el diagnóstico porque pueden determinar el deterioro más temprano que cuando solo se usa la creatinina sérica y, además, permitirían diferenciar entre el daño glomerular o tubular 2. No obstante, el uso de biomarcadores renales está en aumento en medicina humana y veterinaria enfocada en el diagnóstico y monitoreo de la ERC y ERA, y hace énfasis en las características del biomarcador ideal asociadas a que estén presentes en el sitio de daño, la correlación con la expresión del marcador, la función renal, la sensibilidad y la especificidad, entre otras cualidades. Los parámetros conservadores de falla renal identificados en el nitrógeno ureico en sangre (BUN) y la creatinina pueden no resultar tan sensibles y específicos afectando así la oportuna intervención para un mejor resultado en el tratamiento 3.
De los nuevos marcadores evaluados, la Cistatina C sérica y la excreción fraccional de electrolitos en orina, han demostrado ser marcadores más precoces y específicos de la función renal que otros marcadores tradicionales, podrían ser propuestos para su inclusión dentro de la evaluación diagnóstica de un paciente con ERC y en las poblaciones de riesgo, donde la detección precoz de la alteración renal, permitiría instaurar un tratamiento adecuado, que lograría mejorar el manejo de la enfermedad, aumentando la tasa de supervivencia y mejorando la calidad de vida de los pacientes 4.
El objetivo de esta revisión es identificar la importancia a futuro de la cistatina C como biomarcador gold estándar para la determinación de problemas renales agudos en caninos debido a su alta especificidad y evaluación a tiempo de poblaciones en riesgo y disminuyendo la mortalidad, todo ello con respecto a los anteriores biomarcadores mencionados que se encuentran en estudio. Se propone investigar estos biomarcadores debido a su alta posibilidad en cuanto a la sensibilidad y especificidad para un mejor diagnóstico de problemas renales en caninos, ya que actualmente los que se utilizan requieren mucho tiempo y mano de obra, por ende, no se usa de forma rutinaria en la práctica, como lo es la TFG (tasa de filtración glomerular), prueba de oro en función renal. Por otra parte, la creatinina sérica y la urea no son lo suficientemente específicas y sensibles para una detección temprana. Por ello se apunta a la cistatina C como una prueba Gold standard, en beneficio de la ciencia y tecnología.
Esta revisión, contribuye académicamente en cuanto a nuevos conocimientos acerca de este biomarcador y su importancia, puesto que no existen mayores estudios de esta temática en Colombia y de esta forma se contribuye a mejorar el manejo de los problemas renales por parte de los médicos veterinarios, lo cual permite realizar un diagnóstico en una etapa temprana y de esta manera se evitan complicaciones de estas patologías que puedan llevar a la muerte a los caninos.
Biomarcadores apropiados en la enfermedad renal aguda
Existen algunos criterios que los biomarcadores deberían cumplir para que sean elementos de confianza y precocidad diagnóstica. Dentro de las características que éstos deben tener, es que provea información adicional a la que existe en la actualidad, que no sea invasivo, que obtenga resultados rápidos de sensibilidad y especificidad alta, que tenga valores específicos de función normal o anormal del riñón, que pueda distinguir entre lesión intrínsecamente renal y azotemia prerrenal, que genere una idea de la etiología de la lesión, que logre diferenciar entre ERA y ERC, que sea específica para la lesión renal que se encuentre concomitante con alteraciones en otros órganos, que indique severidad de la ERA, que dé una idea del tiempo de exposición al factor etiológico y que sirva como monitoreo durante las terapias de recuperación 5.
Sin embargo, en diversos estudios se considera la tasa de filtración glomerular como el mejor índice para evaluar la función renal, aunque, posee cierta complejidad, no se generan resultados de manera ágil 6,7,8,9, por lo cual no se recomienda utilizar. Se sugiere emplear aquellos marcadores renales séricos y urinarios que permiten detección específica del sitio de disfunción renal 10. Por otra parte, la cistatina C es producida por todas las células nucleadas y se libera a la sangre para ser filtrada en los glomérulos, considerándose por ello un buen detector de fallas renales 11.
Realizar un diagnóstico temprano es un gran desafío, dado que los métodos utilizados actualmente no son totalmente específicos ni sensibles lo cual complica dicho diagnóstico y perjudica la salud del animal. Por lo tanto, en una investigación realizada en la Universidad Sueca de Ciencias Agrónomas, en donde se tomaron 97 caninos a los cuales se les administró la misma dieta y se realizó la respectiva medición de marcadores (Creatinina, dimetilarginina simétrica(SDMA) y Cistatina C) allí se pudo evidenciar que el rendimiento diagnóstico general de creatinina y SDMA como marcadores de disminución de tasa de filtración glomerular eran similares. El rendimiento de la cistatina C fue inferior al de la creatinina y la SDMA. Sin embargo, el uso de SDMA o cistatina C o ambos como complementos de la creatinina puede proporcionar un valor adicional para el diagnóstico de disminución de la TFG 12,13.
Nuevos biomarcadores para la función renal
En la última década se han definido nuevos biomarcadores para la función renal, dentro de los que se encuentran la Cystatina C, (Cys C), Lipocalina asociada a la gelatinasa de los neutrófilos (N-Gal), y molécula de daño renal 1 (KIM-1) entre otros 11. En cuanto a la progresión de la enfermedad, tanto los nuevos marcadores, Cistatina C sérica, excreción fraccional de electrolitos y proteína fijadora del retinol en orina, como el cociente proteína/creatininas urinarias, han resultado ser buenos marcadores de la evolución de esta enfermedad en el perro, detectando un aumento de su concentración conforme se agravaba la lesión renal 4.
Lipocalina asociada a la gelatinasa de los neutrófilos NGAL
Las lipocalinas son proteínas pequeñas que se caracterizan por una amplia gama de propiedades de reconocimiento molecular. Dentro de sus funciones se destaca el transporte de retinol, el olfato, el transporte de feromonas y la síntesis enzimática de prostaglandinas 11. La NGAL es una proteína de 25 kDa unida covalentemente a la gelatinasa de los neutrófilos. Se expresa en bajas concentraciones, pero en caso de daño en el epitelio tubular renal, aumenta su expresión. Originalmente se aisló de los gránulos de los neutrófilos polimorfonucleares. Cabe destacar que, en presencia de daño renal, la proteína NGAL se acumula en abundancia en la sangre, la orina y los túbulos proximales distales. Lo cual indica su utilidad en el diagnóstico de enfermedad renal aguda 11. El N-GAL como proteína presente en los neutrófilos, es utilizada principalmente para demostrar que existe un daño renal, consolidándose como un marcador de daño renal agudo ya que sus concentraciones aumentan en orina cuando las células del epitelio tubular sufren alguna lesión. Las concentraciones de esta proteína en orina son elevadas tanto en pacientes con ERC o en pacientes con daño renal agudo pero las de estos últimos son significativamente más altas pudiendo servir su determinación para diferenciar ambos procesos 14.
Molécula de daño renal (KIM-1)
La KIM es una glicoproteína transmembrana de tipo 1 que no se expresa en el tejido normal del riñón, ni en los fluidos como la orina, pero que tiene expresión significativa en el túbulo proximal posterior a una lesión isquémica o toxicidad 11. Su primer hallazgo se detectó después de 24-48h en el túbulo proximal del riñón en el estado de post isquemia en ratas, mientras que los niveles de creatinina sérica no aumentaron hasta pasados 3,68 días. Estos parámetros han facilitado la identificación de la KIM1 como biomarcador apropiado en lesión renal derivada de toxicidad, especialmente de tipo farmacológico 11.
Retinol-Binding-Protein (RBP)
La RBP es filtrada por el glomérulo renal y posteriormente es reabsorbida en el túbulo proximal. Cuando hay algún daño en las células del epitelio tubular proximal aparecen concentraciones anormales de RBP en orina ya que no se pueden reabsorber. Es una molécula pues que indica y puede dar ideas de dónde existe daño en el riñón, pero su especificidad es baja ya que está afectada por numerosos factores extrarrenales principalmente de origen hepático 15.
α1 y β2 microglobulinas
Ambas son proteínas de bajo peso molecular que participan en procesos antiinflamatorios y son expresadas en todas las células nucleadas. Los niveles de α1-MG han sido medidos en caninos a través de la metodología western blot; junto a ello, se ha validado un método ELISA para β2-MG. En caninos se ha evidenciado a través de algunos estudios que la α1-MG urinaria aumenta en algunas glomerulopatías, y fueron niveles significativamente altos en comparación con caninos clínicamente sanos 5. La utilización de la β2M como medidor biológico tanto de función glomerular como tubular proximal, ha sido reportada frecuentemente en la literatura. La concentración sérica de la β2M depende del balance entre su producción y la degradación de la proteína 16.
Biomarcador cistatina C
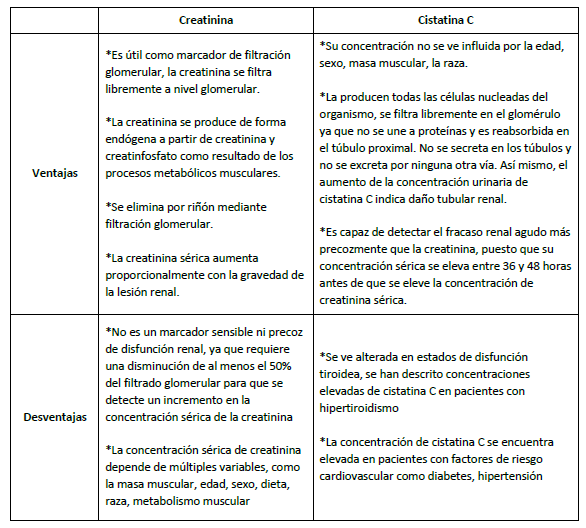
La cistatina C es una proteína que se elimina por filtración glomerular exclusivamente por lo que se convierte en un marcador endógeno de gran valor a la hora de diagnosticar daño renal. Estudios previos han demostrado que tiene una sensibilidad mayor a la creatinina además de ser más precoz 17. La cistatina C es producida por todas las células nucleadas humanas y se ha demostrado que es un gen del tipo de limpieza, con niveles de cistatina C en suero que no han mostrado correlación con ningún estado fisiopatológico que no sea GFR (índice de filtrado glomerular) 18,19.
El nivel plasmático de cistatina C puede expresarse como su nivel de generación a partir de células, dieta y su posterior eliminación a través del intestino, el hígado y los riñones. Esta, es una proteína no glicosilada con un peso molecular de 13,3 kDa, constituida por una sola cadena de 120 aminoácidos con dos puentes disulfuro. Es el producto de un gen de mantenimiento, localizado en el cromosoma 20, lo cual explica su síntesis de forma constante en todas las células nucleadas del organismo y su amplia distribución tisular 20. Es una inhibidora de la cisteína - proteinasa, producida constitutivamente por todas las células nucleadas y se libera a la sangre para ser filtrada en los glomérulos 11. Aproximadamente el 99% de la Cys-C filtrada es reabsorbida por el epitelio tubular 5. Sin embargo, las células epiteliales tubulares catabolizan lo reabsorbido, por lo que la Cys-C, no vuelve a circular 6. Por consiguiente, en ausencia de daño tubular, su concentración en orina es muy baja.
En otros estudios se ha evidenciado que la cistatina C es superior a la creatinina dado que presenta una variación más baja en los resultados expuestos, puesto que es independiente de la edad, el sexo, la masa muscular y la inflamación 13,21,22,23. Lo que sugiere que no es necesario calcular rangos que dependen de estas variables 24. Adicionalmente un gran número de investigaciones favorecen la Cistatina C para la estimación de tasa de filtración glomerular 25,26, principalmente en la fase temprana, lo cual permite implementar un tratamiento y de esta manera retrasar la progresión de la enfermedad renal crónica 27.
Se ha demostrado en diversas investigaciones que la concentración de cistatina C se puede elevar en diferentes tumores como el melanoma metastásico, mieloma múltiple y el cáncer colorrectal. También su papel en pacientes con cirrosis hepática no se ha verificado ampliamente 28. No obstante, es necesario la realización de más estudios en este campo para poder discernir si el aumento de la concentración sérica de cistatina C es debido al proceso tumoral en sí o al deterioro de la función renal 29.
En medicina humana ya se ha establecido que la CisC tiene un mejor valor diagnóstico renal y de determinación de la TFG que la creatinina sérica 21. Las características que llevan a esta proteína a ser un excelente biomarcador renal, son que posee una constante producción y concentración plasmática en situaciones de ausencia de variaciones de la TFG. También, esta proteína presenta una baja variabilidad intraindividuos, no genera uniones proteicas, no tiene secreción tubular, no se genera reabsorción tubular si no existe catabolismo de la proteína 30. En la evaluación de la función glomerular, la Cistatina C sérica ha demostrado ser un marcador de lesión renal tan precoz como la ratio proteína/creatinina en orina. Además, resultó ser más específico que esté y que la urea y la creatinina sanguíneas debido a que no se vio tan influenciado por otros factores extrarrenales que sí influyeron en los marcadores tradicionales 4.
La cistatina C se puede medir en orina o suero canino. Las concentraciones de cistatina C urinaria o sérica se suelen elevar significativamente en perros con enfermedad renal aguda en comparación con aquellos que no la tenían, y se correlacionaron fuertemente con la TFG medida por el aclaramiento de creatinina o iohexol tanto en perros sanos como en aquellos con enfermedad renal 1. Esto generaría una sugerencia de marcador de evaluación que algunos autores lo han postulado como un marcador sensible y con valor predictivo, incluso sobre la creatinina en relación con el índice de la TFG 11.
Fisioanatomía renal en caninos
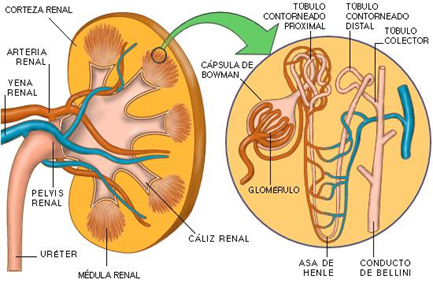
Los riñones son órganos pares, de color marrón-rojizo, forma de alubia y superficie lisa, que se encuentran bajo el techo de la cavidad abdominal, a ambos lados de la columna vertebral. El riñón derecho se encuentra más craneal que el izquierdo, y siempre están rodeados de una cápsula de grasa perirrenal que los protege 31.
El parénquima renal está envuelto de una firme cápsula de fibras colágenas (cápsula fibrosa) y en el borde medial de cada riñón hay una hendidura donde se inserta el hilio renal que conduce a un espacio hueco interno, el seno renal. Este último alberga el dilatado comienzo de la vía excretora, la pelvis renal, el uréter, tejido graso, los vasos y los nervios 31.
El parénquima renal puede subdividirse en:
Corteza del riñón: Es de color marrón-rojizo y finamente granulada. Se encuentra recorrida por líneas radiales, por donde discurren las arterias interlobulillares. Estas arterias, junto al parénquima que las rodea, constituyen los lobulillos corticales 31.
- Parte convoluta (zona externa)
- Parte radiada (zona interna o yuxtaglomerular)
- Zona externa con la base de la pirámide.
- Zona interna con la papila renal
Los vértices de las pirámides medulares se fusionan en la cresta renal. En el perro y en el gato, entre las pseudopapilas ubicadas en posición dorsal y ventral, se introducen dilataciones desde la pelvis renal, que están divididas por los vasos sanguíneos interlobulares 31. Cada pirámide medular junto a la cortical externa forma un lóbulo renal. Los riñones están compuestos por nefronas (unidad funcional del riñón), que se definen como un sistema canalicular de túbulos que incluyen la cápsula de Bowman y el glomérulo (Figura 1). Este último se encuentra formado por asas capilares, que forman una delicada red capilar glomerular, procedente de una pequeña arteriola aferente. El glomérulo se introduce en la parte inicial de la nefrona, formando una cápsula de pared doble: la cápsula glomerular o cápsula de Bowman. El glomérulo, junto con esa cápsula forman lo que denominamos el corpúsculo renal o de Malpighi; estos corpúsculos se encuentran distribuidos uniformemente por la corteza renal 31) (Figura 1). Siguiendo a esta cápsula, se presenta el sistema tubular renal, cuyos túbulos se subdividen en varios segmentos:
Segmento contorneado proximal.
Asa de Henle.
Túbulo contorneado distal.
Túbulo colector.
Conducto papilar.
Área cribosa (que desemboca en la pelvis renal).
Fisiología renal
El riñón, en resumen, se encarga de la eliminación de desechos y el mantenimiento del equilibrio hidroelectrolítico y acido básico, y en esta función intervienen tres mecanismos principales 31:
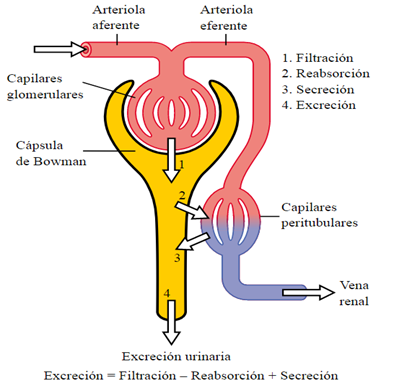
Filtración glomerular
La sangre que sale del corazón por minuto (gasto cardíaco) es recibida por los riñones pasando por entre los glomérulos renales, volumen que se denomina tasa de filtración glomerular. Así mismo, la presión de filtración es uno de los factores determinantes para que el plasma de la sangre pase por entre la membrana glomerular. Por lo tanto, la presión puede ser de dos orígenes: del agua conocida como presión hidrostática o proveniente de las proteínas llamada presión oncótica 33.
La presión resultante o presión eficaz de filtración (PEF) es la suma algebraica de todas estas presiones 33.
El riñón posee un mecanismo de autorregulación de manera que, ante cambios de presión que oscilan entre 80 y 180 mmHg, el flujo sanguíneo y la filtración glomerular se mantengan constantes. Un aumento de la presión en la arteria renal desencadena una vasoconstricción en la arteriola aferente impidiendo de esta manera que la presión en los capilares glomerulares se incremente; por el contrario, si la presión en la arteria renal desciende, la arteriola aferente se vasodilata para mantener la presión y el flujo constante 33.
Reabsorción y secreción tubular
El filtrado glomerular luego de pasar por la cápsula de Bowman pasa por el tubo contorneado proximal, en donde se reabsorbe el 80% de sustancias como sodio, agua, glucosa, aminoácidos, urea, calcio. Posteriormente en el tubo contorneado proximal se reabsorbe desde el 67% hasta el 80% del sodio, cloruro 33.
El Asa de Henle posee una porción descendente y gruesa la cual es muy permeable al agua, más o menos permeable a la urea, el sodio, el cloruro y otros iones y a porción ascendente y delgada no es permeable al agua ni a la urea, pero si posee bombas para la eliminación de cloruro. En esta parte de la nefrona el filtrado se torna muy concentrado y se crea un mecanismo que se ha denominado contracorriente, en el cual la osmolaridad del filtrado cambia desde muy baja en el asa descendente a muy alta en el ascendente de manera que las circunstancias son muy cambiantes en éstas áreas del riñón por lo que los factores que determinan la reabsorción de una sustancia pueden variar. La parte gruesa del asa de Henle forma parte del aparato yuxtaglomerular que está compuesto por la mácula densa, las células yuxtaglomerulares de la arteriola aferente y las células mesangiales 33 (Figura 2).
Las células de la mácula densa se encargan de vigilar el volumen del filtrado glomerular y la concentración de sodio. Si la concentración de este ión es menor, las células de la mácula densa pueden generar una dilatación de las arteriolas glomerulares aferentes para incrementar el flujo al glomérulo, estimular a las células yuxtaglomerulares para que liberen renina a la circulación. Esta hormona convierte el angiotensinógeno que está presente en el torrente sanguíneo en angiotensina I, un agente vasoconstrictor. A su vez en el pulmón, se convierte en angiotensina II mediante la enzima convertidora de angiotensina (ECA) que es una potente vasoconstrictora de las arteriolas eferentes. Así mismo, la angiotensina II estimula las células de la corteza suprarrenal para producir aldosterona que actuara sobre el túbulo contorneado distal. Por lo tanto, los mecanismos anteriormente mencionados incrementan la presión de filtrado glomerular 33.
Es de resaltar que todos los elementos que son reabsorbidos en las diferentes partes de la nefrona pasan al sistema circulatorio y los cambios en la osmolaridad se mantienen tanto para el sistema de tubos del riñón como para el de los capilares sanguíneos 33.
Excreción renal
La función final del sistema renal es excretar la orina. De esta función se encargan los conductos excretores como lo son los cálices renales, los uréteres, la vejiga y la uretra 33.
Daño renal agudo en caninos
Cuando se refiere a una enfermedad renal aguda, es aquella patología la cual se caracteriza por una disminución repentina ya sea en horas o semanas del filtrado glomerular lo cual se origina por la incapacidad del sistema renal para excretar productos de desecho metabólicos como lo son la urea y creatinina 35 lo que se conoce con el nombre de azotemia junto con desbalances hidroelectrolíticos y ácido-base, que se reflejan en la concentración de la orina presentando oliguria en la mayoría de los casos.
Asimismo, la azotemia puede ser producida por varias causas que, dependiendo su origen, generan diferentes afectaciones a nivel renal, por lo cual se clasifican en tres tipos:
Prerrenales
La azotemia prerrenal o hemodinámica se desarrolla en respuesta a una reducción de la perfusión renal, que a su vez genera una disminución de la tasa de filtración glomerular. Cuando ocurre un descenso de la presión o la disminución del volumen sanguíneo que llega al riñón, se activa el sistema nervioso simpático y el sistema renina-angiotensina-aldosterona. Ambos, estimulan al riñón provocando una respuesta fisiológica que consiste en reducir la producción de orina, reteniendo sodio y agua, para mantener la presión y el volumen sanguíneo con la finalidad de permitir que órganos como el corazón y el cerebro no se vean afectados a esto se denomina “oliguria fisiológica”, la cual se presenta junto con una densidad urinaria aumentada y azotemia. En un principio, las nefronas se mantienen intactas, lo que permite la recuperación rápida de la función renal una vez restaurada la perfusión. Las causas más comunes de disminución de la perfusión renal son la deshidratación, hipotensión, shock, y la reducción del gasto cardíaco 36.
Renales - intrínseca
Cuando ocurre una hipoperfusión severa y prolongada sumada a la causa prerrenal, genera lesiones del parénquima, particularmente en los túbulos, donde se producirán lesiones primarias dando como resultado una enfermedad renal aguda intrínseca 36.
Posrenales
La azotemia posrenal es consecuencia de la obstrucción del flujo de orina desde las vías urinarias al organismo, generando una reducción de la TFG y el aumento de la presión en el riñón, a su vez, esta elevación en la presión rompe el equilibrio de las presiones hidrostáticas y oncóticas que determinan la filtración glomerular, lo que lleva a la disminución de la TFG. El deterioro renal es directamente proporcional al tiempo transcurrido, al grado y la localización de la obstrucción. Cuanto más tiempo transcurre y cuanto más alta sea la obstrucción, mayor será el daño renal. Las causas que generan una azotemia posrenal son obstrucción uretral producida por urolitiasis, tapones mucosos, coágulos sanguíneos, neoplasias, detritos por pielonefritis y ruptura de las vías del tracto urinario 36) (Figura 3).
Fases de la Enfermedad Renal aguda en perros
Fase de iniciación
Ocurre cuando existe la presencia de una lesión renal continua y se observa una disminución de la producción de orina o azotemia.
Esta fase puede durar de horas a días, es así como se observa un daño en los túbulos individuales, pero la función renal sigue siendo la adecuada, por esta razón suele ser clínicamente silenciosa, por lo cual no hay signos clínicos evidentes y además los biomarcadores convencionales son demasiado insensibles como para revelar la lesión o para que se piense en la necesidad de intervenir 36.
Fase de extensión
En este momento, la isquemia, la hipoxia, la inflamación y la lesión celular continúan hasta causar apoptosis y/o necrosis celular. De esta forma, la TFG disminuye, se pierde la capacidad de concentración de la orina y aparece oliguria culminando esta etapa. Del mismo modo, las células epiteliales menos afectadas pierden el borde en cepillo de la superficie apical junto con la capacidad de polarización y se desprenden de la membrana basal. Estas lesiones subletales pueden disparar vías intrínsecas que inicien la muerte celular por necrosis o apoptosis 36.
A continuación, se enumeran los eventos que ocurren en el endotelio para una mejor comprensión:
Las células endoteliales normales liberan sustancias vasodilatadoras como óxido nítrico, prostaglandina E2 y prostaciclina y vasoconstrictoras como endotelina, prostanoides y componentes del sistema renina-angiotensina que permanecen en equilibrio para mantener el tono vascular 36.
La vasoconstricción intrarrenal es consecuencia del daño isquémico y/o tóxico que causa un desequilibrio entre tales sustancias que favorece la vasoconstricción 36.
Los tóxicos interfieren con las funciones esenciales de las células alterando las vías metabólicas de producción de adenosin trifosfato (ATP). De la misma forma la isquemia renal produce hipoxia celular y deficiencia de sustratos, lo que conduce a la depleción de ATP, con la pérdida de energía resultante, disminuye la actividad de bombas de transporte dependientes de ATP (bomba Na/K), generando una disminución del transporte celular transmembrana con pérdida de gradiente iónico, que conduce al aumento de la concentración de solutos intracelulares, produciendo balonización celular con daño del citoesqueleto. Este daño endotelial junto con la vasoconstricción, genera interacción entre el endotelio y los eritrocitos provocando el estancamiento de estos últimos y limitando la llegada de oxígeno al epitelio tubular, exacerbando la alteración 36.
El daño de las células endoteliales genera una respuesta inflamatoria con producción de citocinas inflamatorias y especies reactivas de oxígeno que aumentan su permeabilidad 36.
Estas citocinas a su vez inducen quimiocinas que atraen macrófagos, leucocitos polimorfonucleares y linfocitos T a la zona. En un círculo de retroalimentación positiva, las células inflamatorias reclutadas generan más citosinas y especies reactivas de oxígeno, exacerbando la respuesta inflamatoria y causando mayor daño tisular en el endotelio vascular y epitelio tubular. La tumefacción del epitelio tubular y el endotelio vascular producen obstrucción tubular y congestión, respectivamente. Estos sucesos comprometen el flujo tubular y la reperfusión del parénquima sensible al oxígeno 36.
Fase de mantenimiento
Representa el periodo de lesión del parénquima renal. Usualmente, la lesión intrínseca es una Necrosis tubular Aguda (NTA), cuya consecuencia directa es la reducción persistente de la TFG y de todas las funciones de las células tubulares con aparición de azotemia, falta de concentración urinaria y producción variable de orina. Así mismo es importante destacar que a la histopatología la necrosis no es el rasgo más prominente, en cambio, se observan por todo el riñón focos tubulares con lesiones degenerativas, apoptóticas. Esta fase comienza con la aparición de los signos polisistémicos de uremia, la producción de orina suele ser variable, puede producirse oliguria, anuria, poliuria o cursar con producción normal de orina 36 y acompañado de una disminución de la filtración glomerular. Adicionalmente el animal desarrolla uremia y como consecuencia puede presentar debilidad muscular 35.
Fase de recuperación
En esta fase se empiezan a reparar las lesiones renales, se restablece la función y comienzan a mejorar las consecuencias polisistémicas de la disfunción renal. Esta fase puede durar de días a meses. Así mismo, la recuperación renal depende de la normalización de las células con lesiones subletales, de modo que recuperen su polaridad y de la migración de aquellas viables hacia la membrana basal. También deben eliminarse células necróticas y generar más células para repoblar el epitelio tubular 36.
Posteriormente el paciente empieza a presentar poliuria la cual se produce por eliminación de solutos acumulados, aumento de la filtración glomerular y la expulsión y/o disolución de los cilindros de la luz tubular, dando lugar a una lenta recuperación de las células tubulares. Aunque no pueden producirse nuevas nefronas y las dañadas de forma irreversible no se pueden reparar, la hipertrofia funcional de las nefronas supervivientes puede compensar adecuadamente la pérdida y restablecerse la función. Es importante destacar que la poliuria no siempre indica una vuelta a la normalidad y que en aquellas enfermedades normo o poliúricas, la recuperación se verifica al disminuir los compuestos nitrogenados en sangre. En algunos casos, el epitelio tubular no se regenera, ni el riñón se recupera del daño sufrido y los eventos patológicos progresan generando fibrosis intersticial, el rasgo predominante de la transición a enfermedad renal crónica 36.
Enfermedad renal crónica
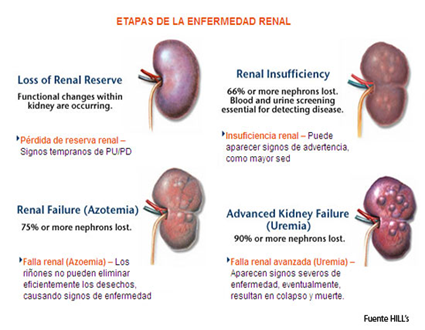
La enfermedad renal crónica (ERC), puede ser definida como la disminución de la funcionalidad renal, expresada en un descenso de la tasa de filtración glomerular (TFG); esta variación en la funcionalidad puede presentarse en uno o ambos riñones y tener cursos superiores a los tres meses de prevalencia. En clínica de pequeños animales, la casuística ante pacientes renales señala que la ERC es la patología renal más frecuente en estas dos especies, con prevalencias mundiales entre el 0,5% y el 1,5% en caninos y el 1% y el 3% en felinos, y que las edades avanzadas son las más afectadas, con frecuencias en pacientes geriátricos del 10% en caninos y hasta del 35% en felinos; debido a la pérdida funcional de las nefronas lo cual genera anormalidades en procesos como filtración, excreción y secreción de sustancias 30 aun así, se ha reportado que la ERC puede afectar a animales de cualquier edad 38. Así mismo, se ha observado un índice de correlación estadística entre el aumento de edad y el riesgo de morir por ERC 11, lo cual demuestra que la edad es un factor de riesgo para padecer una enfermedad renal.
Dada la gran capacidad de reserva del riñón, debe perderse al menos entre el 60 y el 70% de la función renal normal antes de que aumente la azotemia (aumento de las concentraciones de urea o de creatinina y de otros subproductos nitrogenados en la sangre), aunque puede haber cierta hipertrofia de las nefronas 30) durante la primera fase de disminución de la reserva renal. En este estadio, el paciente no presenta ningún síntoma clínico, aunque puede observarse una disminución de la capacidad de concentración de la orina. Existen varios factores que pueden contribuir al desarrollo de la ERC; se ha reportado que enfermedades renales (glomerulonefritis y nefropatías), infecciones, toxinas, medicamentos, hipertensión y aterosclerosis, entre otros, aumentan el riesgo de que un paciente en algún momento de su vida pueda desarrollar ERC; sin embargo, en muchos de los casos no se puede identificar a ciencia cierta el causante de la ERC; aun así, se ha reportado que en animales jóvenes estaría relacionado con problemas congénitos 38,39.
Cistatina C y enfermedad renal en caninos
En los últimos años, la cistatina C en suero (SCysC) ha sido ampliamente investigada como un biomarcador potencial de la tasa de filtración glomerular (TFG). Un estudio en medicina veterinaria sugirió que este analito tenía una mejor sensibilidad y un valor predictivo negativo más alto en comparación con la creatinina para documentar la disminución de la TFG 40. Este interés se basa en su utilización como un marcador endógeno para reemplazar o suplementar a la creatinina sérica en la medición del filtrado glomerular estimado (FGe), y como un marcador pronóstico para la predicción de eventos clínicos. Actualmente existen suficientes evidencias que demuestran una mayor sensibilidad de la cistatina C para la predicción de acontecimientos clínicos en comparación con la creatinina sérica o con el FGe mediante creatinina. Hay sin embargo menos certezas en sus ventajas sobre la creatinina sérica para la medición del FGe 20.
La detección precoz de la enfermedad renal en sus grados más leves sería muy útil para comenzar con un tratamiento de preservación de la función renal y la rápida referencia al nefrólogo, lo que permitirá retardar de esta forma la aparición de la enfermedad renal terminal y la utilización de tratamiento sustitutivo. Una de las principales preocupaciones es que la enfermedad renal progresiva cursa en la mayoría de los casos de manera asintomática 41.
La cistatina C es capaz de detectar el fracaso renal agudo, más precozmente que la creatinina. Debido a que su concentración sérica se eleva entre las 36 y las 48 horas antes de la concentración de creatinina sérica. Esto sucede porque la cistatina C tiene una vida media más corta y una menor distribución corporal, de ahí que constituya un marcador ideal para medir el funcionamiento renal 42.
Cistatina C en el diagnóstico de la enfermedad renal aguda en caninos
La evaluación diagnóstica del paciente con sospecha de ERC debe incluir diversas etapas, que busquen encontrar cualquier variación en la funcionalidad renal, con el fin de determinar si se ha iniciado un proceso de deterioro de las nefronas en el riñón. Es de destacar que la creatinina y la urea sérica, por lo general, se encontrarán aumentadas en los pacientes que han llegado con alguna clase de sintomatología, pero en el caso del paciente asintomático pueden presentarse valores normales o, incluso, por factores extrarrenales, como en el caso de pacientes que han perdido masa muscular o alteraciones de fluidos corporales; en este caso se determina que el paciente se encuentra en un Estadio 1 43.
Estudios recientes sugieren el uso de otras técnicas de diagnóstico que contribuyan a aclarar la funcionalidad renal en pacientes cuyos análisis de creatinina revelan el aumento de esta hasta los límites máximos; para ello se sugiere el análisis de la Cistatina C sérica, como marcador con mayor sensibilidad ante las variaciones en la funcionalidad renal, la cual no sufre influencias de otros factores externos (a diferencia de la creatinina) y es constantemente producida por todas las células nucleadas del organismo y filtradas por el glomérulo 44. Aun así, se ha reportado que neoplasias, como los melanomas, pueden aumentar las concentraciones séricas de cistatina C 45.
En medicina veterinaria se ha incorporado su uso como validador de la alteración de la TFG a través de inmunoensayos que se encuentran disponibles para medicina humana. Estos inmunoensayos fueron validados para su uso en estudios con caninos debido a un análisis western blot que demostró una reactividad cruzada entre los anticuerpos CisC antihumanos y la CisC canina 21.
La CisC puede ser determinada en el suero u orina de los caninos, la concentración urinaria o sérica es considerablemente más alta en animales que presentan una enfermedad renal multietiológica en comparación a los que no presentan una enfermedad renal, y tiene una fuerte correlación con la TFG medible a través de la creatinina en caninos sanos y enfermos 24,46. En comparación a la creatinina, se ha determinado que la concentración de CisC es un mejor indicador de lesión renal temprana 1, a pesar de que se ha demostrado que sí puede presentar variaciones por factores extrarrenales 47.
Se ha podido determinar que la cistatina C no tiene la característica de generar adhesión a otros elementos en el plasma, lo que genera un filtrado glomerular sin restricciones 30. Luego del filtrado glomerular, esta proteína es reabsorbida a nivel tubular por endocitosis y luego es catabolizada, sin liberación posterior al flujo urinario en el lumen tubular por secreción. Al momento de producirse un daño tubular, la reabsorción de esta proteína disminuye y se genera mayor presencia a nivel urinario 48.
Así como se evidencia en la Tabla 1, la cistatina C demuestra mayores ventajas que la creatinina, la mejor evidencia se da en los niveles de reducción en la TFG estimada (TFGe) que se han asociado con reducciones en la concentración de cistatina C en suero 49. También se ha demostrado que la concentración de cistatina C en suero no se altera en ciertas afecciones inflamatorias u otros trastornos del metabolismo 50. Además, se ha sugerido que debido a la independencia de la cistatina C de muchos factores que afectan la creatinina sérica, como la edad, el sexo, la raza y la masa muscular, una ecuación basada en la cistatina C puede ser más útil para detectar la enfermedad renal en los niños, los ancianos y las personas con afecciones que afectan la composición muscular 18. De acuerdo con muchos de estos hallazgos, por lo tanto, se presume que la cistatina C puede usarse como un nuevo biomarcador junto con la creatinina sérica, o como un reemplazo de la creatinina sérica, para identificar mejor la enfermedad renal en la población general 51.
Determinación de Cistatina C por métodos analíticos (Penia)
La cistatina C puede determinarse utilizando ensayos automatizados de turbidimetría de látex mejorada con partículas, o mediante inmunonefelometría mejorada con partículas (PENIA) 53. La investigación de los dos métodos ha demostrado que la cistatina C comprobada con el método PENIA tiene una correlación más fuerte con la TFG 22. Además, se ha informado que el método PENIA es un poco más preciso que el ensayo de turbidimetría mejorada con partículas. También debe considerarse la importancia de asegurar la estandarización del inmunoensayo a medida que avanza la medición de la cistatina C sérica.
Usualmente existen ciertas confusiones a nivel de estos métodos utilizados, sin embargo, cabe destacar que ambas técnicas se basan en la dispersión de la luz, causada por complejos inmunes formados por Cistatina C y partículas de látex recubiertas con anticuerpos policlonales. En el ensayo turbidimétrico, las partículas son partículas de poliestireno y en el ensayo nefelométrico, las partículas son partículas de clorometilstireno. Ambos ensayos usan anticuerpos policlonales de conejo antihumanos Cistatina C 30.
La medición de la concentración de cistatina C circulante se ha evaluado como un marcador de TFG en perros usando inmunoanálisis turbidimétrico mejorado con partículas (PETIA), inmunoensayo nefelométrico mejorado con partículas (PENIA). Ambos fueron validados tanto en suero como en orina 1,54.
Determinación de Cistatina C por métodos analíticos (Petia)
Se ha comprobado que al realizar ensayos turbidimétrico comercial con partículas mejoradas inmunoensayo (PETIA), basado en el uso de anticuerpos antihumanos de cistatina C de conejo para medir la cistatina C en muestras de suero humano, podrían usarse para medir de manera confiable la inmunorreactividad similar a la cistatina C en caninos, en muestras de suero. Además, se evidenció que los niveles de cistatina C entre perros con enfermedad renal clínica fueron superiores a los niveles séricos de Cys-C en perros sanos y perros con enfermedades no renales 55, lo que indica que la cistatina en suero canino podría ser un candidato atractivo para la estimación de la TFG.
La principal diferencia entre estos dos métodos es que Penia solo puede usarse con un inmunonefelómetro especializado, mientras que Petia puede usarse con varios analizadores 30.
También se realiza análisis por el método de Western Blot demostrando la reactividad cruzada del anticuerpo anti-cistatina C humano contra la cistatina C canina, validando su uso en estudios caninos. Mientras que un estudio mostró que la edad, el peso corporal y el sexo no afectaron la cistatina C en perros sanos, otro mostró que la cistatina C fue mayor en perros sanos muy jóvenes o viejos y en aquellos de más de 15 kg 1.
Conclusiones
La Cistatina C cuenta con características que llevan a esta proteína a ser un excelente biomarcador renal ya que posee una constante producción y concentración plasmática en situaciones de ausencia de variaciones de la TFG.
Se puede identificar la importancia a futuro de la cistatina C como Gold estándar para la determinación de problemas renales agudos en caninos debido a su alta especificidad.
Se dice que esta proteína puede usarse como un nuevo biomarcador junto con la creatinina sérica, o como un reemplazo de ella, a fin de que se pueda identificar a tiempo y mejor la enfermedad renal en la población general de caninos en especial aquellos que cuentan con enfermedad glomerular aguda.