Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Producción + Limpia
Print version ISSN 1909-0455
Rev. P+L vol.6 no.1 Caldas Jan./June 2011
1Ingeniera de Alimentos, Especialista en Aseguramiento de la Calidad Microbiológica de los Alimentos, Candidata a Magister en Ciencias Farmaceuticas y Alimentarias, Investigadora grupo GRIAL. Corporación Universitaria Lasallista.
2Químico Farmacéutico. Magister en Ciencias Básicas Biomédicas-Bioquímica. Doctor en Ingeniería - Ambiental. Director grupo GAMA. Corporación Universitaria Lasallista.
3Químico Farmacéutico. Doctor en Ciencias Químicas. Director grupo GRIAL. Corporación Universitaria Lasallista.
Correspondencia: Luz María Alzate Tamayo, e-mail: lualzateo@lasallistadocentes.edu.co
Artículo recibido: 08/04/2011 ; Artículo aprobado: 20/06/2011
Resumen
Nuestras ciudades generan cada vez más cantidad de residuos cuya disposición final se realiza en botaderos a cielo abierto o cuerpos de agua constituyendo un problema para la salud pública, además los elevados volúmenes suponen importantes costos de recolección y disposición final.
Pese a esto, los residuos orgánicos también son una fuente importante de compuestos que pueden ser utilizados debido a sus propiedades favorables tecnológica o nutricionalmente, de hecho recientemente se ha demostrado que los residuos de cítricos contienen antioxidantes que pueden tener un efecto benéfico para la salud humana1.
Estas sustancias pueden ser usadas para producir alimentos funcionales, adicionándolas a alimentos de consumo masivo como el azúcar, la sal, el huevo y la leche para beneficiar una gran cantidad de personas con la ingesta de dichas sustancias. En el caso del huevo, para lograr incorporarle dichas sustancias sería necesaria la intervención desde la nutrición del ave de postura, debido a que la presencia de sustancias bioactivas como los carotenoides en el huevo dependen de la dieta suministrada al animal, por lo cual actualmente se emplean colorantes de origen sintético en su alimentación. Por consiguiente, el uso de los residuos vegetales con alto contenido de carotenoides provenientes de las industrias agroalimentarias y las centrales de abasto son una fuente promisoria para elaborar premezclas para la alimentación de gallinas ponedoras, con el fin de sustituir los pigmentos de origen sintético para obtener huevos de mejor color y de alto contenido de sustancias funcionales, que contribuyan a una alimentación saludable, e incluso a la prevención de enfermedades crónicas. Es posible conferir valor agregado a los residuos vegetales con alto contenido de carotenoides provenientes de la industria agroalimentaria y las centrales de abasto al utilizarlos como materia prima para elaborar premezclas que reemplacen el uso de colorantes artificiales en los concentrados para alimentar gallinas ponedoras.
Palabras clave: alimentos para animales, alimentos funcionales, huevos, pigmentos, antioxidantes, residuos agroindustriales.
Abstract
Our cities generate more and more waste which final disposal is made in open dumps or watercourses, creating a public health problem. The volumes of such waste are so big that collection and disposal costs get higher and higher. Despite this, organic waste is also a source of compounds that can be used, given their technological and nutritional properties. As a matter of fact, it has been recently demonstrated that citric waste has antioxidants that can be beneficial for human health. These substances can be used to produce functional food, adding them to massive use food such as sugar, salt, eggs and milk, positively impacting a great number of people. In the case of eggs, it would be necessary to intervene since the stance bird is being fed in order to add the substances to them. This is so because bioactive substances such as carotenoids in eggs depend on the diet of the animal, hence synthetic dyes are currently being used to feed those birds. The use of vegetable waste with a high carotenoid content taken from agricultural and livestock industries and stores, are a promising source of raw material for pre-mixtures for the feeding of laying hens and substituting synthetic dyes in order to get eggs with a better color and with a high content of functional substances, thus contributing to a healthy feeding and even to prevent chronic diseases. As a conclusion, it is possible to give an added value to vegetable waste with a high carotenoid content from agricultural and livestock industries and stores, using them as raw material for pre-mixtures that can replace the use of artificial dyes in the food for lying hens.
Key words: food for animals, functional foods, eggs, dyes, antioxidants, agricultural and livestock waste.
Resumo
Nossas cidades geram cada vez mais quantidade de resíduos cuja disposição final se realiza em lixões a céu aberto ou a corpos de água, o que constitui um problema para a saúde pública; ademais, os elevados volumes supõem importantes custos de recolha e disposição final. Pese a isto, os resíduos orgânicos também são uma fonte importante de compostos que podem ser utilizados devido a suas propriedades favoráveis tecnológica ou nutricionalmente; de fato recentemente se demonstrou que os resíduos de cítricos contêm antioxidantes que podem ter um efeito benéfico para a saúde humana. Estas substâncias podem ser usadas para produzir alimentos funcionais, adicionando-as a alimentos de consumo em massa como o açúcar, o sal, o ovo e o leite para impactar uma grande quantidade de pessoas com a ingesta de ditas substâncias. No caso do ovo, para conseguir incorporar-lhe ditas substâncias seria necessária a intervenção desde a nutrição do ave de postura, devido a que a presença de substâncias bioativas como os carotenoides no ovo dependem da dieta fornecida ao animal, pelo qual atualmente se empregam corantes de origem sintética em sua alimentação. Portanto, o uso dos resíduos vegetais com alto conteúdo de carotenoides provenientes das indústrias agroalimentares e as centrais de abundância são uma fonte promissória para elaborar pré-misturas para a alimentação de galinhas colocadoras de ovos, com o fm de substituir os pigmentos de origem sintética para obter ovos de melhor cor e de alto conteúdo de substâncias funcionais, que contribuam a uma alimentação saudável, e inclusive à prevenção de doenças crônicas. Em conclusão, é possível conferir valor agregado aos resíduos vegetais com alto conteúdo de carotenoides provenientes da indústria agroalimentar e as centrais de abundância, ao utilizá-los como matéria prima para elaborar pré-misturas que substituam o uso de corantes artificiais nos concentrados para alimentar galinhas.
Palavras importantes: alimentos para animais, alimentos funcionais, ovos, pigmentos, antioxidantes, resíduos agroindustriais.
Introducción
A nivel mundial, la preocupación por el aprovechamiento de residuos ha tomado gran fuerza entre la comunidad científica y sobre todo a nivel industrial, en donde los procesos de transformación generan subproductos que pueden ser útiles en otras actividades. De hecho, estudios recientes han demostrado que las cáscaras de frutas como la naranja contienen antioxidantes que podrían tener un efecto benéfico en la salud humana1. Sin embargo, los residuos generados en las transformaciones agroindustriales y por las pérdidas poscosecha en Colombia aun no han sido aprovechados eficientemente, en parte, porque su valor es aún desconocido y, sobretodo, por la falta de métodos apropiados para la preparación y caracterización de sustancias con la suficiente calidad e inocuidad como para ser usadas en los procesos de mayor valor agregado.
Adicionalmente, los costos de secado, almacenamiento y transporte de los subproductos son factores que limitan económicamente su aplicación industrial y por lo tanto son a menudo utilizados con un escaso tratamiento como alimento para animales, como fertilizantes o simplemente se convierten en focos de contaminación para las fuentes de agua, los mismos cultivos o peor aun son un problema de salud pública en centros de abastecimiento urbanos, en donde su disposición final genera costos cada vez más insostenibles. Por lo tanto, la utilización eficiente, de bajo costo y ecológicamente racional de estos materiales es cada vez más importante, sobre todo por las restricciones legales que ya empiezan a surtir efecto en muchos países.
Aunque los subproductos del procesamiento de alimentos representan un problema de disposición importante para la industria, también son fuentes prometedoras de compuestos que pueden ser utilizados debido a sus propiedades favorables tecnológica o nutricionalmente. De hecho, existe un cuerpo creciente de literatura científica que demuestra la función de los metabolitos secundarios de las plantas en los alimentos y sus efectos potenciales sobre la salud humana. Además, los consumidores son cada vez más conscientes de los problemas de salud relacionados con la dieta, por lo tanto exigen ingredientes naturales que sean seguros y generen beneficios sobre la salud, promoviendo cada vez más la aparición de "alimentos funcionales", o sea un alimento cuyo consumo contribuye a aportar beneficios sobre la salud, por encima del aporte estrictamente nutricional. Es decir que presenta compuestos que han sido identificados como fisiológicamente activos y con demostrados efectos positivos para mantener y potenciar la salud, así como prevenir la aparición de determinadas patologías2,3.
Existen diferentes alternativas para producir alimentos funcionales, entre ellas están: la adición a granel de ingredientes bioactivos durante la etapa de producción del alimento, el aumento de la biodisponibilidad de un ingrediente específico o el aumento y/o aparición natural del ingrediente bioactivo desde la generación del alimento (variedades vegetales mejoradas, influencia en la dieta animal para generar subproductos con características funcionales).
En este sentido, productos alimenticios de consumo masivo como el azúcar, la sal, el huevo y la leche son buenos vehículos para el diseño de alimentos funcionales, puesto que es posible impactar una gran cantidad de personas con la ingesta de componentes bioactivos que pueden, a largo plazo, mejorar el estado de salud y prevenir la aparición de enfermedades crónicas de alto costo.
Sin embargo, a pesar de que el huevo es un alimento de gran valor nutritivo y que a nivel mundial se consumen alrededor de un billón de huevos al año, la funcionalización de este alimento obliga a la intervención desde la nutrición del ave de postura, debido a que la presencia de sustancias bioactivas en el huevo (antioxidantes y carotenoides principalmente), dependen exclusivamente de la dieta suministrada al animal......
De hecho la tendencia actual de los consumidores es preferir huevos con yemas de color amarillo-anaranjado, lo que ha obligado a las explotaciones avícolas dedicadas a producir huevo, adicionar pigmentos sintéticos para reforzar los carotenoides aportados por las materias primas como el maíz, el gluten de maíz y el sorgo a las dietas de gallinas para así satisfacer las exigencias del consumidor a pesar que esto incremente los costos en la producción.
Por lo anterior, se hace necesario buscar fuentes alternativas de origen natural para reemplazar los colorantes sintéticos usados actualmente por la industria avícola. Una alternativa interesante sería el uso de los residuos vegetales provenientes de las industrias agroalimentarias y las centrales de abasto que tengan alto contenido de carotenoides para elaborar premezclas para la alimentación de gallinas ponedoras, de manera que se sustituyan los de origen sintético; de esta manera se estarían beneficiando las centrales de abasto, las empresas agroalimentarias, las empresas productoras de concentrados para gallinas, las productoras de huevos y por último el consumidor.
Las centrales de abasto y las empresas agroindustriales disminuirán los costos asociados a la disposición de residuos sólidos vegetales y por lo tanto el impacto al ambiente sería menor. Para las empresas de concentrados se podrían disminuir los costos de producción, pues disminuirían la utilización de los pigmentos sintéticos usados actualmente para la elaboración de concentrados de gallinas ponedoras. Por su parte, las empresas avícolas podrían producir huevos no solo de mejor color sino con un alto contenido de sustancias funcionales, lo que los hará más atractivos para el consumidor por los consecuentes beneficios que trae la ingesta regular de este tipo de componentes, logrando la prevención en la aparición de determinadas enfermedades como cáncer, enfermedades cardiovasculares, osteoporosis, degeneración macular y formación de cataratas entre otros.
Los colorantes en la industria de alimentos
La adición de colorantes a los alimentos es necesaria para intensificar y estandarizar su apariencia. Los colorantes alimenticios son usados principalmente para contrarrestar pérdidas del color del alimento debido a la exposición a la luz, al aire, a condiciones extremas de temperatura, a la humedad, a variaciones estacionales o simplemente para hacerlo más atractivo a la vista de los consumidores4.
De hecho, la vista permite juzgar el aspecto de un alimento en términos de su forma, textura y color. El aspecto de un alimento es la primera clave de su identificación y con frecuencia predice el grado de satisfacción o placer que se obtendrá al comerlo. El color resulta uno de los factores más importantes responsables de la aceptación o rechazo de los alimentos. Las variaciones en la intensidad de color pueden sugestionar al consumidor, dándole la idea de que el alimento estuvo sujeto a un proceso mal controlado o ha perdido su frescura5.
Las primeras civilizaciones usaban colorantes naturales extraídos de plantas, animales y minerales, como carmina, hena, óxidos de hierro y azafrán para teñir ropa, pintar las pieles y fabricar objetos religiosos y recreativos6. A principios del siglo XX, fueron sintetizados un gran número de colorantes para ser adicionados en alimentos; sin embargo, hasta mediados de este siglo se comienza a regular su uso, debido a que muchos de ellos contenían plomo, cobre y arsénico y representan riesgos muy significativos para la salud7.
Ante los colorantes sintetizados vía química, los naturales tienen algunas desventajas, como: la estabilidad, intensidad de color, entre otros. Sin embargo, a finales del siglo XX, el mercado ha sufrido un cambio que muestra una fuerte tendencia hacia el consumo de productos de origen natural.
Entre las razones que justifican esta preferencia están, principalmente, el cambio en el perfil del consumidor el cual desde finales de la década de los 80 prefiere el uso de productos naturales por considerarlos como símbolo de inocuidad y como productos que aumentan la expectativa de vida o mejoran su calidad, cubriendo de esta manera los sectores salud, alimentación e higiene.
Químicamente, un colorante es una sustancia capaz de absorber determinadas longitudes de onda del espectro visible, por lo que puede impartir color a otro material al cual se adicione. Los colorantes tienen una infinidad de aplicaciones y los productos alimenticios no son la excepción. Normalmente, el consumidor asocia los alimentos con colores específicos8.
Los colorantes y pigmentos se utilizan en una gran variedad de industrias para teñir: pintura, tinta, plásticos, textiles, ceras y parafinas, cosméticos, alimentos, entre otros. Los primeros pigmentos conocidos fueron los minerales naturales, dentro de estos están los óxidos de hierro, los cuales han sido usados desde épocas prehistóricas8.
Además de los minerales, otros de origen animal, como el caso del pigmento rojo de la cochinilla, comenzó a ser producido por los nativos del Perú para ser usado como tinte para textiles desde por lo menos el año 700. La explotación de este pigmento tuvo mucho auge desde la invasión española a tierras americanas. Luego de que en 1856 fuera desarrollado el primer colorante sintético de anilina se sentaron las bases para el desarrollo de cientos de tintes y pigmentos sintéticos. De esta forma se lograron obtener alternativas de coloración de más bajo costo y mejores poderes de tinción, empleando química orgánica, con lo que la extracción de pigmentos a partir de fuentes naturales, se vio un poco rezagada7.
Antioxidantes como ingredientes funcionales
Los antioxidantes fueron comunes en la industria química y de alimentos durante los siglos XIX y XX. En la industria química se habían estudiado los antioxidantes, un grupo de compuestos caracterizados por su capacidad de oxidarse en lugar de otras sustancias presentes en el medio de reacción. Su uso varió, pasando de aditivos en la vulcanización del caucho hasta conservantes de alimentos. Sin embargo, fue solo hasta los años 60 cuando algunos estudios revelaron la importancia de los antioxidantes en la salud, con publicaciones acerca del efecto de los favonoides, el ácido ascórbico y el estrés oxidativo en el cáncer9. La expansión en la investigación de los antioxidantes se vería en las décadas subsiguientes, en donde varios investigadores se dedicaron a estudiar el efecto protector de los antioxidantes en diferentes patologías, intentando entender sus mecanismos y blancos moleculares10.
En cuanto los hallazgos se difundían, el mercado crecía. Para los años 90 el uso de los antioxidantes se había popularizado en los Estados Unidos de America, de tal manera que la mitad de la población consumía suplementos dietarios, un tercio tomaba multivitamínicos y alrededor de una octava parte de la población consumía periódicamente suplementos de vitaminas E y C11.
La suplementación con antioxidantes está fundamentada en estudios epidemiológicos y clínicos que demuestran la estrecha relación entre factores como: dieta, estilo de vida, exposición a radiación, metales, pesticidas, tóxicos, y algunos medicamentos; con la aparición y desarrollo de enfermedades como cáncer, diabetes, aterosclerosis, desordenes neurodegenerativos y envejecimiento. Todas estas condiciones patológicas están asociadas a un estado conocido como "estrés oxidativo", es decir, un aumento en las especies oxidantes (principalmente Especies Reactivas del Oxigeno-EROs) y/o una disminución en los mecanismos de detoxificación de ellas. Las EROs, según su propio nombre, presentan una reactividad más alta que el oxígeno molecular, algunas de ellas pueden ser radicales libres, es decir moléculas o fragmentos moleculares que contienen uno o más electrones desapareados en orbitales atómicos o moleculares. Este electrón desapareado confiere un grado considerable de reactividad al radical libre logrando además que pueda existir de forma independiente por cortos periodos de tiempo12.
De estas especies reactivas, las más frecuentes y entre ellas las más relevantes en los sistemas biológicos son: el anión superóxido (O2-), el radical hidroxilo (HO) y los radicales formados en la oxidación de ácidos grasos poliinsaturados (alcoxilo (alKO) y alquilperoxilo (alKOO). Entre las EROs no radicales se encuentran el peróxido de hidrógeno (H2O2) y el ácido hipocloroso (HOCl). Por otra parte, además de las EROs, existen también especies reactivas del nitrógeno (ERNs) como el óxido nítrico (NO) radical del dióxido de nitrógeno (NO2), y formas no radicales, como el anión del peroxinitrito (ONOO), el ácido peroxinitroso (ONOOH), el anión del nitrosoperoxicarbonato (ONOOCO2-), el catión nitronium (NO2+), y el trióxido del dinitrogeno (N2O3); los cuales, junto con las EROs se generan continuamente en cantidades pequeñas en procesos celulares normales como la señalización celular, la neurotransmisión, la relajación del músculo, el peristaltismo, la agregación de las plaquetas, la modulación de la presión arterial, el control del sistema inmune, la fagocitosis, la producción de la energía celular, la regulación del crecimiento celular, la síntesis de componentes biológicos importantes y el metabolismo de xenobióticos12, 13.
La exposición a radicales libres de una variedad de fuentes ha hecho que los organismos desarrollen una serie de mecanismos de defensa que incluyen: 1) remoción catalítica de radicales libres por enzimas como catalasa (CAT), superóxido dismutasa (SOD), glutatión peroxidasa (GPx). 2) unión de proteínas a metales prooxidantes como hierro y cobre (transferrina, ceruloplasmina). 3) protección contra daño, como las proteínas de choque térmico y 4) estabilización de radicales libres con donadores de protones o electrones como glutatión (GSH), vitamina E (tocoferol), vitamina C (ácido ascórbico), bilirrubina y ácido úrico12.
Vitamina e: este es el nombre genérico de una familia homogénea de compuestos que tienen en su estructura una porción hidroquinona metilada en mayor o menor grado y una cadena isoprenoide. El a-tocoferol, el componente más abundante de la vitamina E, es bien conocido y representa la mayor posibilidad de prevención de la peroxidación de membrana por estabilización de radicales peroxilo. La vitamina E tiene un grupo hidroxilo fenólico responsable de su actividad estabilizadora de radicales libres y una cadena (C16H33) que favorece su inserción en la región lipídica de la bicapa. En sistemas biológicos, una molécula de vitamina E permite proteger 10.000 moléculas de ácidos grasos insaturados14.
La vitamina E puede reaccionar con radicales lipídicos peroxilo, para formar vitamina E radical que es poco reactiva como para reaccionar con ácidos grasos poliinsaturados, actuando en la reacción de peroxidación lipídica como terminador de cadena. La vitamina E radical producida es estable porque el electrón desapareado del átomo de oxígeno puede ser deslocalizado dentro de la estructura del anillo aromático15
Vitamina C (Ácido ascórbico): es un antioxidante que actúa en medios acuosos, como el líquido pleural, el fluido ocular y el espacio intersticial. Actúa en combinación con otros antioxidantes primarios como la vitamina E y los carotenoides, así como en conjunto con las enzimas antioxidantes. La vitamina C coopera con la Vitamina E regenerando el α-tocoferol desde el radical α-tocoferilo en membranas y lipoproteínas. La mayoría de plantas y animales sintetizan ácido ascórbico a partir de la glucosa; sin embargo, los humanos son incapaces de sintetizarlo y requieren obtenerlo de la dieta. El ácido ascórbico es requerido como un cofactor para la actividad enzimática, y su deficiencia dietética causa una enfermedad conocida como escorbuto....
Compuestos fenólicos y favonoides: los compuestos fenólicos son un grupo de metabolitos ampliamente distribuidos que abarcan aproximadamente 8.000 sustancias, divididas en 22 grupos con una estructura común, determinada por un anillo aromático unido al menos a un sustituyente hidroxilo (grupo fenol) y frecuentemente se encuentran como derivados de ésteres, éteres y glicósidos. Los compuestos fenólicos han mostrado una amplia variedad de actividades biológicas: antioxidante, antimicrobiana, antiinflamatoria, inmunomoduladora, antiviral, antiproliferativa, antimutagénica, anticarcinogénica, acciones vasodilatadoras, y prevención de enfermedades coronarias y desordenes neurodegenerativos16, 17.
Por su parte, los favonoides son compuestos fenólicos con amplia distribución en plantas. Estructuralmente consisten de dos anillos bencénicos (anillos A y B) unidos por un heterociclo piránico (anillo C). Biosintéticamente son de origen mixto, pues el anillo A proviene de la ruta de la malonilcoenzima A, mientras que los anillos B y C provienen de la ruta del ácido shikímico. Para su estudio sistemático, los más de 4000 favonoides descritos hasta ahora se han clasificado en varios grupos de acuerdo con las variantes estructurales que presenta el anillo C. Según esto, los favonoides se clasifican en favonas, favonoles, favanonas, favanoles, antocianidinas, catequinas, epicatequinas, auronas e isofavonoides 18. Las cantidades de favonoides y polifenoles en alimentos y plantas incluidas en la dieta humana (frutas, vegetales, té, vino, café, cacao) son mucho más altas que las cantidades de otros antioxidantes como las vitaminas C y E, lo cual hace de estos compuestos los principales antioxidantes adquiridos en la dieta19.
Los flavonoides han mostrado una fuerte actividad antioxidante en sistemas in vitro, principalmente gracias a su bajo potencial de oxidación lo que les confiere capacidad de estabilizar radicales libres donando electrones o átomos de hidrógeno20. Sin embargo, a pesar de su fuerte actividad in vitro, se ha visto que su efecto in vivo es limitado por varios factores, entre ellos la baja absorción, la baja biodisponibilidad y la alta tasa de depuración21.
En general, la controversia es grande, pero se acepta que una dieta rica en frutas y vegetales con alto contenido de polifenoles está asociada con una menor incidencia de enfermedades cardiovasculares, infarto, cáncer y otras enfermedades crónicas. De hecho, 7 de 12 estudios epidemiológicos que evaluaron el riesgo de enfermedades cardiovasculares reportan un efecto protector de los favonoides22, 23, atribuido principalmente a su actividad antioxidante, puesto que el hecho común de estas patologías es un desbalance oxidativo24, 25.
Carotenoides: son pigmentos liposolubles responsables del color rojo, amarillo, naranjado y purpura de frutas y vegetales26, También pigmentan la yema de los huevos, la piel de animales como el salmón, pollo y camarón27. Químicamente se dividen en carotenos (ej. Licopeno y, β caroteno), las cuales contienen grupos de carbono y de hidrogeno y xantofilas (ej. luteína, zeaxantina, and β-criptoxantina) considerados derivados oxigenados. El β-caroteno, el α-caroteno, y la β criptoxantina, son considerados precursores de la vitamina A26.
El β-caroteno se divide para formar dos moléculas de retinaldehído, una fracción de menor importancia se oxida irreversiblemente a ácido retinoico; la cantidad restante es reducida a retinol. El papel biológico de los carotenoides no está limitado solamente a la producción de retinoides o a la protección del aparato fotosintético de plantas contra el daño de la luz; también se ha demostrado que: previene el daño por fotosensibilidad en bacterias, animales y humanos; disminuye el daño genético y las transformaciones malignas; inhibe la inducción tumoral provocada por los rayos UV y agentes químicos y disminuye las lesiones premalignas en humanos. Su principal mecanismo de estabilización de radicales libres está determinado por su capacidad para estabilizar el oxígeno singlete y convertirlo nuevamente a su forma menos reactiva (triplete) a expensas de una activación intramolecular28.
Nutrición animal como una estrategia para producir alimentos funcionales:
La Acción Concertada en la Ciencia de Alimentos Funcionales (FuFoSe, por su siglas en inglés), derivada de la Comisión Europea y coordinada por el Instituto Internacional de Ciencias de la Vida (ILSI, por sus siglas en inglés) define como alimento funcional, aquel cuyo consumo contribuye a aportar beneficios sobre la salud, por encima del aporte estrictamente nutricional. Es decir que presenta compuestos que han sido identificados como fisiológicamente activos y con demostrados efectos positivos para mantener y potenciar la salud, así como prevenir la aparición de determinadas patologías2.
Otra definición bastante aceptada dice que los alimentos funcionales son alimentos a los que se ha añadido (o de los que se han eliminado) uno o varios ingredientes; o alimentos cuya composición química o biodisponibilidad de nutrientes se ha modificado; o de una combinación de estos dos factores.
Es decir, son alimentos modificados, con la particularidad de que alguno de sus componentes (sea o no nutriente) afecte las funciones vitales del organismo de manera específica y positiva.
En el huevo existen componentes de tipo carotenoide como la luteina y zeaxantina, que se encuentran en la yema del huevo y representan una gran importancia comercial ya que, junto con las xantofilas rojas, son responsables del color de la yema del huevo. Adicionalmente, se ha demostrado que estos carotenoides tienen un importante efecto antioxidante, antimutagénico y anticarcinogénico29 30....
En concreto, se ha demostrado que la ingesta de luteína y zeaxantina reduce el riesgo de cataratas y previene la degeneración macular. Ya que estos compuestos están presentes en el cristalino y la región macular de la retina donde ejercen una acción antioxidante31.
También se ha demostrado que la luteína ejerce una acción antiinflamatoria con un importante papel en la prevención de enfermedades coronarias y desarrollo de algunos tipos de cáncer. El huevo es el único alimento de origen animal que aporta luteína y zeaxantina, y aunque su contenido es inferior al de algunas fuentes de origen vegetal, la biodisponibilidad es superior31. De hecho, se ha descrito que 100g de yema contiene 1723 µg de luteína y 1257 µg de zeaxantina, sin embargo su concentración depende de la cantidad presente en la dieta de las gallinas32.
Adicionalmente, se ha mostrado que la incorporación de antioxidantes en la dieta de animales, no solo aumenta el contenido de estas sustancias en los productos derivados, sino que también mejoran considerablemente la salud animal. De hecho, la patente americana 5744502 muestra que en pruebas de alimentación con astaxantina mezclada en el alimento para gallinas con el fin de mejorar el color amarillo de las yemas, se encontró también que este compuesto mejoró la producción de huevos, el porcentaje de fecundación y el estado de salud de la gallinas. Por otra parte, el consumo de alimentos se redujo. La razón para el aumento en el rendimiento de la producción cuando se alimentaron las gallinas con dietas enriquecidas con astaxantina no se conoce, pero se puede suponer que es debido a sus propiedades antioxidantes y por lo tanto la capacidad para estabilizar los radicales libres. De hecho, en ensayos biológicos se verificó que la astaxantina posee claramente las mejores propiedades antioxidantes en comparación con otros carotenoides33.
Es por esta razón que los productos avícolas representan una ventaja adicional para la salud humana debido a la capacidad que tienen las aves de almacenar compuestos bioactivos en formas altamente disponibles. Por ejemplo, se ha demostrado que la suplementación con selenio en dietas para gallinas reproductoras y pollo de engorde se traduce en mayor cantidad de este nutriente en los productos derivados34.
Colorantes para pigmentación de huevos
El huevo es un ingrediente habitual en la alimentación del hombre desde su origen. Se caracteriza por su alta calidad nutritiva, una excelente relación calidad-precio y ser ingrediente básico y versátil a nivel culinario.
Un huevo está formado, básicamente, por una yema central (30%) rodeada por el albumen o clara (60%) y todo ello envuelto por una cáscara externa (10%). El huevo tiene unos contenidos moderados en calorías, se caracteriza por tener proteínas de alto valor nutricional, lípidos fácilmente digeribles y ricos en ácidos grasos insaturados, así como su riqueza en fosforo, hierro y numerosas vitaminas, excepto la vitamina C35. Estos macro y micronutrientes están conservados y protegidos por la cáscara. La cáscara es una estructura rígida compleja formada por carbonato cálcico que contribuye al sistema de defensa frente a la contaminación microbiana del huevo y es un excelente envoltorio natural que preserva el valor nutricional del huevo entero36.
En la avicultura ha tenido gran importancia económica el color de los productos, principalmente por la presión ejercida desde la etapa final del proceso productivo, la comercialización. Entre los consumidores, tanto a escala industrial como individual, la tendencia es preferir productos de colores vivos; en el caso de los huevos se observa una mayor demanda por aquellos que poseen yemas de color amarillo-anaranjado. Por este motivo, en explotaciones avícolas dedicadas a producir huevo, se ha tornado una práctica normal la adición de pigmentos (carotenoides o xantófilas) en cantidades adecuadas a las dietas de gallinas ponedoras para colorear la yema del huevo, la grasa subcutánea y la piel de las aves37.
Las xantofilas están presentes en algunas materias primas de la dieta de gallinas ponedoras, tales como el maíz, el gluten de maíz y el sorgo que contienen xantofilas rojas; y la alfalfa que aporta principalmente xantofilas amarillas. Sin embargo, cuando el suministro de xantofilas aportadas por las materias primas es insuficiente, se incluyen pigmentos en la formulación de las dietas37:
Las xantofilas: son obtenidas de fores, principalmente del género tagetes, conocido comúnmente con el nombre de clavel chino. De hecho, la patente registrada con el número 7381541 (United States Patent) relata la invención por parte de la empresa BASF en el año 2008 del uso de plantas, partes de ellas o extractos del género tagetes que contienen astaxantina, con el fin de administrarlas por vía oral a animales. Se patentó adicionalmente el método para producir el alimento para animales y la pigmentación de los mismos38.
Por su parte, la patente registrada en el año 2007 con el número 7241463 (United States Patent) muestra un tratamiento realizado sobre residuos de crustáceos con enzimas lipolíticas para la obtención de pigmentos, principalmente astaxantina, el cual puede ser usado posteriormente como pigmento en alimentos39.
Maíz: sus principales pigmentos son xantofilas (54%), zeaxantina (23%) y cryptoxantina (8%). La ventaja que posee la zeaxantina es que es altamente absorbible, es uno de los mejores compuestos pigmentantes y posee un intenso color naranja. En general, se necesitan 14 mg de xantofila por 1 kg de alimento para obtener una pigmentación adecuada cuando se utiliza el maíz como única fuente de pigmentación40
Pimentón: su principal pigmento es la capsantina37. Cuando se proporcionan 0.35 mg de capsantina en 100 g de alimento como única fuente de pigmento se obtiene en los huevos un color similar a los que se comercializan en el mercado40.
Alfalfa: el principal pigmentante carotenoide es la luteína, que no es tan efectiva como la zeaxantina del maíz por su color menos intenso40. Con un 5% de harina de alfalfa en la ración se obtiene un color adecuado de la yema. Sin embargo raciones por encima del 5% tendrán un efecto moderado sobre la pigmentación y por encima del 20% se pueden presentar problemas debido a las saponinas y ácidos fenólicos normalmente presentes en la alfalfa.41.
Carotenoides naturales y sintéticos: en el año 1997, la empresa Roche Vitamins patentó (Patente numero 5670548) un método para pigmentar ciertas partes y productos de aves de corral, peces y crustáceos, incluyendo en la dieta uno o varios carotenoides naturales y sintéticos, entre los que se cuentan 2-dehidroplectaniaxantina, desmetilesferoidenona y esferoidenona. Adicionalmente, la patente 6896895 muestra el uso de ésteres de carotenoides para el mismo propósito39.
En general, los pigmentos sintéticos se utilizan ampliamente para conferir coloración a las yemas de huevos y a la piel en pollos broilers. En la última década se han sintetizado una serie de ellos, donde se destacan: Cantaxantina, α-apo-8'-carotenal (Bac), éster etílico del ácido α-apo-8'-carotenoico, (Bace) y Zeaxantina. El Bac y Bace se transfieren de la dieta al huevo y proporcionan un aumento en el color de la yema en aves que son alimentadas con dietas pobres en pigmentos naturales, siendo el Bac un pigmento que puede ser transformado en vitamina A y en derivados de cadenas más cortas.
Se ha comprobado experimentalmente que en la utilización de fuentes sintéticas, específicamente Bac y Bace, en comparación a fuentes naturales como: maíz, maravilla y alfalfa, no presentan diferencias significativas en la eficiencia de utilización40.
Dos productos comerciales son el Carofil y Lutenal, sus diferencias radican en el contenido de distintos carotenoides con características específicas. El Carofil se puede encontrar en tres colores distintos: amarillo, que corresponde a éster apocarotenoico, rojo, que corresponde a cantaxantina y naranja que es una mezcla de los dos anteriores42.
Por otro lado, el Lutenal es una mezcla de un antioxidante y cinco xantofilas: zeaxantina, capsantina, bixina, capsorubina y astanxantina. La utilización de los distintos colores dependerá del uso que se le dé al huevo. Así, para huevos de consumo (de mesa) se recomiendan pequeñas cantidades de Carofil rojo y para huevos de pastelería, se recomienda Carofil amarillo, el cual también es recomendado para broilers40.
Residuos agroindustriales como fuente de ingredientes bioactivos
Las frutas cultivadas en las zonas templadas se caracterizan por tener una gran porción comestible y cantidades moderadas de material de desecho, tales como cáscaras y semillas. En contraste, el procesamiento de frutas tropicales y subtropicales genera una mayor cantidad de residuos que unido al aumento de la producción, representa un problema cada vez mayor, pues el material vegetal suele ser propenso a la descomposición microbiana, lo que limita su explotación comercial.
Los estudios epidemiológicos han señalado que el consumo de frutas y hortalizas confiere beneficios para la salud, por ejemplo, menor riesgo de enfermedad coronaria y accidentes cerebrovasculares, así como ciertos tipos de cáncer. Estos beneficios para la salud se atribuyen principalmente a micronutrientes orgánicos, tales como los carotenoides, polifenoles, tocoferoles, vitamina C y otros. Aunque los consumidores son cada vez más conscientes de los problemas de salud relacionados con la dieta3, un grupo numeroso de la población carece de una ingesta abundante de frutas y verduras, de tal manera que los suplementos dietarios y la fortificación de alimentos se han convertido en una vía alternativa al consumo de sustancias bioactivas, sin embargo, dado que los aditivos sintéticos son cada vez más rechazados por los consumidores, los ingredientes funcionales de preferencia deben proceder de fuentes naturales. A continuación se detallan algunos residuos agroindustriales de importancia económica debido a la presencia de compuestos bioactivos.
Residuos de cítricos: el aprovechamiento industrial de las especies de cítricos se ha convertido en una actividad intensiva en Colombia donde participan empresas dedicadas a toda la cadena productiva (cultivadores, procesadoras, centros de distribución y exportadores), produciendo jugos, pulpas, concentrados y frutas en fresco; pero a medida que la producción crece, se aumenta también la generación de residuos sólidos y líquidos, los cuales están compuestos principalmente de agua, azúcares solubles, fibra, ácidos orgánicos, aminoácidos, minerales, aceites esenciales, favonoides y vitaminas, estando en cantidades diferentes dependiendo de la fracción de la fruta (jugo, cáscara, pulpa, meso-carpio), su estado de madurez y el sistema empleado para la extracción del jugo43.
Específicamente, en cuanto a los favonoides, la naringina es el mayoritario en la toronja, la hesperidina lo es en la naranja, mientras que rutina, hesperidina y diosmina son abundantes en el limón y la mandarina. Otros metabolitos importantes en los cítricos son las cumarinas y ácidos orgánicos como el ácido cítrico y ascórbico44.
Las aplicaciones terapéuticas de algunos de estos compuestos son ya conocidas y utilizadas a nivel clínico. La mezcla micronizada de favonoides conocida comercialmente como Dafón®, que contiene 90 % de diosmina y 10 % de hesperidina es utilizada como un potente medicamento febotónico para el tratamiento de la insuficiencia venosa crónica45. Además, son numerosos los productos fitotera-péuticos y alimentos funcionales comercializados a nivel mundial que contienen, totalmente o como parte de sus principios activos, una fracción favonoide, comúnmente llamada biofavonoides e incluso denominada genéricamente cómo vitamina P.
Es tan promisoria la obtención de compuestos con alto valor a partir de residuos de cítricos, que en el estado de la Florida (EUA), una región productora de cítricos, ha surgido el Laboratorio de Investigación en Cítricos y Productos Subtropicales (Citrus and Subtropical Products Research Laboratory, por su nombre en inglés) precisamente con el interés de recuperar, a partir de residuos de cítricos, productos importantes para uso en la salud humana y en alimentos. Ellos han estimado que el aprovechamiento de los residuos generados por la industria procesadora de cítricos en los Estados Unidos de América, podría suministrar más de 10.000 toneladas de hesperidina por año, muy por debajo de la demanda mundial para esta materia prima46.
Residuos de mango: el mango (Mangifera indica L., Anacardiaceae) es una de las frutas tropicales más importantes47, ha ganado gran popularidad en todo el mundo y cada vez mayor importancia también en el mercado europeo. Los principales residuos del procesamiento de mango son la cáscara y la semilla, los cuales corresponden al 35-60% del peso total del fruto48.
El aceite de la semilla de mango es una prometedora fuente de aceite comestible y ha atraído la atención debido a su perfil de ácidos grasos y triglicéridos, similar a la de la manteca de cacao. Por lo tanto, la legislación ha permitido recientemente el uso de aceite de semilla de mango como un sustituto de la manteca de cacao. Adicionalmente, la semilla de mango se puede utilizar también como fuente de antioxidantes naturales, principalmente compuestos fenólicos y fosfolípidos49, siendo los compuestos fenólicos principalmente ácidos gálico, elágico, y galatos.
Adicionalmente, los extractos etanólicos de semilla de mango son un antimicrobiano de amplio espectro, más eficaces contra bacterias Gram-positivas que contra las bacterias Gram-negativas. Su componente activo parece ser una estructura de tipo polifenólica, sin embargo, su naturaleza exacta aún queda por dilucidar50.
Residuos de banano: (Musa paradisiaca L., Musaceae) representa uno de los cultivos frutales más importantes, con una producción global anual de más de 50 millones de toneladas. La producción mundial de bananos de cocción (plátanos) se eleva a casi 30 millones de toneladas por año. Las cáscaras constituyen cerca del 30% de la fruta madura. Se estima que cerca de 1000 plantas de banano generan 20 a 25 toneladas de pseudotallos que proporcionaría cerca de 5% de almidón comestible51. Los intentos de utilización de residuos de banano incluyen la producción biotecnológica de proteínas, etanol, alfa-amilasa, hemicelulasas y celulasas52. Muy recientemente, los pigmentos tipo antocianinas presentes en las brácteas del banano fueron evaluados para su posible aplicación como colorantes naturales de alimentos. Se concluyó que las brácteas son una buena fuente de antocianinas teniendo las seis antocianidinas más comunes (delfinidina, cianidina, pelargonidina, peonidina, petunidina y malvidina). Adicionalmente se ha encontrado que la mayoría de los carotenoides que se encuentran en cáscaras de plátano son xantofilas esterificados con miristato, y en menor medida con laurato, palmitato o caprato53.
Residuos de uva: aparte de las naranjas, las uvas (Vitis sp., Vitaceae) constituyen la mayor cosecha de fruta en el mundo con más de 60 millones de toneladas producidas anualmente. En Colombia, entre los años 2000 y 2008, se ha triplicado el área sembrada de uva, pasando de producir 12.191 toneladas a 39.493 toneladas, siendo el departamento del Valle del Cauca quien aporta más del 90% de la producción nacional. Gracias a las condiciones agroclimáticas (temperatura, humedad y luminosidad), Colombia produce uva durante todo el año, facilitando también el desarrollo de cepas finas y terruños complejos, lo cual ha permitido el cultivo exitoso de diversos tipos de uva, entre ellos: red-globe, roja, Italia, blanca, river, negra, entre otros; de hecho, el auge en la producción e industrialización de la uva en Colombia ha generado un incremento considerable de residuos agroindustriales, representados en cáscara (piel, orujo o hollejo), semilla, residuos líquidos y semisólidos obtenidos del prensado de la fruta. Los datos a nivel mundial muestran que alrededor del 80% de la cosecha total de uva se utiliza en la elaboración del vino54, y el orujo representa aproximadamente el 20% del peso de las uvas procesadas. De estos datos se puede calcular que las cantidades de orujo de uva ascienden a más de 9 millones de toneladas por año. Su composición varía considerablemente, dependiendo de la variedad de uva y la tecnología de la vinificación. Una gran variedad de productos como etanol, tartratos, ácido cítrico, aceite de semilla de uva, hidrocoloides, y fibra dietaria se recuperan del orujo de uva55. Adicionalmente, catequinas, antocianinas, glucósidos de favonoles, ácidos fenólicos y estilbenos son los principales constituyentes fenólicos de la uva. Particularmente, las antocianinas se han considerado como uno de los componentes más valiosos en la uva, puesto que se ha demostrado que inhiben la oxidación de las lipoproteínas de baja densidad, lo cual está relacionado con su potencial efecto sobre enfermedades cardiovasculares56.
Residuos de tomate: el jugo de tomate (Lycopersicon esculentum MILL, Solanaceae) es el jugo vegetal más importante con respecto al consumo per cápita, seguido por el jugo de zanahoria. Cerca de 7.3% de la materia prima se pierde en forma de residuos durante la preparación de jugo de tomate. El orujo de tomate está compuesto de las pieles y las semillas de la fruta57. Las semillas representan aproximadamente el 10% de la fruta y el 60% del total de residuos y son una fuente de proteína (35%) y grasa (25%), de hecho, el aceite de semilla de tomate ha despertado el interés, ya que es rico en ácidos grasos insaturados, especialmente en ácido linoleico58. Por su parte, el licopeno es el carotenoide principal responsable del color rojo característico de los tomates y constituye aproximadamente del 80 al 90% del contenido total de carotenoides59. La mayoría del licopeno se asocia con la fracción insoluble en agua y con la piel60 y por lo tanto, los extractos de la piel son particularmente ricos en licopeno. Recientemente, también se ha descrito la utilización de orujo de tomate como sustrato para la producción de vitamina B12.
Residuos de zanahoria: la zanahoria (Daucus carota L, Apiaceae) sus jugos y mezclas se encuentran entre las bebidas no alcohólicas más populares. A pesar de ciertas mejoras técnicas en la transformación, incluido el uso de enzimas de despolimerización, se sabe que una parte importante de compuestos valiosos, tales como los carotenos, los ácidos urónicos y azúcares neutros se conserva aun en el orujo de zanahoria, el cual suele ser desechado. El contenido de caroteno total en orujo puede ser de hasta 2 g por kg de materia seca, dependiendo de las condiciones de procesamiento61.
Se han hecho varios intentos para la utilización de pulpa de zanahoria en alimentos como el pan, la torta, el aderezo y encurtidos y para la producción de bebidas funcionales. Sin embargo, la aceptación del consumidor de estos productos todavía tiene que demostrarse, sobre todo porque la calidad sensorial puede verse afectada62.
En cuanto a las tecnologías de secado empleadas para la utilización de residuos de zanahoria se ha mostrado que los pigmentos obtenidos con secado por aspersión son sensibles a la degradación durante el almacenamiento, dependiendo de la hora y la temperatura de almacenamiento. Se sugirió que la estabilidad de los carotenoides en polvo puede ser mejorado considerablemente mediante el empleo de métodos adecuados de envasado y las condiciones de almacenamiento. Por su parte, el polvo liofilizado mostró una mayor estabilidad del pigmento durante el almacenamiento de los productos secos63. La isomerización que también puede contribuir a la decoloración de los pigmentos de zanahoria no se observó después de 15 semanas de almacenamiento de b-caroteno encapsulado en una matriz de maltodextrina64.
Residuos de remolacha: solamente en Europa Occidental se producen más de 200.000 toneladas de remolacha (Beta vulgaris L Chenopodiaceae) cada año, la mayoría de los cuales (90%) se consume como verdura. El resto se transforma en jugo y en colorante alimentario, conocido como rojo remolacha65.
El orujo de la industria de la remolacha es rico en betalaínas, corresponde al 15-30% de la materia prima y en su mayoría se dispone para la alimentación animal o producción de abono. La porción coloreada de la remolacha varía entre 0,4 a 2,0% de la materia seca, dependiendo de la variabilidad intraespecífica, factores edáficos y tratamientos post-cosecha. Las remolachas se encuentran entre los 10 vegetales más potentes en cuanto a capacidad antioxidante, atribuida a un contenido de fenoles totales de 50-60 µmol/g de peso seco66.
En cuanto a la composición química, se conoce que la fracción coloreada consiste principalmente de betacianinas y betaxantinas, mientras que la porción fenólica de la cascara muestra principalmente triptofano, acido p-cumárico y ácido ferúlico67.
Deshidratación y procesamiento de residuos agroindustriales
El secado de los alimentos es uno de los métodos más antiguos que ha utilizado el hombre para conservar las propiedades de los productos de la cosecha. El hombre primitivo utilizó la energía solar que calentaba el medio ambiente, para secar sus alimentos al aire libre. Actualmente el secado de frutas y hortalizas es un proceso industrial muy importante en la preservación de la calidad de los productos agrícolas.
El secado o deshidratación consiste en la extracción del agua contenida en los alimentos por medios físicos hasta que el nivel de agua sea adecuada para su conservación por largos periodos. El nivel de agua deseado lo determina el tipo de producto final, por ejemplo, el secado de granos y cereales se realiza hasta obtener alrededor de 12% de agua en el producto que es parecido a la humedad del aire normal, en el caso de las frutas secas, los niveles son más bajos (8-10%), en el caso de nueces y semillas los niveles son todavía más bajos (3-5%). Cuando la humedad final que se desea está por debajo de la humedad del aire normal o del medio ambiente, es necesario realizar un proceso controlado de secado utilizando aire calentado por cualquier fuente de energía: solar, eléctrica, por combustión de la madera u otros combustibles derivados del petróleo68.
El secado solar controlado: es una alternativa barata en regiones tropicales secas. No así en regiones tropicales húmedas, debido al cambio o aumento repentino de la humedad relativa en el medio ambiente por las lluvias. Para contrarrestar las desventajas del secado al aire libre se han diseñado los secadores o deshidratadores solares, usando la luz solar y las corrientes de aire en forma mucho más eficiente. El secador solar puede ser de varias formas por ejemplo se puede presentar como un cajón semi aislado pintado de negro en su interior y la cara superior de plástico (el vidrio y el plástico dejan pasar la radiación solar sin que se salga nuevamente)69.
El secado por aire caliente: orientado a túneles o cabinas en donde se coloca el producto, es el más eficiente y recomendado, ya que los equipos construidos pueden controlar el proceso de secado: temperatura y velocidad del aire, y la disposición del alimento a secar. Para este secado se utiliza combustible ya sea directamente o sea que el alimento se va a deshidratar por efecto de los gases que se forman quemando el combustible, o indirectamente de tal manera que el combustible calienta el aire que luego se va a utilizar para deshidratar el producto68.
En el secado indirecto se presenta una transferencia de calor por convección y contacto directo del material a deshidratar con el aire caliente en el cual tiene lugar la evaporación. Para que el proceso de secado se realice eficientemente, se requiere establecer las condiciones básicas del proceso como son: temperatura, humedad relativa del aire de secado, flujo de aire, tamaño y forma del producto70.
La temperatura del aire de secado constituye un parámetro básico en el proceso de deshidratación con aire caliente. El incremento de la temperatura aumenta la difusividad del agua dentro del producto, acelerando de esta forma el proceso. Pero no se debe hacer un excesivo incremento de la temperatura, porque provoca deterioro de la calidad del producto, debido a que se pueden presentar reacciones de pardeamiento, formación de costra superficial, gelatinización de los productos que presentan altos contenidos de almidones y pérdidas de compuestos volátiles (aromas)70.
El tiempo de secado depende en gran medida de la cantidad de aire que pasa a través del producto. Por lo tanto, se debe establecer la cantidad de producto que se quiere secar por unidad de tiempo y dimensionar el flujo de aire que se requiere para tal fin. Otros factores importantes son el tamaño y la forma del material a deshidratar. La velocidad de secado de un trozo delgado de producto húmedo, es inversamente proporcional al cuadrado del espesor de la pieza. Esta relación está basada en el hecho de que se presenta una mayor resistencia para remoción de la humedad en las áreas internas que en las áreas externas. Como consecuencia de esto, se puede disminuir el tiempo de secado, si disminuye el tamaño de partículas hasta niveles adecuados70.Existen variaciones en la geometría de los equipos de secado, entre los equipos más comúnmente utilizados se encuentran los secadores de tambor, secadores rotatorios, secador de túnel, de banda68.
Deshidratación por ósmosis: este proceso consiste en preservar el alimento conservándolo en jarabe de azúcar en la superficie de la fruta. Luego se deshidratarán directa o indirectamente. Entre las ventajas de este procedimiento están que la concentración de azúcar en la superficie reduce la decoloración y oscurecimiento del producto, adicionalmente el período de deshidratado se reduce considerablemente71.
secado por aspersión: el secado por aspersión es la operación unitaria en la que se transforma un producto desde un estado líquido hasta un estado en forma pulverizado. Es un proceso prácticamente instantáneo de producir un sólido seco a partir de un fluido, siendo el aire caliente el medio que suministra el calor necesario para la evaporación y al mismo tiempo el medio de transporte del agua eliminada68.
Comparado con otros procesos de evaporación, el secado por aspersión tiene la gran ventaja que el producto puede ser secado sin mucha pérdida de volátiles o componentes termolábiles72. Estas ventajas son especialmente importantes en la producción de alimentos, de hecho en Colombia es común la presencia de estos equipos a nivel industrial en empresas del sector lechero, plantas de procesamiento de café y producción de aditivos para alimentos72.
Una ventaja adicional del secado por atomización es que permite el uso de agentes encapsulantes para lograr, al mismo tiempo que ocurre el secado, la formación de sistemas microencapsulados. En la industria alimentaria se utilizan diferentes materiales como agentes encapsulantes, tales como: carbohidratos, esteres, gomas, lípidos, proteínas y materiales inorgánicos. Dentro de los carbohidratos, las maltodextrinas son importantes para la preparación de jugos para aspersión ya que son incoloras, inodoras y de baja viscosidad; además permite la formación de polvos de libre flujo sin enmascarar el sabor original64.
Requerimientos microbiológicos de alimentos para aves de postura: De acuerdo con la Norma Técnica Colombiana (NTC) 2107, un alimento completo para aves es el producto alimenticio resultante de la mezcla final de materias primas de origen vegetal, animal, vitaminas, minerales y aminoácidos; además, puede contener aditivos no nutricionales aprobados por la autoridad competente. Este producto es capaz de satisfacer todos los requerimientos nutricionales de esta especie, para una determinada edad y propósito, como única fuente de alimento.
En general, los requisitos que deben cumplir este tipo de productos son:
-
El producto no debe contener insectos vivos o partes de éstos, ni huevos o larvas de insectos.
-
El producto no debe contener materias extrañas, tales como fragmentos metálicos, excrementos de roedores u otros.
-
El color debe corresponder al aceptado para las materias primas utilizadas, o presentar colores característicos al proceso, correspondientes a sustancias colorantes permitidas por la legislación nacional vigente.
-
El olor debe ser el característico del producto.
-
El producto debe elaborarse de acuerdo con las buenas prácticas de fabricación.
-
El producto no debe contener sustancias o productos desaprobados por la autoridad competente.
-
El producto deberá cumplir con la composición registrada y garantizada en cuanto al contenido de proteína, grasa, cenizas, fibra, fósforo y calcio.
-
El alimento completo seco para aves deberá contener como máximo 13% de humedad.
Adicionalmente, la protección de la salud humana y animal constituye uno de los objetivos fundamentales de la legislación alimentaria, por ello, se han establecido una serie de normas de higiene en los concentrados animales, encaminadas principalmente a reducir la contaminación microbiológica (bacterias, hongos y levaduras) causante de enfermedades en los animales y en el hombre.
Específicamente, en Colombia, la NTC210773, así como las Directivas del Instituto Colombiano Agropecuario (ICA) DIP - 30 - 100 - 002 y DIP - 30 - 100 - 003, han establecido los requisitos microbiológicos de alimentos para aves como se muestra en la tabla 1.
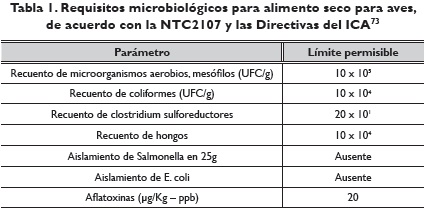
Conclusión
Es posible conferir valor agregado a los residuos vegetales con alto contenido de carotenoides provenientes de la industria agroalimentaria y las centrales de abasto al utilizarlos como materia prima para elaborar premezclas que reemplacen el uso de colorantes artificiales en los concentrados para alimentar gallina ponedoras. Sin embargo, estos residuos no han sido aprovechados eficientemente, en parte, porque su valor es aún desconocido y, sobretodo, por la falta de métodos apropiados para la preparación y caracterización de sustancias de mayor valor con la suficiente calidad e inocuidad como para ser usadas en otros procesos.
Bibliografía
1. LONDONO LONDONO J, LIMA VRD, LARA O, et al. Clean recovery of antioxidant flavonoids from citrus peel: Optimizing an aqueous ultrasound-assisted extraction method. En: Food Chemistry. 2010. Vol. 119, No. 1. p.81-87. [ Links ]
2. ASHWEL M. Conceptos sobre los alimentos funcionales. Belgium: ILSI Press; 2004. [ Links ]
3. GILBERT L. The consumer market for functional foods. En: Journal of Nutraceuticals, Functional and Medical Food. 1997. Vol. 1, No. p.5-21. [ Links ]
4. TRIPATHI M, KHANNA SK, DAS M. Surveillance on use of synthetic colours in eatables vis a vis Prevention of Food Adulteration Act of India. En: Food Control. 2007. Vol. 18, No. 3. p.211-219. [ Links ]
5. FENKO A, SCHIFFERSTEIN HNJ, HUANG T-C, HEKKERT P. What makes products fresh: The smell or the colour? En: Food Quality and Preference. 2009. Vol. 20, No. 5. p.372-379. [ Links ]
6. GREAVES J. Colorants for Cereal and Snack Food. En: Cereal Foods World. 2002. Vol. 47, No. 8. p.374-377. [ Links ]
7. DE SAINT BLANQUAT G. Colorantes Alimentarios. In: Multon JI, ed. Aditivos y auxiliares de fabricación en las industrias agroalimentarias. Zaragoza: Acribia; 2000:343-373. [ Links ]
8. SHWARTZ SJ, VON ELBE JH, GIUSTI MM. Colorants. In: Damodaran S, Parkin KL, Fennema OR, eds. Fennema's Food Chemestry. Fourth ed. Boca Raton, FL: CRC Press; 2008:572. [ Links ]
9. CAMERON E, PAULING L. Supplemental ascorbate in the supportive treatment of cancer: Reevaluation of prolongation of survival times in terminal human cancer. En: Proceedings of the National Academy of Sciences of the United States of America. 1978. Vol. 75, No. 9. p.4538-4542. [ Links ]
10. WILLETT WC, MACMAHON B. Diet and Cancer An Overview. En: New England Journal of Medicine. 1984. Vol. 310, No. 11. p.697-703. [ Links ]
11. RADIMER K, BINDEWALD B, HUGHES J, ERVIN B, SWANSON C, PICCIANO MF. Dietary Supplement Use by US Adults: Data from the National Health and Nutrition Examination Survey, 1999 a 2000. En: American Journal of Epidemiology. 2004. Vol. 160, No. 4. p.339-349. [ Links ]
12. VALKO M, LEIBFRITZ D, MONCOL J, CRONIN MTD, MAZUR M, TELSER J. Free radicals and antioxidants in normal physiological functions and human disease. En: The International Journal of Biochemistry & Cell Biology. 2007. Vol. 39, No. 1. p.44-84. [ Links ]
13. LIMON-PACHECO J, GONSEBATT ME. The role of antioxidants and antioxidant-related enzymes in protective responses to environmentally induced oxidative stress. En: Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 2009. Vol. 674, No. 1-2. p.137-147. [ Links ]
14. TRABER MG, ATKINSON J. Vitamin E, antioxidant and nothing more. En: Free Radical Biology and Medicine. 2007. Vol. 43, No. 1. p.4-15. [ Links ]
15. ROBERFROID; M, CALDERON PB. Free radicals and oxidation phenomena in biological systems. New York: Marcel Dekker Inc.; 1994. [ Links ]
16. HAVSTEEN BH. The biochemistry and medical significance of the favonoids. En: Pharmacology and Therapeutics. 2002. Vol. 96, No. 2-3. p.67-202. [ Links ]
17. SKREDE G, WROLSTAD RE. Flavonoides from Berries and Grapes. In: Shi J, Mazza G, Le Maguer M, eds. Functional Foods: Biochemical and Processing Aspects. Boca Raton, London, New York, Washington, DC: CRC Press; 2002:71-133. [ Links ]
18. TIWARI A. Imbalance in antioxidant defence human diseases: Multiple approach of natural antioxidant therapy. En: Current Science. 2001. Vol. 89, No. 9. p.1179-1187. [ Links ]
19. LOTITO SB, FREI B. Consumption of favonoid-rich foods and increased plasma antioxidant capacity in humans: Cause, consequence, or epiphenomenon? En: Free Radical Biology and Medicine. 2006. Vol. 41, No. 12. p.1727-1746. [ Links ]
20. BORS W, SARAN M. Radical scavenging by favonoid antioxidants. En: Free radical research communications. 1987. Vol. 2, No. 4-6. p.289-294. [ Links ]
21. MANACH C, WILLIAMSON G, MORAND C, SCALBERT A, RÉMÉSY C. Bioavailability and bioefficacy of polyphenols in humans. I. Review of 97 bioavailability studies. En: The American journal of clinical nutrition. 2005. Vol. 81, No. 1 (Suppl). p.230-242. [ Links ]
22. ARTS ICW, HOLLMAN PCH. Polyphenols and disease risk in epidemiologic studies. En: The American journal of clinical nutrition. 2005. Vol. 81, No. 1 Suppl. p.317-325. [ Links ]
23. KNEKT P, KUMPULAINEN J, JÄRVINEN R, et al. Flavonoid intake and risk of chronic diseases. En: The American journal of clinical nutrition. 2002. Vol. 76, No. 3. p.560-568. [ Links ]
24. AVIRAM M, FUHRMAN B. Wine favonoids protect against LDL oxidation and atherosclerosis. En: Annals of the New York Academy of Sciences. 2002. Vol. 957, No. p.146-161. [ Links ]
25. RIETVELD A, WISEMAN S. Antioxidant effects of tea: evidence from human clinical trials. En: The Journal of nutrition. 2003. Vol. 133, No. 10. p.3285-3292. [ Links ]
26. O'CONNELL OF, RYAN L, O'BRIEN NM. Xanthophyll carotenoids are more bioaccessible from fruits than dark green vegetables. En: Nutrition Research. 2007. Vol. 27, No. 5. p.258-264. [ Links ]
27. BADUI DERGAL S. Carotenoides: Química de los Alimentos. Four ed. Mexico: Pearson Educacion; 2006. [ Links ]
28. KRINSKY NI. Antioxidant functions of carotenoids. En: Free Radical Biology and Medicine. 1989. Vol. 7, No. 6. p.617-635. [ Links ]
29. RIBAYA MERCADO JD, JB. B. Lutein and zeaxanthin and their potential roles in disease prevention. En: Journal of the American College of Nutrition. 2004. Vol. No. 23. p.567S-587S. [ Links ]
30. ADA. The position of The American Dietetic Association on Functional Food. En: 2003. Vol. No. p. [ Links ]
31. MOELLER SM, JACQUES PF, BLUMBERG JB. The Potential Role of Dietary Xanthophylls in Cataract and Age-Related Macular Degeneration. En: Journal of the American College of Nutrition. 2000. Vol. 19, No. p.522S-527S. [ Links ]
32. CHUNG HK, RASMUSSEN HM, JOHNSON EJ. Lutein bioavailability is higher from lutein-enriched eggs than from supplements and spinach in men. En: The Journal of Nutrition. 2004. Vol. 134, No. 8. p.1887-1893. [ Links ]
33. MIKI W. Biological functions and activities of animal carotenoids. En: Pure Applied Chemestry. 1991. Vol. 63, No. p.141-146. [ Links ]
34. SURAI PF, SPARKS NHC. Designer eggs: from improvement of egg composition to functional food. En: Trends in Food Science and Technology. 2001. Vol. 12, No. 1. p.7-16. [ Links ]
35. ANTON M, NAU F, LECHEVALIER V. El huevo de gallina como materia prima para la industria de alimentos. In: Jeantet R, Croguennec T, Schuck P, Brule G, eds. Ciencia de los Alimentos. Zaragoza: Acribia; 2007:107. [ Links ]
36. CORRY JEL. Análisis Microbiológico de Huevos y Ovoproductos. In: Mead GC, ed. Análisis Microbiológico de Carne Roja, Aves y Huevos. Zaragoza: Acribia; 2009:181-182. [ Links ]
37. HERNÁNDEZ GIMENO JM. Carotenoides pigmentantes estables: Un nuevo concepto para optimizar los costes en la formulación de piensos de gallinas. En: Selecciones Avícolas. 2003. Vol. XLV, No. 2. p.88-96. [ Links ]
38. FLACHMANN R, SAUER M, SCHOPFER CR, et al., inventors; SunGene GmbH & Co. KGaA (DE), BASF Aktiengesellschaft (DE) BASF Plant Science GmbH (DE) assignee. Methods for producing animal feed preparations with astaxanthin-containing plants or parts of plants of the genus Tagetes USA patent 7,381,541. 2008 June 3, 2008. [ Links ]
39. NIELSEN PM, inventor Novozymes A/S (Bagsvaerd, DK) assignee. Methods for processing crustacean material USA patent 7241463. 2007. [ Links ]
40. CUEVAS B, DIAZ G, RETAMAL C. Pigmentos Utilizados en Raciones de Gallinas Ponedoras. In: Muñoz S, ed. Chile: Editorial del Cardo; 2003. [ Links ]
41. ROLDAN JC, DURÁN NARANJO LF, MARTÍNEZ DÍAZ HA, DURÁN RAMÍREZ F. Manual de Explotación en Aves de Corral. Colombia: Grupo Latino; 2004. [ Links ]
42. DSM NP. Egg Yolk Pigmentation with CAROPHYLL® Red 10% and CAROPHYLL® Yellow 10% In. Swizerland: DSM Nutritional Products Ltd; 2005. [ Links ]
43. BRADDOCK RJ. By-products of citrus fruits. En: Food Technology. 1995. Vol. 49, No. p.74-77. [ Links ]
44. KAWAII S, TOMONO Y, KATASE E, et al. Quantitative Study of Flavonoids in Leaves of Citrus Plants. En: Journal of Agricultural and Food Chemistry. 2000. Vol. 48, No. 9. p.3865-3871. [ Links ]
45. LYSENG-WILLIAMSON KA, PERRY CM. Micronised purifed favonoid fraction: a review of its use in chronic venous insufficiency, venous ulcers and haemorrhoids. En: Drugs. 2003. Vol. 63, No. 1. p.71-100. [ Links ]
46. GROHMANN K, MANTHEY JA, CAMERON RG. Acid-catalyzed hydrolysis of hesperidin at elevated temperatures. En: Carbohydrate Research. 2000. Vol. 328, No. 2. p.141-146. [ Links ]
47. RAMTEKE RS, VIJAYALAKSHMI MR, EIPESON WE. Processing and value addition to mangoes. En: Indian Food Industry. 1999. Vol. 18, No. p.155-163. [ Links ]
48. LARRAURI JA, RUPEREZ P, BORROTO B, SAURA-CALIXTO F. Mango peels as a new tropical fibre: preparation and characterization. En: Lebensmittel-Wissenschaft und -Technologie. 1996. Vol. 29, No. p.729-733. [ Links ]
49. PURAVANKARA D, BOGHRA V, SHARMA RS. Effect of antioxidant principles isolated from mango (Mangifera indica L.) seed kernels on oxidative stability of buffalo ghee (butter-fat). En: Journal of the Science of Food and Agriculture. 2000. Vol. 80, No. p.522-526. [ Links ]
50. KABUKI T, NAKAJIMA H, ARAI M, UEDA S, KUWABARA Y, DOSAKO SI. Characterization of novel antimicrobial compounds from mango (Mangifera indica L.) kernel seeds. En: Food Chemistry. 2000. Vol. 71, No. 1. p.61-66. [ Links ]
51. ANAND JC, MAINI SB. Utilization of fruit and vegetable wastes. En: Indian Food Packer. 1997. Vol. 51, No. p.45-63. [ Links ]
52. MEDEIROS RG, SOFFNER MLAP, THOME JA, et al. The production of hemicellulases by aerobic fungi on medium containing residues of banana plant as substrate. En: Biotechnology Progress. 2000. Vol. 16, No. p.522-524. [ Links ]
53. PAZMIÑO-DURAN EA, GIUSTI MM, WROLSTAD RE, GLORIA MBA. Anthocyanins from banana bracts (Musa paradisiaca) as potential food colorants. En: Food Chemistry. 2001. Vol. 73, No. 3. p.327-332. [ Links ]
54. MAZZA G, MINIATI E.Grapes In: Anthocyanins in fruits, vegetables, and grains. Boca Raton, Ann Harbor, London, Tokyo: CRC Press.; 1993. [ Links ]
55. GIRDHAR N, SATYANARAYANA A. Grape waste as a source of tartrates. En: Indian Food Packer 2000. Vol. 54, No. p.59-61. [ Links ]
56. FRANKEL EN, WATERHOUSE AL, TEISSEDRE PL. Principal Phenolic Phytochemicals in Selected California Wines and Their Antioxidant Activity in Inhibiting Oxidation of Human Low-Density Lipoproteins. En: Journal of Agricultural and Food Chemistry. 1995. Vol. 43, No. 4. p.890-894. [ Links ]
57. AVELINO A, AVELINO HT, ROSEIRO JC, COLLACO MTA. Saccharification of tomato pomace for the production of biomass. En: Bioresource Technology. 1997. Vol. 61, No. 2. p.159-162. [ Links ]
58. ASKAR A. Importance and characteristics of tropical fruits. En: Fruit Processing. 1998. Vol. 8, No. p.273-276. [ Links ]
59. SHI J, LE MAGUER M, MIKE. B. Lycopene from Tomatoes. In: Shi J, Mazza G, Le Maguer M, eds. Functional Foods: Biochemical and Processing Aspects. Boca raton, London, New York, Washington, D.C: CRS Press; 2002:134-167. [ Links ]
60. SHARMA SK, MAGUER ML. Lycopene in tomatoes and tomato pulp fractions. En: Italian Journal of Food Science. 1996. Vol. 2, No. p.107-113. [ Links ]
61. STOLL T, SCHIEBER A, CARLE R. Carrot pomace an underestimated by-product?. In W. Pfan-nhauser, G. R. Fenwick, & S. Khokhar (Eds.), Biologically-active phytochemicals in food: analysis, metabolism, bioavailability and function (pp. 525-527). Cambridge, UK: Royal Society of Chemistry; 2001. [ Links ]
62. HENN T, KUNZ B. Pfanzliche Reststoffe zur Herstellung von Functional Drinks. En: Flusssiges Obst. 1996. Vol. 63, No. p.715-719. [ Links ]
63. TANG YC, CHEN BH. Pigment change of freeze-dried carotenoid powder during storage. En: Food Chemistry. 2000. Vol. 69, No. 1. p.11-17. [ Links ]
64. DESOBRY SA, NETTO FM, LABUZA TP. Comparison of spray-drying, drum-drying and freeze-drying for b-carotene encapsulation and preservation. En: Journal of Food Science. 1997. Vol. 62, No. p.1158-1162. [ Links ]
65. HENRY BS. Natural food colours. In G. F. Hendry, & J. D. Houghton (Eds.), Natural food colorants (pp. 40-79). London: Blackie Academic & Professional.; 1996. [ Links ]
66. VINSON JA, HAO Y, SU X, ZUBIK L. Phenol Antioxidant Quantity and Quality in Foods:  Vegetables. En: Journal of Agricultural and Food Chemistry. 1998. Vol. 46, No. 9. p.3630-3634. [ Links ]
Vegetables. En: Journal of Agricultural and Food Chemistry. 1998. Vol. 46, No. 9. p.3630-3634. [ Links ]
67. KUJALA TS, LOPONEN JM, KLIKA KD, PIHLAJA K. Phenolics and Betacyanins in Red Beetroot (Beta vulgaris) Root: Distribution and Effect of Cold Storage on the Content of Total Phenolics and Three Individual Compounds. En: Journal of Agricultural and Food Chemistry. 2000. Vol. 48, No. 11. p.5338-5342. [ Links ]
68. SINGH R P, HELDMAN DR. Deshidratación. In: Introducción a la Ingeniería de Alimentos. 2 ed. Zaragoza: Acribia; 2009:467-477. [ Links ]
69. ALMADA M, CÁCERES MS, MACHAÍN-SINGER M, PULFER JC. Guia de Uso de secaderos solares para frutas, legumbres, hortalizas, plantas medicinales y carnes. Asunción, Paraguay: UNESCO; 2005. [ Links ]
70. BRENNAN JG, BUTTERS JR, COWELL ND. Introducción a la Deshidratación. ln: Las Operaciones de la Ingeniería de Alimentos. 3 ed. Zaragoza: Acribia; 1998:381-388. [ Links ]
71. SHARMA RS, MULVANEY SJ, RIZVI SSH. Deshidratación Osmótica de Alimentos. In: Ingeniería de los Alimentos: Operaciones Unitarias y Prácticas de Laboratorio. Mexico: Limusa Wiley; 2003:225-230. [ Links ]
72. SHARMA SK, MULVANEY SJ, RIZVI SSH. Secado por Aspersión. In: Ingeniería de los Alimentos: Operaciones Unitarias y Prácticas de Laboratorio. 1 ed. Mexico: Limusa Wiley; 2003:205-208. [ Links ]
73. INSTITUTO COLOMBIANO DE NORMAS TÉCNICAS Y CERTIFICACIóN - ICONTEC. Alimento completo de aves. Bogotá: INCONTEC, 1999. 7p (NTC 2107) [ Links ]














