Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Producción + Limpia
versão impressa ISSN 1909-0455
Rev. P+L vol.7 no.2 Caldas jul./dez. 2012
*Artigo derivado do projeto de investigação titulado "FeCl3 and TiO2 interaction with H2O2 in the liquid waste treatment from the textile industry using artificial light trough fatorial model", para optar ao título de doutor of Science in Environmental Engineering. Financiado pelo Fundo para o Desenvolvimento da Investigação da Corporação Universitária Lasallista.
**Vice–reitor de Investigação da Corporação Universitária Lasallista. Investigador Grupo de Investigação Aplicada ao Meio ambiente – GAMA
Correspondência: Luis Fernando Garcés Giraldo, e-mail: lugarces@lasallista.edu.co
Artigo recebido: 20/05/2012; Artigo aprovado: 21/11/2012
Resumo
Introdução. Os métodos clássicos de eliminação dos corantes têxteis não são úteis devido a que oxidações ou reduções parciais podem gerar produtos secundários altamente tóxicos. Uma grande quantidade dos corantes não são diretamente tóxicos para os organismos vivos; não obstante, sua presença deve ser controlada já que a coloração que dão aos meios de descarga pode chegar a suprimir os processos fotossintéticos nos cursos de água. Objetivo. Selecionar a quantidade ótima de fotosensibilizador e agente oxidante para a degradação do corante Vermelho Novactive F6BS analisado mediante superfícies de respostas. Materiais e métodos. Utilizou-se um lustre de luz ultravioleta marca MIGTHY PURE de 60 Hz, com uma cuba de vidro que armazena 15 L de mostra; a mostra se re-circulou com bomba que manejou um fuxo de 0.047 L/s. Resultados. Melhore-los resultados obtidos para o corante Vermelho Novactive F6BS foram de 76.2% de degradação e um 49.4% de mineralização em duas horas, com o ensaio E7 (60 mg/L de FeCI3 e I mL/L de H202). Conclusões. O corante degrada e mineraliza mais rápidamente com o FeCI3; isto sucedeu no ensaio E7 (60 mg/L FeCI3 e 1.0 mL/L de H202).
Palavras importantes: foto-degradação, corantes têxteis, Vermelho Novactive, mineralização.
Resumen
Introducción. Los métodos clásicos de eliminación de los colorantes textiles no son útiles debido a que oxidaciones o reducciones parciales pueden generar productos secundarios altamente tóxicos. Una gran cantidad de los colorantes no son directamente tóxicos para los organismos vivos; no obstante, su presencia debe ser controlada ya que la coloración que imparten a los medios de descarga puede llegar a suprimir los procesos fotosintéticos en los cursos de agua. Objetivo. Seleccionar la cantidad óptima de fotosensibilizador y agente oxidante para la degradación del colorante Rojo Novactive F6BS analizado mediante superficies de respuestas. Materiales y métodos. Se utilizó una lámpara de luz ultravioleta marca MIGTHY PURE de 60 Hz, con una cubeta de vidrio que almacena 15 L de muestra; la muestra se recirculó con bomba que manejó un flujo de 0.047 L/s. Resultados. Los mejores resultados obtenidos para el colorante Rojo Novactive F6BS fueron de 76.2% de degradación y un 49.4% de mineralización en dos horas, con el ensayo E7 (60 mg/L de FeCI3 y I mL/L de H202). Conclusiones. El colorante degrada y mineraliza más rápidamente con el FeCI3; esto sucedió en el ensayo E7 (60 mg/L FeCI3 y 1.0 mL/L de H202).
Palabras clave: fotodegradación, colorantes textiles, Rojo Novactive, mineralización.
Abstract
Introduction. The classic elimination methods used for textile dyes are not useful due to the fact that partial oxidation or mineralization can generate highly toxic by-products. A great quantity of the dyes is not directly toxic for living organisms, but their presence must be controlled because the coloring on the discharge media can suppress photosynthesis in water. Objective. To select the optimal photo sensitizer and oxidation agent quantities too degrade red Novactive F6BS analyzed with surface responses. Materials and methods. A 60 Hz MIGTHY PURE ultra violet lamp was used, along with a glass bucket with 15L of the simple. This sample was re-circulated with a pump which had a 0.047 L/s flow. Results. The best results obtained for the red Novactive F6BS were 76.2% of degradation and 49.4% of mineralization in two hours, with the E7 test (60 mg/L de FeCl3 and 1 mL/L of H2O2). Conclusions. The dye is more rapidly degraded and mineralized with FeCl3; This took place in the E7 test (60 mg/L FeCl3 and 1.0 mL/L of H2O2).
Key words: photodegradation, textile dyes, red Novactive, mineralization.
Introdução
A indústria têxtil gera resíduos líquidos com ônus orgânicos manifestadas em DBO, DQO, e outros contaminantes que provem das seçóes de lavandería, padronizar, acabamentos e planta de água, além de temperaturas maiores de 30°C e pH fora de casta1-5. Os processos que contribuem ônus contaminantes são:
-
Desgrudes, com vertente de detergentes, emulsionantes, sequestrantes, antiespumantes, solventes, suavizantes e produtos engomantes.
-
Tingidos, com vertente de corantes, igualadores, dispersantes, antiespumantes, estabilizadores de pH, sequestrantes de dureza.
-
Alvejo, com vertente de soda, solventes, branqueadores ópticos, emulsionantes, peróxidos e ácidos.
-
Lavados, com vertente de detergentes e corantes hidrolisados.
-
Padronizar, com vertente de corantes e pigmentos remanentes e produtos auxiliares como ácidos, estabilizadores, álcalis, umectantes, resinas e ligantes.
-
Acabamentos, com aportes de suavizantes, resinas, catalisadores, impermeabilizantes, umectantes, anti-deslizantes, sólidos suspendidos.
Existem três mecanismos principais para aplicar o corante à fibra, fio ou tela: (a) por uma reação química com as moléculas da fibra, (b) por adesão à superfície da fibra ou (c) por absorção na fibra sem que tenha uma reação. As categorias dos tingidos são: ácido, azoico, básico, direto, disperso, pigmento, reativo, solvente, de enxofre e de cuba ou tinta. Na atualidade o mais comum é do que se utilizem os corantes diretos ou reativos para tingir o algodão e os corantes dispersos para tingir o poliéster. Os tingidos diretos e os que reagem com a fibra têm uma fixação de entre 90 e 95% e de 60 a 90%, respectivamente, enquanto nos corantes dispersos a fixação é de entre 80 e 90%. Cada tingido tem características químicas particulares que o fazem mais adequado para certo tipo de fibra, para certo tipo de equipe e imprimem certa cor e qualidade ao material tingido.
Das 700.000 toneladas de tinturas e corantes que se produzem cada ano em todo mundo, entre 10 e 15% se eliminam nos efluentes provenientes das operações de tingido. Num centro de tingido, quase 50% do corante que originalmente se encontrava no banho de corante novo, elimina-se depois da coloração de fibras sintéticas. A geração de água residual numa instalação de tingido normal se calcula entre 1 e 2 milhões de galões ao dia 6-9.
A abundância de corantes (tinturas) e a ampla gama de equipes de tintura que se utilizam na atualidade, dificulta que possam definir-se as características de um água residual deste tipo. Em general, o água residual da tintura por lote é de alto volume, com um grande ônus de contaminantes e tende a conter metais pesados, substâncias aromáticas e hidrocarbonetos halogêneos provenientes do água de recheado do banho de coloração, tudo o qual é tóxico para a vida aquática10-12.
Materiais e Métodos
Para o tingido de prendas na indústria têxtil, um dos corantes mais utilizados é o Vermelho Novactive F6BS. A concentração média na água foi de 300 mg/L para cada um deles, que é a concentração média típica dos efluentes industriais têxteis que contêm estes corantes. Na tabela 1 se apresentam os ensaios que se realizaram; cada ensaio se realizou por triplicado para diminuir o erro experimental. Para os experimentos se utilizou o peróxido de hidrogênio como agente oxidante (H2O2). A duração dos ensaios foi de duas horas.
Análise de Variância (ANOVA)
O modelo utilizado para a porcentagem de degradação e a porcentagem de mineralização como variáveis resposta, foi um modelo de três fatores, efeitos fixos completamente aleatorizado, com três replicas, o nível de confiança é de 95% e a potência para detectar diferenças significativas é de 100%.
É importante anotar que são os efeitos principáis; são os efeitos de interação dos fatores. Estas são constantes e estão sujeitas às seguintes restrições:
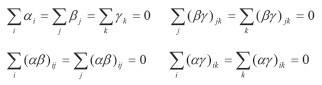
As hipóteses com as que foi realizado o desenho experimental de três fatores de efeitos fixos são as seguintes:

A regra de decisão para aceitar ou recusar a hipótese nula Ho, baseia-se no seguinte critério: Se o se aceita Tem, em caso contrário se recusa.
Desenho fatorial 33
Para otimizar as variáveis resposta: porcentagem de degradação e porcentagem de mineralização, correu-se um desenho fatorial 33 com as variáveis: tempo acumulado, TiO2 ou FeCl3 e H2O2, cujos níveis se apresentam na tabela 2.

Resultados
Experimentação Com FeCl3
Na tabela 3, observa-se como o valor p é (p=0.0001 ≤α), para os efeitos principáis tempo acumulado (minutos), cloreto férrico (mg/L), peróxido de hidrogeno (mL/L) e suas interações. Portanto se recusou a hipótese nula com um nível deconfiança de 95%, com o qual se concluí que estes efeitos e suas interações são significativos, óssea que a mudança no tempo acumulado, a concentração de cloreto férrico (mg/L) e peróxido de hidrogeno (mL/L), bem como suas interações, influi significativamente na porcentagem de degradação e a porcentagem de mineralização. Como as interaçóes são significativas não se pode avaliar os efeitos principais por separados, portanto na figura 1 se apresenta a análise das interações para cada variável resposta.
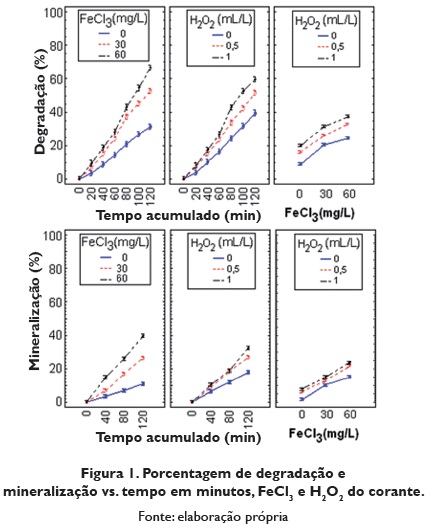
O R2 para os modelos porcentagem de mineralização e a porcentagem de degradação é R2=0,9967 e R2=0,9974 o que indica que cada modelo explica um 99,67% e 99,74% os dados obtidos, por tanto o erro absorve um 0,33% e 0,26% respectivamente, devido a fatores incontroláveis desconhecidos. O anterior indica que os fatores foram bem selecionados e controlados para o experimento. Como cada modelo cumpriu com os supostos e ademais explica mais de 90% dos dados obtidos, concluímos que são adequados para explicar a porcentagem de degradação e a porcentagem de mineralização do vermelho com FeCl3.
Na figura 1 se observa como a porcentagem de degradação aumenta durante o tempo em minutos do experimento, com qualquer nível de cloreto férrico e de peróxido de hidrogeno, mas é melhor este aumento para 60 mg/L de FeCl3 e 1 mL/L de H2O2. Trabalhar sem peróxido de hidrogeno e sem cloreto férrico proporciona a menor degradação. Pode-se ver do que as maiores degradações do corante se obtêm quando se combina 1 mL/L de peróxido de hidrogeno com 60 mg/L de cloreto férrico.
Cinética de Degradação e Mineralização
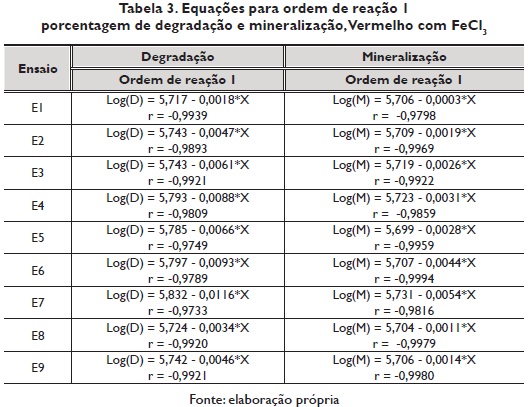
Para determinar se o ordem da reação é um, representou-se gráficamente o logaritmo da concentração residual do corante vs o tempo acumulado, para a porcentagem de degradação e porcentagem de mineralização (figura 2). As reações foram de primeiro ordem (maior valor no coeficiente de correlação). A reação de primeiro ordem dependería da constante de degradação do corante. Os tempos de vida média e as velocidades de reação foram calculados de acordo com as propostas realizadas na equação de ordem de reação I.
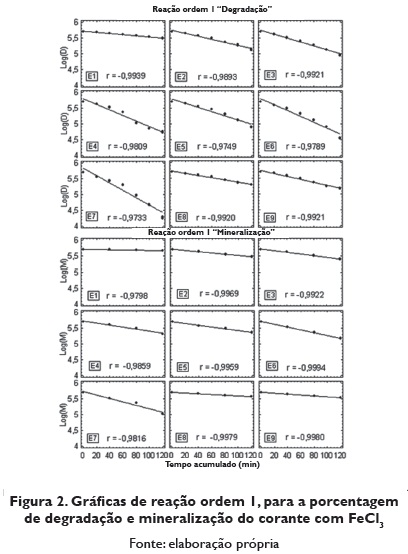
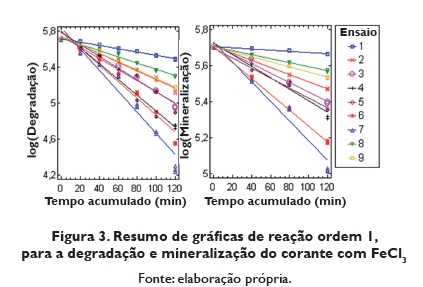
A figura 3 apresenta o resumo do logaritmo da concentração de degradação e logaritmo da concentração de mineralização do corante com FeCl3 Nesta figura se pode observar como o ensaio 7 é o que apresenta maior brinco ñas linhas retas.
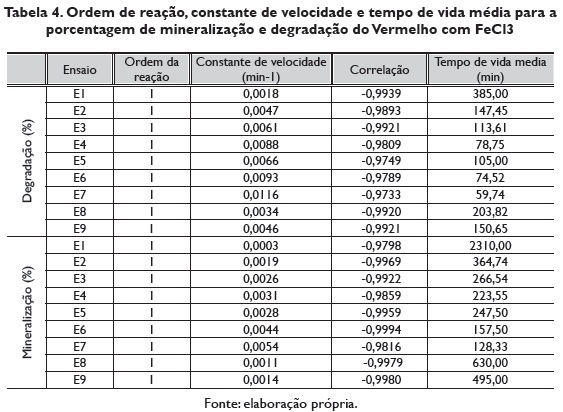
O ordem da reação, a constante de velocidade e o tempo de vida média para cada um dos ensaios realizados na porcentagem de degradação e porcentagem de mineralização do vermelho com FeCl3, observam-se na tabela 4. Segundo a constante de velocidade, a reação de degradação e mineralização do vermelho com FeCl3, mais 3 rápida foi com o ensaio 7, com um tempo de vida médio de 59.74 e 128.33 minutos respectivamente.
Desenho fatorial 33 para otimizar as variáveis respostas
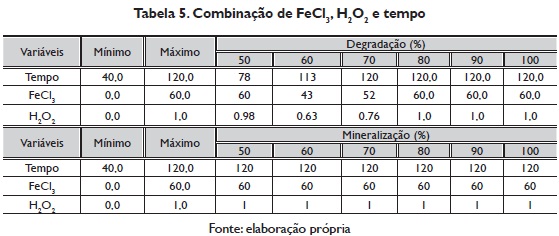
Com a metodologia da brinco ascendente se obtiveram os valores dos fatores que otimizam a variável resposta em cada porcentagem desde 50 até 100%. A combinação de FeCl3, H2O2 e tempo que geram o máximo de porcentagem de degradação e de mineralização se apresenta na tabela 4. A superfície de repostas para as variáveis dependentes estudadas, apresenta-se na figura 4.

O máximo de porcentagem de degradado são estáveis em FeCl3, H202 e tempo depois de 80%, com respeito à porcentagem de mineralização permanece constante nas variáveis FeCl3, H202 e tempo constante desde 50% (tabela 5).
Experimentação com TiO2
Encontrou-se que o valor p é (p=0.000l≤α), para os efeitos principáis "tempo acumulado (minutos), dióxido de titânio (mg/L), peróxido de hidrogeno (mL/L)" e suas interações. Portanto recusamos a hipótese nula com um nível deconfiança do 95%, com o qual se conclui que estes efeitos e suas interações são significativos, óssea que a mudança no tempo acumulado, a concentração de dióxido de titânio (mg/L) e peróxido de hidrogeno (mL/L), bem como suas interações, influi significativamente na porcentagem de degradação e a porcentagem de mineralização. Como as interações são significativas não se pode avaliar os efeitos principais por separados, portanto na figura 5 se apresenta a análise das interações para cada variável resposta.
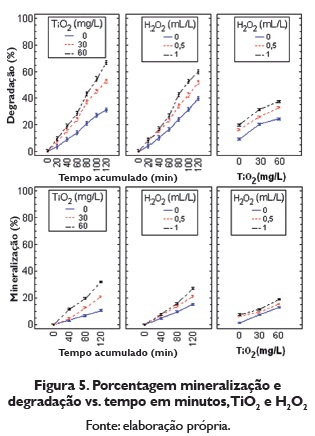
O R2 para os modelos porcentagem de mineralização e a porcentagem de degradação é R2=0,9967 e R2=0,9947 o que indica que cada modelo explica um 99,67% e 99,47% os dados obtidos, por tanto o erro absorve um 0,33% e 0,53% respectivamente, devido a fatores incontroláveis desconhecidos. O anterior indica que os fatores foram bem selecionados e controlados para o experimento. Como cada modelo cumpriu com os supostos e ademais explica mais do 90% dos dados obtidos, concluímos que são adequados para explicar a porcentagem de degradação e a porcentagem de mineralização do corante com TiO2.
Na figura 5 se observa como a porcentagem de degradação aumenta durante o tempo em minutos do experimento, com qualquer nível de dióxido de titânio e de peróxido de hidrogeno, mas é melhor este aumento para 60 mg/L de TiO2 e I mL/L de H202. Trabalhar sem peróxido de hidrogeno e sem dióxido de titânio proporciona a menor degradação. Pode-se ver do que as maiores degradações do corante se obtêm quando se combina 1 mL/L de peróxido de hidrogeno com 60 mg/L de dióxido de titânio.
Cinética de Degradação e Mineralização
Para determinar se o ordem da reação é um, representou-se graficamente o logaritmo da concentração residual do corante vs o tempo acumulado, para a porcentagem de degradação e porcentagem de mineralização (figura 6). As reações foram de primeiro ordem (maior valor no coeficiente de correlação). A reação de primeiro ordem dependería da constante de degradação do corante. Os tempos de vida média e as velocidades de reação foram calculados de acordó com as propostas realizadas na equação de ordem de reação 1.
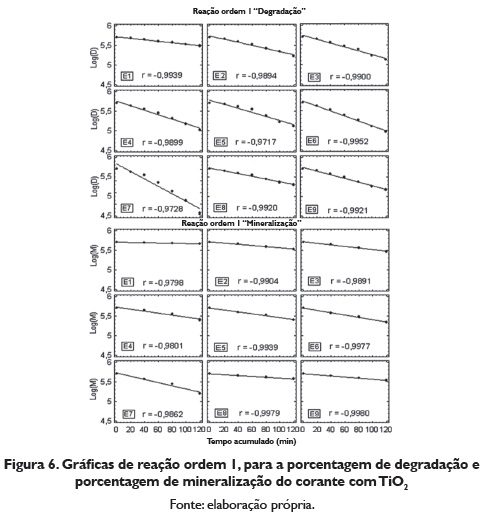
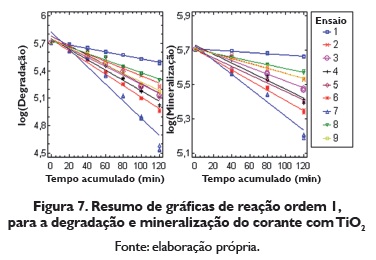
A figura 7 apresenta o resumo do logaritmo da concentração de degradação e logaritmo da concentração de mineralização do Amarelo com TiO2 Nesta figura se pode observar como o ensaio 7 é o que apresenta maior brinco ñas linhas retas.
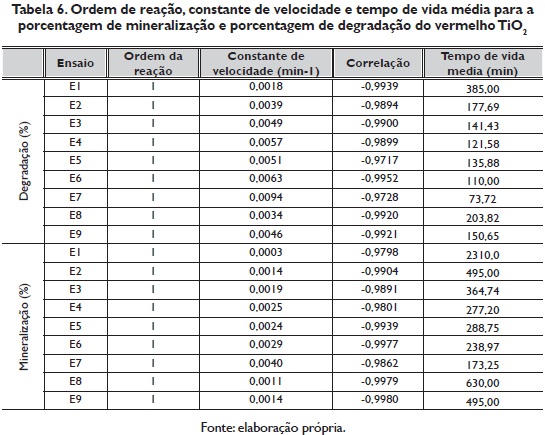
O ordem da reação, a constante de velocidade e o tempo de vida média para cada um dos ensaios realizados na porcentagem de degradação e porcentagem de mineralização do vermelho TIO2, observam-se na tabela 6. Segundo a constante de velocidade, a reação de degradação e mineralização do vermelho TIO2 mais rápida foi com o ensaio 7, com um tempo de vida médio de 73.72 e 173.25 minutos respectivamente.
Para determinar a combinação ótima entre TiO2 e H2O2 que maximizam a porcentagem de degradação e a porcentagem de mineralização, empregou-se a técnica de superfície de respostas por meio de um modelo fatorial 33.
Desenho fatorial 33
A análise de variância feito para o modelo fatorial 33, apresento diferenças significativas para cada um dos efeitos principais, e para a maioria de suas interações, (tabela 7).
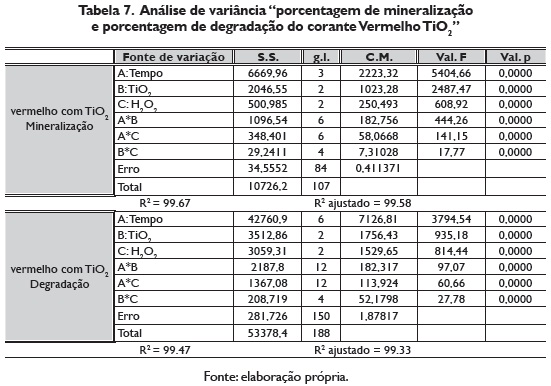
Com a metodología da brinco ascendente se obtiveram os valores dos fatores que otimizam cada uma das variáveis respostas (porcentagem de degradação e porcentagem de mineralização do vermelho com TiO2). O máximo em porcentagem de degradação e o máximo em porcentagem de mineralização se obtêm quando se combina 1.0 mL/L de H2O2, e 60 mg/L de TiO2, (figura 8).
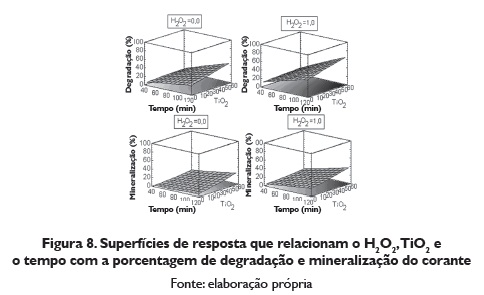
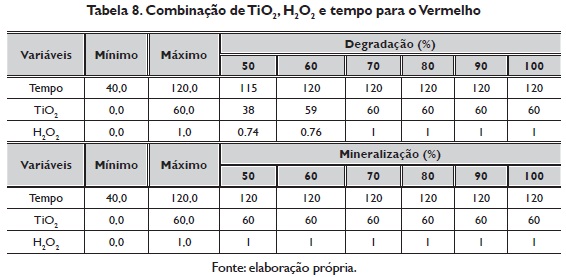
O máximo de porcentagem de degradação são estáveis em TiO2, H202 e tempo, com respeito à porcentagem de mineralização permanece constante nas variáveis TiO2, H2O2 e tempo constante desde o 80% (tabela 8).
Conclusões
Utilizou-se a metodologia da brinco ascendente para otimizar as variáveis resposta, a qual é uma técnica de otimização que tem como objetivo encontrar o e/ou os pontos que maximizam ou minimizam a equação de superfície de resposta. Este processo permite percorrer sequencialmente a trajetória da máxima ou a mínima brinco que conduz à direção do máximo ou do mínimo aumento da resposta.
Para o corante Vermelho Novactive F6BS (FeCl3 e TiO2); conclui-se que o corante degrada e mineraliza mais rapidamente com o FeCl3, isto sucedeu no ensaio E7 (60 mg/L FeCl3 e 1.0 mL/L de H2O2) , onde se obteve uma porcentagem de degradação do 76.2% e uma porcentagem de mineralização de 49.4%. Neste mesmo experimento foi onde se obteve os melhores resultados para a degradação e mineralização do corante com o TiO2.
Referências Bibliográficas
1. ZHAO, Wei; et al. Photodegradation of Sulforhodanine-B dye in plantinized titania dispersions under visible light irradiation: influence of platinium as a functional co-cotalyst. In: The journal of physical chemistry. 2002. Vol 16, No. 16. p. 5022-5028. [ Links ]
2. CHEN, Chuncheng; et al. Photocatalysis by Titanium Dioxide and Polyoxometalate/TiO2 Cocatalysts. Intermediates and Mechanistic Study. In: Enviromental Science & Technology. Ene. 2004. Vol. 38, No. 1, p. 329-337. [ Links ]
3. FRANCO C. Alexander y ORTIZ, Natalia. Manejo y tratamiento de los residuos líquidos de la facultad de ingenierías. Universidad de Antioquia. Departamento de Ingeniería Química, Medellín, 2000. 226 p. [ Links ]
4. NAOMI, L.; et al. Combinative sonolysis and photocatalysis for textile dye degradation. In: Environmental Sciencie-Technology. 2000. Vol. 34. p. 1747-1750. [ Links ]
5. LITTER, Marta; et al. Tratamiento de residuos nucleares líquidos por fotocatálisis heterogénea. Comisión Nacional de Energía Atómica, Unidad de Actividad Química. 2003. [ Links ]
6. ARROYAVE R., Joan; et al. Fotodegradación del pesticida mertect empleando fotofenton con lámpara de luz ultravioleta. En: Fotocatálisis y electrocoagulación para el tratamiento de aguas residuales: investigaciones y aplicaciones. Corporación Universitaria Lasallista. Caldas-Antioquia. 2007. [ Links ]
7. COZ, A. y VILLASEÑOR J. Tratamiento de efluentes fenólicos de la industria de la celulosa: procesos de oxidación avanzada. En: Ingeniería Química. Madrid. Ene 2003 Vol. 35, No 397. p. 104-114. [ Links ]
8. HERNANDEZ A., Marta Lucia y GARCES G., Luis F. Comparación de los tratamientos con TiO2 y FeCl3. En: Fotocatálisis y electrocoagulación para el tratamiento de aguas residuales: investigaciones y aplicaciones. Corporación Universitaria Lasallista. Caldas-Antioquia. 2007. [ Links ]
9. GELOVER, Silvia; MONDRAGÓN, Pedro y JIMÉNEZ, Antonio. Titanium Dioxide sol-Gel Deposited Over Glass and its Application as a Photocatalyst for Water Descontamination. In: Journal of Photochemistry and Photobiology A: Chem. 2004. Vol 165. No. 1-3. p. 241-246. [ Links ]
10. GIL PAVAS, Edison; et al. Foto-oxidación del sistema cromo hexavalente-4-clorofenol. En: Revista universidad EAFIT. Medellín. Vol. 39, No. 131 (Jul.- Sep. 2003); p 60-74. [ Links ]
11. HERNANDEZ A., Marta L. et al. Degradación de aguas residuales de la industria textil por medio de fotocatálisis. En: Revista Lasallista de investigación. Corporación Universitaria Lasallista. Vol. 2, No. 1 (Ene-Jun. 2005); p. 15-19. [ Links ]
12. HERNÁNDEZ A., Marta Lucía. Fotodegradación sensibilizada con TiO2 y Fe3+ del colorante Rojo Recoltive utilizando luz solar y lámpara de luz U.V. Tesis para optar al título de Maestría en Ingeniería Ambiental. Universidad Pontificia Bolivariana, Medellín. 2006. [ Links ]














