Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Producción + Limpia
Print version ISSN 1909-0455
Rev. P+L vol.8 no.2 Caldas July/Dec. 2013
Artículo original / Original article / Artigo original
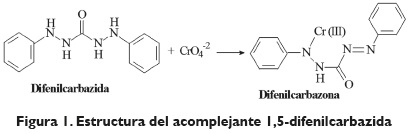
Estandarización de la difenilcarbazida como indicador y acomplejante en la identificación de cromo hexavalente - Cr (VI)*
Standardization of diphenylcarbazid as an indicator and a complexity factor in the identification of chromium hexavalent - Cr (VI)
Estandardização da difenilcarbazida como indicador e complexante na identificação de cromo hexavalente - Cr (VI)
Gloria María Doria Herrera**, Paulo Andrés Paz Ordoñez***, Angelina Hormaza Anaguano****
* Este artículo es derivado del proyecto de investigación titulado "Reutilizacion de la cascarilla de arroz modificada para la remoción de cromo", financiado por la Beca Jóvenes Investigadores de COLCIENCIAS en el año 2009.
** Química, magister en Ciencias Químicas. Docente Ocasional tiempo completo, Universidad Nacional Abierta y a Distancia UNAD de Colombia. E-mail: gloria.doria@unad.edu.co.
*** Ingeniero Quimico,Universidad Nacional de Colombia. E-mail: papaz@unal.edu.co.
**** Magíster en Química, PhD, Profesor Asociado Escuela de Química - Facultad de Ciencias, Universidad Nacional de Colombia - Sede Medellín - Colombia. Directora del Grupo de Investigación SIRYTCOR. E-mail: ahormaza@unal.edu.co.
Article received: 15/09/2013; Article approved: 30/10/2013
Resumen
Introducción. El tratamiento de aguas contaminadas con metales ha cobrado gran importancia en la historia, ya que su presencia no solo genera un desagradable impacto visual, sino que también afecta letalmente los ecosistemas. Uno de los metales más tóxicos y estables en solución es el Cr (VI); su identificación y cuantificación son de gran importancia igual que la remoción del mismo. Dentro de las técnicas de análisis, la colorimetría es una de las más económicas y eficaces en la identificación de este ión metálico en solución, gracias a la acción del acomplejante 1,5-difenilcarbazida que permite determinar con exactitud su presencia en solución. Objetivo. Establecer las mejores condiciones para la implementación de la 1,5- difenilcarbazida como agente acomplejante para la determinación de Cr (VI) en solución. Materiales y métodos. Las mejores condiciones de trabajo se evaluaron a través de la elaboración de las curvas de calibración, identificación de coeficientes de extinción, efecto del disolvente, límite de detección-cuantificación y cinéticas de degradación, luego de adición del acomplejante. Las determinaciones se realizaron por la técnica espectrofotometría de Uv-visible. Resultados. Las curvas de calibración mostraron resultados satisfactorios (99.11 %, 97.35 % y 99.17 %) con un 95 % de confiabilidad; el límite de detección determinado es de 0.096 ppm, y el límite de cuantificación es de 0.35 ppm, resultados bastante satisfactorios debido a la sensibilidad de la técnica; el efecto del disolvente con acetona, metanol y etanol mostró pequeños desplazamientos batocrómicos y buena correlación. Conclusión. La 1,5-difenilcarbazida es un adecuado agente acomplejante para la determinación del Cr (VI) en solución.
Palabras clave: difenilcarbazida, acomplejante, cromo, metales, cuantificación, espectrofotometría Uv-visible.
Abstract
Introduction. The treatment of water polluted with metals has gained a great importance in history, as the presence of such water not only generates a nasty visual impact, but also affects the ecosystems. One of the most toxic and stable metals in solution is Cr (VI). Its identification and quantification are very important, and so is its removal. Among the analysis techniques, colorimetry is one of the most economic and efficient to identify this metallic ion in solution, thanks to the action of the 1,5-diphenylcarbazid, which allows an exact determination of its presence in solution. Objective. To establish the best conditions to implement 1,5- diphenylcarbazid as a complexity agent to determine Cr (VI) in solution. Materials and methods. The best work conditions were assessed by elaborating the calibration curves, identification of extinction coefficients, effect of the dissolvent, detection-quantification limit and degradation kinetics, after the action of the complexity agent. The determinations were performed with the UV- visible spectrophotometry technique. Results. The calibration curves obtained satisfactory results (99.11 %, 97.35 % and 99.17 %) with 95 % of confidence. The detection limit determined is 0.096 ppm and the quantification limit is 0.35 ppm. These results are very satisfactory, given the sensibility of the technique. The effect of the dissolvent with acetone, methanol and ethanol showed small batochromic displacements and a good correlation. Conclusion. 1,5-diphenylcarbazid is an adequate complexity agent to determine Cr (VI) in solution.
Key words: diphenylcarbazid, complexity, chromium, metals, quantification, Uv-visible spectrophotometry.
Resumo
Introdução. O tratamento de águas contaminadas com metais cobrou grande importância na história, já que sua presença não só gera um desagradável impacto visual, senão que também afeta letalmente os ecossistemas. Um dos metais mais tóxicos e estáveis em solução é o Cr (VI); sua identificação e quantificação são de grande importância igual que a remoção do mesmo. Dentro das técnicas de análises, a colorimétrica é uma das mais econômicas e eficazes na identificação deste íon metálico em solução, graças à ação do complexante 1,5-difenilcarbazida que permite determinar com exatidão sua presença em solução. Objetivo. Estabelecer as melhores condições para a implementação da 1,5- difenilcarbazida como agente complexante para a determinação de Cr (VI) em solução. Materiais e métodos. Melhorar as condições de trabalho se avaliaram através da elaboração das curvas de calibração, identificação de coeficientes de extinção, efeito do solvente, limite de detecção-quantificação e cinéticas de degradação, depois de adição do complexante. As determinações se realizaram pela técnica espectrofotometria de Uv-visível. Resultados. As curvas de calibração mostraram resultados satisfatórios (99.11 %, 97.35 % e 99.17 %) com um 95 % de confiabilidade; o limite de detecção determinado é de 0.096 ppm, e o limite de quantificação é de 0.35 ppm, resultados bastante satisfatórios devido à sensibilidade da técnica; o efeito do solvente com acetona, metanol e etanol mostrou pequenos deslocamentos batocrômicos e boa correlação. Conclusão. A 1,5-difenilcarbazida é um adequado agente complexante para a determinação do Cr (VI) em solução.
Palavras importantes: difenilcarbazida, complexante, cromo, metais, quantificação, espectrofotometria, Uv-visível.
Introducción
El interés por el estudio de metales pesados como contaminantes en cuerpos de agua ha incrementa do en los últimos años debido a su naturaleza recalcitrante y su capacidad de bioacumulación en los seres vivos que conducen a graves afecciones tanto en animales y plantas como en la especie humana; metales como cadmio, plomo, cobre, níquel y cromo son producidos por industrias manufactureras, de pigmentos, cueros, pinturas y textiles, entre otras (Preetha, 2007, p.131; Marqués, 2000, p. 601). En particular, el cromo hexavalente es uno de los metales más tóxicos, y sus elevados niveles en el ambiente lo han convertido en una preocupación para la salud humana (Barnhart, 1997, p.3; Téllez, 2003). Este metal posee gran estabilidad en agua y muy en especial en su forma hexavalente.
Existen diversas técnicas analíticas utilizadas para la determinación de Cr (VI); pueden citarse la espectroscopia de adsorción atómica, con la ventaja de una buena sensibilidad en la determinación de metales (1 %); no obstante, la interferencia química debida a distintos procesos derivados de la atomización conduce una notable alteración de las características de la absorción del analito (Pantsar-kallio & Manninen, 1996, p. 89). Por su parte, la cromatografía iónica permite igualmente analizar elementos del orden de microgramos y generar mínimos volúmenes de desechos; sin embargo, la saturación de la columna por la presencia de compuestos orgánicos, agentes oxidantes y cloruros ocasiona cambios en la geometría de los picos de retención conducentes a falsos resultados (Pantsar-kallio & Manninen, 1996, p. 89; Standard Methods: Examination of Waste and Wastewater [APHA-AWWA] 1999).
La colorimetría es considerada uno de los procedimientos más sencillos, económicos y eficientes debido a la gran exactitud y precisión en la cuantificación de metales presentes en bajas concentraciones (> 0,1 mg/L) (Cascaret Carmenaty et al., 2010 p. 9). La presente investigación evaluó una serie de parámetros tales como tiempos óptimos de formación del complejo a través de la determinación de la concentración del acomplejante, concentración del metal bajo pH controlado, proporcionado por una solución buffer (HCl/NaCl), y la evaluación de la influencia de distintos solventes en la estabilidad y sensibilidad de dicho complejo que conducen al perfeccionamiento de la técnica basada en la utilización de la 1,5-difenilcarbazida como estándar primario para la cuantificación del ión Cr (VI). Para garantizar la exactitud en la medición, se utilizó un espectrofotómetro Perkin Elmer Lamba UV-Vis 35 de doble haz, de tal forma que se disponga de una técnica colorimétrica realmente sencilla, eficiente, económica y de gran exactitud para la cuantificación del ión Cr (VI).
Varios autores han reportado estudios acerca de la aplicación y versatilidad de la 1,5-difenilcarbazida como agente acomplejante (Ronald & Lester,1956 p.4862;Bremer et al.,2005 p.691) del ión metálico Cr (VI), tal como se evidencia en la reacción mostrada en la figura 1. No obstante, todos los trabajos datan de los años 50 y en ellos se evidencian algunas falencias tales como la pureza del reactivo, debido a que este era sintetizado; incluso, en algunos trabajos se utiliza una mezcla de 1,5-difenilcarbazida con 1,5-difenilcarbazona; asimismo, la sensibilidad de los equipos utilizados, espectrofotómetros de un solo haz, carencia del control en el valor del pH, situaciones que podían conducir a una descomposición del agente acomplejante; reactivos de naturaleza acídica de acceso limitado y, ante todo, la omisión del tiempo de contacto adecuado para la interacción del reactivo con la solución de Cr (VI) en la formación estable del complejo coloreado (Bremer et al., 2005 p. 691).
Materiales y Métodos
Preparación de la solución
Se preparó la solución madre de Cr(VI), disolviendo 14.14 mg de K2Cr2O7 en 100 mL de agua, lo que es equivalente a decir que en 1.0 mL de solución hay 50 μg de cromo.
En el caso de la difenilcarbazida, se disolvieron 150 mg de 1,5-difenilcarbazida patrón primario en 50 mL de acetona, y se almacenó la mezcla en un frasco oscuro con la finalidad de impedir la formación de productos secundarios con la acción de la luz; cuando la solución pierde su coloración se descarta (Romero et al., 2006 p. E-039; Muradiye & Uysal, 2007, p. 482).
Curvas de calibración y cuantificación
Las curvas de calibración se realizaron bajo el método de adición estándar agregando cantidades conocidas de la solución madre de cromo en el intervalo comprendido entre 0.1 y 4.0 ppm.
La adición de agente acomplejante fue de 20 μL para todo este ensayo. Estos ensayos se llevaron a cabo por triplicado para la evaluación estadística de sus resultados mediante el análisis de índices de correlación, análisis de varianzas y ANOVA.
Para la determinación del límite de cuantificación instrumental, se prepararon 10 blancos enriquecidos a la concentración más baja aceptada. Una vez preparadas las soluciones, se llevan a cabo las mediciones de cada una y posteriormente se calculan el promedio y la desviación estándar de cada grupo de datos (Manjeet et al., 2009, p. 312).
Para el análisis instrumental, se utilizó un espectrofotómetro Perkin Lambda-35 del Grupo SIRYTCOR de la Universidad Nacional de Colombia-Sede Medellín. Este equipo permitió medir la absorbancia de cada una de las soluciones acomplejadas que se obtuvieron, variando la concentración de Cr (VI) y el tiempo de espera para la medición. El análisis de las mediciones y las gráficas de calibración y absorción se obtuvieron con el software que tiene integrado el espectrofotómetro de absorción.
Evaluación de la influencia de variables
Para controlar del pH en todo el experimento, se utilizó una solución buffer (KCl/HCl) a pH de 1, ya que en otros estudios se ha evidenciado que la mejor coloración se logra en medio ácido, debido a la cantidad de protones que se encuentran en el seno de la solución y que facilitan la formación del complejo coloreado (Asociación Española de Farmacéuticos de la Industria [AEFI] 2001; Gupta & Babu, 2009, p. 352).
Para evaluar la influencia de la concentración del reactivo 1,5-difenilcarbazida en la estabilidad y sensibilidad del complejo, se realizó lectura de absorbancia cada 30 segundos durante un período comprendido entre cero y 10 minutos.
Para la determinación del efecto del disolvente en la estabilidad del indicador, se prepararon soluciones con 0.5 mg de 1,5-difenilcarbazida en 2.0 mL de metanol, etanol y acetona. A estas soluciones se les agregaron cantidades conocidas de Cr (VI) en un rango de 0.1 hasta 4.0 ppm o hasta que se conserve una tendencia lineal según calibraciones previas.
Resultados y discusión
Curvas de calibración
Las curvas de calibración se han usado en química analítica para determinar la concentración de un compuesto; se tiene como referente un patrón primario para la preparación de diluciones de concentración conocida, las cuales emitirán una absorbancia que da como consecuencia una gráfica matemáticamente lineal, la cual permitirá por interpolación para cuantificar muestras de concentración desconocidas. Esta relación se apoya a través de la ley de Beer-Lambert (Rubinson, 2000 cap. 3; Doria, 2012 p. 43).
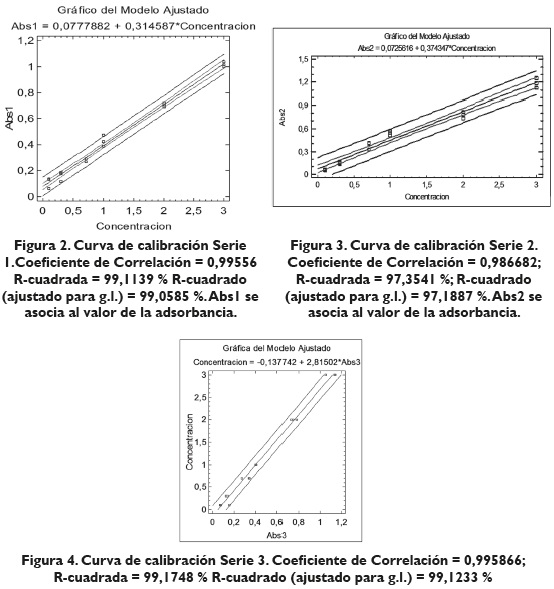
Inicialmente se presentan los resultados obtenidos al elaborar las curvas de calibración, al modificar la concentración de Cr (VI) dentro del rango lineal 0.1-3.0 ppm y usando 20 μL de agente acomplejante preparado en acetona, debido a que en la mayoría de la literatura consultada se hace mención a su estabilidad en acetona (Paz et al.,2010,p.57;Ardea-Torresdey et al.,2000,p.175).Para asegurar la confiabilidad de las gráficas, se les aplicaron tres curvas, y estas se evaluaron estadísticamente con ANOVA, análisis de residuales y correlación entre las series.
En las figuras 2, 3 y 4 se muestran las curvas de calibración asociadas a los experimentos realizados para determinar la curva con mejor ajuste:
Para la escogencia de esta curva, se tuvieron en cuenta los índices de correlación de las series y las varianzas, haciendo uso del paquete estadístico Statgraphics Centurion V15. La ecuación de la curva de calibración mostrada en la figura 4 es la siguiente:
A=0.3523C + 0.0524
Donde C es la concentración de cromo hexavalente en ppm, y A es la absorbancia obtenida por mediciones espectrofotométricas. Con la curva de calibración correcta, se prosigue con el análisis de estabilidad y con la validación del método espectrofotométrico que se está llevando a cabo (Dean & Beverly, 1958, p. 977).
Límite de detección instrumental (LDI) y límite de cuantificación instrumental (LCI)
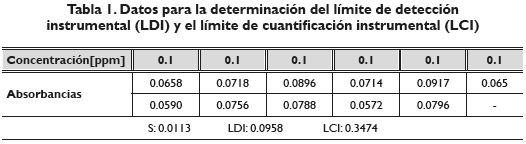
La determinación del límite de detección instrumental se construyó con la concentración más baja encontrada en la curva de calibración que fue a 0.1 ppm; de esta se hicieron doce réplicas para asegurar la veracidad del análisis. La resultados obtenidos para LDI y LCI se muestran en la tabla 1:
El valor de S, corresponde a la desviación estándar de los datos obtenidos del análisis químico. De los resultados alcanzados, se puede decir que el método puede detectar mediciones de absorbancia desde 0.096 ppm; este valor corresponde al LDI en la tabla mostrada, lo cual es inferior a la mínima concentración con la que se está trabajando el método, correspondiente a 0.1 ppm. El resultado de LCI confirma que el método cuantifica confiablemente la concentración de Cr (VI) en solución desde 0.35 ppm, lo cual es adecuado, ya que está dentro del rango lineal, dentro del cual se puede aplicar el método y en el cual se está estudiando la estabilidad y la formación del complejo de cromo hexavalente y difenilcarbazida (Dean & Beverly, 1958, p. 977; Rodríguez et al., 2002, p. 29).
Cinética de degradación
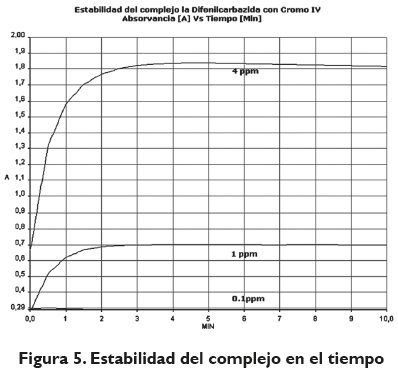
Las concentraciones de la solución de Cr (VI) fueron ajustadas a pH definidos con solución buffer, debido a que este ion metálico en solución tiene la capacidad de cambiar su estado de oxidación (Oliveros-Bastidas et al., 2009, p. 61). El pH óptimo de trabajo del agente acomplejante es de 1.0; por tanto, los análisis se realizaron a este pH.
Para determinar la estabilidad del complejo, se usó una de las aplicaciones del software integrado del espectrofotómetro Lambda 35, denominado Time Drive, con el que se siguió la estabilidad del complejo en un tiempo de 10 minutos, considerado como un tiempo máximo para que se dé la formación del complejo. Los resultados del análisis se muestran en la figura 5; se observa que luego de los 2 minutos de forma experimental se observa que en el caso de la concentración más baja (0.1 ppm), el complejo se forma a partir del segundo minuto después de adicionar el agente acomplejante; en el caso de la concentración intermedia correspondiente a 1 ppm, se aprecia que a partir del primer minuto el complejo empieza a formarse y se conserva estable al término de la prueba, es decir, después de los 10 minutos, por lo cual no se observa degradación; sin embargo, a la concentración más alta (4 ppm), se puede observar que la formación del complejo es casi inmediata,con una medida confiable dentro del segundo minuto; se logra evidenciar a las tres concentraciones analizadas que la formación del complejo conserva estabilidad hasta los 10 minutos; sin embargo, se pudo detectar que al pasar más de 20 minutos expuestos a la luz del ambiente, las muestras a concentraciones más bajas pierden la coloración, y a concentraciones más elevadas se intensifica el color púrpura, por lo que se supone la formación de otras especies en la muestra.
En caso del efecto del solvente, para la preparación del agente acomplejante y sus posibles cambios frente a la banda característica, se utilizaron tres disolventes: acetona, metanol y etanol. Inicialmente, se estudió la estabilidad del agente acomplejante con la acetona debido a que diversos autores (Barnhart, 1997, p. 3;Tflaum & Howick, 1956, p. 78) han reportado reproducibilidad y estabilidad del agente acomplejante; sin embargo, los elevados costos que representa el uso de este disolvente llevaron la investigación a probar su eficacia en solventes tales como el metanol y el etanol, que son asequibles y usados ampliamente en la industria.
En el caso de la acetona utilizada para la preparación de la 1,5-difenilcarbazida, el comportamiento que tiene la banda característica alusiva a la formación del complejo se evidencia a una longitud de ondas alrededor de los 540 nm acorde a lo reportado en la literatura.
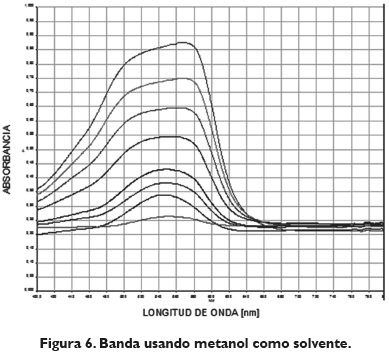
Se hizo un siguiente análisis en condiciones iguales de operación, tal cual como se hizo en el caso de la acetona; se puede observar en la figura 6 una disminución considerable en la intensidad o absorbancia (0.65 a 3 ppm) y una banda a aproximadamente 550 nm que experimenta un desplazamiento batocrómico a medida que se incrementa la concentración del ion metálico hasta una longitud de onda de 570 para una concentración de 3 ppm:
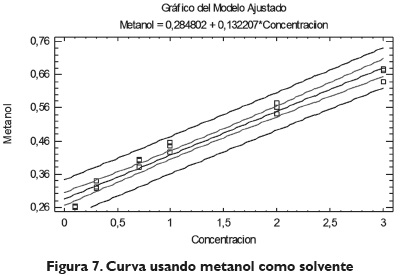
Para determinar el coeficiente de extinción usando este solvente obtenemos la figura 7 con las siguientes características:
Esta curva usada para el análisis con metanol obtuvo una correlación 98 %, la cual se considera aceptada para su utilización en la determinación de concentraciones.
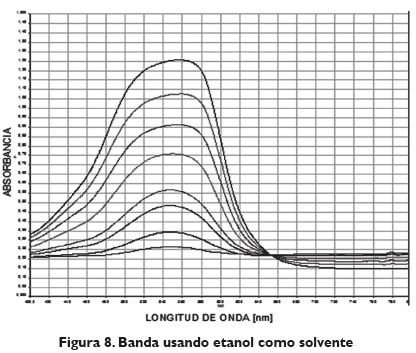
En el caso del uso del etanol, solvente ampliamente usado en la industria, se evidencia un desplazamiento batocrómico en el pico de formación del complejo, hacia 560 nm. La banda presenta absorbancias mayores con respecto al espectro del metanol, debido a la polaridad del solvente, ya que el metanol por su alta polaridad puede estar originando una disminución en las señales, lo cual se traduce en que el complejo se forma con mayor facilidad cuando el solvente no es polar, tal como se muestra en la figura 8.
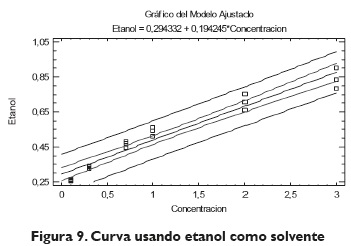
Se observó que la banda característica del etanol es la más alta entre los tres solventes; luego sigue la banda de la acetona, y finalmente, la del metanol; esta banda sugiere la facilidad y rapidez del proceso de formación del complejo; cuando la banda de absorbancia es alta, se considera que la formación del complejo se lleva a cabo más rápido, lo que para concentraciones bajas resulta adecuado, ya que los tiempos de espera que se deben tener van a ser menores.Ahora, el rango de concentraciones con el que se trabajó (0,1-5) se puede considerar medio, ya que la concentración mayor que se logra en el rango lineal es de 3 ppm; por tanto, los tiempos de formación del complejo serían relativamente cortos; se evidencia la curva en la figura 9.
Ahora bien, si lo que se necesita es llevar a cabo una medición confiable, con un proceso de acomplejamiento adecuado, el solvente más estable es la acetona, ya que el tiempo de reacción disponible es un poco más prolongado brindando mayor tiempo para que la muestra no se degrade y, por tanto, se eviten errores en la medición de absorbancia. Por esta razón, y a pesar de que el etanol resulta adecuado para llevar a cabo la detección de Cromo (VI), en un análisis de laboratorio la acetona es el solvente seleccionado debido a la estabilidad ofrecida. Por otro lado, el aspecto lineal que debe conservar la línea de tendencia de la absorbancia del complejo es un factor determinante para la elección del mejor solvente. En este sentido, la acetona presenta un comportamiento lineal más amplio en comparación con los solventes metanol y etanol analizados, atribuyéndole mayor confiabilidad a este solvente.
Conclusiones
Las curvas de calibración mostraron resultados satisfactorios, como lo indica el análisis estadístico al que fueron sometidas; en general, los índices de correlación de las curvas son altos (99.11 %, 97.35 % y 99.17 %) y se escogió el mayor ajuste correspondiente a la serie 3, tomando este criterio como referencia debido a que estadísticamente son confiables las tres curvas.
El límite de detección instrumental (0.096 ppm) muestra que la técnica espectrofotométrica que se aplicó es válida, ya que detecta concentraciones inferiores a la mínima con la que se trabajó en el proyecto de investigación (0.1 ppm). Por otro lado, el Índice de cuantificación instrumental muestra que la técnica es válida para concentraciones bajas, próximas a 0.35 ppm. Este resultado es satisfactorio, ya que la concentración está dentro del rango de trabajo y representa una concentración muy baja.
El estudio de la formación del complejo ayudó a mejorar la medición de las soluciones, ya que al considerar los tiempos adecuados relacionados directamente con la concentración, se determinaron absorbancias similares en experimentos diferentes, lo que beneficia la repetibilidad y reproducibilidad de la técnica espectrofotométrica usada en este trabajo.
La relación directa que presenta la concentración de las soluciones con la velocidad de formación del complejo nos da un parámetro cualitativo sobre el grado de contaminación que tiene una muestra problema, ya que las que estén muy contaminadas se van a colorear más rápido y presentarán un intenso color comparadas con las de baja contaminación. Ahora, para determinar cuantitativamente las muestras, se debe hacer análisis en el laboratorio o usar estándares colorimétricos previamente cuantificados.
La acetona es el solvente más común, ya que la difenilcarbazida se solubiliza fácilmente y las mediciones de absorbancia que se obtienen se localizan en 540 nm, que es donde debe ser evidente la formación del complejo, usando como solvente acetona por su estabilidad; sin embargo, el metanol o etanol presenta buenas características; por la buena solubilidad se pueden usar como posibles solventes teniendo en cuenta el porcentaje de desviación relativa del método.
Agradecimientos
A la Universidad Nacional de Colombia, Sede Medellín y la Dirección de Investigación de la Sede Medellín, DIME, por el respaldo económico a través de la beca de Jóvenes Investigadores e Innovadores en asocio con COLCIENCIAS, año 2009 y al proyecto Código 1118-489-25228 patrocinado por COLCIENCIAS.
Referencias bibliográficas
Asociación Española de Farmacéuticos de la Industria - AEFI. (2001). Validación de Métodos analíticos. Barcelona:AEFI. [ Links ]
APHA-AWWA. (1999). Standard Methods: Examination of Waste and Wastewater. APHA. [ Links ]
Ardea-Torresdey, J.; Tiemann, K.; Armendariz; V.; Bess-Oberto; L.; Chianelli; R.; Rios, J.; Parsons, J. & Gamez, G. (2000). Characterization of Cr(VI) binding and reduction to Cr(III) by the agricultural by products (oat) biomass. J. Hazard. Mater, p. 175-188. [ Links ]
Barnhart, J. (1997). Ocurrences, Uses, and Properties of Chromium. Regulatory and Toxicology and Pharmacology, 26, p 3-7. [ Links ]
Bremer, H.; Fessel, C.; PezzatoIII, L. & PadovaniI, C. (2005). The spectrophotometric method on the routine of 1,5-diphenylcarbazide was adjusted on chromium determination in feces, after its utilization as a biological marker as chromium (III) oxide. Cienc. Rural, 35, p. 691-697. [ Links ]
Cascaret, D.; Pérez, R.; Aguilera, I. y Calzado, O. (2010). Validación interna del método espectofotométrico por adecuación, para la determinación de cromo (VI) en aguas residuales. Revista Cubana de Química, 3, p. 9-13. [ Links ]
Dean, J. A. & Beverly, M. L. (1958). Extraction and Colorimetric Determination of Chromium with 1, 5-Diphenylcarbohydrazide. Anal. Chem., 30, p. 977-979. [ Links ]
Doria, G. (2012). Validación de métodos analíticos: estrategias para asegurar la veracidad del análisis químico. Cuaderno de Investigaciones ZAO, 6 p., 43-47. [ Links ]
Gupta, S. & Babu, B. (2009). Removal of toxic metal Cr(VI) from aqueous solutions using sawdust as adsorbent: Equilibrium, kinetics and regeneration studies. Chem. Eng. J., 150 p. 352-365. [ Links ]
Manahan, S. (1994). Biosorption of heavy metals. Biotechnol. Prog., 11, p. 235-250. [ Links ]
Manjeet, U. & Diwan, V. (2009). Removal of Cr(VI) from aqueous solutions using pre-consumer processing agricultural waste:A case study of rice husk. J. of Hazard. Mater, 162, p. 312-320. [ Links ]
Marqués, M.; Salvador, A.; Morales, A.& De La Guardia, M.(2000). Chromium speciation in liquid matrices: a survey of the literature, Fresen. J. Anal. Chem., 367, 601-613. [ Links ]
Muradiye, I. (2007). Removal of Cr(VI) from industrial wastewaters by adsorption Part I: Determination of optimum conditions. J. Hazard. Mater, 149 p. 482-491. [ Links ]
Oliveros, A.; Carrera, C. y Marín, D. (2009). Estudio por espectrofotometría uv-visible de la reacción entre los iones cianuro y picrato. Un ejemplo práctico de aplicaciones analíticas y estudios cinéticos. Rev.Colomb.Quim, 38(1), p. 61-82. [ Links ]
Paz, P.; Hormaza, A. y Doria, G. (2010). Estudio de la estabilidad de difenilcarbazida como indicador y acomplejante en la identificación de Cromo VI. Memorias CLAQ, p. 57. [ Links ]
Pflaum, R. & HOWICK, L. (1956). The Chromium- difenilcarbazide Reaction. Am. Chem. Soc., 78, p. 4862-4866. [ Links ]
Preetha, B. & Viruthagiri, T. (2007). Bioaccurnulation of chromium(VI), copper(II) and nickel(II) ions by growing Rhizopusarrhizus. Biochem. Eng. J., 34(2), 131. [ Links ]
Pantsar, K. & Manninen, M. (1996). Speciation of chromium in wastewaters by coupled column ion chromatography-inductively coupled plasma mass spectrometry. Journal of Chromatography, 750(1-2), p. 89-95. [ Links ]
Romero, C.; Pellerano, R.; Acevedo, H. y Vázquez, F. (2006). Estandarización condiciones preliminares para la determinación de cromo en muestras ambientales. Comunicaciones Científicas y tecnológicas, Universidad Nacional de Nordeste; E- 039. [ Links ]
Ronald, T. & Lester, C. (1956). The Chromium-Diphenylcarbazide Reaction 1. Anal. Chem., 78, p. 4862-4866. [ Links ]
Rubinson, J. 2000. Análisis Instrumental. Capítulo 3 y 4. España: Editorial Prentice Hall. [ Links ]
Rodríguez, C.; Gómez, H. y Reátegui, S. (2002). Estudio de la sensibilidad espectrofotométrica del cromo (III) y el cromo (VI). Revista Peruana de Química e Ingeniería Química, 5(1), p. 29-36. [ Links ]
Téllez, M.; Carvajal, R. y Gaitán, A. (2003). Aspectos toxicológicos relacionados con la utilización del cromo en el proceso productivo de Curtiembres. Rev. Fac. de Med. Univ. Nal de Colombia, 52(1), 50-61. [ Links ]