Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Producción + Limpia
Print version ISSN 1909-0455
Rev. P+L vol.8 no.2 Caldas July/Dec. 2013
Artículo original / Original article / Artigo original
Degradación fotolítica del carbofurano en aguas del río Ríonegro y en agua ultrapura bajo diferentes condiciones de pH*
Hotolytic degradation of carbofuran in waters from the Rionegro river and in ultra-pure water under different pH conditions
Degradação fotolítica do carbofuran em águas do rio Ríonegro e em água ultrapura sob diferentes condições de pH
Claudio Jiménez Cartagena**, Ana Liliana Giraldo Aguirre***, Daniel Esteban León Pérez****, Gustavo Antonio Peñuela Mesa*****
* Artículo derivado de la tesis de doctorado titulada "Determinación de la residualidad de pesticidas en frutas, pulpas de frutas y agua", tesis desarrollada entre los años 2005 - 2011 y financiada por el grupo GDCON de la Universidad de Antioquia y Colciencias.
** Químico Farmacéutico, magister en Ciencias Básicas Biomédicas Subespecialidad Bioquímica. Doctor en Ingeniería. Director del Grupo de Investigación GAMA de la Corporación Universitaria Lasallista, Caldas - Antioquia, Colombia. E-mail: clajimenez@lasallistadocentes.edu.co.
*** Química Farmacéutica, magister en Ciencias Ambientales con énfasis en Desarrollo Sostenible, estudiante de doctorado en Ciencias Farmacéuticas y Alimentarias. Docente de la Universidad de Antioquia, Medellín - Colombia. E-mail: anagiraldo595@hotmail.com.
**** Ingeniero de Alimentos, estudiante de Maestría en Ciencias Farmacéuticas y Alimentarias. Investigador de la Corporación Universitaria Lasallista, Caldas - Antioquia, Colombia. E-mail: deleonp86@gmail.com.
***** Químico, especialista en Gestión Ambiental Municipal, magister en Ciencias Químicas. Doctor en Química Ambiental. Docente investigador de la Universidad de Antioquia, Medellín - Colombia. E-mail: gpenuela@udea.edu.co.
Artículo recibido: 21/07/2013; Artículo aprobado: 30/10/2013
Resumen
Introducción. El uso de pesticidas en la agricultura ha generado importantes impactos: por un lado, el incremento de la productividad agrícola; por otro lado, una fuente importante de contaminación ambiental, hecho que ha concienciado hacia el estudio de la dinámica de estos contaminantes en el ambiente y en las posibles maneras para su degradación. Objetivo. El objetivo de este artículo fue estudiar la fotólisis del carbofurano en aguas de confluencia a los cultivos en el Oriente Antioqueño utilizando simulador de radiación solar, ensayos de toxicidad y determinación por cromatografía líquida con detector ultravioleta con arreglo de diodos. Materiales y métodos. Para establecer las mejores condiciones de degradación fotolítica se empleó un diseño factorial 3x2x2, evaluando tres variables: pH (5, 7 y 9), tipos de agua (agua ultapura y agua superficial) y concentración de carbofurano; el factor de respuesta definido fue el porcentaje de degradación. Resultados. Como resultado se observa que a medida que aumenta el pH, el porcentaje de degradación del carbofurano es más significativo, mostrando un 30 % y 20 % de degradación a pH 9 durante 90 minutos de irradiación en agua ultrapura y agua superficial, respectivamente. Se observa, además, que bajo condiciones naturales de pH del agua superficial representada por el agua del río Ríonegro, los porcentajes de remoción cuando se irradia una muestra que contiene 10 mg L-1 y 30 mg L-1, se obtienen, respectivamente, 9, 5 % y 21 % de degradación, indicando que a bajas concentraciones de carbofurano el efecto del pH neutro tiende a ejercer una menor influencia sobre la degradación. Conclusiones. Los procesos fotolíticos como mecanismos de degradación primaria en el ambiente presentan una contribución significativa a la degradación del carbofurano cuando este se encuentra a concentraciones relativamente altas; para el caso de las aguas del rio Río Negro ni la presencia de materia orgánica disuelta ni un valor pH neutro presentaron efecto sobre la degradación del carbofurano; no obstante, valores de pH básicos o ácidos tienden a aumentar la degradación del carbofurano.
Palabras clave: carbofurano, plaguicida, degradación, contaminación, fotólisis.
Abstract
Introduction. The use of pesticides in agriculture has generated important impacts: on one side, the increase of agricultural production and, on the other, a big source of environmental pollution. This fact has brought the consciousness of the importance of studying the dynamics of such pollutants in the environment and the possible alternatives to degrade them. Objective. To study the carbolysis of carbofuran in waters confluent to the crops from the East of Antioquia, by the use of a sun radiation simulator, toxicity tests and determination through liquid chromatography -with an ultra-violet detector with a diode array-. Materials and methods. To establish the best photolytic degradation conditions a 3x2x2 factorial design was used, evaluating three variables: pH (5, 7 and 9), types of water (ultra-pure and surface water) and carbofuran concentration. The response factor defined was de degradation percentage. Results. As pH increases the carbofuran's degradation percentage is more significant, with 30% and 20% of degradation at a pH of 9 during 90 minutes of irradiation in ultra-pure water and surface water, respectively. It can also be seen that under natural pH conditions -represented by water from the Ríonegro river- the removal percentages of a 10 mg L-1 and 30 mg L-1 samples, when irradiated, 9, 5% and 21% of degradation are respectively obtained, which means that with low carbofuran concentrations the effect of neutral pH tends to have a lower influence on the degradation. Conclusions. The photolytic processes as primary degradation mechanisms in the environment have a significant contribution to the degradation of carbofuran when this carbofuran is at relatively high concentration rates. For the Rio Negro river waters, neither the dissolved organic matter nor a neutral pH value, had an effect on the carbofuran's degradation. Nevertheless, basic or acid pH values tend to increase the degradation of the carbofuran.
Key words: carbofuran, pesticide, degradation, contamination, photolysis.
Resumo
Introdução. O uso de pesticidas na agricultura gerou importantes impactos: por um lado, o incremento da produtividade agrícola; mas, por outro lado, uma fonte importante de contaminação ambiental, fato que conscientizou para o estudo da dinâmica destes contaminantes no ambiente e nas possíveis maneiras para sua degradação. Objetivo. O objetivo deste artigo foi estudar a fotólise do carbofuran em águas de confluência aos cultivos no Oriente Antioquenho utilizando simulador de radiação solar, ensaios de toxicidade e determinação por cromatografia líquida com detector ultravioleta com arranjo de diodos. Materiais e métodos. Para estabelecer as melhores condições de degradação fotolítica se empregou um desenho fatorial 3x2x2, avaliando três variáveis: PH (5, 7 e 9), tipos de água (água ultapura e água superficial) e concentração de carbofuran; o fator de resposta definido foi a percentagem de degradação. Resultados. Como resultado se observa que à medida que aumenta o PH, a percentagem de degradação do carbofuran é mais significativo mostrando um 30 % e 20 % de degradação a PH 9 durante 90 minutos de irradiação em água ultrapura e água superficial, respectivamente. Observa-se, ademais, que sob condições naturais de PH da água superficial representada pela água do rio Ríonegro, as porcentagens de remoção quando se irradia uma mostra que contém 10 mg L-1 e 30 mg L-1, obtêmse, respectivamente, 9, 5 % e 21 % de degradação, indicando que a baixas concentrações de carbofuran o efeito do PH neutro tende a exercer uma menor influência sobre a degradação. Conclusões. Os processos fotolíticos como mecanismos de degradação primária no ambiente apresentam uma contribuição significativa à degradação do carbofuran quando este se encontra a concentrações relativamente altas; para o caso das águas do rio Rio Negro nem a presença de matéria orgânica dissolvida nem um valor PH neutro apresentaram efeito sobre a degradação do carbofuran; não obstante, valores de PH básicos ou ácidos tendem a aumentar a degradação do carbofuran.
Palavras importantes: carbofuran, pesticidas, degradação, contaminação, fotólise.
Introducción
El amplio uso de pesticidas en toda la industria de la agricultura ha resultado en importantes impactos: de un lado, la utilización de los pesticidas produce un enorme incremento en la productividad agrícola, pero, de otro, debido a su naturaleza peligrosa, los desechos y derrames provenientes de su uso, y del remanente en equipos de aspersión y almacenamiento, han sido fuente de contaminación. Asimismo, la extensa contaminación de suelos con estos compuestos puede determinar la transferencia de estas sustancias peligrosas en otros medios tales como aguas subterráneas y aguas superficiales, incluso, pueden presentarse en suministros de agua de consumo al ser transportadas fuera del sitio de acción y entrar en las aguas superficiales (Arias et al., 2008).
En los últimos años, la importancia de la alteración no biológica (abiótica) en la degradación de los pesticidas ha sido ampliamente estudiada y ha estimulado una gran cantidad de investigaciones concernientes a los mecanismos de degradación, cinética, aislamiento y toxicidad, tanto de los compuestos padre como de los productos de degradación.Transformaciones tales como la degradación microbiológica, la química o la fotoquímica son reconocidas como procesos significativos en determinar el destino y transporte de los pesticidas en el ambiente (Arbeli & Fuentes, 2007; Devipriya & Yesodharan, 2005).
De la misma manera se ha reconocido que la materia orgánica disuelta, ubicuamente presente en suelos y aguas superficiales, juega un importante papel en lo que respecta a la descomposición de los pesticidas, dado que interacciones entre esta y las sustancias químicas han mostrado enlentecer los procesos de degradación, por una parte, mientras que, por otra, la materia orgánica es la primera especie que absorbe luz en el agua superficial;como resultado, reacciones fotoquímicas que toman lugar en este medio pueden influir relevantemente en la descomposición fotoquímica de los pesticidas, la cual representa una importante vía de transformación en las aguas superficiales y en el suelo para estos compuestos (Bachman & Patterson, 1999).
Mucha atención ha sido orientada al carbofurano, insecticida de amplio espectro con alta toxicidad, el cual, se sabe, es un insecticida más persistente que otros carbamatos u organofosforados. El carbofurano (2, 3-dihidro-2, 2-dimetilbenzofuran-7-il metilcarbamato), es un inhibidor de la acetilcolinesterasa, su LD50 oral es 11 mg kg-1 de peso corporal en ratas comparado con 8 mg/kg para el paratión extremadamente tóxico y 1, 300 mg kg-1 para la atrazina, un herbicida de moderada toxicidad (Kuhr & Dorough, 1976).
Es conocido que el carbofurano y sus metabolitos son altamente solubles en agua 0.7 mg ml-1 para el primero, y su estabilidad bajo ciertas condiciones ambientales (vida media en suelos de 150 días) constituye un riesgo para la contaminación, tanto de aguas superficiales como subterráneas (Detomaso, Mascolo & Lopez, 2005). La continua presencia de carbofurano en canales de agua y ríos puede causar severos daños sub-letales y crónicos a los organismos acuáticos (de Melo Plese, Paraiba, Foloni, & Pimentel, 2005), cuya presencia en estos sitios se debe al amplio uso de este compuesto en los cultivo de maíz, arroz, algodón y otros, como un sustituto de los pesticidas organoclorados debido a su más alta biodegradabilidad (Kuhr & Dorough, 1976).
Los valores medidos experimentalmente de coeficientes de partición de carbono orgánico (Koc), en el rango de 14 a 160 indican que el carbofurano se filtrará significativamente en la fase acuosa; la volatilización del suelo no se espera que sea significativa, aunque puede ocurrir algún tipo de evaporación de las plantas, y han sido reportados tiempos de vida media de este compuesto en el agua en un rango de 690 semanas a pH 5 y una semana a pH 8; estudios previos han demostrado que a condiciones alcalinas el carbofurano presenta vidas medias generalmente más pequeñas que a pH más bajos; probablemente se debe a que es una amida que se protona y desportona (valores de Kb) y, por lo tanto, lo hace vulnerable a la hidrólisis alcalina (Chapman & Cole, 1982). De igual forma, el carbofurano puede sufrir hidrólisis ácida y neutra, siendo inestable bajo condiciones en alcalinas y con la aplicación de la fotólisis directa, al igual que la fotooxidación (vía radicales hidroxilo), lo que puede contribuir a las transformaciones del carbofurano en aguas naturales (Hua & Pfalzer-Thompson, 2001).
En este estudio se examinó el comportamiento fotoquímico del carbofurano al estar disuelto en dos diferentes tipos de agua bajo diferentes valores de pH, y ser tratado con luz solar mediante un simulador solar. De esta manera, el efecto del pH y los diferentes tipos de agua fueron investigados para determinar la incidencia sobre la fotodegradación del pH y la materia orgánica presente, empleando como medio de reacción agua ultrapura (agua MilliQ) y agua superficial obtenida del río Ríonegro del municipio de Rionegro Antioquia bajo diferentes concentraciones del compuesto. Por otra parte, fue investigada la capacidad de degradación y mineralización fotolítica sobre el carbofurano en agua a condiciones naturales, empleando como fuente de radiación un simulador solar y en presencia de la materia orgánica que se encuentra en el medio natural, dado que es reconocido que el ácido húmico y nitratos encontrados en el ambiente acuático algunas veces pueden inducir la fotodegradación (Lesce et al., 2006), motivo por el cual es importante determinar la contribución a la degradación del carbofurano del agua natural.
Materiales y métodos
Reactivos
Carbofurano grado Pestanal® (99.90 %) fue obtenido de sigma-aldrich y usado sin purificación posterior. El acetonitrilo (grado HPLC) fue obtenido de Merck, el Hidróxido de sodio 0, 1 M y el ácido clorhídrico 0, 5 M, ambos de Merck fueron usados para ajustar pH. El ftalato ácido de potasio fue obtenido de Carlo Erba y el Vibrio fischer para las pruebas de toxicidad fue obtenido de Strategic diagnostic Inc.
Las muestras fueron preparadas, por una parte, empleando agua ultrapura, la cual fue obtenida pasando agua de ósmosis inversa a través de un sistema Nanopure II de Millipore para obtener agua MilliQ. Por otra parte, se prepararon muestras empleando agua superficial proveniente del rio Ríonegro del municipio de Rionegro en el Oriente Antioqueño.
Diseño experimental
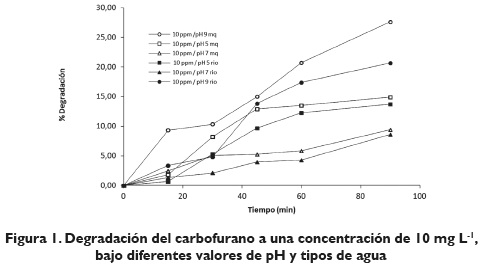
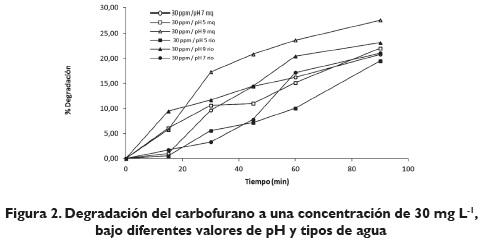
Un diseño factorial 3x2x2 fue usado para establecer las mejores condiciones de pH de la reacción y tipo de agua que procuraron las mayores degradaciones a dos diferentes concentraciones de carbofurano. El diseño factorial con 3nx2n (n=1 y n=2, respectivamente) experimentos, se describe en la tabla 1.
En el diseño factorial de degradación fotolítica del carbofurano se ensayaron tres variables analizando tres siguientes valores de pH (5, 7 y 9, dos diferentes tipos de agua (agua MilliQ y agua superficial) y dos diferentes concentraciones de carbofurano (10 y 30 mg L-1). El factor de respuesta fue definido como el porcentaje de degradación del carbofurano después de 90 minutos de irradiación en simulador solar SuntestCps+, con lámpara de xenón.
Los datos fueron analizados usando el software statgraphics centurion. La validez estadística del sistema fue determinada mediante el método estadístico anova con un nivel de confianza del 95 %.
Sistema fotolítico
Para estudiar el efecto de diferentes factores en la degradación fotolítica del carbofurano se llevó a cabo la reacción en una botella de borosilicato (120 mL) que contenía 100 ml de solución de carbofurano a diferentes concentraciones (10 y 30 mg L-1), diferentes valores de pH (5, 7 y 9) y diferentes tipos de agua (agua MilliQ y agua superficial) como se describe en el diseño experimental presentado en la tabla 1. La solución fue sometida a irradiación en un equipo suntestcps+ (Atlas) (300-800 nm, Xe lamp, 250 W m-2), bajo agitación magnética constante y suministro de oxígeno contenido en el aire. El muestreo fue llevado a cabo a intervalos de tiempo específicos empleando una jeringa de 5 mL conectada al reactor mediante un tubo de teflón, tomando 2 mililitros cada vez. Las muestras obtenidas fueron analizadas mediante un cromatógrafo líquido Agilent 1100 de Agilent Technologies.
De otro lado, para estudiar la degradación de carbofurano a condiciones normales de pH en agua superficial se somete una muestra a degradación bajo irradiación en un equipo suntestcps+ de Atlas (300 nm a 800 nm, lámpara de xenón de 250 W m-2), agitación magnética constante y suministro de oxígeno contenido en el aire. El seguimiento a la degradación y mineralización se realiza mediante cromatógrafo líquido agilent 1100, carbono orgánico total en un analizador O. I. Analytical 1010 TOC y la toxicidad mediante Biolumix.
Análisis de las soluciones degradadas
El análisis de la remoción de carbofurano fue realizado mediante un cromatógrafo líquido (HPLC) Agilent 1100 el cual fue usado para cuantificar las muestras de los experimentos de fotólisis. El detector empleado fue un detector de arreglo de diodos UV-vis DAD G1315B; las separaciones fueron realizadas en una columna C-18 de phenomenex 150mm x 4.6 mm, 5um de tamaño de partícula. Las muestras fueron inyectadas mediante un automuestreador Agilent G1329A modelo 1200. El volumen de inyección fue de 20 μL. El flujo fue de 1 ml min-1 para todos los experimentos. La fase móvil empleada fue de 70 % agua, 30 % acetonitrilo. La longitud de onda de detección fue de 278 nm.
La mineralización de las muestras de carbofurano a condiciones normales fue realizado usando un analizador O.I.Analytical 1010 TOC con una solución de ftalato ácido de potasio como estándar de calibración, la acidificación antes del análisis fue realizado para mantener las soluciones libres de CO2 atmosférico.
Prueba de toxicidad
La toxicidad de las soluciones tratadas se determinó mediante la medición de la CE50 sobre Vibrio fisheri con un instrumento biofix® Lumi-10; la fundamenta en el monitoreo de los cambios en las emisiones de luz natural de una bacteria luminiscente (Photobacteriumphosphoreum); en donde la reacción de bioluminiscencia está asociada al transporte de electrones, de tal modo que una disminución de la bioluminiscencia indica la disminución de la respiración celular. Los xenobióticos alteran la respiración celular modificando el porcentaje de síntesis de proteínas y lípidos y, por ende, el nivel de emisión de luminiscencia; por lo anterior, en presencia de agentes contaminantes, la bioluminiscencia natural de Vibrio fischeri disminuye y la toxicidad se expresa como concentración efectiva 50 (CE50): concentración del agente contaminante que produce una reducción del 50 % en la emisión de luz inicial (Jennings, Rayner-Brandes & Bird, 2001; Johnson, 2005).
Resultados y discusión
Efectos del pH y del tipo de agua en la degradación
La determinación de la influencia de los cambios de pH sobre el porcentaje de degradación del carbofurano, así como la influencia de diferentes tipos de agua correspondientes a agua ultrapura sin presencia de iones, nitratos o materia orgánica disuelta que pueda interferir en la degradación, frente a un agua que contenga dichos componentes (como lo es el agua superficial) son mostradas en las figuras 1 y 2 para dos diferentes concentraciones de carbofurano, 10 y 30 mg L-1, respectivamente. De las figuras 1 y 2 se observa que a medida que aumenta el pH, el porcentaje de degradación del carbofurano es más significativo mostrando un 30 % de degradación a pH 9 durante 90 minutos de irradiación en agua ultrapura, y 20 % de degradación en agua superficial, mientras se produce un 15 % de degradación a pH 5 en agua ultrapura y 14 % de degradación en agua superficial durante el mismo período de tiempo para una concentración de 10 mg L-1, lo que confirma los resultados descritos por Chapman & Cole (1982), quienes establecen que el carbofurano posee tiempos de vida media menores a valores de pH alcalinos.
La figura 2 muestra que al aumentar la concentración de carbofurano bajo las mismas condiciones, un 25 % de degradación se produce a pH 9 en agua ultrapura, y 20 % de degradación en agua superficial, mientras que a pH 5 se produce un 20 % de degradación en agua ultrapura y 18 % de degradación en agua superficial durante 90 minutos de irradiación bajo simulador solar a una concentración de 30 mgL-1; de acuerdo con estos resultados la degradación del carbofurano es levemente influenciada por la concentración y por el pH; no obstante, bajo condiciones naturales, pH 7 principalmente, efectos más marcados son presenciados frente a la degradación del carbofurano. De las figuras 1 y 2 se observa que bajo condiciones naturales de pH del agua superficial (representada por el agua del río Río Negro a pH 7), los porcentajes de remoción cuando se irradia la muestra que contiene 10 mg L-1 y 30 mgL-1 de carbofurano, con una lámpara de xenón en simulador solar una muestra, se obtienen, un porcentaje de degradación de 9, 5 % y 21, respectivamente, esto indica que a bajas concentraciones de carbofurano el efecto del pH neutro tiende a ejercer una menor influencia sobre la degradación que a altas concentraciones. Esta situación puede deberse a que a este valor de pH las cinéticas de degradación presentan un comportamiento de primer orden, e indican que la concentración ejerce una influencia sobre la degradación. Se presenta, entonces, una degradación más pronunciada; a mayores concentraciones no se producen los fenómenos de hidrólisis alcalina a la cual es altamente sensible el carbofurano; no obstante, al presentarse mayores concentraciones de carbofurano, se observó una mayor degradación, lo cual puede deberse a su alto valor de pka (11.90), el cual puede favorecer un entorno alcalino que facilita los fenómenos de hidrólisis. Comparando los resultados del control con agua ultrapura, se observan remociones en esta última de 8, 6 % y 21 % para concentraciones de 10 y 30 mg L-1, respectivamente; quizá pueda ser debido a la mayor concentración, y teniendo en cuenta que la cinética de degradación es de orden 1, hay mayor disponibilidad de compuestos en la superficie que permiten una mayor descomposición; además, hay dependencia de la concentración. Lo anterior indica que el contenido de materia orgánica presente en el agua del río Ríonegro no ejerce un efecto significativo sobre la degradación del carbofurano que pueda encontrarse presente en las aguas del río, pero altas concentraciones de carbofurano pueden sufrir procesos de degradación más acelerados, tal como se indicó anteriormente para aguas superficiales.
Como control de hidrólisis, se utilizaron 10 mg L-1 de carbofurano disuelto en ambos tipos de agua, y se dejó en la oscuridad por un período de 24 horas, y se efectuaron análisis al inicio y al final del tiempo de almacenamiento. Se determinó que ninguna degradación de carbofurano ocurrió durante este tiempo, resultados similares a los reportados por Campbell et al. (Campbell, David, Woodward & Li, 2004).
Condiciones más favorables para la degradación del carbofurano
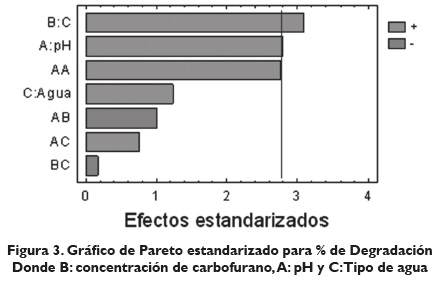
En las figuras 1, 2 y 3, se observa que las variables: concentración de carbofurano y pH son las más significativas de las variables estudiadas ya que tienden a influir en la degradación del analito bajo ensayos de fotólisis. El diagrama de Pareto representado en la figura 3 muestra tanto la magnitud como la importancia de los efectos (variables e interacciones) más significativos, con un intervalo de confianza del 95 %. El gráfico de Pareto representado por una línea de referencia (línea sólida vertical) indica que algún efecto que sobrepase dicha línea es potencialmente importante; de esta manera se observa que la variable concentración de carbofurano representa el efecto más importante en la degradación fotolítica del mismo, el cual fue sometido a radiación solar bajo lámpara de xenón en simulador solar.
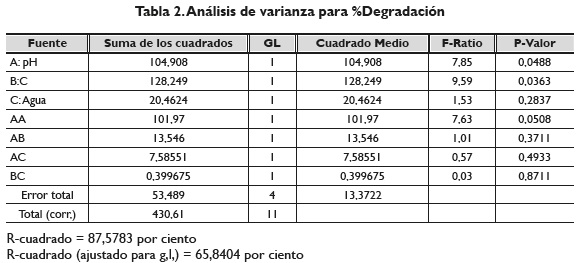
La figura 3 señala el diagrama de Pareto mostrando las interacciones de las variables tomadas en la degradación, que se corrobora con la tabla 2 muestra su análisis de varianza; aunque no es muy perceptible en el Pareto, el análisis de varianza señala con un valor de 0, 0488 y 0, 0363 para las variables pH y concentración del carbofurano, respectivamente, que tanto la concentración como el pH tienen efectos significativos sobre la degradación fotolítica del carbofurano.
Es importante anotar que durante este estudio las características típicas de un agua superficial como la del río Ríonegro no ejercieron influencia significativa sobre la degradación del carbofurano; esto puede deberse a su alta solubilidad en medio acuoso y su bajo coeficiente de adsorción (Koc), lo que comporta un bajo efecto del material disuelto, e indica que las aguas del río Río Negro poseen mayor cantidad de material suspendido que de material disuelto, lo que conlleva la pobre fijación del compuesto.
Degradación del carbofurano
La máxima remoción de carbofurano lograda durante 90 minutos de irradiación en simulador solar fue de 30 % bajo una condición de pH 9 en agua ultrapura como medio de disolución, Estudios de otros autores indican que mediante fotólisis directa con lámpara UV durante un período de 3 horas se produce una degradación completa (Kuo, 2002), mientras que Bertrand et al, empleando luz solar simulada, encontraron un 33 % de degradación en agua destilada determinada en un período de 90 minutos, lo cual es consecuente con lo obtenido en el presente estudio (De Bertrand & Barceló, 1991), Lo anterior sugiere que la presencia de solo una función carbámica hace al carbofurano más persistente (Lesce et al, , 2006) y, por lo tanto, bajo luz solar directa la degradación es más lenta comparada con la lámpara UV, una fuente de radiación de mayor intensidad.
Bajo condiciones normales de degradación (pH 7 y agua superficial) se establece que un porcentaje de degradación de 9, 5 % y una concentración de 10 mgL-1carbofurano, y no se observa diferencia con el agua tipo 1; lo anterior orienta el bajo efecto de la fotólisis y, por ende, la persistencia del carbofurano en las aguas superficiales del río Ríonegro, La constante de velocidad de degradación bajo estas condiciones establece que la degradación de carbofurano tanto en agua superficial como en agua ultrapura sigue una cinética de primer orden con constantes de velocidad de reacción de 7, 94 x 10-4 min-1 y 8, 42 x 10-4 min-1, respectivamente, para una concentración de 10 mg L-1, lo cual indica que no hay diferencia significativa en la velocidad de degradación en ambos tipos de agua; por otra parte, estas constantes calculadas establecen una velocidad de degradación baja para la fotólisis directa en relación con otros procesos de degradación asistida, como es expresado por otros autores previamente, A pesar de que muchos autores establecen que la presencia de materia orgánica disuelta enlentece la velocidad de fotólisis, es conocido que la disminución en la velocidad de fotodegradación se produce básicamente bajo dos fenómenos: el debido a la competencia de la materia orgánica disuelta con el carbofurano por los fotones de luz disponibles, y el debido a la unión entre la materia orgánica y el carbofurano (Bachman & Patterson, 1999), No obstante, en este trabajo los estudios realizados en el agua del río Ríonegro no mostraron un efecto significativo de la materia orgánica contenida en este sobre el porcentaje de degradación del carbofurano ni sobre la velocidad de degradación.
Mineralización
La remoción del COT bajo las condiciones descritas como normales (pH 7 y agua superficial) indica que después de 90 minutos de irradiación en simulador solar solo se produce un 8, 43 % de mineralización en el sistema, siendo el COT inicial de la solución preparada de carbofurano en agua superficial de 290, 25 mg L-1(Kuo, Chiang & Lai, 2006), Estudios anteriores realizados utilizando lámpara de luz UV indican un porcentaje de mineralización de 20 % después de 270 min de irradiación para una concentración de 50 mg L-1 de carbofurano, Comparando estos resultados con los obtenidos con lámpara de xenón en nuestro estudio es de destacar la baja mineralización obtenida que indica, a la vez, una baja degradación fotolítica del carbofurano, lo que confirma su estabilidad ante las variables fotolíticas de reacción y a la generación de productos de degradación que pueden ser más estables que el compuesto padre (Burrows, Canle, Santaballa & Steenken, 2002).
Otros estudios establecen que la velocidad de remoción del COT es disminuida con un incremento del pH a un rango básico, lo cual puede ser atribuido a una mayor proporción de subproductos de la hidrólisis (como el carbofurano fenol), el cual ha encontrado ser menos biodegradable que su compuesto padre el carbofurano, conduciendo a menores remociones de COT para condiciones iniciales de pH neutras y/o alcalina (Mascolo, López, Detomaso & Guzzella, 2004).
Evaluación de la toxicidad bajo la condición de degradación más favorable
La solución preparada de carbofurano en agua superficial en este estudio tiene un EC50 (15 °C, 90 min de irradiación) de 52, 2 % a un pH de 7, La toxicidad de las muestras de agua superficial dopadas con carbofurano a una concentración de 11, 1 mg L-1 presentan al tiempo cero un 34, 8 % de EC50, lo que indica una sobrevivencia baja del Vibrio ficheri como microorganismo bajo estudio; posterior a 90 minutos de irradiación con lámpara de xenón, se observa un EC50 de 52, 2 % que indica que se produjo una reducción de la toxicidad en un 17, 4 %, Lo anterior señala que la baja mineralización y la baja degradación del carbofurano bajo las condiciones de prueba no aseguran una reducción significativa de la toxicidad del mismo; adicionalmente, otros autores establecieron que incrementando el pH inicial de la solución no se observan beneficios en la reducción de la toxicidad de los muestras de carbofurano (Kuo, 2002).
Lo anterior evidencia que la contribución de los procesos fotolíticos a la degradación y mineralización del carbofurano requiere largos períodos de exposición para producir una reducción significativa; no obstante, la fotólisis puede considerarse como el primer mecanismo de degradación de xenobióticos en los espejos de agua.
Conclusión
Los procesos fotolíticos como mecanismos de degradación primaria en el ambiente presentan una contribución significativa a la degradación del carbofurano cuando este se encuentra a concentraciones relativamente altas, para el caso de las aguas del río Ríonegro; ni la presencia de materia orgánica disuelta ni un valor pH neutro presentaron efecto sobre la degradación del carbofurano; no obstante, valores de pH básicos o ácidos tienden a aumentar la degradación del carbofurano.
Una leve reducción del COT y de la toxicidad de una solución de 10 mgL-1 de carbofurano fue encontrada en este trabajo bajo las condiciones de experimentación fotolítica.
Se sugiere realizar estudios más de fondo que incluyan la interacción entre diferentes compuestos como los plaguicidas o contaminantes persistentes en el agua del río y los componentes orgánicos trópicos del mismo, efectuando pruebas de rangos múltiples para cuantificar el efecto de un mayor número de variables sobre la degradación global de todos los compuestos target y no target.
Agradecimientos
Al Sistema de Investigación Lasallista de la Corporación Universitaria Lasallista y al Grupo Diagnóstico y Control de la Contaminación -GDCON- de la Facultad de Ingeniera de la Universidad de Antioquia.
Referencias bibliográficas
Arbeli, Z. & Fuentes, C. (2007). Accelerated biodegradation of pesticides: An overview of the phenomenon, its basis and possible solutions; and a discussion on the tropical dimension. Crop Protection, 26(12), 1733-1746, doi: http://dx.doi.org/10.1016/j.cropro.2007.03.009. [ Links ]
Arias-Estévez, M.; López-Periago, E.; Martínez-Carballo, E.; Simal-Gándara, J., Mejuto, J, -C. & García-Río, L. (2008). The mobility and degradation of pesticides in soils and the pollution of groundwater resources. Agriculture, Ecosystems & Environment, 123(4), 247-260, doi: http://dx.doi.org/10.1016/j.agee.2007.07.011. [ Links ]
Bachman, J. & Patterson, H. (1999). Photodecomposition of the Carbamate Pesticide Carbofuran: Kinetics and the Influence of Dissolved Organic Matter. Environmental Science & Technology, 33(6), 874-881, doi: 10.1021/es9802652. [ Links ]
Burrows, H, D.; Canle, L.; Santaballa, J. & Steenken, S. (2002). Reaction pathways and mechanisms of photodegradation of pesticides. Journal of Photochemistry and Photobiology B: Biology, 67(2), 71-108, doi: http://dx.doi.org/10.1016/S1011-1344(02)00277-4. [ Links ]
Campbell, S.; David, M.; Woodward, L, A. & Li, Q. (2004), Persistence of carbofuran in marine sand and water. Chemosphere, 54(8), 1155-1161, doi: http://dx.doi.org/10.1016/j.chemosphere.2003.09.018. [ Links ]
Chapman, R. & Cole, C. (1982). Observations on the influence of water and soil pH on the persistence of insecticides. Journal of Environmental Science and Health Part B-pesticides Food Contaminants and Agricultural Wastes, 17(5), 487-504, doi: 10, 1080/03601238209372336. [ Links ]
De Bertrand, N. & Barceló, D, (1991). Photodegradation of the carbamate pesticides aldicarb, carbaryl and carbofuran in water. Analytica Chimica Acta, 254(1-2), 235-244, doi: http://dx.doi.org/10.1016/0003-2670(91)90031-Y. [ Links ]
De Melo Plese, L.; Paraiba, L.; Foloni, L. & Pimentel Trevizan, L. (2005). Kinetics of carbosulfan hydrolysis to carbofuran and the subsequent degradation of this last compound in irrigated rice fields. Chemosphere, 60(2), 149-156, doi: http://dx.doi.org/10.1016/j.chemosphere.2005.02.049. [ Links ]
Detomaso, A.; Mascolo, G. & López, A. (2005). Characterization of carbofuran photodegradation by-products by liquid chromatography/hybrid quadrupole time-of-flight mass spectrometry. Rapid Communications in Mass Spectrometry, 19(15), 2193-2202, doi: 10.1002/rcm.2036. [ Links ]
Devipriya, S. & Yesodharan, S. (2005). Photocatalytic degradation of pesticide contaminants in water. Solar Energy Materials and Solar Cells, 86(3). 309-348. doi:http://dx.doi.org/10.1016/j.solmat.2004.07.013. [ Links ]
Hua, I. & Pfalzer-Thompson, U. (2001). Ultrasonic Irradiation of Carbofuran: Decomposition Kinetics and Reactor Characterization. Water Research, 35(6), 1445-1452, doi: http://dx.doi.org/10.1016/S0043-1354(00)00398-5. [ Links ]
Lesce, M, R.; Greca, M.; Cermola, F.; Rubino, M.; Isidori, M. & Pascarella, L. (2006). Transformation and Ecotoxicity of Carbamic Pesticides in Water (5 pp). Environmental Science and Pollution Research, 13(2), 105-109, doi: 10, 1065/espr2005, 10, 285. [ Links ]
Jennings, V.; Rayner-Brandes, M. & Bird, D.(2001). Assessing chemical toxicity with the bioluminescent photobacterium (vibrio fischeri): a comparison of three commercial systems. Water Research, 35(14), 3448-3456, doi: http://dx.doi.org/10.1016/S0043-1354(01)00067-7. [ Links ]
Johnson, B. (2005). Microtox® Acute Toxicity Test, In C, Blaise & J, -F, Férard (Eds.). Smallscale Freshwater Toxicity Investigations (pp, 69-105): Springer Netherlands. [ Links ]
Kuhr, R. & Dorough, H. (1976). Carbamate insecticides: chemistry, biochemistry, and toxicology: CRC Press. [ Links ]
Kuo, W. (2002). Photocatalytic oxidation of pesticide rinsate. Journal of Environmental Science and Health, 37(1), 65-74, doi: 10.1081/pfc-120002898. [ Links ]
Kuo, W.; Chiang, Y. & Lai, L. (2006). Degradation of Carbofuran in Water by Solar Photocatalysis in Presence of Photosensitizers. Journal of Environmental Science and Health, 41(6), 937-948, doi: 10.1080/03601230600806137. [ Links ]
Mascolo, G.; Lopez, A.; Detomaso, A. & Guzzella, L.(2004). UV degradation of carbofuran insecticide in aqueous solution: identification and toxicity evolution of by-products. Water Science & Technology: Water Supply, 4(5/6), 313-319. [ Links ]