Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Producción + Limpia
Print version ISSN 1909-0455
Rev. P+L vol.8 no.2 Caldas July/Dec. 2013
Artículo original / Original article / Artigo original
Tratamiento de lactosuero ácido en un reactor UASB a diferentes cargas constantes y puntuales*
Treatment of acid whey in a UASB reactor at different constant and punctual charges
Tratamento de soro de leite ácido num reator UASB a diferentes ônus constantes e pontuais
Ricardo Adolfo Parra Huertas**; Rafael Germán Campos Montiel***
* Artículo derivado de la tesis de maestría titulada "Efecto de altas descargas puntuales de lactosuero en un sistema de depuración anaerobio", financiado por la Fundación Hidalgo de México.
** Químico de Alimentos, magister en Ciencias de los Alimentos. Docente de la Universidad Pedagógica y Tecnológica de Colombia. E-mail: ricardo.parra@uptc.edu.co.
*** Licenciado en Ingeniería Bioquímica Industrial, magister en Biotecnología, Doctor Biotecnología. Docente de la Universidad Autónoma del Estado de Hidalgo - México. E-mail: rcampos@uaeh.reduaeh.mx.
Artículo recibido: 05/07/2013; Artículo aprobado: 30/10/2013
Resumen
Introducción. En esta investigación se utilizó el lactosuero ácido de la industria que produce queso tipo oaxaca en un reactor UASB. El reactor fue sometido a tres cargas constantes y tres cargas puntuales de lactosuero. El reactor tuvo una capacidad nominal de 2.9 L con un tiempo de retención hidráulica de 1.9 días con un flujo ascendente y cama de lodos del 40 % del volumen del reactor. Objetivo. Evaluar el comportamiento de un reactor UASB a 3 diferentes cargas constantes de lactosuero. Materiales y métodos. Se realizaron 3 diferentes cargas constantes de lactosuero 5200, 7800 y 10500 mg DQO/L día cada una con duración de 22 días y cargas puntuales de 32000, 47000 y 65000 mg DQO/L día de lactosuero cada una con una duración de 24 horas. Tanto al influente como al efluente se determinaron: azúcares totales, ácidos grasos volátiles (AGV), proteína, pH, metano y DQO. Resultados. Los hallazgos mostraron que en las cargas constantes manejadas la eficiencia en remoción de DQO fue 26 %, y para las cargas puntuales fue 57 %. La eficiencia en degradación de azúcares para las cargas constantes y puntuales fue 95 %. Para proteína las eficiencias de remoción en las cargas constantes fueron mayores a 27 %, y para las cargas puntuales la eficiencia fue 46 %. Conclusión. Los valores de ácidos grasos volátiles y metano estuvieron dentro de los límites para un buen funcionamiento del reactor; sin embargo el pH presentó valores ácidos por debajo de lo recomendado.
Palabras clave: lactosuero, digestión anaerobia, agua residual, UASB, reactor.
ABSTRACT
Introduction. For this research work, the acid whey produced by Oaxaca cheese industry in a UASB reactor was used.The reactor was subjected to three constant charges and three punctual charges of the whey. The reactor had a nominal capacity of 2.9 L with 1.9 days of hydraulic retention with an upward flow and a sludge blanket of 40% of the reactor's volume. Objective. Evaluate the behavior of the UASB reactor with three different charges of whey. Materials and methods. Three different constant charges of whey were used (5200, 7800 and 10500 mg CDO/L each one) during 22 days, and punctual charges of 32000, 47000 and 65000 mg DQO/L per day of whey, for each one, during 24 hours. Both the influent and the effluent were determined: total of sugars, volatile fatty acids (VFA's) protein, pH, methane and CDO. Results. The findings demonstrated that in the constant charges used the removal efficiency of CDO was 26 %, and for the punctual charges was 57 %.The sugar degradation efficiency was 95% for the constant and the punctual charges. For the protein, the removal efficiencies in the constant charges were above 27 % and for the punctual charges the efficiency was 46 %. Conclusion. The values of volatile fatty acids and methane were all within the limits for a good functioning of the reactor. Nevertheless, the pH had acid values below the ones recommended.
Key words: whey, anaerobic digestion, waste water, UASB, reactor.
Resumo
Introdução. Nesta investigação se utilizou o soro de leite ácido da indústria que produz queijo tipo Oaxaca num reator UASB. O reator foi submetido a três ônus constantes e três ônus pontuais de soro de leite. O reator teve uma capacidade nominal de 2.9 L com um tempo de retenção hidráulica de 1.9 dias com um fluxo ascendente e cama de lodos do 40 % do volume do reator. Objetivo. Avaliar o comportamento de um reator UASB a 3 diferentes ônus constantes de soro de leite. Materiais e métodos. Realizaram-se 3 diferentes ônus constantes de soro de leite 5200, 7800 e 10500 mg DQO/L dia a cada uma com duração de 22 dias e ônus pontuais de 32000, 47000 e 65000 mg DQO/L dia de soro de leite a cada uma com uma duração de 24 horas.Tanto ao influente como ao efluente se determinaram: açúcares totais, ácidos gordurosos voláteis (AGV), proteína, PH, metano e DQO. Resultados. Os achados mostraram que nos ônus constantes manejadas a eficiência em remoção de DQO foi 26 %, e para os ônus pontuais foi 57 %.A eficiência em degradação de açúcares para os ônus constantes e pontuais foi 95 %. Para proteína as eficiências de remoção nos ônus constantes foram maiores a 27 %, e para os ônus pontuais a eficiência foi 46 %. Conclusão. Os valores de ácidos gordurosos voláteis e metano estiveram dentro dos limites para um bom funcionamento do reator; no entanto o PH apresentou valores ácidos por embaixo do recomendado.
Palavras importantes: soro de leite, digestão anaeróbia, água residual, UASB, reator.
Introducción
El tratamiento y eliminación de aguas residuales (AR) es actualmente uno de los contribuyentes graves del problema ambiental; este tipo de aguas contiene sustancias que causan polución y por lo tanto, contaminan cuerpos de agua receptores (Osho, Mabekoje & Bello, 2010).
Es por lo anterior que existe una necesidad imperiosa de desarrollar tecnologías fiables para el tratamiento de AR. Una opción es la digestión anaerobia que ha atraído cada vez más atención por lo que tiene ventajas como la sencillez del diseño, el uso de equipo no sofisticado, alta eficiencia en el tratamiento, baja producción de lodos, bajo costo de operación y de capital (Liu, Tian & Chen, 2010).
Los procesos biológicos anaerobios como la digestión anaerobia vienen siendo ampliamente utilizados en el tratamiento de aguas residuales agroindustriales como elaboración de bebidas alcohólicas, productos cárnicos y lácteos entre otras (Bedoya & Sanches, 2009).
La digestión anaerobia es un proceso biológico en el que un grupo de microorganismos biodegradan la materia orgánica (sustrato) en la ausencia de oxígeno molecular libre (O2). Como resultado de este complejo proceso biológico, la materia orgánica se convierte principalmente en una mezcla de dióxido de carbono (CO2), nuevas células bacterianas y metano (CH4) (Alkaya & Demirer, 2011), este último compuesto potencialmente valioso que se puede utilizar como combustible en la producción de calor y electricidad (Lim & Wang, 2013; Molino et al., 2013).
La DA consta de tres etapas: hidrólisis, acidogénesis, y metanogénesis (Bo, Wei-min, & Pin-jing, 2007; Hwang, Song, Kim, Kim, & Hwang, 2010).
Hidrólisis: involucra la conversión de material complejo insoluble a soluble y la reducción de polímeros a monómeros (Ghaly, 1991). Esta etapa se puede convertir en la limitante de la digestión anaerobia cuando los polímeros a hidrolizar y fermentar son poco solubles, tóxicos o de difícil biodegradación. Por el contrario, si los sustratos son solubles, fácilmente hidrolizables y fermentables, la primera etapa ocurre sin mayor problema (Ghaly, 1991).
En esta etapa, microorganismos liberan una variedad de enzimas extracelulares hidrolizando complejos orgánicos como carbohidratos, proteínas y grasas en productos solubles como glucosa, alcoholes, aminoácidos y ácidos orgánicos de cadenas larga (Hwang et al. 2010); sin embargo, en esta primera etapa la hidrólisis de la materia orgánica es el paso más lento en comparación con las demás fases o etapas en el proceso anaerobio (Stabnikova, Liu & Wang, 2008).
Acidogénesis: la segunda etapa implica la fermentación de los monómeros en una variedad de productos finales los cuales incluyen ácidos grasos volátiles (AGV), alcoholes, dióxido de carbono e hidrógeno (Ghaly, 1991). Los ácidos orgánicos son subsecuentemente convertidos a acetato, hidrógeno y dióxido de carbono por grupos acetogénicos. El hidrógeno producido por estos organismos es consumido por un grupo metanogénico, y el acetato, por un grupo metanogénico acetoclásico. Esta es una etapa crítica, ya que con ella se evita la acumulación de AGV, los cuales en concentraciones altas pueden inhibir posteriormente la metanogénesis (Ghaly, 1991).
Metanogénesis: según Ghaly (1991) en la metanogénesis los productos finales de los procesos de fermentación (acetato, propionato, ácido fórmico, hidrógeno y dióxido de carbono) son fermentados por otro grupo de microorganismos anaerobios a metano y dióxido de carbono con trazas de otros gases (sulfuros de hidrógeno, amonio, nitrógeno, mercaptanos y aminas).
Los procesos biológicos anaerobios como la digestión anaerobia vienen siendo ampliamente utilizados en el tratamiento de aguas residuales agroindustriales como elaboración de bebidas alcohólicas, productos cárnicos y lácteos, entre otras (Bedoya & Sanches, 2009).
Al respecto, los procesos de tratamiento anaeróbicos son métodos favorables para el tratamiento de efluentes de residuos lácteos, en comparación con procesos aerobios (Demirel, Yenigun & Onay, 2005). Este tipo de aguas son generalmente neutras o poco alcalinas, pero tienen tendencia a volverse ácidas muy rápidamente a causa de la fermentación del azúcar de la leche produciendo ácido láctico, sobre todo en ausencia de oxígeno y la formación simultánea de ácido butírico, descendiendo el pH entre 4, 5 - 5, 0. La composición de estas aguas incluye sustancias orgánicas disueltas como la lactosa, sales minerales y suspensiones coloidales de proteínas, dentro de las que se encuentra la caseína la cual se aglutina mediante la acción enzimática formado los derivados proteicos de la leche, y solamente quedan en el lactosuero lactoalbúmina y lactoglobulina (Bedoya & Sanches, 2009).
La efluente de residuos lácteos más importante es el lactosuero que se define como un líquido translúcido verde obtenido de la leche después de la precipitación de la caseína (Parra, 2009). Al respecto Gannoun (2008) y Parra (2009) mencionan que el lactosuero líquido tiene una demanda biológica de oxígeno (DBO) de 35000 mg/L y demanda química de oxígeno (DQO) 68000 mg/L, y que la lactosa es el principal componente de sólidos que contribuye a la alta DBO y DQO.
Es por lo anterior que este tipo de residuos causa graves problemas de polución, ya que es un contaminante orgánico alto. Teniendo en cuenta lo anterior, la aplicación de un tratamiento aeróbico sería ineficaz, debido principalmente al costo de la suplementación de oxígeno, así como la generación de lodos (Gannoun, 2008). Al respecto, existen tecnologías para el tratamiento de aguas residuales donde no se utilizan y por lo tanto, no generan lodos, como es el caso de las técnicas de filtración por membranas que consiste en la separación de la biomasa en el tratamiento de aguas residuales; sin embargo, esta técnica tiene como desventajas el alto costo de las membranas, la demanda de energía y la falta de control (Ersahin et al., 2012).
En las últimas dos décadas, los procesos anaerobios han resultado ser muy adecuados para el tratamiento de las aguas residuales lácteas. Los resultados han logrado alta velocidad en los reactores y altas eficiencias de remoción de DQO (Omil, Garrido & Arrojo, 2003).
Uno ejemplo de ello es el reactor UASB (Upflow anaerobic sludge blanket) también llamado reactor anaeróbico de flujo ascendente; este es un tanque en el cual las aguas residuales son introducidas en la parte inferior y salen por la parte superior, estableciendo un flujo ascendente que es la mezcla del sistema promovida por el flujo ascensional del fluido y por las burbujas de gas (Bedoya & Sánchez, 2009).
El reactor consiste de dos partes: una columna cilíndrica o rectangular y un separador gas-líquido-sólido (Chong, Sen, kayaalp & Ang, 2012), y puede ser dividido en 4 compartimentos (de abajo hacia arriba): cama de lodos, zona fluidizada, separador de gas líquido y compartimento de sedimentación (Kalogo & Verstraete, 1999).
El reactor es considerado el más utilizado por ser un avance científico y por ser el primero en el desarrollo y aplicación de tecnología anaerobia para aguas residuales industriales especialmente de industrias alimenticias que contenían una concentración media-alta de materiales orgánicos (Kamah, Tawfik, Mahmoud & Halim, 2010; Kalogo & Verstraete, 1999; Rajinikanth, 2008).
Dentro de las ventajas de este reactor se encuentra: alta eficiencia, simplicidad, requerimiento de espacio pequeño, bajo consumo de energía y baja producción de lodos; desventajas: baja eliminación de patógenos y nutrientes, tiempo de puesta en marcha prolongado, posibles malos olores y necesidad de post-tratamiento (Chong et al., 2012; Foresti, 2002). El objetivo de este trabajo fue evaluar las condiciones para el tratamiento de lactosuero en un reactor UASB a 3 diferentes cargas constantes de 5200, 7800 y 10500 mg DQO/L·día con una duración de 22 días y cargas puntuales de 32000, 47000 y 65000 mg DQO/L·día lactosuero con una duración de 24 horas.
Materiales y métodos
Localización
Esta investigación se realizó en los laboratorios de alimentos del Centro de Investigaciones en Ciencia y Tecnología de los Alimentos de la Universidad Autónoma del Estado de Hidalgo en México.
Materiales
Lactosuero. Se utilizó lactosuero ácido proveniente de la elaboración de queso tipo oaxaca obtenido de la Empresa Prounilac en Tulancingo -México. Las muestras fueron proporcionadas por la empresa, colectadas en contenedores de 10 L, llevadas diariamente al laboratorio, refrigeradas y almacenadas a 4 °C para evitar la acidificación y cambios en la composición química del lactosuero. Antes de ser alimentado el reactor, se ajustó el pH a 7 utilizando bicarbonato de sodio puro.
Lodos
Los lodos anaeróbicos granulados utilizados en el experimento fueron tomados de la planta de tratamiento de agua residual local. Estos lodos fueron aclimatados para la degradación de lactosuero y posteriormente los lodos generados de este proceso se podrían utilizar como fertilizante en tierras agrícolas de la región.
Operación del reactor
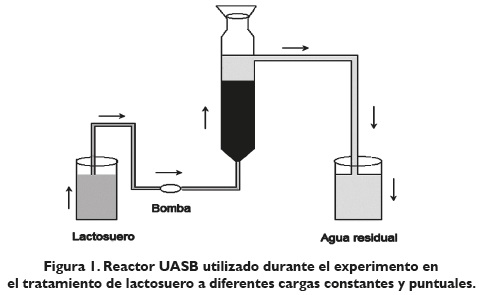
Se utilizó un reactor tipo UASB de vidrio con capacidad de 2, 9 L e inoculado al 40 % de su capacidad con lodos anaerobios previamente adaptados, y con un tiempo de retención hidráulico (TRH) de 1, 9 días; el esquema del reactor utilizado en este experimento se puede observar en la figura 1. La temperatura del experimento fue ambiental entre 18-22 °C simulando condiciones verdaderas de trabajo en planta.
El reactor UASB fue alimentado con lactosuero a través de una bomba peristáltica que alimentaba el reactor de abajo hacia arriba con flujo constante; el volumen de lactosuero utilizado diariamente era 5 litros aproximadamente. En la tabla 1 se observan los tratamientos aplicados. Se manejaron 3 cargas constantes y 3 cargas puntuales de lactosuero. Cada carga constante se mantuvo por 22 días aproximadamente. A cada una de las 3 cargas constantes se aplicaron, a su vez, 3 cargas puntuales; la duración de cada una de las cargas puntuales fue de 24 horas; pasado este período se esperaba a que se recupera el reactor para lo cual transcurría de 3 a 5 días aproximadamente y de nuevo se aplicaba una carga puntual.
Métodos
Tanto al influente como al efluente del reactor UASB se les determinaron diariamente y hasta finalizar el experimento: demanda química de oxígeno (DQO) (APHA, 2005), pH por potenciometría, azúcares totales por la técnica de Padín & Díaz (2009) y la proteína por la técnica de Bradford (1976). Además de los análisis anteriores, se determinaron ácidos grasos volátiles (AGV) al finalizar cada carga contante y carga puntual;estos ácidos se cuantificaron mediante cromatografía de gases con una columna capilar Elite FFAP (Crossbond Carbowax-PEG) de 30 m de longitud en un cromatógrafo de gases Perkin-Elmer. La temperatura del detector de ionización de flama fue de 250 oC, la del inyector fue de 250 oC y de la columna de 130 oC.
Para cuantificar la producción de biogás de los reactores se hizo a través de una manguera de látex instalada en la parte superior del reactor que, a su vez, iba conectada a una probeta con una solución sobresaturada salina; el biogás desplazaba la solución salina y así era cuantificada la producción de biogás. Este análisis se determinó al finalizar cada constante y carga puntual.
Resultados y discusión
DQO
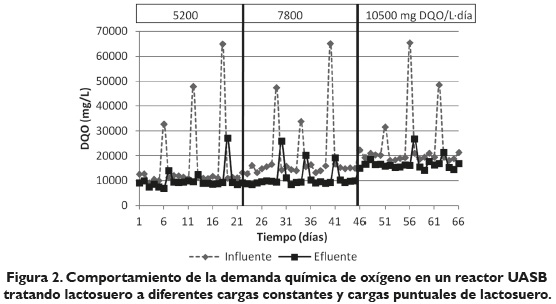
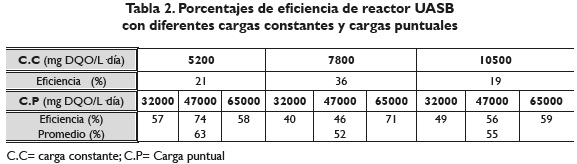
En la figura 2 se observa el comportamiento que tuvo el reactor UASB a diferentes concentraciones de lactosuero y en la tabla 2 los valores de eficiencia para las cargas constantes y las cargas puntuales.
En un estudio realizado por (Najafpour, 2008) utilizando lactosuero diluido en un reactor anaeróbico de flujo ascendente con película de lodos fijos, obtuvieron en el día 10 de trabajo, una eficiencia de remoción de DQO 30 %; en el día 17 de ese mismo experimento, la eficiencia en remoción de DQO fue del 38 %; (Ghaly, 1996) en su trabajo con lactosuero en un reactor UASB y manejando temperaturas de 35 °C y un TRH de 20 días obtuvieron eficiencias en remoción de DQO de 36 %. Rajeshwari, Balakrishnan, Kansal, Lata & Kishore (2009) en su trabajo de estado de arte relacionado con digestión anaerobia mencionan porcentajes de reducción de DQO de 28, 2 % a temperatura de 25 °C y un TRH de 10 días en un reactor anaerobio.
Los valores de la tabla 2 son similares a los reportados en trabajos de McHugh, Collins, & O'Flaherty (2006) reportando una eficiencia en promedio de remoción de DQO de 63, 4 % durante un período de trabajo de 83 días con un TRH de 48 horas y una carga de 5000 mg DQO/L día.
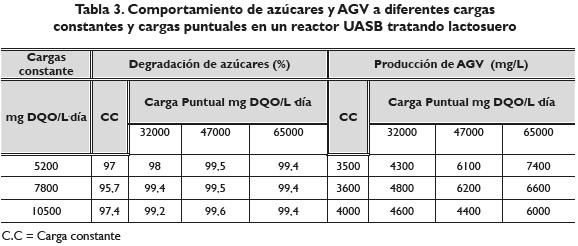
Azúcares
La tabla 3 muestra el comportamiento para el reactor UASB durante la degradación de azúcares; sin importar la carga constante manejada ni la carga puntual aplicada al reactor, se tuvo una eficiencia en degradación de 95 %. Estos resultados son similares a los obtenidos por Najafpour (2008) tratando lactosuero en un reactor anaerobio de flujo ascendente con lodos fijos a una película, quienes encontraron porcentajes degradación de azúcares de 80-85 % a un TRH de 36 horas; en otros resultados obtenidos por Vidal, Carvalho, Méndez & Lema (2000) con lactosuero encontraron eficiencias en un rango de 92-100 %.
Los resultados anteriores son explicados por lo que reseñan Demirel et al. (2005); Vidal, Carvalho, Mendez & Lema (2000) quienes mencionan que la degradación de carbohidratos (como la lactosa) es más rápida y casi total en condiciones anaeróbicas, además de ser el principal sustrato disponible para las bacterias anaerobias que se encuentran en los lodos.
Respecto a los ácidos grasos volátiles se encontraron valores entre 3500 y 7400 mg/L; estos resultados son similares a los obtenidos por Malaspina, Cellamare, Stante & Tilche (1996); Parra (2010) con concentraciones entre 3000 y 6000 mg/L tratando lactosuero.
Al respecto Inanc, Matsui & Ide (1999); Malaspina et al. (1996), en sus trabajos utilizando lactosuero, mencionan que las poblaciones metanogénicas pueden tolerar concentraciones de ácido acético, ácido propiónico y ácido butírico, superiores a 10000 mg/L, además de suponer que este valor es un indicativo de que la digestión anaerobia marcha bien; al respecto, Parkin & Owen (1986) han mencionado que concentraciones de ácidos volátiles arriba de 6000 mg/L pueden ser toleradas.
Proteína
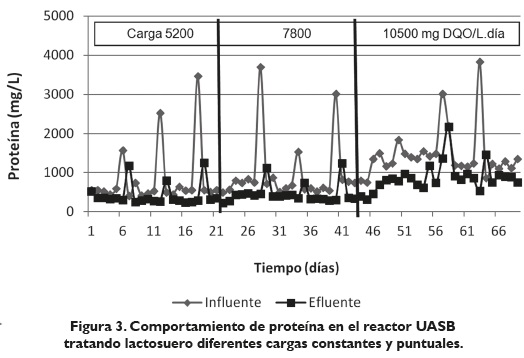
En la figura 3 se observa el comportamiento de la proteína a diferentes cargas constantes en el reactor UASB. Para la carga constante de 5200 mg DQO/L día, las eficiencias en remoción de proteína desde el día 1 hasta el día 22 fueron en promedio del 41, 3 %, la eficiencia en remoción de proteína para las cargas puntuales fue 52, 22 %.
Para la carga constante de 7800 mg DQO/L día, las eficiencias en promedio desde el día 23 hasta el día 45 fueron del 40, 8 %. Para las cargas puntuales se tuvo un promedio de eficiencia en remoción de proteína del 60 %.
Para la carga constante de 10500 mg DQO/L día, las eficiencias desde el día 46 hasta el día 66 fueron en promedio del 27 %; para las cargas puntuales dentro de ese mismo periodo el promedio de eficiencia en remoción de proteína fue 46 %.
Estos resultados concuerdan con los reportados por Saavedra et al. (2005) donde la proteína fue degradada con menores eficiencias que los carbohidratos; sin embargo, en trabajos realizados por Vidal et al., (2000) y en reactores UASB tratando lactosuero, se reportó un 68 % de degradación de proteínas. Estas diferencias se deben probablemente a la temperatura utilizada por Vidal et al., (2000) en su trabajo la cual fue 36 °C. Al respecto, Parkin & Owen (1986) mencionan que una de las condiciones óptimas para la eficiente digestión es la temperatura, en cualquiera de los dos rangos: mesofílica (30- 38 °C) o la termofílica (50-60 °C).
Además de lo anterior, Parkin & Owen (1986) afirman que el material proteico es degradado más completamente a temperaturas termofílicas; de acuerdo con Vidal et al., (2000) la eficiencia de degradación en proteína es menor a la de carbohidratos en condiciones anaerobias, debido a que la hidrólisis de proteínas es más lenta que la hidrólisis de carbohidratos (Parra, 2010).
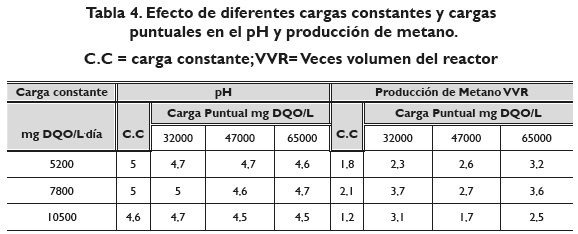
Se reportan en la tabla 4 los valores promedio correspondientes de pH; se observa que la salida del reactor UASB tuvo un pH en un intervalo entre: 4, 6 y 5. Al respecto, el pH es una de las variables más importantes; el mantenimiento en un rango apropiado es requerido para una digestión anaerobia eficiente; generalmente el rango aceptado en promedio es 6, 5-7, 6 (Parkin & Owen, 1986), y de 6, 7-7, 4 según Rajeshwari et al. (2000). Aunque el pH de la metanogénesis es alrededor de 7, el valor óptimo de la hidrólisis y acidogénesis ha sido reportado entre pH 5, 5 a 6, 5 (Ward, Hobbs, Hollinan & Jones, 2008).
La tabla 4, además, indica la producción de metano en el reactor UASB a diferentes cargas de lactosuero. Malaspina et al. (1996), manejando un reactor híbrido con flujo ascendente de 107, 5 L de volumen de trabajo y con una velocidad de carga de 10000 mg DQO/L día, tuvieron una producción de metano de 2, 75 veces el volumen del reactor por día.
De igual forma, Ghaly (1996) reportó valores similares con un reactor de dos etapas de 155 L de volumen de trabajo con velocidades de carga de 3600 a 7200 mg DQO/L día, y reportó datos de 0, 11, y 0, 08 veces el volumen del reactor por día.
Conclusiones
Los resultados obtenidos mostraron que el reactor UASB es una opción viable para el tratamiento de aguas residuales que contienen lactosuero. Las eficiencias de degradación de DQO en promedio fueron 26 % para las cargas constantes y 57 % en las cargas puntuales. El reactor tuvo un porcentaje de degradación de azúcares mayor al 95 % sin tener en cuenta las diferentes cargas manejadas. Para proteína, la degradación estuvo en un intervalo de 50-53 % para los dos tipos de cargas. Los valores de AGV y metano estuvieron dentro de los límites para un buen funcionamiento del reactor, tanto en las cargas constantes como en las cargas puntuales. Los valores de pH, aunque no fueron los esperados, estuvieron cerca de la hidrólisis y acidogénesis.
Agradecimientos
A la "Fundación Hidalgo Produce" en México por el financiamiento del proyecto, la Universidad Autónoma del Estado de Hidalgo y la empresa PROUNILAC por las facilidades otorgadas para la realización de este proyecto.
Referencias bibliográficas
Alkaya, E. & Demirer, G. N. (2011). Anaerobic mesophilic co-digestion of sugar-beet processing wastewater and beet-pulp in batch reactors. Renewable Energy, 36(3), 971-975. doi: http://dx.doi.org/10.1016/j.renene.2010.08.040. [ Links ]
APHA. (2005). Standard Methods for Examination of Water and Wastewater. Washington D.C. U.S.A. [ Links ]
Bedoya, O. & Sanches, L. (2009). Tratamiento de aguas residuales de la industria lactea en sistemas anaearobios tipo UASB. Biotecnologia en el sector agropecuario y agroindustrial, 7(2), 24-31. [ Links ]
Bo, Z.; Wei-min, C. & Pin-jing, H. (2007). Influence of lactic acid on the two-phase anaerobic digestion of kitchen wastes. Journal of Environmental Sciences, 19(2), 244-249. doi: http://dx.doi.org/10.1016/S1001-0742(07)60040-0. [ Links ]
Demirel, B.; Yenigun, O. & Onay, T. (2005). Anaerobic treatment of dairy wastewaters: a review. Process Biochemistry, 40(8), 2583-2595. [ Links ]
Ersahin, M.; Ozgun, H.; Dereli, R.; Ozturk, I.; Roest, K. & Van Lier, J. (2012). A review on dynamic membrane filtration: Materials, applications and future perspectives. Bioresource Technology, 122, 196-206. doi: http://dx.doi.org/10.1016/j.biortech.2012.03.086. [ Links ]
Gannoun, E.; Bouallagui, Y. & Touhami, M. (2008). Ecological clarification of cheese whey prior to anaerobic digestion in upflow anaerobic filter. Bioresource Technology, 99, 6105. [ Links ]
Ghaly, A. E. (1996). A comparative study of anaerobic digestion of acid cheese whey and dairy manure in a two-stage reactor. Bioresource Technology, 58(1), 61-72. doi: http://dx.doi.org/10.1016/S0960-8524(96)00105-8. [ Links ]
Hwang, K.; Song, M.; Kim, W.; Kim, N. & Hwang, S. (2010). Effects of prolonged starvation on methanogenic population dynamics in anaerobic digestion of swine wastewater. Bioresource Technology, 101(1, Supplement), S2-S6. doi: http://dx.doi.org/10.1016/j.biortech.2009.03.070. [ Links ]
Kalogo, Y. & Verstraete, W. (1999). Development of anaerobic sludge bed (ASB) reactor technologies for domestic wastewater treatment: motives and perspectives. World Journal of Microbiology and Biotechnology, 15(5), 523-534. doi: 10.1023/a:1008950121308. [ Links ]
Lim, J. & Wang, J. (2013). Enhanced hydrolysis and methane yield by applying microaeration pretreatment to the anaerobic co-digestion of brown water and food waste. Waste Management, 33(4), 813-819. doi: http://dx.doi.org/10.1016/j.wasman.2012.11.013. [ Links ]
McHugh, S.; Collins, G. & O'Flaherty, V. (2006). Long-term, high-rate anaerobic biological treatment of whey wastewaters at psychrophilic temperatures. Bioresource Technology, 97(14), 1669-1678. doi: http://dx.doi.org/10.1016/j.biortech.2005.07.020. [ Links ]
Molino, A.; Giordano, G.; Motola, V.; Fiorenza, G.; Nanna, F. & Braccio, G. (2013). Electricity production by biomass steam gasification using a high efficiency technology and low environmental impact. Fuel, 103, 179-192. [ Links ]
Najafpour, B.; Asadi, M. & Ghasemi, M. (2008). Biological Treatment of Dairy Wastewater in an Upflow Anaerobic Sludge-Fixed Film Bioreactor. American-Eurasian J. Agric. & Environ. Sci, 4(2), 251. [ Links ]
Parkin, G. & Owen, W. 1986). Fundamentals of Anaerobic Digestion of Wastewater Sludges. Journal of Environmental Engineering, 112(5), 867-920. doi:10.1061/(ASCE)07339372(1986)112:5(867). [ Links ]
Parra, R. (2009). Lactosuero: importancia en la industria de alimentos. Revista facultad Nacional de Agronomía, 62(1), 4967. [ Links ]
Parra, R. (2010). Digestión Anaerobia de Lactosuero: Efecto de Altas Cargas Puntuales. Revista facultad Nacional de Agronomía, 63(1), 5385-5394. [ Links ]
Saavedra, P.; Campos, R.; Cisneros, M.; Monroy, O.; Rodríguez, R. & Pimentel, J. (2005). Congreso AMIDIQ. Paper presented at the Degradación de lactosuero ácido a diferentes concentraciones en un biofiltro hidrolítico Acapulco-México. [ Links ]
Stabnikova, O.; Liu, X. & Wang, J. (2008). Anaerobic digestion of food waste in a hybrid anaerobic solid-liquid system with leachate recirculation in an acidogenic reactor. Biochemical Engineering Journal, 41(2), 198-201. doi: http://dx.doi.org/10.1016/j.bej.2008.05.008. [ Links ]