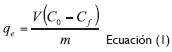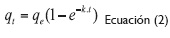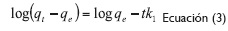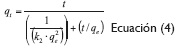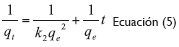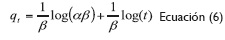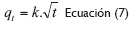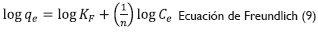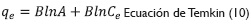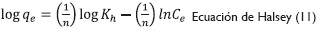Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Producción + Limpia
versão impressa ISSN 1909-0455
Rev. P+L vol.10 no.1 Caldas jan./jun. 2015
Absorción de Cromo Hexavalente en soluciones acuosas por cascaras de naranja (Citrus sinensis)*
Orange Peels used for the Absorption of Hexavalent Chromium in Aqueous Solutions (Citrus sinensis)
Absorção de cromo hexavalente em soluções aquosas por cascaras de laranja (Citrus sinensis)
Candelaria Tejada Tovar**, Edgar Quiñones Bolaños***, Lesly Tejeda Benitez****, Wilfredo Marimón Bolivar*****
* Artículo derivado del proyecto de investigación: Estudio de la adsorción competitiva de metales pesados (cromo, zinc, plomo, niquel) utilizando biomasa residual lignocelulósica modificada con quitosano- (Musa paradisiaca y Citrus sinensis), realizado entre Enero de 2012 y Enero de 2013, financiado por la Universidad de Cartagena.
** Ingeniería. Química, Magister en Educación. Magister en Ingeniería Ambiental. Docente Universidad de Cartagena, Cartagena. Colombia.
*** Ingeniería Civil. Doctor en Ingeniería. Docente de la Facultad de Ingeniería, Universidad de Cartagena, Cartagena, Colombia.
**** Ingeniería Química, Candidata a Doctor en Toxicología Ambiental. Magíster en Ingeniería Ambiental. Docente de la Facultad de Ingeniería, Universidad de Cartagena, Cartagena, Colombia.
***** Ingeniería Químico. Joven investigador Universidad de Cartagena-Colciencias, Cartagena, Colombia.
Correspondencia: Candelaria Tejada Tovar, e-mail:ctejadat@unicartagena.edu.co.
Artículo recibido: 22/10/2014; Artículo aprobado: 11/05/2015
Resumen
Introducción. El cromo se encuentra en efluentes industriales principalmente como Cr (III) y Cr (VI); este último es altamente tóxico para todas las formas de vida, además de mutagénico y carcinogénico en el hombre. Los métodos convencionales para el tratamiento de efluentes con metales pesados, tales como la reducción, la oxidación, el intercambio iónico, la filtración, y las tecnologías de membrana resultan ser costosos e ineficientes a bajas concentraciones de metal. El empleo de biomasa elimina el problema de la toxicidad, y permite recuperar los metales pesados retenidos, así como reutilizar el adsorbente. Objetivo. Estudiar la cáscara de naranja (Citrus sinensis) como un adsorbente de Cr (VI) en soluciones acuosas. Materiales y métodos. La caracterización de los grupos funcionales de las cáscaras se llevó a cabo mediante análisis elemental y espectroscopia de infrarrojo. La determinación de la concentración de Cr (VI) se realizó mediante el método de la difenilcarbazida usando un espectrofotómetro UV-vis. Resultados. Se encontró que el residuo agroindustrial usado presenta una remoción de 66,6 % de Cr (VI) en un tiempo de 120 min. El fenómeno fue descrito de mejor manera por la isoterma de Langmuir, al mostrar una la capacidad de adsorción de 16,66 mg/g. La cinética siguió el comportamiento de adsorción de pseudo-segundo orden. Conclusiones. Las condiciones más favorables para la adsorción de iones de Cr (VI) sobre cáscara de naranja se dieron a pH de 3 y un tamaño de adsorbente de 0,425 mm. Se comprobó que estas podrían ser usadas para remover Cr (VI) de aguas residuales de curtiembres y otras industrias.
Palabras clave: Adsorbente lignocelulósico, cinética de adsorción, cromo (VI), isoterma de adsorción.
Abstract
Introduction. Chromium can be found in industrial effluents, usually as CR (III) and CR (VI). The latter is very toxic for all of the life forms and is also mutagenic and carcinogenic in humans. The conventional methods to treat effluents with heavy metals, such as reduction, oxidation, ionic exchange, filtering and membrane technologies are expensive and inefficient at low metal concentrations. The use of biomass eliminates the toxicity problem and allows the recovery of the heavy metals retained, plus the possibility of reusing the adsorbent. Objective. Orange peel as a Cr (VI) in aqueous solutions was studied. Materials and methods. The characterization of the functional groups of the peels was performed by means of an elemental analysis and infrared spectroscopy. The determination of the Cr (VI) concentration was made with the diphenylcarbazide method, by the use of a UV-vis spectrophotometer. Results. The agro industrial waste used shows a 66,6 % removal of Cr (VI) in a 120 minutes period. The phenomenon was better described by the Langmuir isotherm, having a 16,66 mg/g adsorption capacity. The kinetics followed the pseudo-second order adsorption behavior. Conclusions. The most favorable conditions for the Cr (VI) ions adsorption on orange peels were those at a 3 pH and an adsorbent size of 0,425mm.It was demonstrated that the peels can be used to remove Cr (VI) from waste water originated by tannery and other industries.
Key words: Lignocellulosic adsorbent, adsorption kinetics, chromium (VI), adsorption isotherm.
Resumo
Introdução. O cromo se encontra em efluentes industriais principalmente como Cr (III) e Cr (VI); este último é altamente tóxico para todas as formas de vida, além de mutagênico e carcinogênico no homem. Os métodos convencionais para o tratamento de efluentes com metais pesados, tais como a redução, a oxidação, o intercâmbio iônico,a filtragem,e as tecnologias de membrana resultam ser custosos e ineficientes a baixas concentrações de metal. O emprego de biomassa elimina o problema da toxicidade, e permite recuperar os metais pesados retidos, bem como reutilizar o adsorvente. Objetivo. No presente trabalho se estudou a casca de laranja (Citrus sinensis) como um adsorvente de Cr (VI) em soluções aquosas. Materiais e métodos. A caracterização dos grupos funcionais das cascas se levou a cabo mediante análise elementar e espectroscopia de infravermelho. A determinação da concentração de Cr (VI) realizou-se mediante o método da difenilcarbazida usando um espectrofotómetro UV-vis. Resultados. Encontrou-se que o resíduo agroindustrial usado apresenta uma remoção de 66,6 % de Cr (VI) num tempo de 120 min. O fenômeno foi descrito de melhor maneira pela isoterma de Langmuir, ao mostrar uma a capacidade de adsorção de 16,66 mg/g. A cinética seguiu o comportamento de adsorção de pseudo-segundo ordem. Conclusões. As condições mais favoráveis para a adsorção de íons de Cr (VI) sobre casca de laranja se deram a PH de 3 e um tamanho de adsorvente de 0,425 mm. Comprovou-se do que estas poderiam ser usadas para remover Cr (VI) de águas residuais de curtumes e outras indústrias.
Palavras chaves: Adsorvente lignocelulósico, cinética de adsorção, cromo (VI), isoterma de adsorção.
Introducción
La contaminación por metales pesados es un problema ambiental que ha tenido un notorio crecimiento desde hace ya más de una década, debido a que estos son de uso generalizado y se encuentran frecuentemente en las aguas residuales industriales. La liberación de los líquidos contaminados con estos iones metálicos en nichos acuáticos supone una amenaza no solo para la vida acuática, sino también para toda la cadena alimentaria, y en última instancia pone en serio peligro la salud de los seres humanos (Shen, Pan, Zhang, Huang y Gong, 2012,180).
El cromo es un metal pesado observado en corrientes naturales en sus dos estados de oxidación estables: Cr (III) y Cr (VI). Este metal presenta una particularidad: el Cr (III) es relativamente inofensivo e inmóvil, pero en soluciones acuosas sufre un proceso de oxidación y pasa a Cr (VI), el cual se transporta fácilmente a través de los suelos y del agua, y es altamente oxidante, tóxico, carcinogénico y mutagénico (Higuera, Flórez y Arroyave, 2009, 60).
Los compuestos de Cr (VI) son perjudiciales si son ingeridos, y la exposición a este puede causar carcinomas, asma y dermatitis, entre otros daños (Vinodhini y Das, 2010, 9). El cromo se absorbe por vía oral, respiratoria o dérmica, se distribuye en el nivel de médula ósea, pulmones, ganglios linfáticos, bazo, riñón, e hígado, y es rápidamente absorbido por los eritrocitos e integrado a otras células por el sistema transportador de sulfatos, provocando graves alteraciones en el ADN (Miretzkya y Fernández, 2010, 2). La Organización Mundial de la Salud (OMS) recomienda desde 1958 una concentración máxima de 0,05 mg/L de Cr (VI) en el agua de consumo. Este valor ha sido revisado haciendo nuevos estudios sobre sus efectos en la salud humana, pero ha permanecido constante (Superintendencia Nacional de Servicios de Saneamiento - SUNASS, 2012).
En vista de los riesgos de contaminación causados por el Cr (VI), se han estudiado varios métodos para su remoción, como precipitación química, ósmosis inversa, intercambio iónico, flotación de espuma, electrólisis y adsorción (Altun y Pehlivan, 2012, 694).
Entre los métodos antes mencionados, la adsorción es una alternativa económicamente factible, debido a su fácil operación y al desarrollo de diversos adsorbentes de bajo costo (Campos, 2008l, 16). Se ha utilizado una variedad de materiales como adsorbentes de Cr (VI) entre los que se encuentran: carbón activado obtenido a partir de diferentes materiales de desecho, biomateriales, hidrotalcita, quitosana, goethita, bauxita, entre otros (Park, Lim,Yun, y Park, 2007, 300; Sahu, Acharya y Meikap, 2009, 819).
La adsorción mediante residuos agroindustriales resulta bastante prometedora; las paredes celulares de los materiales bioadsorbentes poseen polisacáridos, proteínas y lípidos, y por tanto, numerosos grupos funcionales capaces de enlazar metales pesados en la superficie de estos. Entre los grupos funcionales presentes, se puede hacer mención de los grupos amino, carboxílico, hidroxilo, fosfato y tiol,que difieren en su afinidad y especificidad respecto a la susceptibilidad para unirse a los diferentes iones metálicos (Ghimire, Inoue,Yamaguchi, Makino y Miyajima, 2003, 4947), siendo los grupos hidroxilo y carboxílico los más asociados a la retención del Cr (VI). En este sentido es importante resaltar la cáscara de naranja como un bioadsorbente con gran potencial, pues ha sido usada para remover iones cromo presentes en soluciones preparadas en el laboratorio, utilizadas como modelo de aguas contaminadas con concentraciones de 100 ppm de Cr (VI), obteniéndose porcentajes de adsorción de 61,2 % para condiciones de operación: pH de 5, tiempo de contacto de 60 horas, tamaño de partícula en el intervalo de 0,300 a 0,4200 mm y relación material adsorbente a volumen de solución de 4g/L (Pinzón-Bedoya y Vera-Villamizar, 2009, 96).
Dentro de los efluentes con mayor carga de Cr (VI) se encuentra la industria de curtiembres. En Colombia existen numerosas industrias de este tipo; datos oficiales reportan aproximadamente 800 funcionando. El 60 % se ubica en Bogotá y su sabana, y de ese porcentaje, el 90 %, en la localidad de Tunjuelito, donde el río Tunjuelito recibe 138 vertimientos, con un promedio de 6,7 vertimientos por kilómetro. De la carga de metales pesados arrojada al río, un 79,81 % corresponde a cromo;19,19 %, a zinc, y el resto (1 %), a otros metales (Miretzkya y Fernández, 2010, 2), superando las disposiciones contempladas en el Decreto 3930 de 2010 de la legislación colombiana (SUNASS, 2012), la cual establece como criterio máximo de calidad admisible para la destinación de recurso hídrico para el consumo humano y doméstico un valor de 0,05 ppm de Cr (VI).
Además, en Colombia la producción de naranja en el 2011 fue de aproximadamente 228.128 toneladas (Agronet, 2011), y el desarrollo creciente de agroindustrias como la de cítricos ha generado una gran producción de residuos agroindustriales. Estas cifras de producción muestran la futura disposición de residuos cítricos, teniendo en cuenta que en el proceso de extracción, se obtiene como residuo entre el 45 y 60 % de su peso, distribuido en: cáscaras (50 a 55 % del residuo), hollejo (de 30 a 35 %) y semillas (alrededor del 10 %) (Hutton, 1987). Esto hace que se obtenga una alta cantidad de residuo durante la extracción de la naranja (Pinzón-Bedoya y Tamayo-Cardona, 2010, 22).
Por tal razón, en este estudio se analizó la remoción de Cr (VI) usando cáscara de naranja (Citrus sinensis), por ser el residuo más abundante en las agroindustrias y del cual no se hace uso alguno. Se realiza este estudio con el fin de probar la capacidad de adsorción de la cáscara de naranja propia de la región caribe colombiana; además, se determinaron las condiciones más favorables de adsorción como pH, tamaño de partícula, concentración de adsorbente y tiempo de equilibrio de adsorción.
Materiales y métodos
Todos los reactivos utilizados en este estudio fueron de grado analítico. La solución acuosa de Cr (VI) se preparó añadiendo 0,1414 gr de K2Cr2O7 a 100 mL de agua desionizadapara obtener una concentración de 500 ppm; luego se tomaron 20 mL de la solución patrón y se añadieron 80 mL de agua desionizada. El pH de la solución se varió usando ácido clorhídrico 0,1 N y soluciones de hidróxido de sodio 0,5 % p/v.
Preparación de adsorbente
Los residuos lignocelulósicos se obtuvieron de cáscara de naranja procedente de ventas ambulantes de jugo en la ciudad de Cartagena, las cuales usan naranja de tipo valencia, cultivada en la región Caribe colombiana, teniendo en cuenta, como requisito indispensable para su selección, el mejor estado de la biomasa, para evitar su pronta descomposición y garantizar una operación de secado en condiciones adecuadas.
Se tomó una muestra de aproximadamente 676 g de cáscara. Estas fueron cortadas de forma manual en trozos pequeños de aproximadamente 1 cm, con el fin de facilitar su manipulación en las etapas posteriores. Luego, fueron lavadascon agua destilada a 60°C por 30 minutos; posteriormente se lavaron con 1,5 volumen de etanol al 96 % a 50 °C por 30 min, todo bajo agitación lenta (40 rpm), con el fin de extraer partículas de desecho que pudieran interferir en el proceso adsorptivo; posteriormente fueron secadas a 90 °C durante 24 horas (Anandkumara y Mandal, 2011, 1088; Anwar, Shafique,Waheed-uz-Zaman, Salman, Dar y Anwar, 2010, 1753; Sciban, Klašnja y Škrbić, 2006, 266; Ahalya, Kanamadi y Ramachandra, 2008, 78). Después, la biomasa preparada se molió en un molino de cuchillas y se tamizó para una selección de tamaño de (0,3-0,425-0,525mm), a mallas 50,40 y 30, según Norma ASTM, respectivamente.
Caracterización del adsorbente
Una vez preparada la cáscara de naranja, se procedió a la caracterización de la misma, caracterización que consistió en determinar los elementos presentes por diferentes métodos analíticos (carbono: AOAC 949.14, hidrogeno:AOAC 949.14, nitrógeno:AOA 984.13Kjeldahl, azufre: digestión).Además, se determinó el contenido de cenizas: termogravimetría, pectina: digestión ácida y termogravimetría, lignina: fotocolorimetría, celulosa y hemicelulosa: digestión y termogravimetría. Mientras que la verificación de los grupos funcionales que participan en la adsorción de metales pesados se realizó por Espectroscopía Infrarroja (IR). Los análisis fueron realizados en el laboratorio de química analítica de la Universidad de Cartagena.
Estudios de adsorción
Se llevaron a cabo estudios por lotes en vasos de precipitado de 1000 mL usando 300 mL de solución de Cr (VI) a 100 ppm. Las condiciones de operación estudiadas fueron de 180 rpm, temperatura ambiente, 24 °C, 3 niveles de pH (3, 4, y 5), tres niveles de concentración de adsorbente (2, 4, y 6 g/L) y tiempo de contacto estándar de 1 hora. El análisis de la concentración final se realizó mediante el método de difenilcarbazida en un espectrofotómetro UV-Vis (Balasubramanian y Pugalenthi, 1999, 459; Chen,Yue, Gao, Li, Xuy Fu, 2012, 116). Cabe destacar que previamente fue realizada la curva de calibración del equipo, detectando el límite de detección del mismo. Después de estos ensayos la capacidad de adsorción se calculó mediante la ecuación 1:
Donde qees la cantidad de adsorbato adsorbido en el equilibrio (mg/g), Coy Cf son las concentraciones inicial y final, luego del equilibrio (mg/L) de Cr (VI) en la solución,V es el volumen (L) de solución tomada y m es la masa (g) de adsorbente usado.
Además, con el fin de determinar el modelo cinético adecuado para la adsorción de Cr (VI) se evaluaron cuatro ecuaciones cinéticas:
La ecuación del modelo cinético Pseudo Primer Orden (ecuación 2) y su linealización (ecuación 3) se presentan a continuación:
Donde Kl, es la constante de Pseudo Primer Orden (min-1), qe capacidad de adsorción en el equilibrio (mg/g) y qt capacidad de adsorción en el tiempo (mg/g) (Holan, Volesky y Prasetyo, 1993, 821).
La ecuación del modelo cinético de Pseudo-Segundo Orden (ecuación 4) y su linealización (ecuación 5), utilizadas fueron las siguientes:
Donde k2 es la constante cinética de Pseudo segundo orden (mg/g. min) (Holan, Volesky y Prasetyo, 1993, 821).
El tercer modelo de estudio fue el Modelo de Elovich, el cual supone sitios activos heterogéneos en el adsorbente, con diferentes energías de activación, basándose en un mecanismo de reacción de segundo orden para un proceso de reacción heterogénea. La expresión matemática linealizada utilizada se presenta a continuación en la ecuación 6:
Donde α, constante de la ecuación de Elovich (mg/g. min); β, exponente en la ecuación de Elovich (g/ mg) (Holan,Volesky y Prasetyo, 1993, 821).
El último modelo hace énfasis en la difusión intraparticular, y se basa en un mecanismo de difusión en el interior de los poros de la partícula de adsorbente y la difusión propiamente dicha en el sólido, lo que conduce a que el adsorbente posea una estructura porosa homogénea. Matemáticamente es expresada así en la ecuación 7:
Siendo k la constante de difusión (Holan, Volesky y Prasetyo, 1993, 821).
Resultados y discusión
Caracterización del adsorbente
Los resultados obtenidos para determinar la composición elemental de la cáscara de naranja mostraron que el elemento obtenido en un mayor porcentaje es el carbono (42,04 %), seguido por el hidrógeno (5,44 %), mientras que el nitrógeno (0,70 %), el contenido del azufre es de 0,08 ppm. Además, las cenizas representan el 1,26 %, la pectina el 10,98 %, la lignina el 6,51 %, la celulosa el 13,08 % y la hemicelulosa el 6,47 % de la biomasa estudiada. Se puede deducir que la adsorción de Cr (VI) se verá favorecida por el alto porcentaje de carbono presente en la biomasa estudiada.
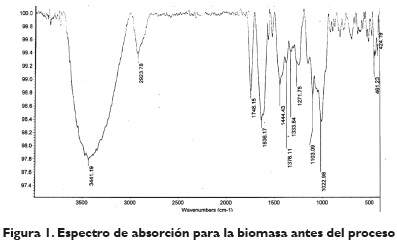
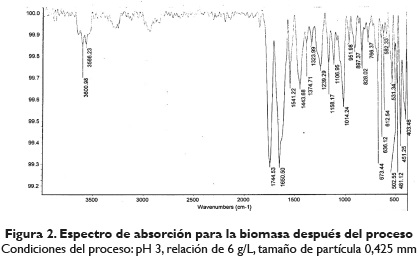
Además, mediante la técnica de espectroscopia de infrarrojo por transformada de Fourier (FITR), se determinaron los grupos funcionales superficiales orgánicos de la cáscara de naranja para conocer de manera general la estructura química de la misma. En las figuras 1 y 2, se muestran los espectros de infrarrojo para la cáscara de naranja antes y después del proceso de adsorción. El infrarrojo después del proceso de adsorción se hizo con la muestra a las condiciones de las cuales se obtuvo la mayor capacidad de adsorción. El intenso pico a 3441 cm-1, mostrado en el espectro de la cáscara de naranja antes del proceso, es un indicativo del cambio de los grupos hidroxilo que van desde 3340 a 3600 cm-1, perteneciente a vibraciones de celulosa, pectina, agua absorbida y adsorbida, hemicelulosa y lignina. El pico a 2923,78 cm-1se atribuye a las vibraciones C-H de metilo, metileno y grupos metoxi. Los picos alrededor de 1748,15 cm-1 corresponden al estiramiento carbonilo C=O, lo que indica la vibración de los grupos carboxilo de pectina, hemicelulosa y lignina en la biomasa estudiada. El pico alrededor de 1636,17 cm-1 se produce por el estiramiento de C=C, como consecuencia de la presencia de anillos aromáticos en la lignina. El pico alrededor de 1444,43 cm-1 se debe a la presencia de C-H,alifáticos y aromáticos, grupos en el plano de deformación, vibraciones de metilo, metileno y grupos metoxi, desde los 1333,24 cm-1 hasta 1022 cm-1 corresponde al grupo C-O de alcoholes y ácidos carboxílicos (Pinzón-Bedoya y Tamayo, 2008, 33; Deveciy Kar, 2013, 193; Lugo-Lugo, Barrera-Díaz, Ureña-Nuñez, Bilyeu y Linares-Hernández, 2012, 124).
Al comparar los espectros de la cáscara de naranja antes y después del proceso de adsorción, se observa que todos estos picos muestran una disminución en la intensidad y ancho de las bandas debido a una pequeña variación en la frecuencia de adsorción; esto podría atribuirse a la unión de los iones Cr (VI) con los grupos-OH, -CH, C=O, y C-O, presentes en el bioadsorbente, que impiden la vibración de los mismos. Se destaca que el pico del grupo funcional carboxilo cambió significativamente de los grupos 1636,17 cm-1 a 1650,50 cm-1, lo que corresponde a un cambio en la energía de unión del grupo funcional. Por lo tanto, este resultado confirma la participación de grupos de ácido carboxílico en la unión de los iones de Cr (VI) con la cáscara de naranja (Pinzón-Bedoya y Tamayo, 2008, 33; Deveci y Kar, 2013, 193; Lugo-Lugo et al. 2012, 124).
Estudio de adsorción
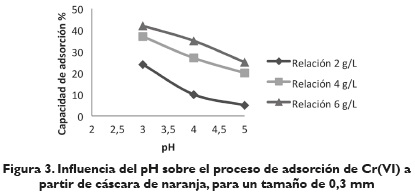
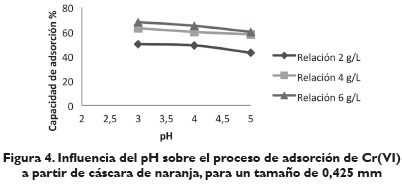
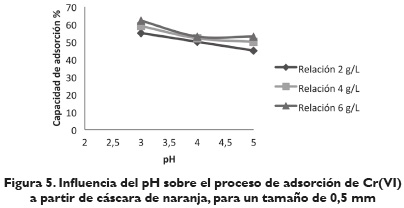
Efecto del pH. En las figuras 3, 4, y 5, se observa el valor del porcentaje de ion metálico adsorbido por la cáscara de naranja a diferentes valores de pH (3, 4, 5) para los 3 tipos de tamaño de cáscara de naranja usados. En ellas se aprecia que la capacidad de adsorción de Cr (VI) está fuertemente influenciada por el pH, siguiendo un comportamiento creciente del porcentaje de adsorción de iones metálicos, a medida que disminuye el pH.
Lo anterior muestra la alta influencia del pH en el mecanismo de adsorción. Un pH bajo hace que la superficie del biomaterial, cargado positivamente con grupos amino y carboxilo, sean protonados llevando a un incremento en la tasa de eliminación de iones Cr (VI) en fase acuosa. Es importante señalar que los protones y electrones (suministrados por los grupos donadores de electrones en el biomaterial) son necesarios para la reducción de Cr (VI) a Cr (III), y que los grupos carboxilo propios de las biomasas son los responsables de captar los iones metálicos de las soluciones para que los grupo hidroxilos realicen la reducción de Cr (VI) a Cr (III), formándose un complejo que no deje escapar al metal nuevamente a la solución (Ariff, Mel, Hasan y Karim, 1999, 295).
Efecto de la cantidad de absorbente. Al analizar las figuras 3, 4, y 5, se determina la influencia de la cantidad de cáscara de naranja con respecto al volumen de fase acuosa. Se observa que en todos los casos la cantidad de metal adsorbido aumenta rápidamente al aumentar la relación sólido/líquido hasta una relación de 6 g/L. Por lo anterior, se consideró conveniente para los siguientes experimentos seleccionar la relación de 6g/L como la dosis a utilizar para la realización de los ensayos posteriores. Las condiciones de operación para este experimento fueron pH 3 y tamaño de partícula 0,425 mm y 0,5 mm.
Efecto del tamaño de partícula. De los resultados obtenidos en el proceso de adsorción del Cr (VI) con cáscara de naranja para los tres tipos de tamaño seleccionados, 0,300, 0,425, 0,5 mm, se observa que la máxima cantidad de metal adsorbido se encuentra para los dos últimos tamaños en un intervalo de 40-60 %. El mayor porcentaje de adsorción es de 66,80 %, el cual corresponde a un tamaño de partícula de 0,425 mm a pH 3 y 6 g/L; sin embargo, a las mismas condiciones para el tamaño de partícula de 0,5 mm se observa una disminución de la capacidad de adsorción. Se concluye que el tamaño de las partículas del material adsorbente influye en la adsorción, debido a que esta tiene lugar fundamentalmente en las paredes de las partículas; por lo tanto, al disminuir el tamaño de las partículas, el número de centros activos por unidad se incrementa, al igual que la capacidad de adsorción de iones de Cr (VI). Respecto a los resultados obtenidos con un tamaño de partícula de 0,3 mm se podría establecer que no dieron buenos resultados al darse una aglomeración de estas pequeñas partículas de adsorbente, lo que disminuyó su área superficial, y por tanto, su capacidad de adsorción.
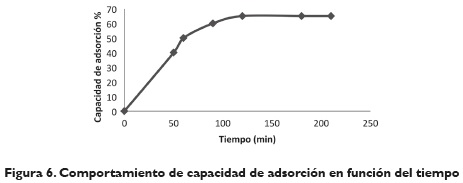
Efecto del tiempo de contacto y cinética de adsorción. La capacidad de adsorción de iones de Cr (VI) fue estudiada como función del tiempo, con el fin de establecer el tiempo de equilibrio. La figura 6 muestra que el potencial de remoción es mayor al inicio del proceso, debido a que probablemente la mayorárea de la superficie está disponible al principio para la adsorción de los iones metálicos. Como la superficie de los sitios disponibles se agota, la tasa de adsorción se controla por la medida en que el adsorbato se transporta desde el exterior a los sitios interiores de las partículas adsorbentes. Los resultados de tiempo de equilibrio se alcanzaron en 120 minutos, ya que después de este tiempo no se obtiene mayor variación.
Bajo esta condición de tiempo de equilibrio encontrada se hizo el estudio de la cinética de adsorción, que describe la velocidad de adsorción del adsorbato, lo que a su vez controla el tiempo de residencia en la interface sólido-líquido, y permite predecir la velocidad a la cual el metal es removido. Así los datos experimentales fueron correlacionados con cada uno de los modelos ajustándolos y obteniendo los siguientes parámetros:
Pseudo- primer orden: qe= 18,21 mg/g; k1= -0,05 min-1; R2= 0,666.
Pseudo- segundo orden: qe= 16,66 mg/g; K1= 0,020 min-1; R2= 0,999.
Elovich: α= 1,16x103 mg/ (g.min); Β= 13,192 mg/g; R2= 0,743.
Difusión Intraparticular: Kl= 0,149 mg/g*min1/2; R2= 0,642.
Se observa que la ecuación de pseudo segundo orden explica de mejor forma el fenómeno de adsorción, pues es la que mejor ajusta los datos experimentales. De este modo el adsorbato se adsorbe en dos sitios activos de la biomasa, que en el caso de la cáscara de naranja serían los grupos funcionales hidroxilo y carboxilo, ya que la ecuación de pseudo primer orden no se aplica bien a lo largo de todo el tiempo de contacto y es aplicable en general sobre el inicio del proceso de adsorción.
Efecto de la concentración inicial de Cr (VI) y las isotermas de adsorción. Se estudió el efecto que tiene la concentración inicial de la solución en la capacidad de adsorción en el intervalo de 20 ppm a 100 ppm. Se aplicaron las isotermas de adsorción que tienen como función describir una relación analítica que correlaciona la cantidad de un determinado componente adsorbido en una interface con la concentración de este componente en el seno de la fase. Las isotermas de adsorción usadas fueron:
Donde qees la cantidad de material sorbido por cantidad de adsorbente (mmol/g);C, la concentración de equilibrio (mmolL-1); qm, la cantidad de metal necesario para formar una monocapa en la superficie (mmolg-1); KL, la constante de equilibrio de Langmuir; Kh es la constante de Halsey, y KF la constantes de equilibrio de Freundlich; n es el exponente de cada ecuación característica (Ariff et al. 1999, 294; Pranab, 2009, 119; Feng, Gong, Zeng, Niu, Zhang, Niu, Deng y Yan, 2010, 491).
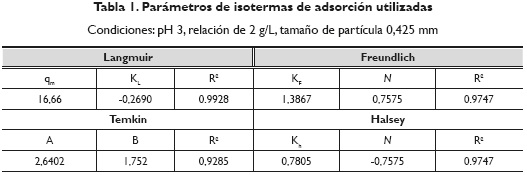
Luego de aplicar las expresiones matemáticas de las ecuaciones 8 a la 11, se obtuvieron los parámetros observados en la tabla 1.
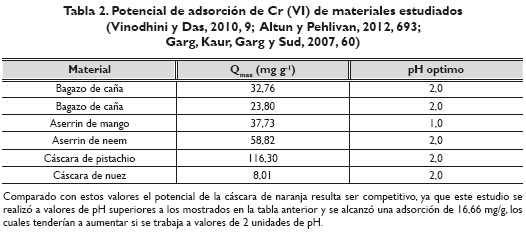
Se establece que la isoterma de Langmuir es la que mejor describe la adsorción de Cr (VI) en cáscaras de naranja. Esto indica que la superficie del adsorbente es uniforme, es decir, todos los sitios de adsorción son equivalentes, y las moléculas adsorbidas no interaccionan. La máxima adsorción solo se forma en una monocapa, lo cual implica que moléculas de adsorbato no se depositan sobre otras, ya adsorbidas; solo lo hacen en la superficie libre del adsorbente. Dados estos valores se puede establecer una comparación con estudios de adsorción de Cr (VI) de materiales encontrados en la región caribe colombiana; estos se muestran en la tabla 2.
Conclusiones
Se puede concluir de la adsorción de iones de Cr (VI) sobre cáscara de naranja, que las condiciones de adsorción más favorables para este proceso se dieron a pH bajo de 3 y un tamaño de partícula de adsorbente de 0,425 mm. Del estudio de cinética de adsorción se pudo comprobar que la cáscara de naranja tiene dos centros activos de adsorción: grupos hidroxilo y carboxilo, esto descrito mediante la correlación de pseudo segundo orden. De igual forma, la isoterma de Langmuir es la que mejor describe la interacción de los metales en los centros activos por solo poseer un espacio en la superficie del adsorbente y no existir una superposición de iones metálicos. Con esto se comprobó que este bioadsorbente lignocelulósico tiene un buen porcentaje de remoción y puede ser implementando para la remediación de aguas residuales industriales.
Agradecimientos
Este estudio fue financiado por la Universidad de Cartagena, en la quinta convocatoria de proyectos financiables, por lo cual agradecemos su apoyo.
Referencias bibliográficas
Agronet. (2011). Red de información y comunicación estrátegica del sector agropecuario-Agronet. Obtenido de Análisis-Estadísticas. Bogotá: Ministerio de agricultura. Recuperado de: http://www.agronet.gov.co. [ Links ]
Ahalya, N.; Kanamadi, R. D. y Ramachandra, T.V. (2008). Biosorption of Chromium (VI) by Tamarindusindica pod shells. Journal Environmental Science Resource International, 1 (2), 77-81. [ Links ]
Altun, T. y Pehlivan, E. (2012). Removal of Cr (VI) from aqueous solutions by modified walnut shells. Food Chemistry, 132, 693-700. [ Links ]
Anandkumara, J. y Mandal, B. (2011). Adsorption of chromium (VI) and Rhodamine B by surface modified tannery waste: Kinetic, mechanistic and thermodynamic studies. Journal Hazardous Material, 186, 1088-1096. [ Links ]
Anwar, J.; Shafique, U.; Waheed-uz-Zaman, Salman, M.; Dar, A.; y Anwar, S.(2010). Removal of Pb (II) and Cd (II) from water by adsorption on peels of banana. Bioresource Technology, 101(6), 1752-1755. [ Links ]
Ariff, A. B.;Mel, M.; Hasan, M. A.; y Karim, M.I. A. (1999). The kinetics and mechanism of lead (II) biosorption by powderized Rhizopusoligosporus. Journal Microbiology and Biotechnology, 15(2), 291-298. [ Links ]
Balasubramanian, S. y Pugalenthi, V. (1999). Determination of total chromium in tannery waste water by inductively coupled plasma-atomic emission spectrometry, flame atomic absorption spectrometry and UV-visible spectrophotometric methods. Talanta, 50(3), 457-467. [ Links ]
Campos, E. (2008). Estudio de la adsorción de cromo hexavalente como biomaterial la ectodermis de opuntia. Quivera, 10(1), 16-31. [ Links ]
Chen, S.; Yue, Q.; Gao, B.; Li, Q.; Xu, X. y Fu, K. (2012). Adsorption of hexavalent chromium from aqueous solution by modified corn stalk:A fixed-bed column study. Bioresource Technology, 113, 114-120. [ Links ]
Deveci, H. y Kar, Y.(2013). Adsorption of hexavalent chromium from aqueous solutions by bio-chars obtained during biomass pyrolysis. Journal of Industrial and Engineering Chemistry, 19, 190-196. [ Links ]
Feng, Y.; Gong, J. L.; Zeng, G. M.; Niu, Q. Y.; Zhang, H. Y.; Niu, C. G.; Deng, J. H. y Yan, M. (2010). Adsorption of Cd (II) and Zn (II) from aqueous solutions using magnetic hydroxyapatite nanoparticles as adsorbents. En: J. Chemical Engineering, 162(2), 487-494. [ Links ]
Garg, U. K.; Kaur, M. P.; Garg,V. K. y Sud, D. (2007). Removal of hexavalent chromium from aqueous solution by agricultural waste biomass. Journal of Hazardous Materials, 140, 60-68. [ Links ]
Ghimire, K. N.; Inoue, K.; Yamaguchi, H.; Makino, K. y Miyajima, T. (2003). Adsorptive separation of arsenate and arsenate anions from aqueous medium by orange waste. Water Research, 37(20), 4945-4953. [ Links ]
Higuera, O.; Flórez, L. C. y Arroyave, J. F. (2009). Studying chromium biosorption using Arabica coffee leaves. Ingeniería e Investigación, 29(2), 59-64. [ Links ]
Holan, Z. R.; Volesky, B. y Prasetyo, I. (1993). Biosorption of cadmium by biomass of marine algae. Biotechnology and Bioenginering, 41(8), 819-825. [ Links ]
Hutton K. (1987). Citrus pulp in formulated diets. Australia, New South Wales: Farre DJ editors, Department Biochemical Microbiology Nutrition, University New England, Armidale. [ Links ]
Lugo-Lugo, V.; Barrera-Diaz, C.; Ureña-Nuñez, F.; Bilyeu, B. y Linares-Hernandez, I. (2012). Biosorption of Cr (III) and Fe(III) in single and binary systems onto pretreated orange peel. Journal of Environmental Management, 112, 120-127. [ Links ]
Miretzkya, P. y Fernández, A. (2010). Cr (VI) and Cr (III) removal from aqueous solution by raw and modified lignocellulosic materials: A review. Journal Hazardous Material, 180, 1-19. [ Links ]
Park, D.; Lim, S. R.; Yun, Y. S. y Park, J. M. (2007). Reliable evidences that the removal mechanism of hexavalent chromium by natural biomaterials is adsorption-coupled reduction. Chemosphere, 70, 298-305. [ Links ]
Pinzón-Bedoya, M. L. y Tamayo, A. M. (2008). Caracterización de la cáscara de naranja para su uso como material bioadsorbente. Revista BISTUA, 6(1), 28-37. [ Links ]
Pinzón-Bedoya, M.L. y Tamayo-Cardona, A. M. (2010). Influencia del pH en la bioadsorción de Cr (III) sobre cáscara de naranja: Determinación de las condiciones de operación en proceso discontinuo. Revista Bistua, 8(1), 21-30. [ Links ]
Pinzón-Bedoya, M. L. y Vera-Villamizar, L.E. (2009). Kinetic modeling biosorption of Cr (III) using orange shell. Dyna, 76(160), 95-106. [ Links ]
Pranab, K. G. (2009). Hexavalent chromium [Cr(VI)] removal by acid modified waste activated carbons. Journal Hazardous Material, 71(1-3), 116-122. [ Links ]
Sahu, J. N.; Acharya, J. y Meikap, B. C.(2009). Response surface modeling and optimization of chromium (VI) removal from aqueous solution using Tamarind wood activated carbon in batch process. Journal Hazardous Material, 172(8), 818-825. [ Links ]
Sciban, M.; Klašnja, M. y Škrbić, B.(2006). Modified softwood sawdust as adsorbent of heavy metal ions from water. Journal Hazardous Material, 136(2), 266-271. [ Links ]
Shen, H.; Pan, S.; Zhang, Y.; Huang, X. y Gong, H.(2012). A new insight on the adsorption mechanism of amino-functionalized nano-Fe3O4 magnetic polymers in Cu (II), Cr (VI) co-existing water system. Journal Chemical Engineering, 183, 180-191. [ Links ]
Superintendencia Nacional de Servicios de Saneamiento. SUNASS. (2012). Perú: Oficio Circular No-677. Mediante este oficio la SUNASS estableció los valores límite máximo permisibles de los parámetros de calidad del agua; ello originado por la carencia de una norma nacional actualizada, ya que la vigente data del año 1946 y no considera varios parámetros, como turbiedad, coliformes, pH, aluminio, nitratos, cadmio, mercurio, cromo, entre otros: para los cuales se ha tomado los valores guía que recomienda la Organización Mundial de la Salud, OMS.Recuperado de: http://www.sunass.gob.pe /doc/normas%20legales/legisla%20web%28cambio%29/normas/calidad%20de%20agua/Oficio%20677.pdf. [ Links ]
Vinodhini, V. & Das, N. (2010). Packed bed column studies on Cr (VI) removal from tannery wastewater by neem sawdust. Desalination, 264 (1-2), 9-14. [ Links ]