Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Producción + Limpia
Print version ISSN 1909-0455
Rev. P+L vol.11 no.1 Caldas Jan./June 2016
Determinación de la concentración de pigmentos carotenoides en harina de residuos de chontaduro (Bactris gasipaes)*
Determination of carotenoid pigments in palm pear fruit (Bactris gasipaes) waste flour
Determinação da concentração de pigmentos carotenoides em farinha de resíduos de pupunha (Bactris gasipaes)
Jader Martínez Girón**, Luis Eduardo Ordóñez Santos***
* Artículo derivado del proyecto de investigación "Microencapsulación de pigmentos carotenoides presentes en residuos de chontaduro (Bactris gasipaes) y su evaluación como colorante natural en productos de panificación" financiado por la Dirección de Investigaciones (DIPAL) de la Universidad Nacional de Colombia-Sede Palmira a través del Proyecto Hermes 19784, realizado entre Febrero de 2014 y Septiembre de 2015.
** Químico y tecnólogo en Alimentos, magíster en Educación, Tesista de maestría en Ingeniería Agroindustrial de la Universidad Nacional de Colombia-Sede Palmira, docente de la Universidad del Valle-Sede Palmira, Colombia.
*** Ingeniero Agroindustrial, doctor en Ciencia y Tecnología en Alimentos, líder del Grupo de Investigación en Procesos Agroindustriales (GIPA), docente de la Universidad Nacional de Colombia-Sede Palmira, Colombia.
Autor correspondencia: Luis Eduardo Ordoñez Santos, E-mail: leordonezs@unal.edu.co.
Artículo recibido: 11/11/2015; Artículo aprobado: 20/05/2016
Resumen
Introducción. Los residuos de chontaduro son subproductos que se generan posterior a su consumo y/o transformación agroindustrial. En el Valle del Cauca, Colombia tradicionalmente se consume el mesocarpio de chontaduro cocido con sal y/o miel. Sin embargo, los residuos que se generan ("piel") en la mayoría de los casos son desechados. Objetivo. Determinar la composición de los pigmentos carotenoides responsables del color característico de la harina obtenida a partir de los residuos de este fruto (HRC), con el fin de contemplar su uso como colorante natural. Materiales y métodos. La identificación y la cuantificación de los carotenoides se consiguió utilizando una columna YMC, columna de fase inversa de carotenoides S-5 C30 (4.60 mm × 150 mm: tamaño de partícula, 5 µm), en un equipo de HPLC utilizando un detector DAD con longitud de onda fijada en 450 nm. Resultados. Los resultados obtenidos en la HRC evidenciaron presencia de violaxantina (1.35 ± 0.10 µg/g), luteína (4.87 ± 0.20 µg/g), zeaxantina ( 4.37 ± 0.20 µg/g). 15-cis β caroteno (3.86 ± 1.40 µg/g), 13-cis β caroteno (25.12 ± 0.23 µg/g), All-trans β caroteno (125.43 ± 3.20 µg/g), 9-cis β caroteno (17.10 ± 0.38 µg/g) y α-caroteno (12.59 ± 2.80 µg/g). Conclusión. La HRC es una importante fuente de carotenoides, principalmente de All-trans β caroteno, pigmento carotenoide que puede ser una fuente importante como colorante natural y provitamina A para la industria alimentaria. Por otra parte, este es uno de los primeros estudios de cuantificación de carotenoides en harina de epicarpio ("piel") de chontaduro.
Palabras clave: β-caroteno, colorante natural, epicarpio, extracción, HPLC.
Abstract
Introduction. The waste of palm pear fruit are byproducts generated after its consumption and/or industrial transformation. In Valle del Cauca, Colombia, the palm pear fruit´s mesocarp is traditionally cooked and consumed with salt or sugar. Nevertheless, the waste generated (peel) is usually thrown away. Objective. Determine the composition of the carotenoid pigments that give the characteristic color to the flour obtained from this fruit, in order to consider its use as a natural colorant. Materials and methods. The identification and quantification of the carotenoids was achieved by the use of a YMC column, reversed-phase column of carotenoids S-5 C30 (4.60 mm × 150 mm: particle size, 5 µm), in a HPLC equipment using a DAD detector with 450nm wavelength. Results. The results obtained in the flour demonstrated that there are: violaxanthin (1.35 ± 0.10 µg/g), lutein (4.87 ± 0.20 µg/g), zeaxanthin (4.37 ± 0.20 µg/g), 15-cis β carotene (3.86 ± 1.40 µg/g), 13-cis β carotene (25.12 ± 0.23 µg/g), All-trans β carotene (125.43 ± 3.20 µg/g), 9-cis β carotene (17.10 ± 0.38 µg/g) and α-carotene (12.59 ± 2.80 µg/g). Conclusion. Palm pear fruit´s flour is an important source of carotenoids, especially All-trans β carotene, a carotenoid pigment that can be an important source of provitamin A and also be a natural colorant for food industries. On the other hand, this is one of the first studies on carotenoids quantification in palm pear fruit´s epicarp flour.
Key words: β-carotene, natural colorant, epicarp, extraction, palm pear fruit.
Resumo
Introdução. Os resíduos de pupunha são subprodutos que se geram posterior a seu consumo e/ou transformação agroindustrial. No Valle del Cauca, Colômbia tradicionalmente se consume o mesocarpo de pupunha cozido com sal e/ou mel. Mas, os resíduos que se geram ("pele") na maioria dos casos são descartados. Objetivo. Determinar a composição dos pigmentos carotenoides responsáveis da cor característica da farinha obtida a partir dos resíduos deste fruto (HRC), com o fim de contemplar seu uso como colorante natural. Materiais e métodos. A identificação e a quantificação dos carotenoides se conseguiu utilizando uma coluna YMC, coluna de fase inversa de carotenoides S-5 C30 (4.60 mm × 150 mm: tamanho de partícula, 5 µm), em um equipamento de HPLC utilizando um detector DAD com longitude de onda fixada em 450 nm. Resultados. Os resultados obtidos na HRC evidenciaram presença de violaxantina (1.35 ± 0.10 µg/g), luteína (4.87 ± 0.20 µg/g), zeaxantina (4.37 ± 0.20 µg/g), 15-cis β caroteno (3.86 ± 1.40 µg/g), 13-cis β caroteno (25.12 ± 0.23 µg/g), All-trans β caroteno (125.43 ± 3.20 µg/g), 9-cis β caroteno (17.10 ± 0.38 µg/g) e α-caroteno (12.59 ± 2.80 µg/g). Conclusão. A HRC é uma importante fonte de carotenoides, principalmente de All-trans β caroteno, pigmento carotenoide que pode ser uma fonte importante como colorante natural e provitamina A para a indústria alimentar. Por outra parte, este é um dos primeiros estudos de quantificação de carotenoides em farinha de epicarpo ("pele") de pupunha.
Palavras chave: β-caroteno, colorante natural, epicarpo, extração, HPLC.
Introducción
Los carotenoides, denominados también como tetraterpenoides, son pigmentos lipofílicos, hidrofóbicos que dan origen al color amarillo, naranja, violeta y rojo en diversos tejidos vegetales como también en algunos tejidos de origen animal. Los carotenoides predominan generalmente en el reino vegetal y están contenidos en tallo, hojas, flores y frutos de muchas plantas, con menor intensidad en la raíz (Namitha y Negi, 2010). Los carotenoides se clasifican en carotenos y xantofilas. Los carotenos están formados por carbono e hidrógeno, presentan características de hidrocarburos y se disuelven mejor en hexano y éter de petróleo. El β-caroteno, α-caroteno y el licopeno son los más representativos de este grupo de carotenoides. Las xantofilas están formadas por carbono, hidrogeno y oxígeno, es decir, son la representación oxidada de los carotenoides. Se disuelven fácilmente en metanol y etanol. Entre estas están: la violaxantina, la luteína, la fucoxantina, el β-apo-8-carotenal, entre otros. (Saini et al. 2015). Algunos carotenoides por su actividad antioxidante son fuente de provitamina A,es decir,son precursores de retinol, la forma activa de la vitamina A. Los carotenoides más abundantes de la dieta que se convierten en vitamina A son: β-caroteno, α-β-caroteno y criptoxantina con β-caroteno que es el precursor más importante de vitamina A, principalmente debido a su prevalencia en algunos vegetales (Haskell, 2013).
Por otra parte, Colombia por su diversidad climática posee diversas matrices naturales de estos pigmentos, entre los que se destacan los frutos de chontaduro (Bactris gasipaes) como una fuente promisoria de pigmentos carotenoides. El contenido de carotenoides en frutos de chontaduro es muy variable de acuerdo con la región de origen, las condiciones de cultivo, el estado de maduración, el tratamiento térmico aplicado, entre otros. Jatunov et al. (2010) y Quesada et al. (2011) realizaron estudios del contenido de carotenoides en frutos de chontaduro de diferentes regiones y encontraron diferencias significativas en todas las variedades evaluadas. Los anteriores autores reportan que el contenido total de carotenoides en mesocarpio de chontaduro puede alcanzar valores promedio de 120 µg/g en fruta fresca, siendo el β-caroteno el carotenoide mayoritario con valores medios de 45 %, seguido del γ-caroteno 32 % y el licopeno 18.50 %. Unido a los carotenoides, este fruto posee altos niveles de fibra, grasa, ocho aminoácidos esenciales, y bajo contenido de sodio y azúcares (Yuyama et al. 2003). El fruto puede consumirse en fresco y cocinado, se utiliza en la agroindustria para la fabricación de harina, almidón, conservas, compotas, mermeladas, jaleas y otros productos de repostería.A su vez,también son comestibles la flor, el endospermo y el cogollo (Bolanho et al. 2014).
Sin embargo, los residuos de chontaduro (Bactris gasipaes), entendiendo como residuos al epicarpio con trazas de mesocarpio ("cascaras"), hasta el momento han sido poco estudiados desde el punto de vista del contenido de carotenoides y propiedades antioxidantes, ya que en la mayoría de los casos son desechados, o empleados en la alimentación animal (Perea et al. 2013).
En el Valle del Cauca, el mesocarpio del fruto de chontaduro se emplea para la alimentación humana y animal, se aprovecha principalmente como fruto cocido, harinas y bebidas fermentadas; sin embargo, ha sido escaso el uso que se le ha dado al epicarpio del fruto. Dado lo anterior, el objetivo de este estudio consistió en evaluar la concentración de los pigmentos carotenoides de la harina obtenida a partir de los residuos ("cáscaras") de frutos de chontaduro (Bactris gasipaes).
Materiales y métodos
Obtención de la harina de residuos de chontaduro
En diferentes puntos del mercado municipal de Palmira-Valle del Cauca (Colombia) fueron adquiridos 15 kilogramos de residuos de chontaduro (Bactris gasipaes) cocido compuestos por epicarpio y restos de mesocarpio. Las muestras fueron sometidas a un proceso de clasificación y limpieza con hipoclorito a 150 ppm y se deshidrataron por convección forzada (60 °C, y velocidad del aire 3 m.s-1) hasta obtener un valor de humedad entre el 9.50 - 11 %. Luego se realizó un proceso de molienda y se pasaron las muestras por un juego de tamices (malla 60) para homogeneizar el tamaño de las mismas a un valor menor e igual a 0.25 mm. La harina obtenida fue almacenada en recipiente de vidrio estéril a 5 °C bajo la aplicación de una atmósfera de nitrógeno y protección a la luz.
Extracción de pigmentos carotenoides
La extracción de pigmentos carotenoides de la harina de residuos de chontaduro se realizó siguiendo el método sugerido por Rodríguez-Amaya y Kimura (2004), Chávez et al. (2005) y Ceballos et al. (2012). Para lo anterior, se partió de 1 gramo de muestra que se depositó en un tubo Falcón con 10 mL de acetona. Después de 10 min, se añadieron 10 mL de éter de petróleo (0.1 % de antioxidante BHT) y se mezclaron utilizando un Ultraturrax (T18 IKA Janke y Kunkel) durante 1 min. A la mezcla se le adicionaron 5 mL de agua destilada y luego fueron centrifugadas, utilizando una centrífuga (Eppendorf 5804R, Hamburgo, Alemania), a 3000 rpm, durante 10 min, a 10 °C. Se recogió la fase orgánica y la extracción se repitió en el residuo, centrifugando la muestra con 5 mL de acetona y 5 mL de éter de petróleo (0.1 % de antioxidante BHT). En total, se realizaron cuatro extracciones hasta que los residuos se tornaron completamente incoloros, indicando la culminación de la extracción de los pigmentos responsables del color en la harina de residuos de chontaduro. La fase orgánica, luego, fue mezclada con 10 mL de solución de NaCl 0.1 N y se centrifugó a 3000 rpm, durante 7 min, a 10 °C. Este proceso de lavado se repitió dos veces adicionales. La fase acuosa fue retirada con una micropipeta Pasteur y la fase lipídica se llevó a un volumen de 40 mL, con éter de petróleo (0.1 % de antioxidante BHT).
Saponificación
Para la saponificación de la muestra, el extracto se disolvió en 40 mL de solución alcohólica de KOH al 10 % diluido en metanol. La solución se colocó en plancha agitadora, en erlenmeyer recubierto con aluminio, se saturó con gas nitrógeno (N2) y el recipiente se dejó completamente sellado durante 16 horas en refrigeración (4°C), para permitir la hidrólisis. A continuación, la mezcla se transfirió a un embudo de separación, y se adicionaron 25 mL de éter: hexano (1:1) y 50 mL de agua destilada. El KOH fue eliminado por lavados sucesivos con una solución al 10 % de NaCl. El extracto se secó bajo una atmósfera de N2 y se disolvió en la fase móvil para HPLC.
Identificación y cuantificación de pigmentos carotenoides
La cuantificación de pigmentos carotenoides se determinó mediante la técnica de cromatografía líquida de alta resolución (CLAR) siguiendo el método sugerido por Rodríguez-Amaya y Kimura (2004) y Ceballos et al. (2012). Para lo anterior 15 mL del extracto se transfirieron en tubos de vidrio estériles recubiertos con papel aluminio y se concentraron mediante un evaporador de nitrógeno (N-Berlín, MA, EE.UU.). Inmediatamente antes de la inyección, en el mismo tubo, el extracto seco se disolvió totalmente en 1.5 mL (1:1) de metanol y metil terc-butil éter (MeOH: MTBE) grado-HPLC; después la muestra se sometió a ultrasonido por 10 s y se agitó en un vórtex VWR de múltiples tubos (2400 rpm; 60 s) y se filtró a través de un filtro de 0.22-0.24 µm de politetrafluoroetileno. La identificación y la cuantificación de los carotenoides se consiguió utilizando una columna YMC, columna de fase inversa de carotenoides S-5 C30 (4.60 mm × 150 mm: tamaño de partícula, 5 µm), en un equipo de HPLC (Agilent Technologies 1200, Waldbronn, Alemania), utilizando un detector DAD con longitud de onda fijada en 450 nm. Los picos se identificaron mediante la comparación del tiempo de retención y características espectrales contra un estándar puro a partir de Carote Nature GmbH, Lupsingen, Suiza: Violaxantina grado-HPLC 95 %; Zeaxantina grado-HPLC 97%; Licopeno grado-HPLC 95 %, β-Criptoxantina grado-HPLC 97 %; Luteína grado-HPLC 97%; α-carotenos grado-HPLC 97 %; β-carotenos grado-HPLC 96 %; (E/Z) -Fitoeno grado-HPLC 98 % y Xantofilas grado-HPLC 90 %; todos marca Sigma-Aldrich Chemical Corporation. El perfil de pigmentos carotenoides se determinó mediante la integración del área del pico contra la curva estándar respectiva. Los carotenoides contenidos en las muestras se estimaron con base en peso seco.
Análisis estadístico
Los resultados se expresaron como valores medios ± SD bajo un diseño unifactorial. La linealidad de la curva (coeficiente de correlación) fue 0.99925 a los 2, 6, 10, 14, 18, 25, 30 niveles de ppm, y sobre la base de tres repeticiones. La desviación estándar en condiciones de repetibilidad fue de 2.2 %. El tratamiento de datos fue evaluado bajo el paquete estadístico SSPS 18 Windows.
Resultados
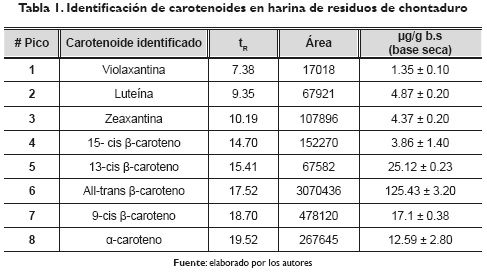
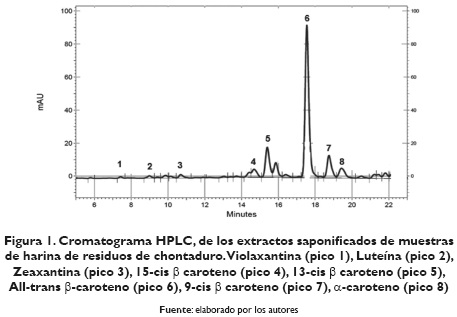
Los pigmentos carotenoides encontrados en la harina de residuos de chontaduro HRC se presentan en la tabla 1 y en la figura 1. Se identificaron por HPLC, 8 tipos de carotenoides en señal detectada a 450 nm. El principal pigmento carotenoide identificado fue el All-trans β-caroteno (pico 6), seguido del 13-cis β-caroteno (pico 5), 9-cis β caroteno (pico 7), α-caroteno (pico 8), luteína (pico 2), zeaxantina (pico 3), 15-cis βcaroteno (pico 4) y violaxantina (pico 1). Las concentraciones para cada uno de los pigmentos obtenidos fue para la violaxantina (1.35 ± 0.10 µg/g), luteína (4.87 ± 0.20 µg/g), zeaxantina (4.37 ± 0.20 µg/g), 15-cis β caroteno (3.86 ±1.40 µg/g), 13-cis β caroteno (25.12 ± 0.23 µg/g), All-trans β caroteno (125.43 ± 3.20 µg/g), 9-cis β caroteno (17.10 ± 0.38 µg/g) y α-caroteno (12.59 ± 2.80 µg/g). Cabe destacar que el All-trans β caroteno es el pigmento que mayor ha sido cuantificado en mesocarpio de chontaduro de acuerdo con lo reportado por Rosso y Mercadante (2007), quienes informaron un valor de 55.51 µg/g en mesocarpio de chontaduro variedad Amazonas. Quesada et al. (2011) encontraron un valor de 24.40 µg/g en mesocarpio de chontaduro variedad Ecuador, y Rojas-Garbanzo et al. (2011) hallaron un valor de 96 ± 1.70 µg/g en mesocarpio de chontaduro variedad Costa Rica.
En la figura 1, se puede observar el cromatograma de identificación de pigmentos carotenoides presentes en harina de piel de chontaduro (HRC). Molecularmente la resonancia de conjugación de los dobles enlaces que presentan las estructuras de los pigmentos carotenoides conforman un cromóforo que permite que estos sean cuantificados por métodos espectrofotométricos como el UV/VIS o mediante el empleo de técnicas instrumentales como lo es la cromatografía líquida de alta resolución (CLAR) (Rodríguez-Amaya, 2001; Scott, 2001).
Una revisión de la literatura indica que las investigaciones adelantadas se han centrado en estudiar la concentración de pigmentos carotenoides presentes en la pulpa (mesocarpio) de chontaduro en fresco, cocido y en harina, sin reportar la concentración de los pigmentos carotenoides presentes en la piel (epicarpio). En este sentido, en relación con la concentración de carotenoides obtenida en otros estudios, Jatunov et al. (2010) adelantaron determinaciones en pulpa de chontaduro cocido de diferentes países encontrando para la variedad Costa Rica 52 ± 0.01 µg/g y para la variedad Brasil 68 ± 0.23 µg/g. Por otra parte, estudios reportados por Rosso y Mercadante (2007) en frutos nativos de la Amazonia Brasileña registraron valores de 197.66 µg/g de carotenoides totales en pulpa de chontaduro en fresco; Rojas-Garbanzo et al. (2011) realizaron estudios en pulpa de frutos cocidos y en harina de pulpa de chontaduro procedentes de Costa Rica, registrando valores de carotenoides totales de 286.90 ± 0.70 µg/g en frutos cocidos y 237.70 ± 0.60 µg/g en harina de pulpa de chontaduro. Al comparar los resultados obtenidos con los anteriormente mencionados, se puede evidenciar que el contenido de carotenoides es altamente variable entre el mesocarpio de chontaduro y la harina de piel de chontaduro. Lo anterior obedece a la reorientación molecular que presentan los pigmentos debido a las condiciones térmicas y mecánicas durante el secado y la molienda que originan una estabilización de bandas isoméricas (Rodríguez-Amaya et al. 2008). Otros estudios existentes han evidenciado que no solo el tratamiento térmico incide en la concentración o disminución de carotenoides en frutos de chontaduro,sino que también difiere dependiendo del origen del material vegetal, la variedad, el estado fisiológico,la variabilidad climática durante el cultivo, las condiciones de almacenamiento y el procedimiento de extracción (Rodríguez-Amaya, 1996; Rosso y Mercadante, 2007). Dado lo anterior, los resultados obtenidos muestran que la concentración de carotenoides en harina de residuos de frutos chontaduro promisorios del Valle del Cauca, Colombia, puede variar significativamente de acuerdo con el tratamiento térmico aplicado (cocción y secado en horno), el acondicionamiento mecánico (molienda y tamizado) y la parte evaluada del fruto (epicarpio y/o mesocarpio).
Todos los carotenoides identificados (tabla 1) fueron reportados en términos de concentración en base seca, de acuerdo con lo sugerido por Rodríguez-Amaya (1996) y Rosso et al. (2007); al igual, todas las muestras analizadas fueron saponificadas debido al alto contenido de extracto etéreo que presentan los frutos de chontaduro (Bactris gasipaes).
Un análisis detallado de los pigmentos carotenoides que se presentan en la tabla 1 muestra que la violaxantina es el carotenoide del grupo de las xantofilas que presentó la concentración más baja en la harina de residuos de chontaduro. En este sentido Rojas-Garbanzo et al. (2011) no encontraron presencia de violaxantina en harina de mesocarpio de chontaduro pero sí identificaron el 9-cis licopeno demostrando una tendencia de variabilidad de los frutos. Sin embargo, en contraste con otras variedades de frutos de palma de chontaduro, es importante resaltar que en este estudio se identificaron tres pigmentos del grupo de las xantofilas (Pico 1, 2 y 3) con una representación del 16.90 %.
El perfil encontrado en este estudio para la harina de residuos de chontaduro permite observar la identificación de los picos característicos de las xantofilas (violaxantina, zeaxantina y la luteína), las cuales ya han sido identificadas en el mesocarpio de frutos de chontaduro de acuerdo con los resultados obtenidos por Jatunov et al. (2010). Valores similares se han cuantificado para β-caroteno, γ-caroteno y α-caroteno como lo han informado, para pulpa de chontaduro, Rosso y Mercadante (2007) y Jatunov et al. (2010). Es de anotar que los porcentajes de equivalencia de carotenoides obtenidos en este estudio presentan similitud a los reportados por Rojas-Garbanzo et al. (2011), quienes encontraron una fracción entre el 70-90 % de equivalencia de β-caroteno, y a su vez confirmaron la identificación del 13 Cis β-caroteno y el 15 Cis β-caroteno en frutos de chontaduro. Por otra parte, Quesada et al. (2011) reportaron que la mayor fracción del perfil de pigmentos carotenoides para el mesocarpio de chontaduro variedad Ecuador y Yurimaguas correspondiópara el pigmento E-β-caroteno.
En este orden de ideas,se observa una significativa correlación metabólica de los pigmentos encontrados en la harina de epicarpio, con respecto a los de mesocarpio. En este estudio el 13 Cis β-caroteno y el 15 Cis β-caroteno fueron encontrados en las muestras de harina de residuos procedentes de frutos de palma de chontaduro, lo que explica la no cuantificación de β-criptoxantina, debido a que de acuerdo con la ruta molecular de biosíntesis retrosintética que siguen los carotenoides se favorecería la formación de fitoeno (Cazzonelli et al. 2010).
Por otra parte, el efecto del tratamiento térmico sobre los pigmentos carotenoides ha sido un tema de gran interés para los procesadores de alimentos. Normalmente el tratamiento térmico de cocción o secado reduce o aumenta el contenido de carotenoides y puede cambiar las propiedades bioactivas de diversos compuestos (Gama y Sylos, 2005). Sin embargo, de acuerdo con los resultados obtenidos en este estudio, a pesar del tratamiento de secado aplicado a los residuos cocidos, se logró cuantificar carotenoides que están presentes en el mesocarpio de chontaduro cocinado. En este sentido Rodríguez-Amaya et al. (2008) reportaron que el tratamiento térmico controlado permite un reordenamiento asociativo de carotenoides con ácidos grasos o proteínas de la fruta (lipoproteínas), a su vez, por la ciclación de algunos de los isómeros α-caroteno y el desprendimiento de grupos hidroxilo (OH-) con conjugación de moléculas de agua en uno de los anillos cíclicos insaturados desactivados por las transferencias de calor desde el agua a la fruta por conducción (Martínez y Ordoñez, 2015).
Es importante anotar que el All-trans β caroteno y el 13-cis β caroteno fueron los pigmentos que presentaron la mayor concentración en la harina de residuos de chontaduro. A su vez, son dos de los principales pigmentos carotenoides que se constituyen como fuente de provitamina A. Según lo reportado por Saini et al. (2015), el All-trans β caroteno presenta una conversión del 100 % a provitamina A y el 13-cis β caroteno presenta una conversión del 53 %. Los carotenoides tienen la propiedad de transformarse biológicamente a vitamina A, mediante la actividad de provitamina A, a partir de alimentos generalmente de origen vegetal y algunos de origen animal. La ventaja de la provitamina A es su actividad para convertirse en vitamina A únicamente cuando lo requiere el cuerpo, evitando la toxicidad por sobredosis de vitamina A. Para que haya actividad provitamina A el requerimiento mínimo es una cadena poliénica de 11 carbonos con un anillo β-ionona no sustituido; por lo tanto, el fitoflueno y el licopeno no son provitamina A por carecer de anillos β-ionona. A su vez, la zeaxantina, astaxantina, luteína y violaxantina poseen anillos β sustituyentes, por lo tanto, no son provitamina A (Haskell, 2013).
Debido a los pigmentos carotenoides encontrados en la harina de residuos de chontaduro, este producto, desde el punto de vista agroindustrial, puede ser empleado en la industria alimentaria como una alternativa de colorante natural y/o sustituto de harina. En este sentido, otros autores han adelantado investigaciones con el fin de encontrar harinas estables obtenidas a partir de cáscaras de frutas que aporten compuestos bioactivos y que puedan ser empleadas como sustituto parcial de harina de trigo en productos de panadería y pastelería. Tenemos el caso de Aziah et al. (2011), quienes realizaron el análisis nutricional y sensorial de tortas elaboradas con adición de harina de cáscara de mango. Por otra parte, Garzón et al. (2011) desarrollaron un producto de panadería de alto valor nutricional a partir de harina obtenida de banano verde con cáscara.
Conclusiones
De la presente investigación se puede concluir que la harina de residuos de chontaduro es una importante fuente de pigmentos carotenoides al presentar concentraciones de All-trans β caroteno (125.43 ± 3.20 µg/g), 13-cis β caroteno (25.12 ± 0.23 µg/g), 9-cis β caroteno (17.1 ± 0.38 µg/g), α-caroteno (12.59 ± 2.80 µg/g), luteína (4.87 ± 0.20 µg/g), zeaxantina (4.37 ± 0.20 µg/g), 15-cis β caroteno (3.86 ± 1.40 µg/g) y violaxantina (1.35 ± 0.10 µg/g). Los anteriores pigmentos carotenoides encontrados en la harina de residuos de chontaduro convierten a este subproducto en una posible alternativa de colorante natural que podría ser evaluada como sustituto parcial en diferentes matrices biológicas.
Agradecimientos
Los autores expresan sus agradecimientos al laboratorio de Calidad Nutricional CIAT-Palmira, al laboratorio de Investigación de Frutas y Hortalizas de la Universidad Nacional de Colombia-Sede Palmira y a la Dirección de Investigaciones (DIPAL) de la Universidad Nacional de Colombia-Sede Palmira por el financiamiento de reactivos,equipos y materiales empleados en esta investigación.
Referencias bibliográficas
Aziah A.; Noor, W.; Lee Min y Rajeev Bhat. (2011). Nutritional and sensory quality evaluation of sponge cake prepared by incorporation of high dietary fiber containing mango (Mangifera indica var. Chokanan) pulp and peel flours. International Journal of Food Sciences and Nutrition, 62(6), 559-567. [ Links ]
Bolanho, B.; Eliane Danesi y Adelaide del Pino, B. (2014). Characterization of flours made from peach palm Bactris gasipaes Kunth) byproducts as a new food ingredient. Journal of Food and Nutrition, 53(1), 51-59. [ Links ]
Cazzonelli, C. y Pogson, B. (2010). Source to sink: regulation of carotenoid biosynthesis in plants. Trends in Plant Science, 15, 266-274. [ Links ]
Ceballos, H.; Luna, J.; Escobar, A.; Pérez, J.; Ortiz, D., Sánchez, T.; Pachón, H. y D. Dufour, D. (2012). Spatial distribution of dry matter in yellow fleshed cassava roots and its influence on carotenoids retention upon boiling. Food Research International, 45, 52-59. [ Links ]
Chávez, A.; T. Sánchez, G.; Jaramillo, J.; Bedoya, J.; Echeverry, E.; y Bolaños. (2005). Variation of quality traits in cassava roots evaluated in landracees and improved clones. Euphytica, 143, 125-133. [ Links ]
De Rosso V. y Mercadante A (2007). Identification and quantification of carotenoids, by HPLCPDA-MS/MS, from Amazonian fruits. Journal of Agricultural and Food Chemistry, 55, 5062-5072. [ Links ]
Gama, J. y C. Sylos. (2005). Major carotenoid composition of Brazilian Valencia orange juice: identification and quantification by HPLC. Food Research International, 38, 899-903. [ Links ]
Garzón, M.; Acosta, L.; Cardona-María, L.; Hurtado, A.; Rodríguez, A.; Taborda, N. y Mejía, G. (2011). Desarrollo de un producto de panadería con alto valor nutricional a partir de la harina obtenida del banano verde con cáscara: una nueva opción para el aprovechamiento de residuos de la industria de exportación. Producción Más Limpia, 6(1), 96-107. [ Links ]
Haskell, M. (2013). Provitamin A carotenoids as a dietary source of vitamin A. In S. A. Tanumihardjo (Ed.), Carotenoids and human health. Humana Press, 249-260. [ Links ]
Jatunov, S.; Quesada, S.; Díaz, C. y Murillo E. (2010). Carotenoid composition and antioxidant activity of the raw and boiled fruit mesocarp of six varieties of Bactris gasipaes. Archivos Latinoamericanos de Nutrición, 60(1), 99-104. [ Links ]
Martínez-Girón and Ordoñez-Santos. (2015). Efecto del procesamiento térmico sobre el color superficial del pimentón rojo (Capsicum annuum) variedad nataly. Revista Biotecnología en el Sector Agropecuario y Agroindustrial, 13(2), 104-113. [ Links ]
Namitha, K. y Negi, P. S. (2010). Chemistry and biotechnology of carotenoids. Critical Reviews in Food Science and Nutrition, 50(8), 728-760. [ Links ]
Perea, D.; Guardia M.; Medina H. y Hinestroza L. (2013). Bromatological characterization plants species and by-products in the humid tropic of Colombia. Acta Agronómica. Colombia. 62(4), 326-332. [ Links ]
Quesada, G.; Sorel, G.; Navarro, L. y Gómez, G. (2011). Carotenoids composition, antioxidant activity and glycemic index of two varieties of Bactris gasipaes. Emirates Journal of Food and Agriculture, 23 (6), 482-489. [ Links ]
Rodríguez-Amaya D. (1996). Assessment of the provitamin A contents of foods - the Brazilian experience. Journal of Food Composition and Analysis, 9, 196-230. [ Links ]
Rodríguez-Amaya, D. (2001). A guide to carotenoid analysis in foods. Washington DC: ILSI Press. [ Links ]
Rodriguez-Amaya, D. y Kimura, M. (2004). HarvestPlus handbook for carotenoid analysis. HarvestPlus Tech. Monogr. 2. International Food Policy Research Institute (IFPRI) and International Center for Tropical Agriculture (CIAT). Washington, DC and Cali, Colombia, 14-23. [ Links ]
Rodríguez-Amaya DB, Kimura M, Godoy HT, Amaya-Farfan J. (2008). Updated Brazilian database on food carotenoids: Factors affecting carotenoid composition. Journal of Food Composition and Analysis, 21, 445-463. [ Links ]
Rojas-Garbanzo C., Pérez A. M., Bustos-Carmona J., Vaillant F., Identification and quantification of carotenoids by HPLC-DAD during the process of peach palm (Bactris gasipaes H.B.K.) flour. (2001). Food Research International, 44, 2377-2384. [ Links ]
Saini Ramesh Kumar, Shivraj Hariram Nile, Sewon Park. (2015). Carotenoids from fruits and vegetables: Chemistry, analysis, occurrence, bioavailability and biological activities. Food Research International, 76, 735-750. [ Links ]
Scott, J. (2001). Detection and measurement of carotenoids by UV/VIS spectrophotometry. In R. Wrolstad, T. Acree, E. Decker, M. Penner, D. Reid, S. Schwartz, C. Shoemaker, D. Smith, & P. Spoms (Eds.). Current Protocols in Food Analytical Chemistry, A2, F2.2.1-F2.2.10. [ Links ]
Yuyama, L.; Aguiar, J.; Yuyama, K.; Clement, C.; Macedo, S.; Fávaro, D.; Afonso, C.; Vasconcellos, M.; Pimentel, S. Badolato, E. y Vannucchi, H. (2003). Chemical composition of the fruit mesocarp of three peach palm (Bactris gasipaes) population grown in Central Amazonia, Brazil. International Journal of Food Sciences and Nutrition, 54, 49-56. [ Links ]