Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Producción + Limpia
versão impressa ISSN 1909-0455
Rev. P+L vol.11 no.2 Caldas jul./dez. 2016
https://doi.org/10.22507/pml.v11n2a9
DOI: http://dx.doi.org/10.22507/pml.v11n2a9
Aprovechamiento de las escamas de la industria acuícola en el departamento del Huila, Colombia*
Use of fish scales from acuicultural industries in the Huila Province, Colombia
Aproveitamento das escamas da indústria aquícola no departamento Huila, Colômbia
Angela Goretty García Gómez**, Rodrigo Romero Ramos***, Hans Thielin Castro Salazar
* Proyecto desarrollado mediante convenio 008 del 2014; entre Corredor Tecnológico de la Gobernación del Huila, Proceal S. A., Corporación Universitaria del Huila Corhuila, Corporación Centro de Desarrollo Tecnológico Surcolombiano Acuapez; Centro de formación Agroindustrial-Huila SENA.
** Magister en Ingeniería área Civil con énfasis en Gestión Ambiental. Docente asistente Departamento de Ciencias Naturales y Exactas Universidad Surcolombiana. Neiva, Colombia
*** Tecnólogo en Acuicultura. Corporación Centro de Desarrollo Tecnológico Surcolombiano ACUAPEZ. Neiva, Colombia
**** Doctor en Química. Corporación Universitaria del Huila Corhuila.
Autor para correspondencia: Angela Goretty García Gómez, email: angela.garcia@usco.edu.co
Artículo recibido: 26/05/2016; Artículo aprobado: 30/11/2016.
RESUMEN
Introducción. En el mundo la industria acuícola representa casi el 50 % de los productos pesqueros existentes, y el Huila ocupa el primer lugar en Colombia en producción y exportación de Tilapia (Oreochromis sp); sin embargo, como toda actividad industrial de transformación, en esta se generan una serie de residuos que afectan al medioambiente uno de ellos son las escamas; las cuales, en algunos casos son arrojados a los cuerpos de agua produciendo un aumento en la carga orgánica, o en otros son enterradas, aumentando la proliferación de vectores como moscas y roedores; en pro de tener una industria enmarcada en los normas del desarrollo sostenible.
Objetivo. Buscar alternativas para la valorización de las escamas generadas en las diferentes etapas de procesamiento de Tilapia (Orechromis sp), con el fin de obtener biopolímeros, como la quitina y el quitosano; los cuales tienen grandes aplicaciones para la industria farmacéutica y cosmética.
Materiales y métodos. Para ello, las escamas fueron sometidas a un proceso de limpieza y de secado, y posteriormente a técnicas químicas de desmineralización, desproteinización y desacetilación, con el fin de obtener los productos deseados; las escamas fueron tratadas con NaOH 0,5N a 80 °C por 4 h, luego mezcladas con HCL 1,25N a 30 °C por 8 h, y llevadas a pH neutro; para la fase de desacetilación se evaluaron dos técnicas, una con una base fuerte que se trató de NaOH a 0,75N a una temperatura de 100 °C denominada (Ml), y la otra con un ácido fuerte de HCl a 37 % por 24 h (M2).
Resultados. Se obtuvieron resultados positivos para el análisis infrarrojo en apatita, hidroxiapatita, y quitosano.
Conclusión. La obtención de este polímero implica una opción de valorización de este subproducto, con el fin de que la industria piscícola huilense aumente sus ingresos y se desarrolle sosteniblemente este sector.
Palabras clave: quitosano, escamas de pescado, Huila.
ABSTRACT
Introduction. Acuicultural industries represent almost 50 % of the fish products available and Huila province holds the first place in Colombia in terms of tilapia fish (Oreochromis sp) production and exports. Nevertheless, like any transformation industrial activity, it generates waste products that affect the environment and fish scales are one of them. In some cases they are thrown into the water bodies, increasing the organic matter content, or buried, increasing the proliferation of vectors such as flies or rodents. In order to have an industry that meets the sustainable development standards.
Objective. Alternatives to make the fish scales generated by the different stages of tilapia fish processing an asset were sought, aiming to obtain biopolymers such as chitin and chitosan, which have great application chances in the pharmaceutical and the cosmetic industries.
Materials and method. For that purpose, the scales were cleaned and dried and, later, chemically demineralized deproteinized and deacetylated in order to obtain the products intended. The scales were treated with NaOH 0,5N at 80 °C for four hours, then mixed with HCL l,25N at 30 °C during eight hours and taken to neutral pH. For the deacetylation, two techniques were evaluated: one with a strong base, NaOH at 0,75N at 100 °C called (Ml) and the other with a strong acid of HCl at 37 % during 24 hours called (M2).
Result. Obtaining positive results in the infrared analysis for apatite, hydroxyapatite, and chitosan.
Conclusion. The acquisition of this polymer implies an option of valorization of this byproduct, in order that the fish industry huilense increase its income and this sector is developed sustainably.
Key words: chitosan, fish scales, Huila.
RESUMO
Introdução. No mundo a indústria aquícola representa quase 50 % dos produtos pesqueiros existentes, e o Huila ocupa o primeiro lugar na Colômbia em produção e exportação de Tilapia (Oreochromis sp); mas, como toda atividade industrial de transformação, nesta se geram uma série de resíduos que afetam ao meio-ambiente um deles são as escamas; as quais, em alguns casos são jogados aos corpos de água produzindo um aumento na carga orgânica, ou em outros são enterradas, aumentando a proliferação de vectores como moscas e roedores; em pró de ter uma indústria marcada nas normas do desenvolvimento sustentável. Objetivo. Pesquisar alternativas para a valorização das escamas geradas nas diferentes etapas de processamento de Tilapia (Orechromis sp), com o fim de obter biopolímeros, como a quitina e o quitosana; os quais tem grandes aplicações para a indústria farmacêutica e cosmética. Materiais e método. Para isto, as escamas foram submetidas a um processo de limpeza e de secado, e posteriormente a técnicas químicas de desmineralização, des-proteinização e des-acetilação, com o fim de obter os produtos desejados; as escamas foram tratadas com NaOH 0,5N a 80 °C por 4 h, logo misturadas com HCL 1,25N a 30 °C por 8 h, e levadas a pH neutro; para a fase de desacetilaç desacetilação se avaliaram duas técnicas, uma com uma base forte que se tratou de NaOH a 0,75N a uma temperatura de 100 ºC denominada (M1), e a outra com um ácido forte de HCl a 37 % por 24 h (M2). Resultado. obtendo resultados positivos para a análise infravermelho em apatita, hidroxiapatita, e quitosana. Conclusão. A obtenção desse polímero envolve uma avaliação da opção deste produto, para que a indústria da piscicultura huilense aumentar sua renda e sustentável desenvolver este sector.
Palavras chave: quitosana, escamas de peixe, Huila.
INTRODUCCIÓN
En el ámbito mundial la industria acuícola representa casi el 50 % de los productos pesqueros, destinado a la alimentación, (FAO, Organización de la Naciones Unidas para la Alimentación y la Agricultura, 2014). Esta práctica se ha caracterizado por un notable crecimiento en la década del 2000, con una producción estimada en el mundo de ll,2 millones de toneladas en 2010 (FAO, Organización de las Naciones Unidas para la Agricultura y la Alimentacion, 2012). Colombia no ha sido ajeno a este crecimiento, y fue el departamento del Huila el que generó el 43 % de la producción total de tilapia roja y negra en el año 2011 (Fedesarrollo, 2015).
Sin embargo, como toda actividad industrial, esta genera una serie de contaminación a lo largo de toda la cadena productiva; tal es el caso de los procesos de producción y procesamiento de peces; en este primer proceso se pueden generar impactos ambientales por la carga orgánica, los nutrientes, los medicamentos y los pesticidas aplicados (European Commission, 2015); asimismo, las actividades de procesamiento pueden generar impactos en el agua, procedentes de peces muertos, residuos de pescado como cabezas, esqueletos, aletas, escamas, restos de piensos, efluentes, envases y embalajes (JACUMAR; Junta Nacional asesora de cultivos marinos, 2008); a pesar de estos impactos negativos ambientales, se debe propender por desarrollar una industria acuícola huilense económica y ambientalmente sostenible.
Diversas organizaciones mundialmente se han centrado en desarrollar la acuicultura desde una perspectiva de desarrollo sostenible (European Commission, 2015); siguiendo estas directrices al nivel tanto nacional como internacional, se promueve la investigación para la recuperación, eliminación y reutilización de los residuos sólidos generados en el procesamiento de los peces (Centro de Cooperación del Mediterraneo de UICN, 2007); Autoridad Nacional de Acuicultura y pesca (AUNAP) y Organización de las Naciones Unidas para la alimentación y agricultura FAO, 2014), ya que se estima que los residuos generados del procesamiento pueden llegar a ser superiores al 50 % del peso total del pez (Fabienne Guérard, Daniel Sellos, y Yves Le Gal, 2005); entre estos residuos, las escamas del pez son las menos aprovechadas, a pesar de contener proteínas como colágeno tipo I y apatita (fosfato de calcio, carbonato de magnesio y carbonato de calcio) que pueden ser aprovechados (Muslim, Rahman, Begum, y Rahman, 2013).
Algunas investigaciones en el ámbito internacional se han realizado para el aprovechamiento de las escamas con el fin de obtener biopolímeros como son la quitina y el quitosano, productos utilizados en las industrias cosmética, farmacéutica, bioquímica, biomédica, y para el tratamiento de aguas residuales, entre otros usos. Uawonggul, Kongsri y Chanthai et al. (2011) obtuvieron estos biopolímeros a partir de escamas de tilapia (tilapia nilótica) con el fin de tratar aguas residuales. Por otro lado, Muslim, Rahman, Begum y Rahman (2013), obtuvieron quitosano y carboxiquitosano a partir de escamas de Labeo rohitay, demostrando que es viable obtener este polímero a partir de las escamas de peces, ya que la mayor síntesis industrial para la obtención de estos polímeros se lleva a cabo a partir de los caparazones de crustáceos (Sierra, Orozco, Quintana, y Ospina, 2013).
Esta investigación se basa en la obtención de quitosano a partir de las escamas de tilapia roja y negra (Oreochromis sp), por métodos químicos con el fin darle un valor agregado a este subproducto, generado en la industria acuícola del departamento del Huila.
MATERIALES Y MÉTODOS
La materia prima fueron las escamas de tilapia roja y Negra (Oreochromis sp) proporcionadas directamente por la planta procesadora de carne de pescado Frigorífico del Sur de Proceal S. A., ubicada en el municipio de Rivera-Huila; todos los reactivos utilizados en los ensayos fueron grado analítico.
Inicialmente, la materia prima fue sometida a un proceso de adecuación en el edificio de laboratorios de la Corporación Universitaria del Huila, Corhuila; las escamas fueron lavadas con agua potable, con el fin de eliminar toda la materia orgánica adherida como agallas, cola, vísceras, piel, espinas; una vez limpias y libres de impurezas, fueron secadas en un invernadero solar por 3 días a una temperatura promedio de 45 °C; posteriormente se procedió a triturar las escamas secas en un molino industrial de 1 caballo de fuerza y se clasificaron en un tamiz de 500 micras, obteniendo un tamaño de partícula adecuado para su extracción. De acuerdo con Sierra, Orozco, Quintana y Ospina (2013), los protocolos para la extracción de quitina y quitosano cuentan con los procesos de acondicionamiento del material, desproteinización, desmineralización, y desacetilación; este último paso, necesario para la obtención de quitosano.
Siguiendo con esta metodología las muestras fueron sometidas a los siguientes procesos:
Desproteinización
Este proceso consiste en eliminar las proteínas; para esto se preparó una solución de NaOH (hidróxido de sodio), a una concentración de 0,3 N en una relación 1:5 a una temperatura de 80 °C y por un tiempo de 4 horas.
Desmineralización
Esta etapa del proceso consiste en eliminar los minerales de calcio presentes en las escamas; esto se realizó con una solución de ácido clorhídrico a una concentración de 0,5N relación 1:5 a temperatura ambiente por 8 horas. La purificación se llevó a cabo con NaOH 0,75 N relación 1:5 a una temperatura de 100 °C por una hora; posteriormente fue filtrado y secado a 60 °C por dos horas para proceder a la desacetilación.
Desacetilación
Esta etapa del proceso es cuando se trata de eliminar los grupos acetilos, lo cual se puede realizar con una base o con un ácido fuerte; la base escogida fue hidróxido de sodio a una concentración del 40 % y una relación de 1:5, la cual llamaremos Ml; adicionalmente, se llevó a cabo la desacetilación con un ácido fuerte como es el ácido clorhídrico en una concentración de 37 % relación 1:5. M2, y se envió para su análisis una muestra de quitosano comercial extraido de los caparazones de cangrejos M3.
Análisis de las muestras
Las muestras fueron enviadas para su análisis por difracción de rayos X al laboratorio de rayos X de la Universidad Industrial de Santander, UIS, y analizadas por un difractómetro de polvo marca BRUNKER modelo D8 ADVANCE con Geometría DaVinci con un voltaje de 40kV, corriente de 30mA, y rendija de divergencia 0,6mm.
RESULTADOS Y DISCUSIÓN
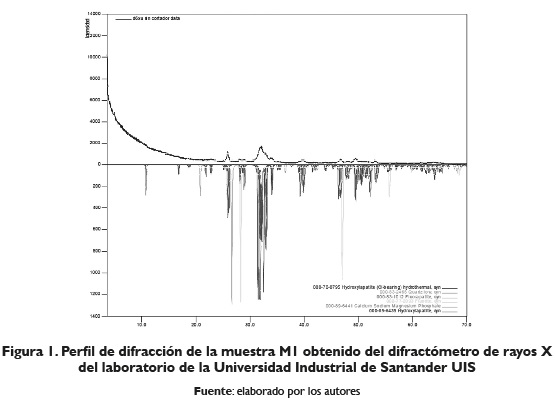
A continuación, se muestran los perfiles de difracción de rayos X obtenidos de las muestras identificadas como M1, M2 y M3.
En la muestra denominada MI de la figura I, se observa presencia de hidroxiapatita, fosfato de calcio, de sodio y magnesio, carbonato y apatita, indicando que no se descompuso totalmente la fracción de escamas. Las muestras denominadas M2 y M3 figuras II y III respectivamente, presentaron algunas similitudes en sus perfiles de difracción. En la figura II (M2), se observan tres bandas características ubicadas a 8,92°; 20,00° y 40,22° en el eje 2Theta. Además, se observan tres reflexiones adicionales con poca intensidad, ubicadas a 27,78°, 29,31° y 35,11° en el eje 2Theta, las cuales no pudieron ser asignadas a alguna fase reportada en la base de datos de la PDF-2. del International Centre for Diffraction Data (ICDD); por otro lado, en la figura III (M3), la cual corresponde al quitosano comercial, se observan, en su perfil de difracción, tres bandas características ubicadas a 9,15°, 20,09° y 40,28° en el eje 2Theta. Además, se observan cuatro reflexiones adicionales con poca intensidad ubicadas a 29,47°, 34,92°, 36,14° y 38,18° en el eje 2Theta, que no pudieron ser asignadas a alguna fase reportada en la base de datos de la PDF-2.
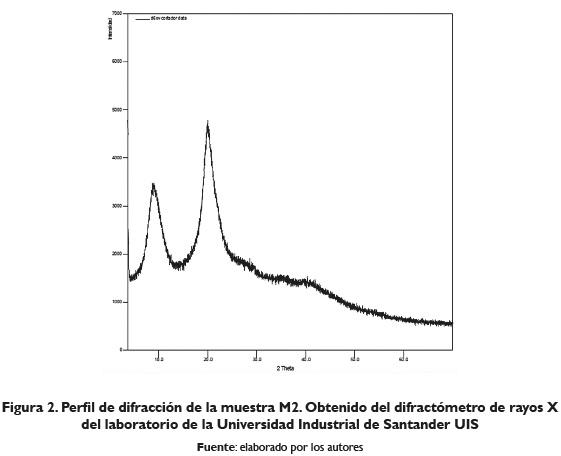
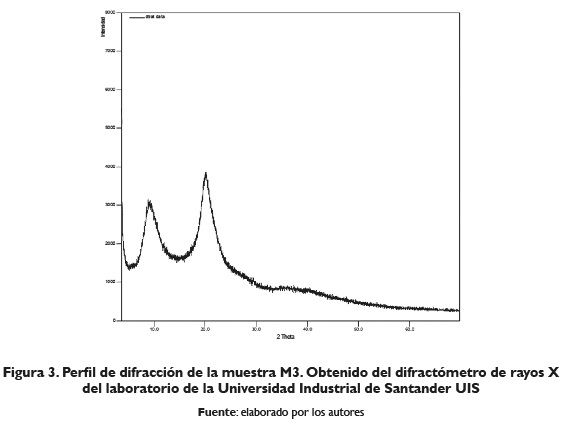
Al realizar una búsqueda en la base de datos de la PDF2 del International Centre for Diffraction Data (ICDD) no se encuentra coincidencia con el perfil de difracción reportado para el quitosano; sin embargo, según Judson Wong (2013) el quitosano extraído de cáscaras de camarón presenta dos picos anchos de difracción ubicados a 10° y 21° en el eje 2 Theta, coincidiendo con dos de los picos obtenidos en los dos difractogramas de M2 y M3.
Los espectros de difracción reportados por Entsar, Khaled y Maher (2008) obtenidos para quitina y quitosano de diferentes fuentes, como concha de camarón marrón (Penaeus Aztecus) (BS), conchas de camarón rosa (Penaeus durarum) (PS), plumas de sepia (CT), plumas de calamar (SQ), conchas de cangrejo (CR) y conchas de cigala (CF) presentaron picos para la quitina en el espectro de difracción de rayos X alrededor de 9-10° en el eje 2Theta, y en 20-21°, eje 2Theta; sin embargo, argumentan que la nitidez de las bandas es mayor en las muestras de quitina que en su análogo de quitosano, y que para el quitosono la banda de 9.9° disminuye después de la desacetilación. Por otro lado, Kumaril, Rath y Kumar (2016), obtuvieron quitosano a partir de cáscaras de camarón y de escamas de peces los cuales mostraron diferentes picos característicos a valores de 19,50°, 29,52° y 32,21°, eje 2Theta, mientras que el quitosano de escamas de pescado exhibió picos a 25,79 y 32,02°, lo cual coincide parcialmente con los picos hallados en las muestras analizadas M2 y M3, lo que proporciona un indicio de la obtención de quitosano.
Las aproximaciones obtenidas del porcentaje de cristalinidad de las muestras M2 y M3 fueron determinadas con el programa Diffract Suite TOPAS, a partir de la descripción de la contribución de la intensidad procedente de la parte cristalina y amorfa, mediante el método de única línea de ajuste (Single line fitting) en el rango de 4°-60° eje 2Theta. Los ajustes obtenidos se pueden observar en las figuras 4 y 5.
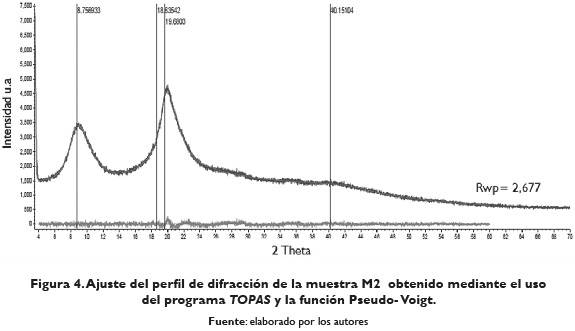
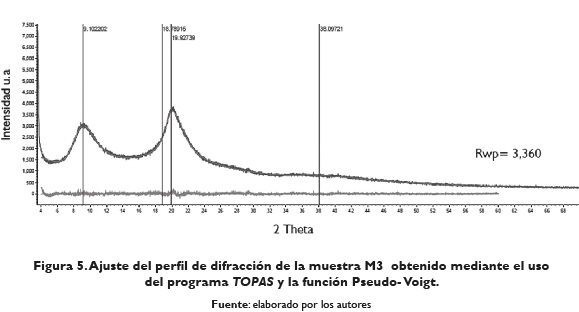
Al considerar las reflexiones con poca intensidad ubicadas a 27,78°; 29,31° y 35,11° eje 2Theta, durante el ajuste del perfil de difracción mediante el uso del programa TOPAS, se obtiene un porcentaje de cristalinidad de 81 % para la muestra M2 con un valor de Rwp o factor del difractograma ponderado, "weight profile R- factor", de 2,677. De igual manera las aproximaciones obtenidas del porcentaje de cristalinidad de la muestra M3, ubicadas a 29,47°, 34,92°, 36,14° y 38,18° eje 2Theta reportan un porcentaje de cristalinidad de 75,17 % con un valor de Rwp de 3,360. En la tabla 1 se presenta el porcentaje de cristalinidad para la quitina y el quitosano obtenido de diferentes fuentes marinas.
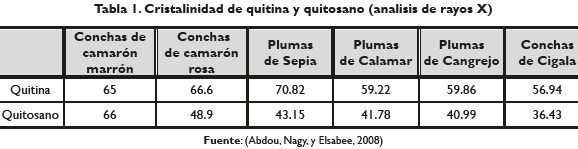
Al comparar estos valores del porcentaje de cristalinidad reportados en el cuadro anterior, se plantea que en el proceso de desacetilación se da un caos en el ordenamiento de las moléculas del polímero, lo cual se manifiesta con un porcentaje de cristalinidad menor en el quitosano que en la quitina; concordando con lo argumentado por Zaku, Emmanuel, Aguzue y Thomas (2011), ya que que la nitidez de las bandas es mayor en las muestras de quitina que en su análogo de quitosano, con ligera disminución en el porcentaje cristalino. Sin embargo, difiere con lo reportado en este estudio, ya que el porcentaje de cristalización fue mayor en la muestra obtenida de las escamas de tilapia, que en el quitosano comercial.
CONCLUSIONES
El quitosano fue extraído de las escamas de tilapia proveniente del departamento del Huila, en donde su preparación siguió los pasos de desmineralización, seguida de desproteinización y desacetilación. El quitosano obtenido M2 mostró similitudes con el quitosano comercial M3, en lo referente a los picos reportados en 10° y 21° utilizando el difractómero de rayos X, por lo cual podemos decir que es factible obtener quitosano de las escamas de la tilapia (Oreochromis sp); en cuanto al porcentaje de cristalinidad, presentó mejores resultados el quitosano obtenido a partir de escamas de tilapia, con 81 %, utilizando para el proceso de desacetilación un ácido fuerte como es el ácido clorhídrico en una concentración de 37 %; el haber obtenido este polímero implica que puede llegar a ser una opción de valorización de este subproducto con el fin de que la industria piscícola huilense aumente sus ingresos y se desarrolle sosteniblemente este sector.
AGRADECIMIENTOS
Los autores agradecen al Centro de Investigación Piscícola Acuapez, así como a la Procesadora de Alimentos (Proceal) y a la Gobernación del Huila, y a la Corporación Universitaria del Huila, Corhuila, por los recursos económicos y el apoyo realizado en esta investigación.
REFERENCIAS BIBLIOGRÁFICAS
Abdou, E., Nagy, K., & Elsabee, M. (2008). Extraction and characterization of chitin and chitosan from local sources. Bioresource Technology, 99, 1359-1367. [ Links ]
Autoridad Nacional de Acuicultura y pesca (AUNAP) y Organización de las Naciones Unidas para la alimentación y agricultura FAO. (2014). Plan Nacional para el Desarrollo Sostenible de la Acuicultura en Colombia PlaNDAS. Recuperado el 20 de 06 de 2016, de Pagina de AUNAP: http://aunap.gov.co/wp-content/uploads/2016/04/Plan-Nacional-para-el-Desarrollo-de-la-Acuicultura-Sostenible-Colombia.pdf. [ Links ]
Centro de cooperación del Mediterráneo de UICN. (2007). Guía para el Desarrollo Sostenible de la Acuicultura Mediterránea. Interacciones entre la Acuicultura y el Medio Ambiente. Recuperado el 22 de 03 de 2016, de uicn.org: https://www.iucn.org/sites/dev/files/import/downloads/interactions_es_lr.pdf. [ Links ]
Emilio, C. (2010). Propuesta de automatización y control para un proceso de obtención de un polímero biodegradable llamado "Quitosano. México: escuela superior de ingeniería mecánica y eléctrica. [ Links ]
European Commission. Science for Environment Policy Sustainable Aquaculture. Recuperado el 15 de 04 de 2016, de Comisión Europea: http://ec.europa.eu/environment/integration/research/newsalert/pdf/sustainable_ aquaculture_FB11_en.pdf. [ Links ]
Fabienne Guérard, Daniel Sellos, & Yves Le Gal. (2005). Fish and Shellfish Upgrading, Traceability. En R. Ulber, & Y. L. Gal, MARINE BIOTECHNOLOGY I (pág. 127). New York: Springer. [ Links ]
Fao, (2003). Fao.org. Recuperado el 15 de 03 de 2016, de fao sala de prensa en profundidad: http://www.fao.org/spanish/newsroom/focus/2003/aquaculture-defs.htm. [ Links ]
Fao, Organización de la Naciones Unidas para la alimentación y la agricultura. (2014). El estado mundial de la pesca y la acuicultura, oportunidades y desafios. Recuperado el 16 de 04 de 2016, de FAO.org: http://www.fao.org/3/a-13720s.pdf. [ Links ]
Fao, Organización de las Naciones Unidas para la Agricultura y la Alimentacion. (2012). El estado mundial de la pesca y la acuicultura. Recuperado el 18 de 02 de 2016, de FAO. org: http://www.fao.org/3/a-12727s.pdf. [ Links ]
Fao. (2011). Estado Mundial de la Pesca y la Acuiculltura. [ Links ]
Fedesarrollo, (15 de Agosto de 2015). La economía en el departamento del Huila: Diagnóstico y perspectivas a mediano plazo. Recuperado el 28 de febrero de 2016, de andi.com.co: http://www.andi.com.co/SecTH/Documents/ESTUDIO%20REGIONAL%20HUILA%20FINAL%20Ago%2014.pdf. [ Links ]
Gammons, C., Slotton, D., Gerbrandt, B., Weight, W., Young, C., McNearny, R., y otros. (2006). Mercury concentrations of fish, river water, and sediment in the Rio Ramis-Lake Titicaca watershed, Peru. Science of the Total Environment (368), 637-648. [ Links ]
Jacumar; Junta Nacional asesora de cultivos marinos. (2008). Guía de minimización de residuos acuicultura. Madrid: Ministerio del Medio Ambiente y Medio rural y marino. [ Links ]
Kumari, S., Rath, P., & Kumar, S. (2016). Chitosan from shrimp shell (Crangon crangon) and fish scales (Labeorohita): Extraction and characterization. African Journal of Biotechnology, 1258-1268. [ Links ]
Muslim, T., Rahman, M., Begum, H. & Rahman, M. (2013). Chitosan and Carboxymethyl Chitosan from Fish Scales of Labeo rohita. Dhaka Univ. J. Sci, 61 (1), 145-148. [ Links ]
Sierra, D., Orozco, C., Quintana, M. , & Ospina, W. (2013). Optimización de un protocolo de extracción de quitina y quitosano desde caparazones de crustáceos. Scientia et Technica, 18 (1), 260-266. [ Links ]
Uawonggul, N., Kongsri, S., & Chanthai, S. (2011). Study on Dye-Binding Interactions of Chitosan Obtained from the Fish Scale of Tilapia (Tilapia nilotica). International Journal of Pure & Applied Chemistry, 6 (2), 139-147. [ Links ]
Wong, J. (2013). Synthesis and characterisation of chitosan from shrimp shells. Universidad Tunku Abdul Rahman. [ Links ]
Zaku, S., Emmanuel, S., Aguzue, O., & Thomas, S. (2011). Extraction and characterization of chitin; a functional biopolymer obtained from scales of common carp fish (Cyprinus carpio 1.): A lesser known source. African Journal of Food Science, 5 (8), 478 - 483. [ Links ]














