Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Producción + Limpia
versão impressa ISSN 1909-0455
Rev. P+L vol.11 no.2 Caldas jul./dez. 2016
https://doi.org/10.22507/pml.v11n2a11
DOI: http://dx.doi.org/10.22507/pml.v11n2a11
Remoción de metales pesados comúnmente generados por la actividad industrial, empleando macrófitas neotropicales*
Removal of heavy metals commonly generated by industrial activities, by means of neotropical macrophytes
Remoção de metais pesados comumente gerados pela atividade industrial, empregando macrófitas neotropicales
Diego Iván Caviedes Rubio**, Daniel Ricardo Delgado***, Alfredo Olaya Amaya****
*Artículo de revisión derivado del proyecto de investigación "Evaluación de la capacidad de las macrófitas (Eichhornia crasspes, Lemna minor y Cymbopogon nardus) para la remoción de metales pesados y algunos antibióticos y hormonas comúnmente presentes en aguas residuales agroindustriales" financiado por la Universidad Cooperativa de Colombia y el CONADI, y realizado entre los años 2014 y 2015.
**Magíster en Ecología y Gestión de Ecosistemas Estratégicos y Candidato a magíster en Ingeniería y Gestión Ambiental. Docente investigador de la Universidad Cooperativa de Colombia, sede Neiva, Colombia.
*** Doctor en Química Farmacéutica. Docente investigador de la Universidad Cooperativa de Colombia, sede Neiva, Colombia.
**** Doctor en Ingeniería, Área de Recursos Hidráulicos. Docente de la Universidad Surcolombiana, Neiva, Colombia.
Autor para correspondencia: Diego Iván Caviedes Rubio, e-mail: deigo.caviedesr@campusucc.edu.co
Artículo recibido: 15/09/2015; Artículo aprobado: 30/11/2016.
RESUMEN
Este documento recopila resultados de numerosas investigaciones referentes al empleo de 30 especies de plantas acuáticas comunes en el trópico americano para la remoción de algunos metales pesados de uso común en la actividad industrial, que se han reportado en aguas residuales. De igual manera, incluye la revisión de aspectos metodológicos para la experimentación con estas plantas, las condiciones a escala de laboratorio y las técnicas más empleadas para la cuantificación química de los microcontaminantes.
Palabras clave: metales pesados, remoción, acuáticas flotantes.
ABSTRACT
This document gathers results from several research Works about the use of 30 aquatic common plants from the American tropical zone for the removal of some heavy metals commonly used in industrial activities, and which have been reported in waste water. The paper also includes the revision of methodological aspects for the experiments with these plants, the conditions at scale of laboratories and the most used techniques for the chemical quantification of the microcontaminants.
Key words: heavy metals, removal, floating aquatic plants.
RESUMO
Este documento recopila resultados de numerosas investigações referentes ao emprego de 30 espécies de plantas aquáticas comuns no trópico americano para a remoção de alguns metais pesados de uso comum na atividade industrial, que se há reportado em águas residuais. De igual maneira, inclui a revisão de aspectos metodológicos para a experimentação com estas plantas, as condições a escala de laboratório e as técnicas mais empregadas para a quantificação química dos micro-contaminantes.
Palavras chave: metais pesados, remoção, aquáticas flutuantes.
INTRODUCCIÓN
Las plantas acuáticas, también conocidas como macrófitas, están representadas por toda la vegetación que crece en la zona litoral de lagos, embalses y ríos, ya sea en la zona de interface agua-tierra (emergentes), sobre la superficie de agua (flotantes) o totalmente sumergida (sumergidas). Actualmente se han reportado aproximadamente 42 familias de dicotiledóneas acuáticas, 30 familias de monocotiledóneas, 6 familias de pteridofitas y 17 familias de briofitas (Hamilton, Evert y Eichhorn, 1992; Roldán y Ramírez, 2008); en total, se tienen registros de 2614 especies de macrófitas vasculares en todo el mundo, de las cuales 984 se encuentran en la biorregión neotropical (nativas de América, desde el norte de México hasta el centro de Argentina), clasificadas en 192 géneros y de las cuales el 61 % (604 especies) se encuentran clasificadas como endémicas (Chambers, Lacoul, Murphy y Thomaz, 2008). Su dominancia invasiva en los ecosistemas acuáticos es consecuencia del éxito adaptativo que les confiere su plasticidad fenotípica que, igualmente, puede ser potenciada con la oferta de recursos en ecosistemas acuáticos alterados por el hombre, básicamente en los que se ha alterado la composición fisicoquímica y/o se ha reducido su caudal natural (Rial, 2013). Las macrófitas enraizadas o emergentes toman los nutrientes de los sedimentos o del agua intersticial de estos, pero las flotantes los toman simplemente del agua; estas características han permitido emplearlas como una tecnología ecológica denominada Fitorremediación que ha recibido cada vez más atención luego del descubrimiento de especies hiperacumuladoras con la capacidad de absorber, acumular, trasladar y concentrar gran cantidad de ciertos elementos tóxicos en sus estructuras, principalmente metales pesados y productos xenobióticos (Rahman y Hasegawa, 2011).
Los usos industriales de los metales y otros procesos internos (por ejemplo, la quema de combustibles fósiles, incineración de residuos, tubos de escape de automóviles, los procesos de fundición y la utilización de los lodos de depuradora como material de relleno y fertilizantes) han introducido grandes cantidades de metales pesados potencialmente tóxicos en la atmósfera y en los ambientes acuáticos y terrestres (Fu y Wang, . O'Connell, Birkinshaw, y O'Dwyer, 2008); cantidades cercanas a 109 kg/año de metales traza son emitidas al medio hidrosférico, siendo las aguas residuales domésticas, las plantas térmicas, las fundiciones y las acerías, las principales fuentes de emisión (tabla 1); el orden de flujos de emisión a la atmósfera corresponde a Mn > Zn > Cu ≈ Cr > Pb > Ni > V > As ≈ Mo > Se > Cd ≈ Sb > Hg (Domenech y Peral, 2008. Nemerow y Dasgupta, 1998).
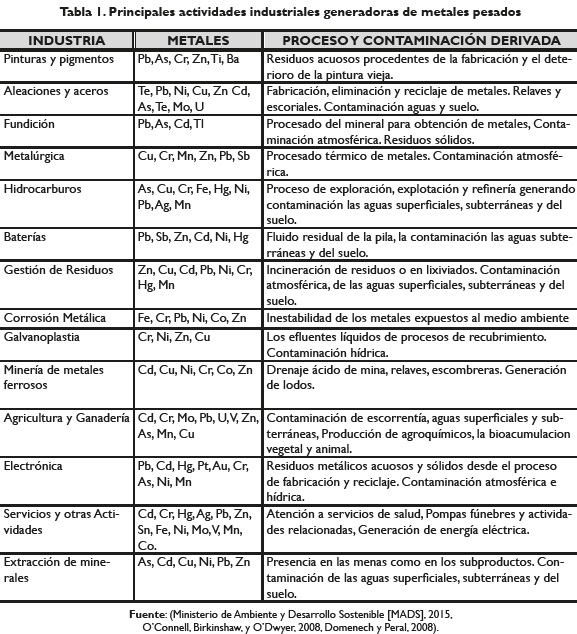
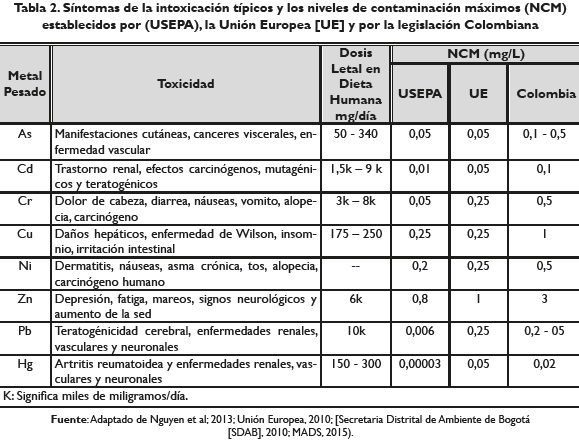
La toxicidad de los metales pesados depende de su movilidad en el medio que, a su vez, depende de su especiación química, persistencia y tendencia de acumulación o bioacumulación (Domenech y Peral, 2008. Kumar et al. 2012). En la tabla 2 se describen los síntomas típicos de la intoxicación, la dosis letal en la dieta humana y los niveles de contaminación máximos (NCM) establecidos por la Agencia de Protección Ambiental de los Estados Unidos [USEPA] (Nguyen et al. 2013. Spiro y Stigliani, 2006), la Unión Europea y por la legislación Colombiana (MADS, 2015) para algunos metales pesados.
Plantas acuáticas para remoción de contaminantes
Debido a la habilidad que tienen las macrófitas acuáticas para asimilar hasta cierto punto todos los constituyentes del agua considerados como contaminantes, estas se han empleado en la detección y remoción de sustancias en efluentes de aguas residuales domésticas e industriales (Bolaños, Casas y Aguirre, 2008); la importancia de las macrófitas radica en su facilidad para ser empleadas en núcleos rurales debido a su bajo consumo de energía convencional y a la practicidad en el montaje y operación de los sistemas de tratamiento. Aun así, todavía no se han esclarecido rigurosamente los procesos que tienen lugar en la depuración de aguas residuales con macrófitas flotantes (Martelo y Lara, 2012).
Los tratamientos de aguas residuales que involucran macrófitas han demostrado ser eficientes en la remediación de aguas con contenidos de nutrientes, materia orgánica y sustancias tóxicas como arsénico, zinc, cadmio, cobre, plomo, cromo, y mercurio (Shi, Wang, Rousseau y Lens. 2010; Martelo y Lara, 2012). A pesar de la diversidad de especies del trópico americano, las especies Eichhornia crassipes, Pistia strartiotes y Lemna minor han sido las más investigadas en tratamientos de aguas residuales debido a su fácil y exitosa adaptación a las condiciones ambientales.
Remoción de metales pesados
Los ecosistemas acuáticos se utilizan directa o indirectamente, como receptores de líquidos y sólidos potencialmente tóxicos de origen doméstico, agrícola e industrial, que incluyen altas concentraciones de nutrientes, materia orgánica y metales pesados que deben ser controlados (Kim, Igunnu y Chen, 2014). Gran variedad de plantas se han empleado para la remoción de nitrógeno, fósforo, sólidos, materia orgánica y metales, obteniéndose de estos últimos buenas eficiencias a escala real y de laboratorio; las tasas de remoción de metales en los humedales dependen del tipo de elemento (Hg> Mn> Fe = Cd> Pb = Cr> Zn Cu => Al> Ni> As), sus formas iónicas, las condiciones del sustrato, la temporada, y las especies de plantas, debido a la diversidad de tolerancias a elevadas concentraciones de algunos metales (Kim et al. 2014. Ali, Khan y Sajad, 2013. Kearney y Zhu, 2012).
Generalmente la mayor acumulación de metales se observa en el sistema radicular de la planta donde diferentes estructuras celulares almacenan, retienen y oxidan diferentes especies de metales para luego dar paso y facilitar el transporte a las partes aéreas, donde su concentración por bioacumulación depende, en gran medida, de la temporada vegetativa, en particular, la acumulación puede aumentar bruscamente al final de la temporada de crecimiento (Bragato, Brix y Malagoni, 2006 ). Las plantas flotantes tienen la propiedad de no promover la adsorción del metal al sustrato, pero sí, de almacenarlo en su biomasa (Marchand, Mench, Jacob y Otte, 2010); por otro lado, las macrófitas enraizadas (emergentes) son generalmente más influenciadas por los metales en los sedimentos que por del agua; por lo tanto, la bioacumulación es mayor cuando hay sedimentos contaminados por metales pesados (Bonanno y Lo Giudice, 2010).
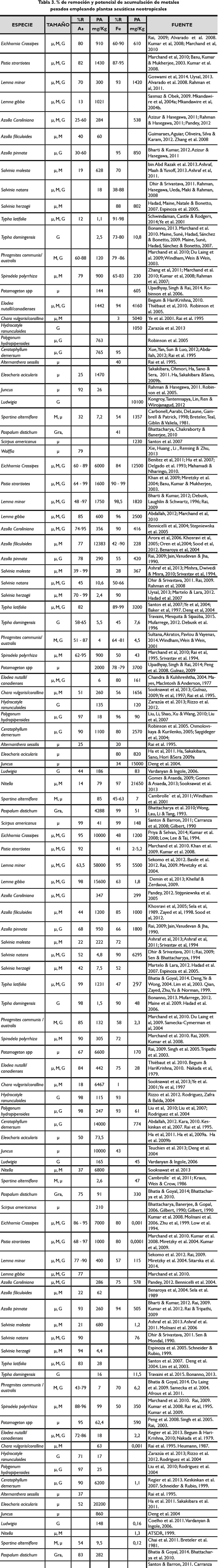
A continuación, en la tabla 3, se presenta una recopilación de los resultados de diversos estudios realizados para evaluar la capacidad de remoción de metales pesados empleando plantas acuáticas. Las plantas sobre las que se realiza la revisión son las 30 macrófitas de distribución neotropical que registran mayor número de estudios publicados; en esta tabla se registran los valores máximos removidos y acumulados por cada planta respecto a 10 metales pesados (As, Fe, Cr, Pb, Zn, Ni, Cu, Cd, Mn, Hg). De este grupo de 30 especies, 13 son flotantes (Eichhornia Crassipes, Pistia strartiotes, Lemna minor, Lemna gibba, Azolla Caroliniana, Azolla filiculoides, Azolla pinnata, Salvinia molesta, Salvinia natans, Salvinia herzogii, Spirodela polyrrhiza, Wolffia, Hydrocotyle ranunculoides), /2 son emergentes (Typha latifolia, Phragmites communis, Polygonum hydropiperoides, Typha domingensis, Alternanthera sessilis, Juncus, Phragmites australis, Ludwigia, Eleocharis acicularis, Spartina alterniflora, Paspalum distichum, Scirpus americanus) y 5 sumergidas (Potamogeton spp, Elodea nutalli/canadienses, Chara vulgaris/corallina, Nitella, Ceratophyllum demersum).
Tolerancia de las macrófitas y efectos tóxicos de los metales pesados
La absorción y acumulación de los elementos depende de las especies químicas disponibles en el entorno, así como en la morfofisiologia de la planta. En general las macrófitas acuáticas se asemejan en que su sistema radicular se reduce o degenera completamente; en que la cutícula es muy delgada, permitiendo a los brotes adsorber metales directamente del agua, y finalmente, en que su sistema vascular se reduce y la corriente de transpiración es limitada o inexistente (Malec, Mysliwa, Prasad, Waloszek y Strzatka, 2011); estudios anteriores han demostrado que las macrófitas emergentes son más sensibles que las sumergidas y estas, a su vez, más sensibles que las flotantes (Azaeda y Zaman, 2013). Por otro lado, las plantas acuáticas presentan diversos mecanismos de tolerancia a los metales pesados entre los que se incluye la inmovilización del metal, cuyos mecanismos, entre otros, corresponden a la deposición en la pared celular, el intercambio catiónico y la sorción por biomasa (viva y no viva) (Yang y Ye, 2009); la quelación es otro mecanismo empleado por las macrófitas, donde cationes como el glutatión, fitoquelatinas, metalotioneinas o compuestos como aminoácidos, fenoles o ácidos orgánicos, actúan como agentes quelantes, formando complejos estables con iones metálicos, para de esta manera limitar la circulación de sustancias tóxicas en el organismo vegetal (Delmail y Labrousse, 2014). Por su parte, los mecanismos de translocación son los responsables de trasladar los metales a otros órganos para su deposición, a través del xilema u otros tejidos, y finalmente las macrófitas presentan diversas transformaciones metabólicas para generalmente reducir el estrés oxidativo, modificando agentes reductores y aumentando la actividad enzimática (Malec et al.; Sharma, Singh y Manchada, 2015).
El estudio de la tolerancia de las macrófitas a la presencia de metales pesados en el agua y a su absorción metabólica presenta un amplio índice de resultados, los cuales, independientemente de las especies y de los metales estudiados, exponen múltiples variaciones en los resultados publicados, como consecuencia de la variedad de las dimensiones experimentales, del pH del agua en que se realiza la prueba, de la concentración del metal y de los tiempos de exposición a este, así como también influye la estación o ubicación geográfica en donde se realiza la prueba e, incluso, la presencia de determinada biota microbiana con la cual la planta puede establecer una relación simbiótica que favorezca la tolerancia a determinados metales.
Los efectos de la toxicidad de los metales, dependiendo de la especie expuesta, son muy similares y se traducen en patologías como cambio del color del follaje y la inhibición de la fotosíntesis; inhibición o dificultad para el crecimiento de los tejidos vegetales y síntesis enzimática, y estrés oxidativo, entre otros. A continuación, se presentarán algunos efectos patológicos causados por la exposición a niveles tóxicos de diferentes metales.
Cobre (Cu)
El Cu juega un importante papel en la síntesis de metaloenzimas y la transferencia de energía, y es esencial en la estabilidad estructural de los cromosomas. Pero, el exceso de Cu acumulado en el tejido vegetal, principalmente en la raíz, puede ser tóxico para las plantas; afecta varios procesos y crecimientos fisiológicos y bioquímicos, a partir del estrés oxidativo que genera (Azaeda y Zaman, 2013), como, por ejemplo, la reducción del nitrógeno total metabolizado y el aumento de anomalías en la mitosis observable en la punta de la raíz; disminuye el contenido de clorofila e inhibe el crecimiento foliar (Mishra et al. 2010; Marchand et al. 2014).
Cadmio (Cd)
El Cd no es un elemento esencial para el crecimiento vegetal, pero sus efectos tóxicos sobre los sistemas biológicos se potencian debido a que los iones de Cd2+ son fácilmente absorbidos por las estructuras radiculares de muchas especies de plantas y luego trasladados a las hojas. El Cd puede ser nocivo a una concentración de 5 a 30 mgKg-l (Teuchies et al. 2013); principalmente inhibe el crecimiento al afectar la fotosíntesis, fluorescencia de la clorofila y la absorción de nutrientes por las plantas (Mishra et al. 2010). El cadmio también genera estrés oxidativo mediante la liberación de radicales libre y especies reactivas de oxígeno que destruyen los lípidos de membrana,proteínas, pigmentos y ácidos nucleicos, induciendo así la muerte de las plantas (Foyer, Lelandais y Kunert, 1994; Bonanno y Lo Giudice, 2010).
Cromo (Cr)
El Cr, en ninguna de sus formas (Cr6+) y (Cr3+), es esencial para las plantas. Es tóxico para la mayoría de las plantas superiores a 10 g de peso seco, inhibiendo su crecimiento y desarrollo (Davies et al. 2002). Se bioacumula principalmente en las raíces y un mínimo en órganos vegetativos y reproductivos (Vymazal et al. 2007; Bonanno y Lo Giudice, 2010). La razón de la alta acumulación en las raíces podría ser su inmovilización en las vacuolas de las células de la raíz, lo que hace que sea menos tóxico; por lo tanto, puede ser una reacción natural de defensa de la planta en respuesta a la toxicidad, reduciendo el Cr6+ a Cr3+ durante su paso a través de la endodermis (Shankers et al; 2005).
Arsénico (As)
La toxicidad por arsénico depende de su especiación; las especies de arsénico inorgánico generalmente son más tóxicas que las especies orgánicas. As3+ es más tóxico que el As5+, y el ácido dimetilarsínico (DMAA) y ácido monomethylarsonico (MMAA) son más tóxicos que sus compuestos originales. Las vegetales reducen de manera eficiente el As5+ a As3+ (Zhao et al; 2009) y se han reportado niveles de tolerancia superiores a los 1000 mg Kg-' en peso seco (Azizur y Hasegawa, 2011). El arseniato es un análogo de fosfato y, por lo tanto, interfiere con los procesos celulares esenciales, tales como la fosforilación oxidativa y la síntesis de ATP, mientras que la toxicidad de As3+ es debido a su habilidad para unirse a grupos sulfhidrilo, con los consiguientes efectos perjudiciales sobre el funcionamiento general de proteínas (Tripathi et al. 2007).
Zinc (Zn)
Aunque el Zn es un elemento esencial para las plantas superiores debido a su participación en muchos procesos metabólicos, la exposición prolongada a altas concentraciones de este metal genera efectos tóxicos debido al estrés oxidativo (Azaeda y Zaman, 2013), como el incremento de la permeabilidad de la membrana de la raíz y afectación a la actividad de varias enzimas (Mishra et al. 2010). Su rango fitotóxico oscila entre los 500 y 1500 mg Kg^ (Chaney, 1989; Teuchies et al. 2013).
Mercurio (Hg)
La acumulación del Hg es predomínate en las raíces de las plantas; esto suprime la absorción de N, P y K, inhibe la biosíntesis de clorofila y reduce el contenido de proteínas en el follaje de la planta (Kumar et al. 2009). La fotosíntesis es afectada tanto en la fase lumínica como en la fase a oscuras, debido a la sustitución del átomo central de Mg presente en las moléculas de clorofila, por un átomo de Hg (Patra y Sharma, 2000).
Manganeso (Mn)
El Mn es un micronutriente esencial para las plantas y juega un papel importante en la actividad de diversos tipos de enzimas. Se considera que es tóxico para las plantas en un rango de 50500 mg Kg -1 (Bonanno y Lo Giudice, 2010). Su efecto tóxico en altas concentraciones se evidencia en el desarreglo de la aerénquima hoja y una reducción en el crecimiento de las plantas, clorofila total, concentración de carotenoides y antocianinas, y una baja actividad de la catalasa (Lizieri, Kuki y Aguiar, 2012).
Hierro (Fe), Níquel (Ni) y Plomo (Pb)
La toxicidad causada por la exposición al hierro en las macrófitas es muy variable respecto a la especie; generalmente el efecto que se evidencia es la reducción del crecimiento, aunque no impide su recuperación (Immers et al. 2014). Por otro lado, el Ni es requerido en menor cantidad para los procesos metabólicos de las macrófitas. Concentraciones de más de 5 mg Kg-1 son venenosas, como resultado de la inhibición de la fotosíntesis y la reducción del crecimiento (Bonanno y Lo Giudice, 2010). Contrario a los dos metales anteriores, el Pb no es un elemento esencial en los organismos vegetales, por lo que puede resultar téxico, tiende a acumularse en las raíces, y presenta escasa translocación en los órganos de la superficie. Su rango fitotóxico es de 30 a 300 mg Kg^ (Teuchies et al. 2013; Roos, 1994). Este metal disminuye la síntesis de clorofila, la actividad enzimática y el transporte mitocondrial de electrones (Mishra et al. 2007).
Técnicas analíticas para cuantificar metales pesados
Las técnicas más utilizadas para la cuantificación de metales pesados corresponden a la espectrometría de absorción atómica con corrección de fondo (Fernandez, Roeckel y Aspe, 2014; Liang et al. 2013); también se realiza con llama o en ausencia de esta (Sekomo et al. 2012). En otros casos, se emplea el método de plasma acoplado inductivamente a absorción atómica (Teuchies et al. 2013; Bennicelli et al. 2004).
Cuando la técnica se requiere para medir la bioacumulación en el tejido vegetal, las muestras, dependiendo de la morfología de la especie, deben tener un proceso de secado que oscila entre 70 y 105 °C en hornos convencionales de secado vegetal u hornos microondas, durante períodos de 1 a 3 días (Sekomo et al. 2012; Benítez et al. ). Luego o durante el proceso de secado, el material vegetal se degrada con ácidos (HCl o HNO3) y se vuelve a secar durante un período corto, para luego someterlo a alguna de las técnicas anteriores (Teuchies et al. 2013; Kumar et al. 2009).
Experimentos a escala de laboratorio
El mayor porcentaje de estudios sobre remoción de contaminantes que incluyen plantas acuáticas se realiza a escala de laboratorio; algunos como Zimmels, Kirzhner y Kadmon (2009) incluyen procesos de aireación y recirculación de las aguas tratadas, las cuales pueden ser aguas residuales verdaderas o simplemente soluciones acuosas de un contaminante específico a remover. En algunos casos los recipientes que contienen entre 15 y 50 L del líquido a tratar (Sekomo et al. 2012; Nesterenko, Zimmels, Kirzhner y Armon, 2012; Shi et al. 2010) se irradian con luz artificial y otros se cubren para impedir la evapotranspiración. Los tiempos de exposición o retención al agua residual o al contaminante específico fluctúan entre 1 día o hasta 6 semanas (Sekomo et al. 2012).
Las muestras de plantas se toman de su propio hábitat o en crecimiento natural controlado (Zimmels, Kirzhner y Malkovskaja, 2006). En muchos casos las muestras se esterilizan sumergiéndolas en etanol o en un proceso que incluye al etanol y posteriormente al hipoclorito de sodio; se lavan finalmente con agua destilada y se incluye una mezcla preservativa de plantas, todo esto para evitar la acción de bacterias y hongos (Guimaraes et al. 2012; Nesterenko et al. 2012).
CONCLUSIONES
El tratamiento para la remoción de contaminantes presentes en aguas residuales de diferentes orígenes, utilizando macrófitas para su bioabsorción, está atrayendo en mayor proporción la atención para su aplicación como tratamiento secundario. Se puede observar que la información respecto de investigaciones que emplean plantas acuáticas del trópico americano, para remover contaminantes, es amplia para especies como Eichhornia Crassipes, Pistia strartiotes y Lemna minor, las cuales han demostrado su versatilidad y tolerancia; pero también se puede observar que las investigaciones, con estas especies, encaminadas a remover microcontaminantes xenobióticos y algunos metales pesados específicos, es limitada.
Las técnicas de cuantificación de microcontaminantes, a pesar de su complejidad y especificidad, se encuentran bien definidas y certificadas de acuerdo con diversos parámetros internacionales de calidad. Para el caso de los contaminantes tratados en este estudio, las técnicas más utilizadas son la espectrometría de masas (MS), la cromatografía líquida de alta precisión (HPLC) y la espectrofotometría (UV), ya sea, a partir de muestras del agua tratada o de material vegetal.
REFERENCIAS BIBLIOGRÁFICAS
Abdallah, M. (2012). Phytoremediation of heavy metals from aqueous solutions by two aquatic macrophytes, Ceratophyllum demersum and Lemna gibba L. EnvironmentalTechnology (United Kingdom), 33(14), 1609-1614. [ Links ]
Afrous, A.; Manshouri, M.; Liaghat, A.; Pazira, E. & Sedghi, H. (2011). Mercury and arsenic accumulation by three species of aquatic plants in Dezful, Iran. African Journal of Agricultural Research, 6(24), 5391 - 5397. [ Links ]
Ali, H. Khan, E. & Sajad, M. (2013). Phytoremediation of heavy metals - Concepts and applications. Chemosphere, 91. 869-881 [ Links ]
Alvarado, S.; Guédez, M.; Lué-Merú, M.; Anzalone, A.; Arroyo, C. & Gyula, Z. (2008). Arsenic removal from waters by bioremediation with the aquatic plants WaterHyacinth (Eichhornia crassipes) and Lesser Duckweed (Lemna minor). Bioresource Technology, 99, 8436-8440. [ Links ]
Arora, A.; Saxena, S. & Sharma, D. (2006). Tolerance and phytoaccumulation of chromium by three Azolla species. World Journal of Microbiology and Biotechnology 22(2), 97-100. [ Links ]
Ashraf, M.; Maah, M. & Yusoff, I. (2013). Evaluation of natural phytoremediation process occurring at ex-tin mining catchment (Article). Chiang Mai Journal of Science, 40, 198-213. [ Links ]
Ashraf, M.; Maah, M. & Yusoff, I. (2011). Heavy metals accumulation in plants growing in ex tin mining catchment. International Journal of Environmental Science and Technology, 8 (2), 401-416. [ Links ]
Atsdr. (1999). Toxicological Profile for Mercury.Agency for Toxic Substances and Disease Registry. U. S. Department of Health and Human Services. United States, p. 676. [ Links ]
Azaeda, T. & Zaman, T. (2013). Heavy Metal Uptake and Tolerance of Charophytes. En Gupta, D. (2013). Heavy Metal Stress in Plants. Berlin Heidelberg, pp. 111-120. [ Links ]
Azizur, M. & Hasegawa, H. (2011). Aquatic arsenic: Phytoremediation using floating macrophytes, Chemosphere, 83, 633-646. [ Links ]
Basile, A.; Sorbo, S.; Conte, B.; Castaldo, R.; Trinchella, F.; Capasso, C. & V. Carginale. (2012). Toxicity, Accumulation, and Removal of Heavy Metals by Three Aquatic Macrophytes, International Journal of Phytoremediation, 14 (4), 374-387. [ Links ]
Basu, A.; Kumar, S. & Mukherjee, S. (2003). Arsenic reduction from aqueous environment by water lettuce (Pistia stratiotes L.), Indian Journal Environmental Health, 45(2), 143-150. [ Links ]
Bhatia, M. & Goyal, D. (2014). Analyzing Remediation Potential of Wastewater Through Wetland Plants: A Review. Environmental Progress & Sustainable Energy, 33 (1), 9-27. [ Links ]
Bhattacharya, T., Chakraborty, S. & Banerjee, D. (2010). Heavy metal uptake and its effect on macronutrients, chlorophyll, protein, and peroxidase activity of Paspalum distichum grown on sludge-dosed soils: Heavy metal uptake and its effect on P. distichum. Environmental Monitoring and Assessment, 169 (1-4), 15-26. [ Links ]
Bhattacharya, T., Banerjee, D. & Gopal, B. 2006. Heavy metal uptake by Scirpus littoralis Schrad. from fly ash dosed and metal spiked soils. Environmental MonitoringAssistance, 121, 361-378. [ Links ]
Begum, A. & HariKrishna, S. (2010). Bioaccumulation of Trace metals by aquatic plants. International Journal of ChemTech Research, 2 (1), 250-254. [ Links ]
Benaroya, R.; Tzin, V.; Tel-Or, E. & Zamski, E. (2004). Lead accumulation in the aquatic fern Azolla filiculoides. Plant Physiology and Biochemmistry, 42, 639-645. [ Links ]
Benítez, R.; Calero, V.; Peña, E. & Martin, J. (2011). Evaluation of the Kinetics of Accumulation of Chromium in Water Hyacinth (Eichhornia crassipes). Biotecnología en el Sector Agropecuario y Agroindustrial, 9 (2), 66-73. [ Links ]
Bennicelli, R.; Stepniewska, Z.; Banach, A.; Szajnocha, K. & Ostrowski, J. (2004). Theability of Azolla caroliniana to remove heavy metals (Hg(II), Cr(III), Cr(VI)) from municipal wastewater. Chemosphere, 55, 141-146. [ Links ]
Bharti, S. & Kumar, T. (2012). Phytoremediation of the coalmine effluent. Ecotoxicology and Environmental Safety, 81(1), 36-42. [ Links ]
Bin Abd Razak, A.; bin Ab, Z.; bin Zakaria, I.; bin Mohd Said, M.; bt Sulaiman, S. & bt Abdul Halim, H. (2013). Treatment of industrial wastewater at gebeng area using Eichornia crassipes sp. (Water Hyacinth), Pistia Stratiotes sp.(Water Lettuce) and Salvinia molesta sp.(Giant Salvinia) (Article). Advances in Environmental Biology, 7, 3802-3807. [ Links ]
Bolaños, S.; Casas, J. & Aguirre, N. (2008). Análisis comparativo de la remoción de un sustrato orgánico por las macrófitas Pistia stratiotes y Egeria densa en un sistema batch. Gestión y Ambiente, 11(2), 39-48. [ Links ]
Bonanno, G. (2013). Comparative performance of trace element bioaccumulation and biomonitoring in the plant species Typha domingensis, Phragmites australis and Arundo donax, Ecotoxicology and Environmental Safety, 97 (1), 124-130. [ Links ]
Bonanno, G. & Lo Giudice, R. (2010). Heavy metal bioaccumulation by the organs of Phragmites australis (common reed) and their potential use as contamination indicators. Ecological Indicators, 10, 639-645. [ Links ]
Bragato, C.; Brix, H. & Malagoli, M. (2006). Accumulation of nutrients and heavy metals in Phragmites australis (Cav.) Trin. ex Steudel and Bolboschoenus maritimus (L.) Palla in a constructed wetland of the Venice lagoon watershed. Environmental Pollution, 144, 967-975. [ Links ]
Breteler, R.; Teal, J.; Giblin, A. & Valiela, I. (1981). Trace element enrichments in decomposing litter of Spartina altemiflora, Aquatic Botany, 11, 111-120. [ Links ]
Cambrollé, J.; Mateos, E.; Redondo, S.; Luque, T. & Figueroa, M. (2011). The role of two Spartina species in phytostabilization and bioaccumulation of Co, Cr, and Ni in the Tinto-Odiel estuary (SW Spain). Hydrobiologia, 671, 95-103. [ Links ]
Carbonell, A.; Aarabi, M.; Delaune, R.; Gambrell, R. & Patrick, W. Jr. (1998). Arsenic in wetland vegetation: availability, phytotoxicity, uptake and effects on plant growth and nutrition. Science of the Total Environment, 217 (3), 189-199. [ Links ]
Carranza, C.; Alonso, A.; Alfaro, M. & García, R. (2008). Accumulation and Distribution of Heavy Metals in Scirpus americanus and Typha latifolia from an Artificial Lagoon in San Luis Potosí, México. Water, Air, and Soil Pollution, 188 (1-4), 297-309. [ Links ]
Coelho, S.; Guimaraes, J.; Miranda, M.; Poirier, H.; Mauro, J.; Lucotte, M. & Mergler, D. 2011. Mercury and flooding cycles in the Tapajós river basin, Brazilian Amazon: The role of periphyton of a floating macrophyte (Paspalum repens). Science of The Total Environment, 409(14), 2746-2753. [ Links ]
Chai, M.; Li, R.; Shi, F.; Liu, F.; Pan, X.; Cao, D. & Wen, X. (2011). Effects of cadmium stress on growth, metal accumulation and organic acids of Spartina alterniflora Loisel. African Journal of Biotechnology, 11(22), 6091-6099. [ Links ]
Chambers, P.; Lacoul, P.; Murphy, K. & Thomaz, S. (2008). Global diversity of aquatic macrophytes in freshwater. Hydrobiologia, 595, 9-26. [ Links ]
Chandra, P. & Kulshreshtha, K. (2004). Chromium accumulation and toxicity in aquatic vascular plants. The Botanical Review. 70, 313-327. [ Links ]
Chaney, R. (1989). Toxic element accumulation in soils and crops: protecting soil fertility and agricultural food chains. In: Bar-Yosef, B., Barrow, N.J., Goldshmid, J. (Eds.), Inorganic Contaminants in the Vadose Zone. Springer-Verlag, Berlin, p. 140-158. [ Links ]
Chinmayee, M.; Stephan, P.; Anu, M.; Sheeba, A.; Mini, I. & Swapna, T. (2013). Cadmium stress on antioxidant activity of two Alternanthera sp. Journal of Scientific and Industrial Research, 72 (9-10), 558-562. [ Links ]
Davies, F.; Puryear, J.; Newton, R.; Egilla, J. & Grossi, J. (2002). Mycorrhizal fungi increase chromium uptake by sunflower plants: influence on tissue mineral concentration, growth and gas exchange. Journal of Plant Nutrition, 25 (11), 2389-2407. [ Links ]
Debusk, T.; Laughlin, R. & Schwartz, L. (1996). Retention and compartmentalization of lead and cadmium in wetland microcosms. Water Research, 30, 2707-2716. [ Links ]
Demim, S.; Drouiche, N.; Aouabed, A.; Benayad, T.; Dendene-Badache, O. & Semsari, S. (2013). Cadmium and nickel: Assessment of the physiological effects and heavy metal removal using a response surface approach by L. gibba, Ecological Engineering, 61, Part A, 426-435. [ Links ]
Deng, H.; Ye, Z. & Wong, M. (2004). Accumulation of lead, zinc, copper and cadmium by 12 wetland plant species thriving in metal-contaminated sites in China. Environmental Pollution, 132, 29-40. [ Links ]
Delgado, M.; Bigeriego, M. & Guardiola, E. (1993). Uptake of Zn, Cr and Cd by water hyacinth. Water Research, 27, 269-272. [ Links ]
Delmail, D. & Labrousse, P. (2014). Heavy-Metal Attack on Freshwater Side: Physiological Defense Strategies of Macrophytes and Ecotoxicological Ops. In P. Ahmad & M. R. Wani (Eds.), Physiological Mechanisms and Adaptation Strategies in Plants Under Changing Environment (pp. 31-54). [ Links ]
Domenech, X. & Peral, J. (2008). Química Ambiental de Sistemas Terrestres. Editorial Reverté. Barcelona. P. 239. [ Links ]
Dhir, B. & Srivastava, S. (2011). Heavy metal removal from a multi-metal solution and wastewater by Salvinia natans, Ecological Engineering, 37, 893-896. [ Links ]
Du Laing, G.; Van de Moortel A.; Moors, W.; De Grauwe, P.; Meers, E.; Tack, F. & Verloo, M. (2009). Factors affecting metal concentrations in reed plants (Phragmites australis) of intertidal marshes in the Scheldt estuary. Ecological Engineering, 35, 310-318. [ Links ]
Espinoza, F.; Zacarkim, C.; Palacio, S.; Obregon, C.; Zenatti, D.; Galante, R.; Rossi, N.; Rossi, F.; Pereira, I. & Welter. R. (2005). Removal of heavy metal from polluted river water using aquatic macrophytes Salvinia sp. Brazilian Journal of Physics, 35 (3b), 744-746. [ Links ]
Fernández, K.; Roeckel, M. & Aspe, E. (2014). Heavy metals removal from influents to prevent mortality in salmon fry, Aquacultural Engineering, 58, 103-106. [ Links ]
Foyer, C.; Lelandais, M. & Kunert, K. (1994). Photooxidative stress in plants. Physiology Plantarum, 92, 696-717. [ Links ]
Fu, F. & Wang, Q. (2011). Removal of heavy metal ions from wastewaters: A review. Journal of Environmental Management, 92, 407-418. [ Links ]
Gilbert, H. (1990). Elementos nutritifs (N et P), metaux lourds (Zn, Cu, Pb y Hg) et productivité vegetale dans un marais intermareal d'eau douce, Quebec (Quebec). Canadian Journal of Botany, 68 (4), 857-863. [ Links ]
Gomes, P. & Asaeda, T. (2013). Phytoremediation of heavy metals by calcifying macro-algae (Nitella pseudoflabellata): Implications of redox insensitive end products, Chemosphere, 92, 1328-1334. [ Links ]
Gomes, P. & Asaeda, T. (2009). Phytoremediation of Chromium (VI) by Nitella and impact of calcium encrustation. Journal of Hazardous Materials, 166, 1332-1338. [ Links ]
Goswami, C.; Majumder, A.; Misra, K. & Bandyopadhyay, K. (2014). Arsenic Uptake by Lemna minor in Hydroponic System. International Journal of Phytoremediation. 16, 1221-1227. [ Links ]
Guimaraes, F.; Aguiar, R.; Oliveira, J.; Silva, J. & Karam, D. (2012). Potencial de macrófitos para eliminar el arsénico de la solución acuosa. Planta Daninha, 30 (4), 683-896. [ Links ]
Gulnaz, O. (2009). Adsorption of Pb (II) lons by Lemma minor, Potamogeton crispus and Chara vulgaris: Kinetic Modelling. Journal of Applied Biological Sciences, 3 (2), 85-91. [ Links ]
Ha, N. Sakakibara, M. Sano, S. (2011). Accumulation of Indium and other heavy metals by Eleocharis acicularis: An option for phytoremediation and phytomining, Bioresource Technology, 102, 2228-2234. [ Links ]
Ha, N.; Sakakibara, M.; Sano, S.; Hori, R. & Sera, K. (2009a). The potential of Eleochari acicularis for phytoremediation: case study at an abandoned mine site. Clean-Soil Air Water, 37, 203-208. [ Links ]
Ha, N.; Sakakibara, M. & Sano, S. (2009b). Phytoremediation of Sb, As, Cu, and Zn from contaminated water by the aquatic macrophyte Eleocharis acicularis. Clean Soil, Air, Water, 37, 720-725. [ Links ]
Hadad, H.; Maine, M.; Natale, G. & Bonetto, C. (2007). The effect of nutrient addition on metal tolerance in Salvinia herzogii, Ecological Engineering, 31, 122-131. [ Links ]
Hadad, H.; Maine, M.; Natale, G. & Bonetto, C. (2006). Macrophyte growth in a pilot-scale constructed wetland for industrial wastewater treatment. Chemosphere 63, 1744-1753. [ Links ]
Hamilton, P.; Evert, R. & Eichhorn, S. (1992). Biología de las Plantas. Vol. 2. Editorial Reverté, p. 1134. [ Links ]
Heumann, H. (1987). Effects of heavy metals on growth and ultra structure of Chara vulgaris. Protoplasma, 136 (1), 37-48. [ Links ]
Hu, C.; Zhang, L.; Hamilton, D.; Zhou,W.;Yang, T. & Zhu, D. (2007). Physiological responses induced by copper bioaccumulation in Eichhornia crassipes (Mart.). Hydrobiologia, 579, 211-218. [ Links ]
Immers, A.; Vendrig, K.; Ibelings, B.; Van Donk, E.; Ter Heerdt, Geurts, J. & Bakker, E. (2014). Iron addition as a measure to restore water quality: Implications for macrophyte growth. Aquatic Botany, 116, 44-52. [ Links ]
Jain, S.; Vasudevan, P. & Jha, N. (1990). Azolla pinnata r.br. and lemna minor l. for removal of lead and zinc from polluted water, Water Research, 24, 177-183. [ Links ]
Kara, Y. (2010). Bioaccumulation of nickel by aquatic macrophytes. Desalination Water Treatment. 19, 325-328. [ Links ]
Kearney, M. & Zhu,W. (2012). Growth of three wetland plant species under single and multi-pollutant wastewater conditions. Ecological Engineering, 47, 214-220. [ Links ]
Keskinkan, O.; Goksu, M.; Yuceer, M. & Basibuyuk, M. (2007). Comparison of the Adsorption Capabilities of Myriophyllum spicatum and Ceratophyllum demersum for Zinc, Copper and Lead. Engineering in Life Sciences, 7 (2), 192-196. [ Links ]
Khan, S.; Ahmad, I.; Tahir Shah, M.; Rehman, S. & Khaliq, A. (2009). Use of constructed wetland for the removal of heavy metals from industrial wastewater. Journal of Environmental Management, 90, 3451-3457. [ Links ]
Khellaf, N. & Zerdaoui, M. (2009). Phytoaccumulation of zinc by the aquatic plant, Lemna gibba L., Bioresource Technology, 100 (23), 6137-6140. [ Links ]
Khosravi, M.; Rakhshaee, R. & Taghi Ganji, M. (2005). Pre-treatment processes of Azolla filiculoides to remove Pb(II), Cd (II), Ni (II) and Zn (II) from aqueous solution in batch and fixed-bed reactor. Journal of Hazardous Materials, 127, 228-237. [ Links ]
Kim, G.; Igunnu, E. & Chen, G. (2014). A sun light assisted dual purpose photoelectrochemical cell for low voltage removal of heavy metals and organic pollutants in wastewater, Chemical Engineering Journal, 244, 411-421. [ Links ]
King, J; Harmon, S; Fu, T; Gladden, J. 2002. Mercury removal, methylmercury formation, and sulfate-reducing bacteria profiles in wetland mesocosms, Chemosphere, 46, p. 859-870. [ Links ]
Kongroy, P.; Tantemsapya, N.; Lin, Y.; Jing, S. & Wirojanagud, W. (2012). Spatial distribution of metals in the constructed wetlands. International Journal of Phytoremediation, 14, 128-141. [ Links ]
Kumar, V. & Tripathi, B. (2008). Concurrent removal and accumulation of heavy metals by the three aquatic macrophytes. Bioresource technology, 99(15), 7091-7097. [ Links ]
Kumar, V.; AlkaRani, U.; Vinita, P. & Tripathi, B. (2008). Phytoremediation of Mercury and Arsenic from Tropical Opencast Coalmine Effluent Through Naturally Occurring Aquatic Macrophytes. Water, Air, and Soil Pollution, 192(1-4), 303-314. [ Links ]
Kumar, V.; Tripathi, B. & Kim, K. (2009). Removal and accumulation of mercury by aquatic macrophytes from an open cast coal mine effluent. Journal of Hazardous Materials, 172, 749-754. [ Links ]
Kumar, P.; Ramalingam, S.; Sathyaselvabala, V; Kirupha, S.; Murugesan, A. & Sivanesan, S, et al. (2012). Removal of Cd (II) from aqueous solution by agricultural waste cashew nut shell. Korean Journal of Chemical Engineering. 29, 756-768. [ Links ]
Kraus, M.; Weis, P. & Crow, J. (1986). The excretion of heavy metals by the salt marsh cord grass,Spartina alterniflora, and Spartina's role in mercury cycling, Marine Environmental Research, 20, 307-316. [ Links ]
Liang, X.; Ning, X.; Chen, G.; Lin, M. & Wang, Y. (2013). Concentrations and speciation of heavy metals in sludge from nine textile dyeing plants. Ecotoxicology and Environmental Safety, 98, 128-134. [ Links ]
Lim, P.; Mak, K.; Mohamed, N. & Noor, A. (2003). Removal and speciation of heavy metals along the treatment path of wastewater in subsurface-flow constructed wetlands. Water Science and Technology, 48, 307-313. [ Links ]
Liu, J.; Li, G.; Shao, W.; Xu, J. & Wang, D. (2010). Variations in uptake and translocation of copper, chromium and nickel among nineteen wetland plant species. Pedosphere 20, 96-103. [ Links ]
Liu, J.; Dong, Y.; Xu, H.; Wang, D. & Xu, J. (2007). Accumulation of Cd, Pb and Zn by 19 wetland plant species in constructed wetland, Journal of Hazardous Materials, 147, 947-953. [ Links ]
Lizieri, C.; Kuki, K.; & Aguiar, R. (2012). The Morphophysiological Responses of Free-Floating Aquatic Macrophytes to a Supra-optimal Supply of Manganese. Water, Air, & Soil PollutionAn International Journal of Environmental Pollution, 223, 2807-2820. [ Links ]
Low, K.; Lee, C. & Tai, C. (1994). Biosorption of copper by water hyacinth rootsJournal of Environmental Science and Health. Part A Environmental Science and engineering and Toxicology, 29 (1), 171 -188. [ Links ]
Mads. (2015). Ministerio de Ambiente y Desarrollo Sostenible. República de Colombia. Resolución 0631 de 2015 "Por la cual se establecen los parámetros y los valores límites máximos permisibles en vertimientos puntuales a cuerpos de aguas superficiales y a sistemas de alcantarillado público, y se dictan otras disposiciones, p. 62. [ Links ]
Mahamadi, C. & Nharingo, T. (2010). Competitive adsorption of Pb2+, Cd2+ and Zn2+ ions onto Eichhornia crassipes in binary and ternary systems, Bioresource Technology, 101, 859-864. [ Links ]
Maine, M.; Duarte, M. & Suñe, N. (2001). Cadmium uptake by floating macrophytes. Water research, 35 (11), 2629-2634. [ Links ]
Maine, A.; Suñe, N. & Lagger, S. (2004). Bioaccumulation: comparison of the capacity of two aquatic macrophytes. Water Research, 38, 1494-1501. [ Links ]
Maine, M.; Suné, N.; Hadad, H.; Sánchez, G. & Bonetto, C. (2007). Removal efficiency of a constructed wetland for wastewater treatment according to vegetation dominance. Chemosphere, 68, 1105-1113. [ Links ]
Maine, M.; Suné, N.; Hadad, H.; Sánchez, G. & Bonetto, C. (2009). Influence of the vegetation on the removal of heavy metals and nutrients in a constructed wetland. Journal of Environmental Management, 90, 355-363. [ Links ]
Malec, P.; Mysliwa-Kurdziel, M.; Prasad, B.; Waloszek, A. & Strzatka, K. (2011). Role of Aquatic Macrophytes in Biogeochemical Cycling of Heavy Metals, Relevance to Soil-Sediment Continuum Detoxification and Ecosystem Health. En: I. Sherameti and A. Varma (eds.), Detoxification of Heavy Metals, Soil Biology 30 p. 345-368. [ Links ]
Marchand, L.; Nsanganwimana, F.; Lamy, J.; Quintela-Sabaris, C.; Gonnelli, C.; Colzi, I.; Fletcher, T.; Oustriére, N.; Kolbas, A.; Kidd, P.; Bordas, F.; Newell, P.; Alvarenga, P.; Deletic, A. & Mench, M. (2014). Root biomass production in populations of six rooted macrophytes in response to Cu exposure: Intra-specific variability versus constitutive-like tolerance, Environmental Pollution, 193, 205-215. [ Links ]
Marchand, L.; Mench, M.; Jacob, D. & Otte, M. (2010). Metal and metalloid removal in constructed wetlands, withem phasis on the importance of plants and standardized measurements: A review, Environmental Pollution, 158, 3447-3461. [ Links ]
Martelo, J. & Lara, J. (2012). Floating macrophytes on the wastewater treatment: a state of the art review. Ingeniería y Ciencia, 8(15), 221-243. [ Links ]
Mayes, R.; MacIntosh, A. & Anderson, V. (1977). Uptake of cadmium and lead by a rooted aquatic macrophyte (Elodea canadensis). Ecology, 58, 1176-1180. [ Links ]
Mishra, R.; Dwivedi, S. & Misra, S. (2010). Chromium removal from tannery effluent by phytoremediation (Article). Pollution Research, 29, 69-71. [ Links ]
Miretzky, P.; Saralegui, A. & Cirelli, A. (2004). Aquatic macrophytes potential for the simultaneous removal of heavy metals (Buenos Aires, Argentina). Chemosphere, 57(8), 997-1005. [ Links ]
Mkandawire, M.; Lyubun, Y.; Kosterin, P. & Dudel, E. (2004a). Toxicity of arsenic species to Lemna gibba L. and the influence of phosphate on arsenic bioavailability. Environmental Toxicology, 19, 26-35. [ Links ]
Mkandawire, M.; Taubert, B. & Dudel, E. (2004b). Capacity of Lemna gibba L. (duckweed) for uranium and arsenic phytoremediation in mine tailing waters. International Journal of Phytoremediation, 6(4), 347-362. [ Links ]
Molisani, M.; Rocha, R.; Machado, W.; Barreto, R. & Lacerda, I. (2006). Mercury contents in aquatic macrophytes from two Reservoirs in the Paraíba do sul: Guandu river system, SE, Brazil. Brazilian Journal of Biology, 66 (1a), 101-107. [ Links ]
Mufarrege, M. (2012). Tolerancia y eficiencia de Typha domingensis Pers. en la retención de metales y nutrientes de efluentes industriales. (Tesis Doctoral). Facultad de Ingeniería Química, Universidad Nacional del Litoral. Argentina, p, 177. [ Links ]
Nakada, M.; Fukaya, K.; Takeshita, S. & Wada, Y. (1979). The accumulation of heavy metals in the submerged plant (Elodea nuttallii). Bulletin of Environmental Contamination and Toxicology. 22, 21-27. [ Links ]
Nemerow, N. & Dasgupta, A. (1998). Tratamiento de vertidos industriales peligrosos. Ed. Dias de Santos. Madrid, p. 822. [ Links ]
Nesterenko, A.; Kirzhner, F.; Zimmels, Y. & Armon, R. (2012). Eichhornia crassipes capability to remove naphthalene from wastewater in the absence of bacteria. Chemosphere, 87 (10), 1186-1191. [ Links ]
Nguyen, T.; Ngo, H.; Guo, W.; Zhang, J.; Liang, S.; Yue, Q. & Li, Q. (2013). Applicability of agricultural waste and by-products for adsorptive removal of heavy metals from wastewater. Bioresource Technology, 148, 574-585. [ Links ]
O'Connell, D.; Birkinshaw, C. & O'Dwyer, T. (2008). Heavy metal adsorbents prepared from the modification of cellulose: A review. Bioresource Technology, 99, 6709-6724. [ Links ]
Oren, R.; Tzin, V.; Tel-Or, E. & Zamski, E. (2004). Lead accumulation in the aquatic fern Azolla filiculoides, Plant Physiology and Biochemistry,42, 639-645. [ Links ]
Osmolovskaya, N. & Kurilenko, V. (2005). Macrophytes in phytoremediation of heavy metal contaminated wáter and sediments in urban inland ponds. Geophysical Research Abstracts, 7, 10510. [ Links ]
Pandey, V. (2012). Phytoremediation of heavy metals from fly ash pond by Azolla caroliniana, Ecotoxicology and Environmental Safety, 82, 8-12. [ Links ]
Patra, M & Sharma, A. (2000). Mercury toxicity in plants. The Botanical Review. 66, 379-422. [ Links ]
Peng, K.; Luo, C.; Lou, L.; Li, X. & Shen, Z. (2008). Bioaccumulation of heavy metals by the aquatic plants Potamogeton pectinatus L. and Potamogeton malaianus Miq. and their potential use for contamination indicators and in wastewater treatment. Science of the Total Environment, 392, 22-29. [ Links ]
Qian, J.; Zayed, A.; Zhu, Y.; Yu, M. & Norman, T. 1999. Phytoaccumulation of trace elements by wetland plants, III: uptake and accumulation of ten trace elements by twelve plant species. Journal Environmental Quality, 28, 1448-1455. [ Links ]
Rahman, M. & Hasegawa, H. (2011). Aquatic arsenic: Phytoremediation using floating macrophytes. Chemosphere, 85(5), 633-646. [ Links ]
Rahman, M.; Hasegawa, H.; Ueda, K.; Maki, T. & Rahman, M. (2008). Influence of phosphate and iron ions in selective uptake of arsenic species by water fern (Salvinia natans L.). Chemical Engineering Journal. 145, 179-184. [ Links ]
Rahman, M.; Hasegawa, H.; Ueda, K.; Maki, T.; Okumura, C. & Rahman, M. (2007). Arsenic accumulation in duckweed (Spirodela polyrhiza L.): a good option for phytoremediation. Chemosphere, 69, 493-499. [ Links ]
Rai, U.; Sinha, S.; Tripathi, P. & Chandra, P. (1995). Wastewater treatability potential of some aquatic macrophytes: Removal of heavy metals. Ecological Engineering, 5, 5-12. [ Links ]
Rai, U.; Tripathi, R.; Vajpayee, P.; Pandey, N.; Ali, M. & Gupta, D. (2003). Cadmium accumulation and its phytotoxicity in Potamogeton pectinatus (Potamogetonaceae). Bull Environmental Contamination and Toxicology. 70: 566-579. [ Links ]
Rai, P. & Tripathi, B. (2009). Comparative assessment of Azolla pinnata and Vallisneria spiralis in Hg removal from G.B. Pant Sagar of Singrauli Industrial region, India. Environmental Monitoring and Assessment, 148, 75-84. [ Links ]
Rai, P. (2009). Heavy metals in water, sediments and wetland plants in an aquatic ecosystem of tropical industrial region, India. Environmental Monitoring and Assessment, 158, 433-457. [ Links ]
Rial, A. (2013). Plantas acuáticas: aspectos sobre su distribución geográfica, condición de maleza y usos. Biota Colombiana 14(2), 79-91. [ Links ]
Regier, N.; Larras, F.; Garcia, A.; Ungureanu, V.; Amouroux, D. & Cosio, C. (2013). Mercury bioaccumulation in the aquatic plant Elodea nuttallii in the field and in microcosm: Accumulation in shoots from the water might involve copper transporters, Chemosphere, 90, 595-602. [ Links ]
Rizzo, P.; Bres, P.; Arreghini, S.; Crespo, D.; Serafini, R. & de Iorio, A. (2012). Remediation of feedlot effluents using aquatic plants. Revista de la Facultad de Ciencias Agrarias, 44 (2), 47-64. [ Links ]
Robinson, B.; Kim, N.; Marchetti, M.; Moni, C.; Schroeter, L.; van den Dijssel, C.; Milne, G. & Clothier, B. (2006). Arsenic hyperaccumulation by aquatic macrophytes in the Taupo Volcanic Zone, New Zealand, Environmental and Experimental Botany, Vol. 58.Pag. 206-215. [ Links ]
Robinson, B.; Marchetti, M.; Moni, C.; Schroeter, L.; van den Dijssel, C.; Milne, G.; Bolan, N. & Mahimairaja, S. (2005). Arsenic accumulation by aquatic and terrestrial plants. In Naidu, R.; Smith, E.; Owens, G.; Bhattacharya, P. & Nadebaum, P. (Eds.), Managing Arsenic in the Environment: From Soil to Human Health. CSIRO, Collingwood, Victoria, pp. 235-247. [ Links ]
Rodríguez, G.; Zafra, A. & Balda, R. (2004). Diseño de una unidad piloto compacta para la remoción de metales pesados (Zn, Ni, Cu) presentes en aguas residuales industriales, empleando humedales subsuperficiales con tres especies de vegetación. Seminario Internacional "Gestión Integral de Servicios Relacionados con el Agua en Saneamientos Nucleados". Universidad del Valle. Instituto CINARA. 9 pp. [ Links ]
Roldán, G. & Ramírez, J. (2008). Fundamentos de limnología Neotropical. 2.a edición. Editorial Universidad de Antioquia. 422 p. [ Links ]
Roos, M. (1994). Sources and forms of potentially toxic metals in soil-plant systems. In: Ross, M.S. (Ed.), Toxic Metals in Soil-Plant System.John Wiley, Chichester, pp. 3-25. [ Links ]
Sakakibara, M.; Ohmori, Y.; Ha, N.; Sano, S. & Sera, K. (2011). Phytoremediation of heavy metal contaminated water and sediment by Eleocharis acicularis. Clean: Soil, Air, Water, 39, 735-741. [ Links ]
Samecka-Cymerman, A. Stepien, D. Kempers, A. 2004. Efficiency in removing pollutants by constructed wetland purification systems in Poland. Journal of Toxicology and Environmental Health-Part A-Current Issues 67, 265-275. [ Links ]
Priya, E. & Selvan, P. 2014. Water hyacinth (Eichhornia crassipes) - An efficient and economic adsorbent for textile effluent treatment-A review, Arabian Journal of Chemistry. Available online 13 March 2014. [ Links ]
Santos, M. & Barrón, M. (2011). Lead, Chromium and Manganese Removal by in Vitro Root Cultures of Two Aquatic Macrophytes Species: Typha Latifolia L. and Scirpus Americanus Pers. International Journal of Phytoremediation. 13, 538-551. [ Links ]
Santos, M.; Barrón, M. & La Torre, A. (2007). Induction of in vitro roots cultures of Thypha latifolia and Scirpus americanus and study of their capacity to remove heavy metals. Electronic Journal of Biotechnology, 10, 417-424. [ Links ]
Sasmaz, A. & Obek, E. (2009). The accumulation of arsenic, uranium, and boron in Lemna gibba L. exposed to secondary effluents. Ecological Engineering, 35, 1564-1567. [ Links ]
Saygideger, S.; Dogan, M. & Keser, G. (2004). Effect of lead and pH on lead uptake, chlorophyll and nitrogen content of Typha latifolia L. and Ceratophyllum demersum L. International Journal of Agricultural and Biology, 6, 168-172. [ Links ]
Schneider, I. & Rubio, J. (1999). Sorption of Heavy Metal Ions by the Nonliving Biomass of Freshwater Macrophytes. Environmental Science & Technology, 33 (13), 2213-2217. [ Links ]
Schwindaman, J.; Castle, J. & Rodgers Jr., J. (2014). Fate and distribution of arsenic in a process-designed pilot-scale constructed wetland treatment system, Ecological Engineering, 68, 251-259. [ Links ]
Sdab. 2010. Concentraciones de referencia para los vertimientos industriales realizados a la red de alcantarillado y de los vertimientos industriales y domésticos efectuados a cuerpos de agua de la ciudad de Bogotá. Primer Informe. Secretaria Distrital de Ambiente Bogotá, Centro de Investigaciones en Ingeniería Ambiental -CIIA- Departamento de Ingeniería Civil y Ambiental Universidad de los Andes, Bogotá. Colombia, p. 163. [ Links ]
Sekomo, C.; Diederik, P.; Rousseau, L.; Saleh, A.; Piet, N. & Lens, L. (2012). Heavy metal removal in duckweed and algaeponds as a polishing step for textile wastewater treatment, Ecological Engineering, 44, 102-110. [ Links ]
Sela, M.; Garty, J. & Tel-Or, E. (1989). The accumulation and the effect of heavy metals on the water fern Azolla filiculoides. New Phytologist. 112(1), 7-12. [ Links ]
Sen, A. & Mondal, N. (1990). Removal and uptake of copper (II) by Salvinia natans from waste water. Water, Air, and Soil Pollution. 49, 1-6. [ Links ]
Sen, A. & Bhattacharyya, M. (1994). Studies of uptake and toxic effects of NI (II) on Salvinia natans. Water, Air, and Soil Pollution. 78, 141-152. [ Links ]
Singh, N.; Pandey, G.; Rai, U.; Tripathi, R.; Singh, H. & Gupta, D. (2005). Metal accumulation and ecophysiological effects of distillery effluent on Potamogeton pectinatus L. Bulletin Environmental Contamination and Toxicology, 74, 857-863. [ Links ]
Sitarska, M.; Traczewska, T.; Stanicka-totocka, A.; Filyarovskaya, V & Zamorska-Wojdyta, D. (2014). Accumulation of mercury in the biomass of selected pleustophytes. Environment Protection Engineering, 40 (1), 165-174. [ Links ]
Shankers, A.; Cervantes, C.; Losa-Tavera, H. & Avdainayagam, S. (2005). Chromium toxicity in plants. Environment International, 31 (5), 739-753. [ Links ]
Sharma, S.; Singh, B. & Manchanda, V. (2015). Phytoremediation: role of terrestrial plants and aquatic macrophytes in the remediation of radionuclides and heavy metal contaminated soil and wáter. Environmental Science and Pollution Research, 22, 946-962. [ Links ]
Spiro, T. & Stigliani, W. (2006). Química Medioambiental. 2° Edición. Editorial Pearson Prentice Hall, p. 504. [ Links ]
Shi, W.; Wang, L.; Rousseau, D. & Lens, P. (2010). Removal of estrone, 17-ethinylestradiol, and 17-estradiol in algae and duckweed-based wastewater treatment systems. Environmental Science and Pollution Research, 17 (4), 824-833. [ Links ]
Sood, A.; Uniyal, P.; Prasanna, R. & Ahluwalia, A. (2012). Phytoremediation potential of aquatic macrophyte, Azolla. Ambio, 41,122-137. [ Links ]
Sooksawat, N.; Meetam, M.; Kruatrachue, M.; Pokethitiyook, P. & Nathalang, K. (2013). Phytoremediation potential of charophytes: Bioaccumulation and toxicity studies of cadmium, lead and zinc, Journal of Environmental Sciences, 25, 596-604. [ Links ]
Srivastav, R.; Gupta, S.; Nigam, K. & Vasudevan, P. (1994). Treatment of chromium and nickel in wastewater by using aquatic plants (Article). Water Research. 28, 1631-1638. [ Links ]
Stepniewska, Z.; Bennicelli, R.; Balakhnina,T.; Szajnocha, K.; Banach, A. & Woliñska, A. (2005). Potential of Azolla caroliniana for the removal of Pb and Cd from wastewaters. International Agrophysics, 19 (3), 251-255. [ Links ]
Suñe, N.; Sánchez, G.; Caffaratti, S. & Maine, M. (2007). Cadmium and chromium removal kinetics from solution by two aquatic macrophytes, Environmental Pollution, 145, 467-473. [ Links ]
Sultana, M.; Akratos, C.; Pavlou, S. & Vayenas, D. (2014). Chromium removal in constructed wetlands: A review, International Biodeterioration & Biodegradation, 96, 181-190. [ Links ]
Teuchies, J.; Sander, J.; Oosterlee, L.; Bervoets, L. & Meire, P. (2013). Role of plants in metal cycling in a tidal wetland: Implications for phytoremidiation. Science of the Total Environment, 445, 146-154. [ Links ]
Thiébaut, G.; Gross,Y.; Gierlinski, P. & Boiché, A. (2010). Accumulation of metals in Elodea canadensis and Elodea nuttallii: Implications for plant-macroinvertebrate interactions, Science of The Total Environment, 408, 5499-5505. [ Links ]
Travaini, F.; Mesquita, M. & Sipauba, L. (2015). Constructed Wetland for Treating Effluent from Subtropical Aquaculture Farm. Water, Air, & Soil Pollution, 226 (3), 1-10. [ Links ]
Tripathi, R.; Srivastava, S.; Mishra, S.; Singh, N.; Tuli, R.; Gupta, D. & Maathuis, F. (2007). Arsenic hazards: strategies for tolerance and remediation by plants, Trends in Biotechnology, 25, 158-165. [ Links ]
Tripathi, R.; Rai, U.; Vajpayee, M.; Ali, M.; Khan, E.; Gupta, D.; Mishra, S.; Shukla, M. & Singh, S. (2003). Biochemical responses of Potamogeton pectinatus L. exposed to higher concentration of zinc. Bulletin of Environmental Contamination and Toxicology, 71, 255-262. [ Links ]
Unión Europea. 2010. Directiva 2010175/UE del Parlamento Europeo y del Consejo del 24 de noviembre de 2010 sobre las emisiones industriales (prevención y control integrados de la contaminación). Diario Oficial de la Unión Europea. L 334117, p. 103. [ Links ]
Upatham, E.; Boonyapookana, B.; Kruatrachue, M.; Pokethitiyook, P. & Parkpoomkamol, K. (2002). Biosorption of Cadmium and Chromium in Duckweed Wolffia globosa. International Journal of Phytoremediation, 4 (2), 73-86. [ Links ]
Upadhyay, A.; Singh, N. & Rai, U. (2014). Comparative metal accumulation potential of Potamogeton pectinatus L. and Potamogeton crispus L.: Role of enzymatic and non-enzymatic antioxidants in tolerance and detoxification of metals, Aquatic Botany, 117, 27-32. [ Links ]
Uysal, Y. (2013). Removal of chromium ions from wastewater by duckweed, Lemna minor L. byusing a pilot system with continuous flow, Journal of Hazardous Materials, 263(2), 486-492. [ Links ]
Vardanyan, L. & Ingole, B. (2006). Studies on heavy metal accumulation in aquatic macrophytes from Sevan (Armenia) and Carambolim (India) lake systems. Environment International. 32, 208-218. [ Links ]
Vymazal, J.; Svehla, J.; Krópfelová, L. & Chrastny, V (2007). Trace metals in Phragmites australis and Phalaris arundinacea growing in constructed and natural wetlands. Science of the Total Environment, 380, 154-162. [ Links ]
Windham, L.; Weis, J. & Weis, P. (2001). Lead uptake, distribution and effects in two dominant salt marsh macrophytes Spartina alterniflora (cordgrass) and Phragmites australis (common reed). Marine Pollution Bulletin, 42, 811-816. [ Links ]
Windham, L.; Weis, J. & Weis, P. (2003). Uptake and distribution of metals in two dominant salt marsh macrophytes, Spartina alterniflora (cordgrass) and Phragmites australis (common reed). Estuarine Coastal and Shelf Science, 56 (1), 63-72. [ Links ]
Wong, M.; Lau, W.; Li, S. & Tang, C. (1983). Root growth of two grass species on iron ore tailings at elevated levels of manganese, iron, and copper. Environmental Research, 30 (1), 26-33. [ Links ]
Xie, W.; Huang, Q.; Li, G.; Rensing, C. & Zhu, Y. (2013). Cadmium Accumulation in the Rootless Macrophyte Wolffia Globosa and Its Potential for Phytoremediation, International Journal of Phytoremediation, 15 (4), 385-397. [ Links ]
Xue, P.; Yan, C.; Sun, G. & Luo, Z. (2012). Arsenic accumulation and speciation in the submerged macrophyte. Literature Cited 50 Ceratophyllum demersum L. Environmental Science Pollutation Research, 19, 3969-3976. [ Links ]
Yang, J & Ye, Z. (2009). Metal Accumulation and Tolerance in Wetland Plants. Review. Frontiers of Biology in China, 4 (3), 282-288. [ Links ]
Ye, Z.; Whitting, S.; Lin, Z.; Lytle, C.; Qian, J. & Terry, N. (2001). Removal and Distribution of Iron, Manganese, Cobalt, and Nickel within a Pennsylvania Constructed Wetland Treating Coal Combustion By-Product Leachate. Journal of Environmental Quality, 30, 1464-1473. [ Links ]
Ye, Z.; Baker, A.; Wong, M. & Willis, A. (1997). Zinc, lead and cadmium tolerance, uptake and accumulation by Typha latifolia. New Phytologist, 136, 469-480. [ Links ]
Zarazúa, G.; Ávila, P.; Tejeda, S.; Valdivia, M.; Zepeda, C. & Macedo, G. (2013). Assessment of Heavy Metal Cr, Mn, Fe, Cu, Zn and Pb IN water Sombrerillo (Hydrocotyle ranunculoides) High River Course Lerma, Mexico. Revista Internacional de Contaminación Ambiental, 29 (2), 17-24. [ Links ]
Zayed, A.; Gowthaman, S. & Terry, N. (1998). Phytoaccumulation of trace elements by wetland plants, I: Duckweed. Journal of Environmental Quality, 27, 715-721. [ Links ]
Zhang, X.; Hu Y.; Liu, Y. & Chen, B. (2011). Arsenic uptake, accumulation and phytofi ltration by duckweed (Spirodela polyrhiza L.). Journal Environmental Science (China) 23(4), 601-606. [ Links ]
Zhang, X.; Lin, A.; Zhao, F.; Xu, G.; Duan, G. & Zhu, Y. (2008). Arsenic accumulation by the aquatic fern Azolla: Comparison of arsenate uptake, speciation and efflux by Azolla caroliniana and Azolla filiculoides. Environmental Pollution, 156, 1149-1155. [ Links ]
Zhu, Y; Zayed, A.; Qian, J.; Souza, M. & Terry, N. (1999). Phytoaccumulation of trace elements by wetland plants. II water hyacinth (Eichhornia crassipes). Journal Environmental Quality, 28, 339-344. [ Links ]
Zimmels, Y.; Kirzhner, F. & A. Malkovskaja. (2006). Application of Eichhornia crassipes and Pistia stratiotes for treatment of urban sewage in Israel. Journal of environmental management, 81 (4), 420-428. [ Links ]
Zimmels, Y.; Kirzhner, F. & Kadmon, A. (2009). Effect of circulation and aeration on wastewater treatment by floating aquatic plants. Separation and Purification Technology, 66(3), 570-577. [ Links ]














