Introducción
Las pilas y baterías de níquel-hidruro metálico (Ni-MH -Nickel-Metal Hydride-) son pilas alcalinas de tipo secundario, pues utilizan como electrolito una base, y son recargables. Contienen un electrodo positivo compuesto de oxihidróxido de níquel (NiOOH) y, adicionalmente, una aleación compuesta fundamentalmente por tierras raras como electrodo negativo, la cual permite absorber hidrógeno (Linden & Reddy, 2002). Estas pilas pueden ser utilizadas varias veces (Dell & Rand, 2001), ya que la reacción electroquímica espontánea puede ser revertida al hacer pasar una corriente a través de la pila en dirección opuesta a la de la descarga; este proceso puede llevarse a cabo cientos o miles de veces (Vincent & Scrosati, 1997; Besenhard, 1999).
Una vez agotada su capacidad de recarga, las pilas y baterías Ni-MH se convierten en un desecho doméstico, terminando su vida útil en vertederos municipales. En estas circunstancias, existe la posibilidad de que las baterías interactúen con los ácidos que produce la materia orgánica de los demás desechos circundantes o del propio suelo, lo que puede corroer su cubierta exterior y, a su vez, producir la liberación de los metales, principalmente níquel y tierras raras, así como las demás sustancias químicas contenidas dentro de ellas. Aunque el níquel es un elemento esencial para las plantas, en altas concentraciones se absorbe como catión Ni+2 que lo convierte en un elemento fitotóxico. Por su parte, los elementos denominados tierras raras se caracterizan por ser inflamables y reactivos, ya que pueden reaccionar a temperatura ambiente con agua o la humedad contenida en el aire, liberando gas hidrógeno, el cual resulta explosivo e inflamable (Correia & Martín, 2004).
Los principales mecanismos empleados para el tratamiento de pilas y baterías gastadas están basados en procesos pirometalúrgicos o hidrometalúrgicos. En el caso de las baterías Ni-MH, no suelen ser usados los procesos pirometalúrgicos (Sayilgan y otros, 2009) y, aunque se han empleado procesos hidrometalúrgicos para su tratamiento, tales como los sistemas BATENUS y BATMIX, estos requieren del uso de ácido sulfúrico como agente lixiviante y una posterior electrólisis o intercambios iónicos selectivos para la extracción de los metales de interés (Sayilgan y otros, 2009; Frohlich & Sewing, 1995; Nogueira & Margarido, 2012). El uso de ácidos minerales (i. e. sulfúrico, clorhídrico o nítrico) en esta clase de procesos resulta, por ende, riesgoso, y podría involucrar impactos ambientales importantes. Una oportunidad de disminución del impacto ambiental de los procesos hidrometalúrgicos radica en el uso de agentes lixiviantes basados en ácidos orgánicos, los cuales, al ser de origen biológico, resultan fácilmente degradables.
Con base en la realidad antes expuesta, en el presente trabajo se propone una ruta de procesamiento hidrometalúrgico para los desechos de baterías Ni-MH agotadas, basada en el uso de ácido acético 5 % v / v (vinagre comercial) como agente lixiviante. Este ácido orgánico resulta de fácil adquisición y manipulación, y es, además, amigable con el ambiente. El uso de este tipo de ácido se justifica, además, en vista de que los acetatos de metales pesados encuentran aplicabilidad en diversas industrias tales como la cerámica, la textil (Patnaik, 2003) o la de los fertilizantes (Olivares, Aguiar & Colonnello, 2011). Por ende, este modo de transformación química de los metales contenidos en las pilas desechadas permitiría su valorización, abriendo así las posibilidades de innovación tecnológica en el campo de la metalurgia recuperativa que aplica para este tipo de residuos tecnológicos.
Materiales y métodos
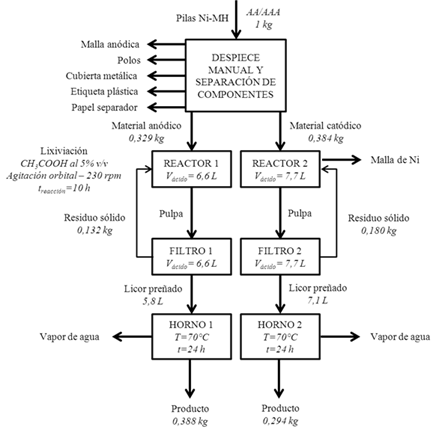
Se empleó una muestra de 6,0 kg de pilas Ni-MH convencionales (tamaños AA y AAA) y baterías Ni-MH asociadas a artefactos electrónicos inalámbricos, todas provenientes de un lote de pilas y baterías gastadas de diferentes tipos y tamaños, obtenido en una jornada comunitaria de recolección de residuos electrónicos, realizada en la ciudad de Caracas (Moccia, Romero, Orta & Delvasto, 2015). Las pilas Ni-MH fueron desensambladas de forma manual, utilizando pinzas, tal como se puede observar en la figura 1, a fin de separar los materiales anódico y catódico del resto de los componentes de las pilas. La caracterización fisicoquímica del material de interés fue realizada en un estudio previo (Zambrano y otros, 2015). Este estudio mostró que el material anódico de las pilas estaba conformado por una aleación de níquel y tierras raras, mientras que el material catódico contenía níquel metal, óxido de níquel (NiO) e hidróxido de níquel (Ni(OH)2). La composición química del material anódico fue (% en peso): 50 % Ni; 18 % La; 6,2 % Co; 1,4 % K; 2,3 % Mn. Por su parte, la composición química del material catódico fue (% en peso): 53 % Ni; 3,7 % Co; 2,9 % Zn; 2,0 % K (Zambrano y otros, 2015).

Fuente: elaborado por los autores
Figura 1 Muestra del despiece manual llevado a cabo en una pila AA Ni-MH. (a) Extracción de la cubierta metálica de la pila. (b) Material catódico. (c) Material anódico.
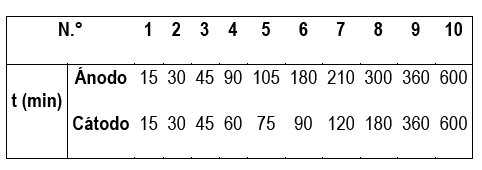
El tratamiento hidrometalúrgico de los materiales electródicos de las pilas Ni-MH se realizó por separado, para el material catódico y para el material anódico, mediante lixiviación dinámica en frascos Erlenmeyer agitados, a temperatura ambiente (25 °). Se utilizó una masa de aproximadamente 5 g de cada tipo de material electródico y un volumen en cada frasco de 100 mL de ácido acético (CH3COOH), al 5 % v / v (vinagre comercial). Para cada tipo de material se realizaron diez (10) lixiviaciones, con el fin de evaluar la cinética de lixiviación; los tiempos evaluados se muestran en la tabla 1. Los matraces fueron colocados en un agitador orbital DigiSystem Laboratory Instruments modelo OS340C, tal como se muestra en la figura 2, a una velocidad de 230 rpm. Estos experimentos se realizaron por triplicado.
Tabla 1 Tiempo de reacción, t, de cada uno de los frascos agitados empleados en la lixiviación del material electródico de las pilas Ni-MH
Fuente: elaborado por los autores

Fuente: elaborado por los autores
Figura 2 Montaje experimental de lixiviaciones empleando un agitador orbital
Una vez finalizado el tiempo de reacción de cada frasco, se cuantificó la cantidad de Co, Fe, Ni, Mn y Zn disuelto a través de espectroscopía atómica (AS - Atomic Spectroscopy). El producto obtenido luego de lixiviar el material electródico durante 600 min fue sometido a evaporación / cristalización, en una estufa a 70 °C durante 24 h. Luego del proceso de cristalización, el producto fue molido y, posteriormente, sometido a caracterización fisicoquímica. Además de AS, se emplearon las siguientes técnicas de caracterización: microscopía electrónica de barrido (SEM - Scanning Electron Microscopy) con espectroscopía de energía dispersiva (EDS- Energy Dispersive Spectroscopy), difracción de rayos X (XRD - X Ray Diffraction) y espectroscopía infrarroja por transformada de Fourier (FTIR - Fourier Transform Infrared Spectroscopy).
Debido a que el producto es sólido, el primer paso para llevar a cabo su análisis a través de AS fue disolverlo completamente. A tales fines, una cantidad de aproximadamente 350 mg de producto sólido fue disuelta utilizando 2 mL de HCl al 37 % y 10 mL de agua destilada. La solución obtenida se aforó en un matraz de 25 mL, a partir del cual se realizaron las diluciones pertinentes para la cuantificación de cada elemento. En general, la solución se atomizó utilizando una llama, constituida por una mezcla de aire / acetileno. Para el caso de elementos de alto punto de fusión (La, Al), se utilizó como combustible una mezcla de acetileno / óxido nitroso. Al cuantificar elementos muy fácilmente ionizables a la llama (Na, K), se agregó a la muestra cloruro de cesio (CsCl), como supresor de ionización (Harris, 2006). Para garantizar una relación lineal entre la absorción (o emisión) de radiación y la concentración del analito (Skoog, West, Holler & Crouch, 2005), se preparó una serie de patrones con concentración conocida dentro del rango lineal de cada elemento a partir de soluciones estándar de 1000 ppm de concentración. En el caso del lantano, sus patrones se prepararon a partir de óxido de lantano (La2O3) de 99,9 % de pureza.
Para el análisis mediante SEM-EDS, una muestra representativa del producto obtenido fue colocada sobre adhesivo conductor de carbono y, posteriormente, recubierta por deposición catódica; se empleó un microscopio electrónico de barrido JEOL modelo JSM-6390 que operó a un voltaje de aceleración de 30 kV. En el análisis de XRD, se empleó un difractómetro Philips PW-1840 con una longitud de onda incidente correspondiente a la radiación Kα1 del cobre (1,5406 Å). Se realizaron barridos desde 2θ=10° hasta 2θ=90°, a una velocidad de 0,02 2θ·s-1, un voltaje de 30 kV y con una corriente de 22 mA. La identificación de las fases cristalinas presentes en las muestras se llevó a cabo haciendo uso de la base de datos ICDD (International Centre for Diffraction Data). Finalmente, el análisis por FTIR se llevó a cabo con un espectrómetro Bruker Tensor 27, realizándose 32 barridos sucesivos por espectro, con una resolución espectral de 2 cm-1.
Resultados
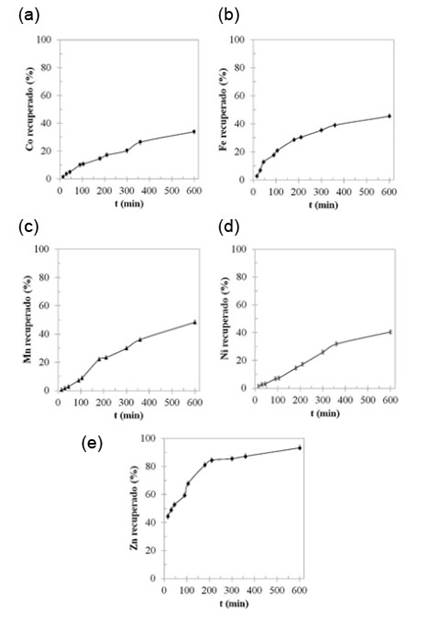
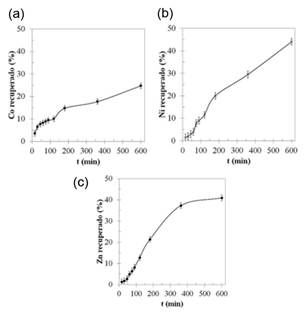
En la figura 3 y en la figura 4 se observan los resultados de la lixiviación con ácido acético para el material anódico y para el material catódico, respectivamente. En los mismos se presenta el porcentaje de metal contenido en el residuo de pila (ánodo o cátodo) que pasa a la disolución, en función del tiempo, valores que se obtienen a partir del análisis químico por espectroscopía atómica (AS) de las disoluciones obtenidas en la etapa de lixiviación.
Fuente: elaborado por los autores
Figura 3 Metales en solución en función del tiempo con respecto al contenido en el material anódico de las pilas Ni-MH inicialmente, luego de lixiviar en frasco agitado empleando CH3COOH al 5% v/v. (a) Co. (b) Fe. (c) Mn. (d) Ni. (e) Zn
Fuente: elaborado por los autores
Figura 4 Metales en solución en función del tiempo con respecto al contenido en el material catódico de las pilas Ni-MH inicialmente, luego de lixiviar en frasco agitado empleando CH3COOH al 5 % v/v. (a) Co. (b) Ni. (c) Zn
Cada punto representa el promedio de tres réplicas, y las barras de error indican la desviación estándar. En el caso del material anódico, el porcentaje de Ni disuelto para su posterior recuperación estuvo alrededor de 40 %, mientras que este valor fue cercano a 45 %, para el caso del material catódico. Estos valores resultan bajos, para lo normalmente aceptado en procesos llevados a cabo para este mismo tipo de materiales, empleando HCl como agente lixiviante (Zambrano y otros, 2015).
Además de Ni (metal mayoritario presente en los electrodos de las pilas), también se observó la disolución de metales como Co, Fe, Mn y Zn. En promedio, se tuvo un porcentaje de disolución (recuperación) de aproximadamente 39 % con respecto a la masa total de estos metales en cada electrodo, a excepción del Zn en el ánodo, el cual se disolvió casi en su totalidad, alcanzando un 93% de recuperación en la solución. Una vez alcanzados los 600 minutos del tratamiento de lixiviación, las soluciones obtenidas, tanto para el material anódico como para el material catódico, se sometieron a un proceso de evaporación / cristalización, con el objeto de recuperar de ellas un material sólido que contuviera, de forma concentrada, a los metales lixiviados.
La apariencia de estos dos productos sólidos, obtenidos luego de lixiviar los materiales electródicos con CH3COOH al 5 % v / v, se muestra en la figura 5. Si bien no se efectuó una medición cuantitativa del color de estos productos, la tonalidad verduzca que presentan pudiera considerarse indicativa de la presencia en estos de compuestos portadores de níquel. Se conoce que el color verde es característico de óxidos, hidróxidos y sales de níquel, tales como el acetato de níquel (Ni(CH3COO)2) (Sharpe, 1993; Odetti & Bottani, 2006). En la figura 6 se muestran las imágenes SEM de electrones secundarios de los materiales mostrados en la figura 5. Tanto el producto obtenido a partir del tratamiento del material anódico, como el que se obtiene del tratamiento del material catódico presentan forma irregular y aspecto granular-facetado, con un tamaño variable, que oscila entre 5 y 100 micrómetros. Se realizó un microanálisis químico semicuantitativo mediante EDS de toda el área de las imágenes de las figuras 6(a) y 6(b), cuyos resultados se muestran en la tabla 2. Este microanálisis químico muestra la presencia mayoritaria de Ni en ambos productos, así como también de C y O, lo que es de esperarse debido al agente lixiviante empleado, un ácido orgánico. No obstante, la presencia de O también puede ser indicio de que el Ni bajo la forma de algún compuesto oxidado, mientras que el C también puede provenir del recubrimiento empleado para la preparación de la muestra para su análisis por SEM-EDS (Mukhopadhyay, 2003). Además del Ni como principal elemento metálico, se observó también la presencia de La, y Co en el producto anódico y de K y Na en el producto catódico. Se detectó, además, un pequeño porcentaje de K y Mn en el producto anódico, y de Co y Zn en el producto catódico. Debe recordarse, sin embargo, que los valores obtenidos a través de SEM-EDS solo son referenciales, por tratarse de un análisis de tipo semicuantitativo.

Fuente: elaborado por los autores
Figura 5 Apariencia de los productos obtenidos luego de lixiviar el material electródico con CH3COOH al 5 % v / v durante 600 min y someter los licores preñados a evaporación / cristalización en una estufa a 70 °C durante 24 h, después de ser sometidos a molienda. (a) Producto anódico. (b) Producto catódico

Fuente: elaborado por los autores
Figura 6 Imágenes SEM de electrones secundarios de los productos obtenidos luego de lixiviar el material electródico con CH3COOH al 5 % v / v durante 600 min y someter los licores preñados a evaporación / cristalización en una estufa a 70 °C durante 24 h, después de ser sometidos a molienda. (a) Producto anódico. (b) Producto catódico
Tabla 2 Porcentaje en peso de cada elemento detectado sobre el área de las imágenes SEM de electrones secundarios, mostradas en la figura 6, obtenido por microanálisis químico semicuantitativo EDS

Fuente: elaborado por los autores
En razón de lo anterior, los resultados vistos en la tabla 2 sirvieron de guía para la ejecución de un análisis químico cuantitativo global, mediante AS, para ambos productos sólidos obtenidos. Dicho análisis, mostrado en la tabla 3, confirma la presencia de los elementos metálicos detectados por SEM-EDS. Se obtuvo que el producto anódico estaba formado, principalmente, por un 17,6 % en peso de Ni y un 9,6 % en peso de La, mientras que el producto catódico contenía fundamentalmente Ni, representando dicho elemento hasta el 30 % en peso del producto. La presencia en ambos productos de K y Na, en porcentajes apreciables, se atribuye al hecho de que los hidróxidos de dichos elementos se emplean en el electrolito de las pilas Ni-MH (Linden & Reddy, 2002; Dell & Rand, 2001; Scott, 2009).
Tabla 3 Análisis químico realizado por AS a los productos obtenidos luego de lixiviar el material electródico con CH3COOH al 5 % v / v durante 600 min y someter los licores preñados a evaporación / cristalización en una estufa a 70 °C durante 24 h

Fuente: elaborado por los autores
Para completar la caracterización de los productos, obtenidos luego del procesamiento del ánodo y el cátodo de las baterías Ni-MH con ácido acético, se procedió a realizar un estudio de difracción de rayos x (XRD) y de espectroscopía infrarroja por transformada de Fourier (FTIR) de los mismos. Los análisis XRD de los dos productos obtenidos, anódico y catódico, se muestran en las figuras 7 y 8, respectivamente. El detalle de la identificación de los compuestos presentes, mediante comparación con fichas patrón ICDD, se resume en las tablas 4 y 5. Por su parte, en las figuras 9 y 10, los espectros FTIR de los dos productos obtenidos.
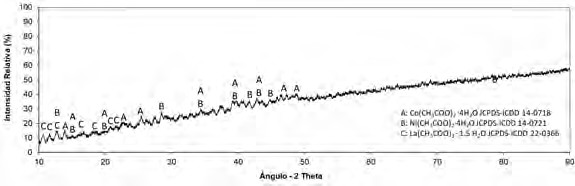
Fuente: elaborado por los autores
Figura 7 Difractograma de rayos X del producto obtenido luego de lixiviar el material anódico de las pilas Ni-MH gastadas con CH3COOH al 5 % v / v durante 600 min y someter el licor preñado a evaporación / cristalización en una estufa a 70 °C durante 24h
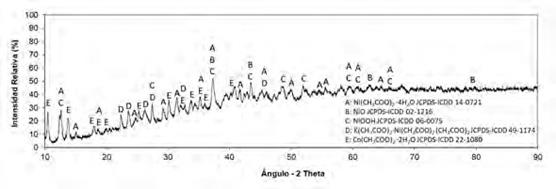
Fuente: elaborado por los autores
Figura 8 Difractograma de rayos X del producto obtenido luego de lixiviar el material catódico de las pilas Ni-MH gastadas con CH3COOH al 5 % v / v durante 600 min y someter el licor preñado a evaporación / cristalización en una estufa a 70 °C durante 24h
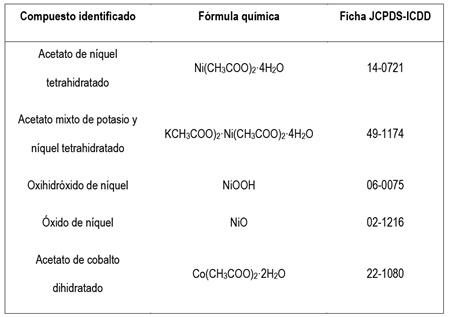
Tabla 4 Compuestos identificados a través de XRD en el producto obtenido luego de lixiviar el material anódico de las pilas Ni-MH gastadas con CH3COOH al 5 % v / v durante 600 min y someter el licor preñado a evaporación / cristalización en una estufa a 70 °C durante 24h

Fuente: elaborado por los autores
Tabla 5 Compuestos identificados a través de XRD en el producto obtenido luego de lixiviar el material catódico de las pilas Ni-MH gastadas con CH3COOH al 5 % v / v durante 600 min y someter el licor preñado a evaporación / cristalización en una estufa a 70 °C durante 24 h.
Fuente: elaborado por los autores
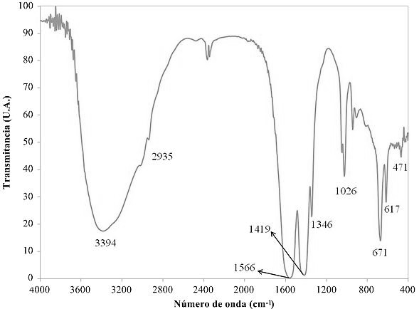
Fuente: elaborado por los autores
Figura 9 Espectro IR del producto obtenido luego de lixiviar el material anódico de las pilas Ni-MH gastadas con CH3COOH al 5 % v / v durante 600 min y someter el licor preñado a evaporación / cristalización en una estufa a 70 °C durante 24h
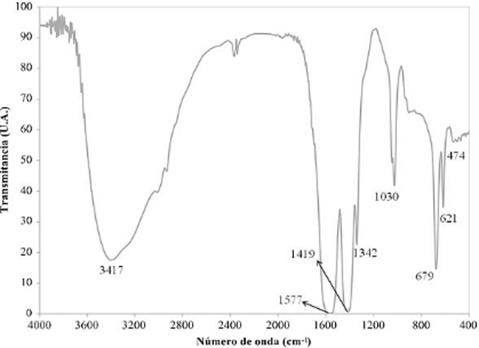
Fuente: elaborado por los autores
Figura 10 Espectro IR del producto obtenido luego de lixiviar el material catódico de las pilas Ni-MH gastadas con CH3COOH al 5 % v / v durante 600 min y someter el licor preñado a evaporación / cristalización en una estufa a 70 °C durante 24 h
Tanto en la figura 9 como en la figura 10, las vibraciones moleculares observadas en el espectro infrarrojo de cada producto permiten verificar la naturaleza de los compuestos identificados a través de XRD. En el caso del producto obtenido a partir de la lixiviación del ánodo (figura 9), las bandas a 1566, 1419 y 1346 cm-1 son características de los estiramientos simétricos y asimétricos COO- de los grupos carboxílicos presentes en sales de ácidos carboxílicos (acetatos de metales); las bandas a 2935 y 1026 cm-1 se asocian con el estiramiento CH- y un tipo de vibración característica de los grupos CH3- en los acetatos; las bandas a 671 y 617 cm-1 son flexiones fuera del plano de grupos OH- que pueden estar asociados al estiramiento a 471 cm-1, característico de enlaces metal-oxígeno que existen en los hidróxidos metálicos (Socrates, 2001; Coates, 2000; Larkin, 2011). La banda a 3394 cm-1 corresponde al estiramiento HOH del agua presente en la red cristalina (Sócrates, 2001; Stuart, 2004), lo que confirma la presencia de los acetatos en su forma hidratada. Se descarta la presencia de ácido acético libre, que hubiese quedado en exceso luego de la lixiviación, ya que no se observa su banda característica, a aproximadamente 1700 cm-1 (Coates, 2000). Lo anterior también se aplica al espectro del producto obtenido a partir del cátodo, mostrado en la figura 10, pues las bandas, aunque a números de onda ligeramente distintos, poseen la misma morfología y representan la misma clase de compuestos.
Discusión
Estudios previos (Zambrano y otros, 2015) demostraron que al lixiviar a temperatura ambiente los materiales catódicos y anódicos de las pilas Ni-MH desechadas, se puede llegar a recuperar, en solución, poco más del 90 % del níquel inicialmente presente en estos desechos. En el presente estudio, tanto la figura 3 como la figura 4 muestran que el rendimiento obtenido en la disolución de Ni empleando CH3COOH al 5 % v / v (vinagre comercial) sobre los electrodos de las pilas Ni-MH es muy bajo, estando alrededor del 40% de recuperación. Sin duda, este valor bajo obedece a la naturaleza de ácido débil que tiene el ácido acético y resulta evidente que este valor pudiera mejorarse al incrementarla concentración de ácido acético o la temperatura de reacción, pues se trata de un medio que no es regido por la difusión (Llorente, 1991). Sin embargo, la temperatura óptima de lixiviación no fue objeto de estudio en el presente trabajo, en vista que lo que se pretendía era caracterizar los compuestos tipo sales orgánicas que era posible obtener a partir de las baterías, cuando sus materiales electródicos son procesados con vinagre comercial. Tanto en la figura 3 como en la figura 4 se registra la presencia minoritaria de otros metales en el lixiviado, tales como Co, Mn y Zn, lo cual es natural, puesto que dichos metales suelen ser añadidos en pequeñas proporciones a los electrodos las pilas Ni-MH, fundamentalmente como modificadores del comportamiento eléctrico de los compuestos de níquel (Zambrano, y otros, 2015; Pietrelli, Bellomo, Fontana, & Montereali, 2005; Wu, y otros, 2009). A pesar de que, durante la lixiviación, estos metales presentaron un porcentaje de recuperación relativamente alto, particularmente en el caso del Zn (93 %), la tabla 3 muestra que la presencia de estos elementos en los productos obtenidos es pequeña, representando poco menos del 3,5 % en peso del total del producto y, de hecho, en los análisis por XRD solamente fue posible identificar compuestos de níquel, cobalto y lantano, tal y como se aprecia en las tablas 4 y 5.
En este orden de ideas, las técnicas de caracterización empleadas permitieron identificar con precisión el tipo y composición de los productos obtenidos. De este modo, se puede visualizar una variedad de posibles aplicaciones para cada uno de dichos productos. Si bien, cada compuesto puede ser empleado en distintas industrias, la idea sería apuntar a un mismo tipo de proceso o industria, en la cual convergiesen, como materia prima, los compuestos identificados en cada producto. Por ejemplo, de acuerdo con Patnaik (2013), el producto obtenido a partir del tratamiento con ácido acético del material catódico de la pila Ni-MH, rico en níquel (30 % en peso) podría utilizarse como aditivo para las industrias textil, cerámicas tradicionales y en la manufactura de vidrios coloreados. Por otro lado, el producto que se obtuvo al tratar los ánodos de las pilas Ni-MH con ácido acético presenta un contenido elevado de níquel (17,6 %) y de tierras raras (9,6 % de La), lo que también lo convierte en candidato interesante para la manufactura de fritas de vidrio coloreadas para la industria cerámica (Patniak, 2013). Por su parte, la combinación de níquel y lantano, bajo la forma de una sal orgánica (acetato), posibilitaría otros usos en los cuales la absorción de estos metales, por parte de seres vivos, resulte fundamental. Es el caso de su aplicación como fertilizantes aportantes de oligoelementos (micronutrientes) en cultivos vegetales. A fin de visualizar la importancia que tienen las tierras raras en la agricultura, debe considerarse que China, principal productor de elementos de tierras raras en el mundo (90 % de la producción mundial en 2001), dedica cerca del 1,5 % de su producción de óxidos de estos elementos a la agricultura (práctica que realiza desde 1972), mientras que Estados Unidos también ha implementado el uso de tierras raras en la agricultura desde 1979 (Olivares, Aguiar & Colonnello, 2011). Siendo también el níquel un oligoelemento para ciertos cultivos (Liu, Simonne, & Li, 2011), esta combinación de tierras raras y níquel, bajo la forma de una sal orgánica, pudiera resultar interesante para la industria agrícola.
Según lo expuesto anteriormente y, con base en los resultados obtenidos en el presente estudio, se realizó un balance de masas en todos los pasos involucrados durante el tratamiento con ácido acético de los materiales electródicos de las baterías Ni-MH gastadas, y se presenta en la figura 11 un diagrama de flujo de procesos. Dicho diagrama constituye una ruta para la valorización hidrometalúrgica para pilas Ni-MH convencionales (tamaños AA y AAA), tomando como base de cálculo 1 kg de pilas gastadas que ingresan al proceso. Es importante destacar que los componentes metálicos de las pilas Ni-MH, que no son lixiviados (malla anódica, cubierta metálica y polos), pueden ser comercializados como aleaciones Fe-Ni para su posterior reciclaje, por ejemplo, a través de métodos pirometalúrgicos convencionales (fundición), aumentando así los beneficios de retorno económico al proceso. En el caso del material catódico, luego de recircular el residuo, en el reactor se obtendrá cierta masa de mallas de níquel metálico que debe ser purgada para poder continuar con el proceso de lixiviación del material activo. Estas mallas también pueden ser comercializadas por separado, bajo la forma de chatarra de níquel.
Conclusión
Los resultados obtenidos a través del presente trabajo de investigación demuestran que es posible valorizar el material electródico de las pilas Ni-MH gastadas a través de un proceso hidrometalúrgico que emplea ácido acético (vinagre comercial). Este proceso permitió la producción de sales orgánicas (acetatos), portadoras de níquel y tierras raras, las cuales podrían aprovecharse en diferentes industrias. El proceso planteado, así como los productos que genera, no solo implican una aplicación novedosa de la metalurgia extractiva recuperativa, sino que también constituyen una contribución para atenuar el potencial daño ambiental que genera desechar esta clase de artefactos directamente en vertederos municipales.