Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Luna Azul
Print version ISSN 1909-2474
Luna Azul no.37 Manizales July/Dec. 2013
BEHAVIOR OF GUAVA MATERIALS (Psidiumguajava LINNEO) ON THE ROOT KNOT NEMATODE [Meloidogyne incognita (KOFOID & WHITE) CHITWOOD AND Meloidogyne javanica (TREUB) CHITWOOD] PARASITISM
1 Ing. Agr. alejandra.duque7@gmail.com
2 M.Sc. Profesor Asistente, Programa de Maestría en Fitopatología, Facultad de Ciencias Agropecuarias, Universidad de Caldas. oscar.guzman@ucaldas.edu.co
Las raíces del guayabo son parasitadas por el nematodo del nudo radical (Meloidogyne spp.), ocasionando pérdidas de la producción entre 30 y 60%. Debido a esto, el principal objetivo de esta investigación fue evaluar en condiciones de almácigo la reacción de cuatro variedades de guayabo al ataque del complejo Meloidogyne incognita y M. javanica. En el vivero Jaibaná Frutales, del municipio de Pereira (Risaralda), plántulas de cuatro variedades: Pera y Común (Psidium guajava), Agrio (Psidium friedrichsthalianum) y Peruano (Psidium cattleianum), fueron sembradas en bolsas de plástico que contenían suelo y cascarilla de arroz en proporción 3:1. Veinte días después de sembradas, a 15 plántulas de cada una de las variedades le fueron inoculadas una mezcla de 1.000, 5.000 y 10.000 huevos y juveniles de Meloidogyne, y los respectivos testigos sin inocular. Las plántulas fueron asignadas bajo un diseño experimental completamente aleatorio. Las variedades Peruano con 5,75g y 8,03g de peso seco de raíces y parte aérea, respectivamente, y Agrio con 10,27g y 9,23g de peso seco de raíces y parte aérea, respectivamente, presentaron el menor índice de nudosidad con 0,1 y 1,1, y reproducción de Meloidogyne spp. con valores entre 75 y 4.575 huevos y juveniles/100g de raíces. Estas variedades fueron estadísticamente diferentes a la variedad Pera con 13,96g y 11,33g de peso seco de raíces y parte aérea, respectivamente, y Común con 11,35g y 13,9g de peso seco de raíces y parte aérea, respectivamente, quienes presentaron mayor índice de nudosidad con 5 y reproducción con 149.775 huevos y 72.950 juveniles/100g de raíces. Las variedades Agrio y Peruano fueron resistentes e inmunes, respectivamente, al ataque de Meloidogyne incognita y M. javanica, permitiendo ser utilizadas como portainjertos o patrones; mientras que las variedades Pera y Común fueron altamente susceptibles.
PALABRAS CLAVENematodos fitoparásitos, nudo radical, índice de nudosidad, reproducción.
ABSTRACTGuava roots are parasitized by the root knot nematode (Meloidogyne spp.), which causes production losses between 30 and 60%. Due to this, the main goal of this research was to evaluate the reaction of four varieties of guava under nursery conditions to the attack of Meloidogyne incognita and M. javanica complex. In the Jaibaná Frutales nursery, in the municipality of Pereira (Risaralda), seedlings of four varieties of guava: Guava pear and Common guava (Psidiumguajava), Cas guava (Psidiumfriedrichsthalianum), and Peruvian guava (Psidiumcattleianum), were planted in plastic bags containing soil and rice hull in a 3:1 proportion. Twenty days after planted, 15 seedlings of each variety were inoculated with a mixture of 1,000, 5,000 and 10,000 eggs and Meloidogyne spp juveniles, and their respective controls without inoculation. Seedlings were assigned under a completely randomized design. The Peruvian guava variety with 5.75g and 8.03g roots and aerial parts dry weight respectively, and Cas guava variety with 10.27g and 9.23g roots and aerial parts dry weight, respectively, had the lowest root gall index with 0.1 and 1.1, and Meloidogyne spp. reproduction with values between 75 and 4.575 eggs and juveniles/100g of roots. These varieties were statistically different from the guava Pear variety with 13,96g y 11,33g roots and aerial parts dry weight respectively, and Common guava with 11,35g y 13,9g roots and aerial parts dry weight respectively, which had the highest root gall index with 5 and reproduction with 149.775 eggs and 72.950 juveniles/100g of roots. In conclusion, the Cas and Peruvian varieties were resistant and immune respectively, to Meloidogyne incognita and M. javanica, allowing them to be used as rootstocks or patronages, while guava Pear and Common guava were highly susceptible to both species.
KEY WORDSPlan parasitic nematodes, root knot nematode, root gall index, reproduction.
INTRODUCCIÓN
La planta de guayabo (Psidium guajav aLinneo), es una especie originaria del trópico y subtrópico americano cuyo centro de dispersión va desde México hasta Brasil, dentro de los 35º latitud norte y 35º latitud sur (Hutchinson, 1973; Medina et al., 1978; Lozano et al., 2002). El árbol de guayabo posee una altura que varía desde 3 a 10 m; la epidermis de los troncos y ramas maduras es lisa, delgada, de color castaño-rosado y provista de innumerables lenticelos o poros; y también descama o muda cuando envejece (Hamilton & Seagrave-Smith, 1959; Bourdelles & Estanove, 1967; Malo & Campbell, 1972; Popenoe, 1974; Medina et al., 1978).
El guayabo se desarrolla bien desde el nivel de mar hasta los 2000 msnm, con temperaturas entre 16 y 34ºC, precipitación anual entre 1.000 y 1.800 mm y humedad relativa entre 36 y 96% (Gómez et al., 1999; García, Lin & Chang, 2003). La planta posee una raíz principal, pivotante, con crecimiento inicial normalmente superior a las raíces secundarias y se desarrolla bien en varios suelos, desde arenosos hasta arcillosos; sin embargo, para una producción comercial es preferible sembrar en suelos de textura franca (Gómez et al., 1999; Manica et al., 2000).El árbol de guayabo es muy resistente a la salinidad, tolerando pH entre 4,5 y 8,2; comportándose mejor con pH entre 6,0 y 7,0. Asimismo, tolera períodos prolongados de sequía, hasta 6 meses, y crece sobre diferentes tipos de suelos, desde arenosos hasta arcillosos, siempre y cuando se tenga una buena fertilidad y profundidad (Samson, 1991; García, Lin & Chang, 2003; SAG et al., 2005).
En Colombia hay sembradas 226.803 ha con frutales, que produjeron 3143.602 ton en el año 2009, con un incremento de 7,15% en área y 7,6% en producción con respecto al año 2005. El cultivo de guayabo, posee un área sembrada de 4.805 ha y un área en edad productiva de 3.819 ha, con una producción de 56.975 ton y un rendimiento promedio nacional de 10 ton.ha-1. El departamento líder en producción es el Meta con el 28,4% del área total en Colombia (ENA, 2012). Este cultivo demanda más de 750.000 jornales.año-1, utilizados en labores de recolección y empaque, siendo el 72% en mano de obra familiar, principalmente femenina. La guayaba provee la materia prima para el funcionamiento de 200 fábricas de bocadillo que generan 3.000 empleos directos y 4.000 indirectos (Parra, 2005).
Los frutos de guayaba proporcionan fibra dietaria y vitaminas antioxidantes asociadas con la disminución de lipoproteínas (Singh et al., 1992) y glucosa sanguínea (Yusof & Said, 2004), contienen polifenoles, estos son metabolitos secundarios que producen las plantas con actividad antioxidante beneficiosa para la salud humana (Instituto Nacional de Nutrición, 2001) y aminoácidos como la lisina con un contenido de 24 mg.100g-1 de pulpa, 8 g de triptófano como de metionina que contribuyen con el crecimiento del cerebro humano, el cual se desarrolla en un 90% durante los tres primeros años de vida (Lee, 1992). El consumo de la guayaba reduce el estrés oxidativo y modifica el perfil lipídico, con lo cual reduce el riesgo de enfermedades causadas por radicales libres y el elevado colesterol sanguíneo (Rahmatet et al., 2004). También es reconocido el valor de la guayaba para reducir el colesterol HDL de la sangre, previene contra la tuberculosis y actúa como neutralizante de la acidez de los hidratos de carbono. En cuanto al contenido de vitamina C, contiene hasta 1.160 mg.100g-1, cuando la naranja solo alcanza 54 (Lee, 1992).
El cultivo del guayabo es afectado por varias plagas y patógenos a través de su crecimiento vegetativo y reproductivo. Entre las principales plagas, se encuentran: la mosca de la fruta, Anastrepha striata Schiner,y el picudo de la guayaba, Conotrachelus psidii Marshall; entre las principales enfermedades, las más importantes son: la costra o clavo de la guayaba, Pestalotia versicolor Speg., la roya, Pucciniapsidii Wint.y los nematodos fitoparásitosde los géneros Meloidogyne spp., Rotylechus spp., Pratylenchus spp., Hoplolaimus spp., Tylenchorynchus spp., y Helicotylenchus spp. De estos nematodos, el género más importante por su incidencia y población es Meloidogyne spp., conocido como nematodo del nudo radical (Villota & Varón, 1997; Lozano et al., 2002; Perry & Moens, 2006; Perry, Moens & Starr, 2009).
El guayabo es altamente susceptible al ataque del nematodo del nudo radical (Meloidogyne spp.), el cual se alimenta de las raíces ocasionando nudos o agallas y un menor desarrollo de estas, reduciendola capacidad de absorción de agua y nutrientes del suelo (Mitkowski & Abawi, 2003; Luc, Sikora & Bridge, 2005).Como consecuencia de lo anterior, los árboles poseen un menor crecimiento vegetativo que varía entre 22 a 50%, con apariencia raquítica; las hojas se vuelven más pequeñas, adoptan un color rojizo y se secan, finalmente la vida útil del cultivo se reduce y se afecta la capacidad productiva de las plantas (Ruiz, 1980; Rodríguez, Fernández & Shesteperov, 1985; González, 1986). En cultivos comerciales de guayabo severamente atacados por nematodos, Lozano et al. (2002) y Bolaños et al. (2011) registraron pérdidas de la producción entre 30 y 60%; mientras que Villota y Varón (1997), reportaron pérdidas superiores al 60%.
En Cuba, Cuadra y Quincosa (1982) estudiaron el comportamiento de Psidium friedrichsthalianum ante el parasitismo de Meloidogyne incognita y encontraron que esta especie es totalmente resistente al daño causado por estenematodo. Además se demostró que es compatible con injertos por disponer de gran vigor y alta calidad para emitir nuevas raíces. Otras especies como Psidium cattleianum, Psidium molle, Psidium guayabita y Psidium guineensis son susceptibles al parasitismo de Meloidogyne spp. (Cuadra & Quincosa, 1982; Babatola & Oyedunmade,1992). Se ha señalado que una alternativa para hacer frente a esta plaga es el establecimiento de programas de mejoramiento genético, partiendo de portainjertos resistentes o tolerantes al nematodo. Los estudios realizados en el municipio de Mara, en el estado de Zulia (Venezuela), han permitido determinar a Psidium friedrichsthalianum como portainjerto resistente; y a algunas selecciones de Psidium guajava como tolerantes a Meloidogyne incognita (Casassa et al., 2000).
En un estudio realizado por Villota y Varón (1997), se evaluaron 23 cultivares promisorios de guayabo del banco de germoplasma de Corpoica, centro de investigación Palmira. De cada material de guayabo se inocularon 12 plántulas de aproximadamente 10 cm de altura. Se inocularon con 10.000 huevos de Meloidogyne incognita raza 2 colectada en guayabo. Como resultado de este ensayo, se concluyó que todos los cultivares fueron altamente susceptibles al ataque de esta especie. El nematodo limitó el desarrollo de la plántula encontrándose pérdidas en peso aéreo y seco desde 7,9 hasta 79,7% y en altura desde 5,5 hasta 56%. El índice de nudosidad en el sistema radical fue superior a 4 en todos los materiales; sin embargo, los cultivares 0330 (Psidium friedrichsthalianum), 1493-13 (Criolla; Baranoa, Colombia) y 0328 (Roja africana; Kindia, India) presentaron los índices de reproducción más bajos, con 0,5, 1,6 y 1,9, respectivamente. El cultivar que resultó más susceptible fue el 0235 (Guayaba Puerto Rico), donde se encontraron 56.169 estados juveniles y 223.206 huevos/g seco de raíz.
El problema de nematodos fitoparásitos en el cultivo del guayabo, es de importancia nacional e internacional, debido a que las variedades comerciales son altamente susceptibles a ellos. Por tal motivo, es necesario buscar alternativas que generen bajos costos al agricultor, que sean efectivas en su control y amigables con el medio ambiente. Es por esto, que una opción es la utilización de patrones resistentes a estos nematodos, que además de generar resistencia no disminuyan las producciones y por ende no se vea afectado el productor. Debido a lo anterior, los objetivos de esta investigación fueron evaluar la reacción de materiales de guayabo al ataque del nematodo formador de nudos, complejo Meloidogyne incognita y M. javanica, y analizar el crecimiento aéreo y radical de las variedades inoculadas con el nematodo.
MATERIALES Y MÉTODOSLocalización. El estudio se realizó en el vivero Jaibaná Frutales, ubicado en la vereda Cerritos del municipio de Pereira (Risaralda), en el km 3 de la vía que conduce de Cerritos a La Virginia (Risaralda), a una altitud de 1210 msnm, con temperatura promedio anual de 22ºC, precipitación anual de 1600 mm y humedad relativa de 80%.
Material vegetal. Se utilizaron semillas de cuatro variedades de guayabo: 1) Psidium guajava, variedad Palmira ICA-1,conocida comercialmente como Guayaba Pera, 2) variedad Común, 3) Psidium friedrichsthalianum, conocido como guayabo Agrio, coronilla o cas, y 4) Psidium cattleianum, conocida como guayabita del Perú o guayaba Peruana. De esta última existen dos tipos, las de cáscara roja y las de cáscara amarilla, para esta investigación se utilizaron las de cáscara roja. Las semillas de los materiales mencionados se consiguieron en el vivero Jaibaná Frutales descrito anteriormente.
Obtención de plántulas. Se recolectaron frutos maduros de los árboles de las cuatro variedades a evaluar, posteriormente se les extrajo la semilla, luego se les realizó un lavado y se dejaron secar a la sombra por un periodo de 4 días. Posteriormente, las semillas se sembraron en bandejas de germinación, de cada variedad se sembraron 2 bandejas, a las cuales se les introdujeron 2 semillas en cada lóculo. Todas las semillas de las diferentes variedades se sembraron el mismo día, teniendo en cuenta que las primeras en germinar fueron las variedades Pera y Común (a los 25 días después de siembra), mientras que las variedades Peruana y Agria, germinaron a los 35 y 40 días, respectivamente. En las bandejas de germinación permanecieron dos meses antes de trasplantarlas a bolsas de almácigo.
Las bandejas de germinación utilizadas para la siembra de semillas de las diferentes variedades eran de 40 lóculos, previamente desinfectadas con hipoclorito de sodio al 1%, y llenadas con turba Klasmann TS-3.
Obtención de inóculo de Meloidogyne spp. Se tomaron plantas de guayabo Pera altamente infestadas con el nematodo del nudo radical Meloidogyne spp., que se encontraban ubicadas en el vivero Jaibaná Frutales antes descrito.
La extracción de nematodos de las raíces de guayabo se realizó en el Laboratorio de Fitopatología del Departamento de Producción Agropecuaria de la Universidad de Caldas, basados en el principio de flotación de los nematodos en azúcar realizado por Jewkins y Taylor (1964) y Meredith (1973), y el procedimiento se realizó de la siguiente manera:
Las raíces infestadas con el nematodo se lavaron con agua a presión, después se cortaron transversalmente en trozos de aproximadamente 1 cm para luego homogenizarlas. Estos trozos se colocaron dentro del vaso de una licuadora con 500 ml de agua y luego se licuaron a alta velocidad, 10 segundos en 3 intervalos. La solución del licuado se depositó en un tamiz de 500 um el cual se colocó sobre un tamiz de 250 um, este sobre otro de 106 um y por último sobre uno de 25 um. La muestra se lavó con agua a presión para que se desprendieran los nematodos, y el material que quedó en el tamiz de 25 um, se depositó todo su contenido, en tubos de centrifugación de polipropileno de 50 ml de capacidad. Estos se colocaron a centrifugar a 3800 rpm durante 5 minutos para que se separará el agua de los nematodos, y de esta manera quedaran precipitados. Luego, se eliminó el agua restante y al precipitado se le adicionaron 50 ml de sacarosa al 50% (solución de azúcar). Nuevamente se llevó a centrifugación a 3800 rpm durante 5 minutos; como consecuencia de la centrifugación se obtuvo una sedimentación de las partículas pesadas en el fondo del tubo. Los nematodos se ubicaron en una capa intermedia (gradiente de sacarosa). Después de que los nematodos se extrajeron, se depositó este contenido en el tamiz de 25 um y se lavó con agua abundante para evitar que el azúcar afectara los nematodos. Finalmente se recogieron 20 ml en una caja de Petri y se procedió al conteo de los mismos, para posteriormente hacer la inoculación en campo.
La identificación de las especies del género Meloidogyne se realizó con base en los caracteres morfológicos de las hembras, utilizando las claves taxonómicas de Perry, Moens y Starr (2009). En este género, las características de los patrones perineales de las hembras adultas han constituido históricamente los elementos fundamentales en la identificación de sus especies. Las especies identificadas fueron Meloidogyne incognita y M. javanica.
Sustrato utilizado para el llenado de las bolsas. Para el trasplante de las plántulas a las bolsas negras de plástico con dimensiones de 17 x 43 cm, se utilizó como sustrato una mezcla de suelo negro, textura franca, con cascarilla de arroz en proporción 3:1, tratada con Basamid (200 g.m-3); a esta se le incorporó DAP y fosforita (1 kg.m-3 de cada uno) al momento de la aplicación de Basamid.
Procedimiento para la inoculación de Meloidogyne spp. De las bandejas de germinación se recolectaron 60 plántulas de la variedad Palmira ICA-1, las cuales fueron trasplantadas a las bolsas de plástico de 17 x 43 cm. Después de 20 días de sembradas las plántulas, a cada una de ellas se le hizo un riego y cuatro huecos, de aproximadamente 4 cm de profundidad, en los cuatro puntos cardinales, para luego realizar la aplicación de los tratamientos, en donde se inocularon 1.000 huevos y juveniles de Meloidogyne spp. a 15 plántulas (tratamiento 1), luego se inocularon 5.000 huevos y juveniles de Meloidogyne spp. a otras 15 plántulas (tratamiento 2), al igual que 10.000 huevos y juveniles Meloidogyne spp. a 15 plántulas (tratamiento 3). Las 15 plántulas restantes fueron el testigo absoluto, sin inóculo del nematodo (tratamiento 4). El anterior procedimiento también fue realizado a las variedades Psidium friedrichsthalianum (tratamientos, 5, 6, 7 y 8, respectivamente), Psidium cattleianum (tratamientos 9, 10, 11 y 12, respectivamente), y Psidium guajava (tratamientos 13, 14, 15 y 16, respectivamente). Para el montaje del experimento en campo se realizaron cuatro camas en guadua levantadas a 40 cm del suelo para evitar contaminación. Cada cama de guadua estaba divida a su vez en cuatro partes, las cuales contenían 15 plántulas, para un total por cama de 60 plántulas, y por las cuatro camas 240.
Desde los 50 días después de la inoculación y hasta los 150 días, se realizaron lecturas quincenales de altura de planta, número de hojas y número de brotes del tallo principal. A los 150 días, se realizó un muestreo destructivo de todas las plantas evaluadas y los tejidos de cada una de ellas se depositaron en bolsas transparentes de 50 cm x 30 cm debidamente marcadas con el número de tratamiento y repetición. De las 15 repeticiones de cada tratamiento, se recolectó la parte aérea de las 15 para determinar el peso seco de la parte aérea y se recolectaron 5 raíces determinar el peso seco (g) de raíces. Este procedimiento se realizó en un horno marca AUTONICS TZ4L, a una temperatura constante de 90ºC durante 48 h, y después de este tiempo, se procedió al pesaje de cada muestra. Con las 10 muestras restantes de raíces de cada tratamiento se evaluó el índice de nudosidad contando el número de agallas y también se realizó la extracción basados en el principio de flotación de los nematodos en azúcar realizado por Jewkins y Taylor (1964) y Meredith (1973) descrito anteriormente, para contabilizar los huevos y juveniles de Meloidogyne spp. y el número de huevos por gramo de raíces secas.
Porcentaje de reducción. Para medir el efecto de Meloidogyne spp., sobre los diferentes materiales evaluados, se trabajó con base en el porcentaje de reducción de cada parámetro de crecimiento, el cual se obtuvo así: Porcentaje de reducción = [(plantas testigo - plantas inoculadas) / plantas testigo] x 100.
También se evaluó el índice de reproducción, que se calculó mediante la relación entre la población final y la cantidad inicial inoculada de Meloidogyne spp. por tratamiento, y el índice de agallas con base en la escala de evaluación de infección de raíces con agallas causadas por Meloidogyne spp., propuesta por Bridge y Page (1980).
Evaluación de la resistencia. La resistencia de los materiales de guayabo se evaluó con base en el índice de nudosidad propuesto por Taylor y Sasser (1978), el cual se determinó teniendo en cuenta el número de agallas y/o masas de huevos en raíces por planta (Tabla 1) utilizando la siguiente escala de evaluación:
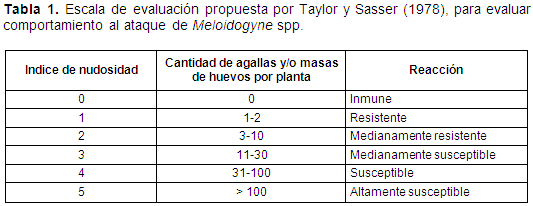
Diseño experimental. Las plántulas fueron asignadas bajo un diseño experimental completamente aleatorio, donde se evaluaron 16 tratamientos con 15 repeticiones cada uno.
Análisis estadístico. Para cada material de guayabo, se determinaron los promedios y coeficiente de variación para cada una de las variables evaluadas. Análisis de varianza al 5% para las variables evaluadas de acuerdo con el diseño completamente aleatorio. Cuando el análisis de varianza mostró efecto de tratamientos, se aplicó la prueba de Tukey al 5% para establecer la diferencia entre los promedios de los tratamientos. Los análisis se realizaron con el programa estadístico SAS versión 9.0.
RESULTADOS Y DISCUSIÓNReacción del sistema radical de las variedades de guayabo al parasitismo de Meloidogyne incognita y M. javanica
Las variedades de guayabo Peruano, Psidium cattleianum, con un índice de nudosidad entre 0 y 0,1 y guayabo Agrio, Psidium friedrichsthalianum, con un índice entre 0,2 y 1,1 (Tabla 2), fueron las que presentaron el mejor comportamientoal parasitismo del nematodo formador de nudos o agallas, M. incognita y M. javanica, siendo inmunes y resistentes, respectivamente, a estos nematodos según la escala de Taylor y Sasser (1978). Como consecuencia de lo anterior, estos materiales de guayabo presentaron menor cantidad de huevos y juveniles en raíces y suelo con valores entre 75 y 4.575 huevos y juveniles en 100g de raíces en las tres concentraciones inoculadas de Meloidogyne spp.; al igual que un índice de reproducción del nematodo menor a 47 (Tabla 1). Asimismo, cada una de estas variedades presentó valores similares en la materia seca de raíces con un promedio de 5,75g y 10,27g, en la variedad Peruana y Agria, respectivamente, cuando fueron inoculadas con 1.000, 5.000 o 10.000 estados infectivos de Meloidogyne spp., siendo estadísticamente diferentes entre ellas en esta variable (Figura 1). Lo anterior, demostró que ambos materiales de guayabo no fueron afectados por las diferentes concentraciones del nematodo fitoparásito comportándose como resistentes e inmunes, tal como se explicó anteriormente.

Las anteriores variedades de guayabo, Peruano y Agrio, fueron estadísticamente diferentes al guayabo (Psidium guajava) variedad Pera y variedad Común,quienes en su reacción al parasitismo del nematodo formador de nudos o agallas, M. incognita y M. javanica, presentaron un índice de nudosidad de 5 (Tabla 2, Figura 2), siendo ambos materiales altamente susceptibles a estos nematodos según la escala de Taylor y Sasser (1978). Debido a esto, la variedad Pera y Común presentaron la mayor cantidad de huevos en 100g de raíces, entre 52.328 y 149.775, y juveniles en 100g de raíces, entre 27.300 y 72.950, y un índice de reproducción entre 1.036 y 14.759 (Tabla 2, Figura 3), lo cual evidencia la preferencia alimenticia y reproductiva del complejo M. incognita y M. javanica en estos materiales de guayabo. Es importante resaltar que el guayabo Común presentó tres veces menos huevos y dos veces menos juveniles que el guayabo Pera; sin embargo, en el número de juveniles en 100g de suelo fue el valor más alto con 627 (Tabla 2). Los valores anteriores de índice de nudosidad y de reproducción son muy importantes debido al potencial infectivo del nematodo que nuevamente puede iniciar infecciones en las plantas aledañas en condiciones de campo.
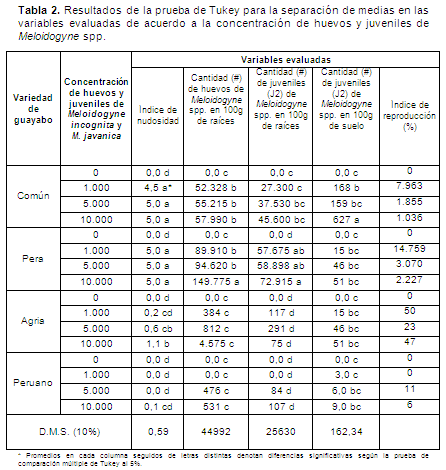

En la variable materia seca de raíces, las variedades Pera y Común presentaron la mayor cantidad de materia seca de raíces con valores de 16,6 y 15,6, respectivamente, siendo estadísticamente diferentes a las variedades Peruana y Agria que tuvieron valores de 5,43 y 10,37g, respectivamente, cuando estos materiales no fueron inoculados con los nematodos fitoparásitos (Figura 1). Las anteriores diferencias fueron debidas al crecimiento vegetativo de cada variedad, ya que las variedades Pera y Común tienen una tasa de desarrollo mayor a las variedades Peruana y Común (Figura 3).

Cuando las plantas de la variedad Pera no fueron inoculadas por el nematodo, presentaron la mayor materia seca de raíces con 16,6g, este valor disminuyó en 3,18%, 21,9% y 23,52% cuando las plantas fueron inoculadas con 1.000, 5.000 y 10.000 estados infectivos, respectivamente, del nematodo formador de nudos o agallas, M. incognita y M. javanica (Figuras 1, 3 y 4); en las plantas de la variedad Común sin inocular, la materia seca de raíces fue de 15,6g, la cual disminuyó en 13,29%, 32,09% y 36,82% cuando las plantas fueron inoculadas con 1.000, 5.000 y 10.000 estados infectivos, respectivamente, del mismo nematodo fitoparásito (Figuras 1, 3 y 4). En ambos materiales de guayabo se encontró que el complejo M. incognita y M. javanica ocasionó pérdidas altas en el sistema radical de las plantas, llegando hasta 32% en tan solo 130 días después de haber sido inoculadas.


Los datos de la variable peso seco de las raíces fueron ajustados a análisis de regresión polinómica en función de la cantidad de inóculo de Meloidogyne spp., encontrándose una correlación directa entre estas variables. Por ejemplo, las variedades Pera y Común pudieron ajustarse a un modelo de regresión polinómico de orden 2 con coeficientes de determinación (R2) de 0,98 (Figura 1), los cuales se traducen en que el 98% de los datos pudieron ser explicados por este modelo en ambas variedades. Con lo anterior, se demostró la alta confiabilidad de los resultados obtenidos y la relación inversa (interacción negativa) entre el aumento de la concentración de inóculo de Meloidogyne spp. y la disminución del peso seco de las raíces de las plántulas de guayabo. Con estos resultados, nuevamente se demostró cómo las raíces de los materiales de guayabo Pera y Común son severamente parasitadas por el complejo M. incognita y M. javanica.
El comportamiento de los datos de peso seco de las raíces para las variedades de guayabo Peruano y Agrio, pudo explicarse mediante un modelo de regresión polinómico de orden 3, con coeficientes de determinación (R2) de 1 para ambas variedades (Figura 1); indicando que la desviación de los datos con respecto a la curva es cero, es decir que los datos se ajustan perfectamente al polinomio, mostrando nuevamente la alta confiabilidad de ellos. Asimismo, se mostró cómo el sistema radical de las variedades de guayabo Peruano y Agrio no varió significativamente cuando fueron inoculados por las tres concentraciones del complejo M. incognita y M. javanica.
La guayaba Peruana, presentó los menores valores en todas las variables evaluadas (Tabla 2). Este resultado coincide con lo evaluado por Carneiroet al. (2007), donde se demuestra que la variedad Agria presenta resistencia moderada y la variedad Peruana presenta inmunidad al ataque del complejo M. incognita y M. javanica. Igualmente, ambas variedades se caracterizaron por presentar las menores cantidades de nódulos en la evaluación del índice de agallas, número de huevos de Meloidogyne spp. en 100 g de raíz, numero de juveniles de Meloidogyne spp. en 100 g de raíz y juveniles Meloidogyne spp. en 100 g suelo; resultados que permiten concluir sus atributos de resistencia al ataque del nematodo del nudo radical Meloidogyne spp. Estos resultados coinciden con los estudios de Casassaet al. (1997), Villota y Varón (1997), Matheus et al. (1999), Casassa et al. (2000), Carneiroet al. (2007) y Molero, Molina y Cassasa-Padrón (2010), quienes coinciden en que la variedad Agria es altamente resistente al ataque de Meloidogyne incognita.
Cuadra y Quincosa (1982) y Babatola y Oyedunmade (1992), reportaron que las especies Psidium cattleianum (variedad Peruana) P. molle, P. Guineensis y P. Guayabita son altamente susceptibles al ataque de Meloidogyne spp. Es por lo anterior que la variedad Agria (Psidium friedrichsthalianum)se ha señalado como una alternativa para el manejo genético de Meloidogyne spp., partiendo del uso de portainjertos resistentes o tolerantes al nematodo. Estudios realizados en el municipio de Mara, estado de Zulia (Venezuela), han permitido determinar a P. Friedrichsthalianum como portainjerto resistente; y a algunas selecciones de P. guajava como tolerantes a M. incognita (Casassa et al., 1997, 2000). Kwee y Chong (1990), afirman que árboles de dos años afectados con Meloidogyne spp. presentan pobre crecimiento y marcado enanismo.
De esta manera, se confirman los resultados de Casassa et al. (1997), Villota y Varón (1997), Matheus et al. (1999), Casassa et al. (2000), Carneiro et al. (2007) y Molero, Molina y Cassasa-Padrón(2010), quienes coinciden en que la variedad Agria (Psidium friedrichsthalianum) es altamente resistente al ataque de Meloidogyne spp. En contraste, Cuadra y Quincosa (1982) y Babatola y Oyedunmade (1992), reportan que las especies Psidium cattleianum (variedad Peruana), P. molle, P. Guineensis y P. guayabitason altamente susceptibles al ataque de Meloidogyne spp. Los resultados de esta investigación permitieron comprobar la resistencia que tiene la variedad Agria al ataque del nematodo del nudo radical Meloidogyne incognita y M. javanica, resultados que también fueron demostrados por Cuadra y Quincosa (1982), Casassa et al. (1997), Villota y Varón (1997), Matheus et al. (1999), Casassa et al. (2000), Carneiro et al. (2007) y Molero, Molina y Cassasa-Padrón (2010).
Según Cuadra y Quincosa (1982), el guayabo Agrio (Psidium friedrichsthalianum) es débilmente atacado por Meloidogyne spp. y mantiene esta característica después de haber sido injertado sobre Psidium guajava. González y Sourd (1992), evaluaron tres especies de Psidium: P. Friedrichsthalianum Berg-Niedenzu, P. guinensis L. y P. guajava L. evaluando su tolerancia a nematodos, pudiéndose observar que la incidencia de estos fue de mediana a alta; la menos susceptible fue P. friedrichsthalianum y la más afectada P. guajava L.
Para el caso de Psidium cattleianum al igual que para Psidium friedrichsthalianum han referido cierto grado de tolerancia a nematodos del género Meloidogyne (Díaz-Silveira, 1975; Gonzálvez, 1989; Pérez, 2000). Respecto al estrés abiótico, P. cattleianum puede soportar pequeños periodos de sequía o de inundación y se da bien en suelos pobres (Morton, 2000). A su vez, es resistente a las bajas temperaturas (-5,5ºC) y P. friedrichsthalianum es capaz de prosperar bien en regiones elevadas, por encima de los 1500 msnm.
Navarro-Barthelemy et al. (2009), mencionan que el índice de nudosidad no debe ser utilizado como único elemento para determinar la resistencia de un genotipo o cultivar frente a M. incognita, aun cuando este se considera un elemento importante para estimar el daño provocado por este patógeno. Un estudio realizado por Crozzoli y González (1989) sobre el comportamiento agronómico de once patrones de cítricos al nematodo Tylenchulus semipenetrans en Venezuela, permitió concluir que la acción del nematodo afectó significativamente el peso aéreo fresco y seco de limón Volkameriano al mandarino Cleopatra, pero no afectó significativamente el peso radical fresco y seco, ni la altura de las plantas evaluadas. Padilla, López y Vargas (1980), mencionan que un mayor número de nudos en el sistema radical causados por Meloidogyne spp. produce un aumento del peso de los sistemas radicales, estos resultados son contradictorios a los encontrados en esta investigación.
Sikora y Fernández (2005), mencionan que cuando las plantas son severamente infestadas por Meloidogyne spp. el sistema radical se reduce a un número limitado de raíces funcionales. Se observa la presencia de agallas y los sistemas vasculares completamente desorganizados. Hay escasas raíces secundarias, afectándose la absorción y transporte de agua y nutrientes. Si las plantas sobreviven a estas condiciones, la floración y fructificación se reducen marcadamente y como consecuencias se afectan los rendimientos. Greco y Di Vito (2009), establecieron el umbral de daño de Meloidogyne para un diverso número de cultivos e informaron que el promedio es aproximadamente de 0,5 a 2 juveniles (J2).g-1 de suelo.
Son muchos los casos que describen la correlación entre la cantidad de nematodos fitoparásitos y el nivel de daño alcanzado en la plantas. Por ejemplo, en banano (Musa spp.), Davide y Marasigan (1985) encontraron una reducción del 60 y 45 % en peso del racimo en plantas inoculadas con 4.000 Radopholus similis y 10.000 Meloidogyne incognita. Moens y Araya (2002) encontraron pérdidas del 27 y 32% cuando inocularon plantas de banano con 1.000 R. similis o 1.000 M. incognita, respectivamente. Según Murray (1980) y Zem y Alves (1983), las plantas de banano con altas infecciones de R. similis resultan en bajas producciones, racimos de bajo peso y volcamiento de las plantas. Asimismo, Kwee y Chong (1990) afirmaron que debido a que el nematodo Meloidogyne spp. afecta el sistema radical de la planta, esto se evidencia en el follaje porque toma una coloración verde pálido, además hay una defoliación durante periodo seco o bajo estrés fisiológico por ausencia de agua.
Moens et al. (2003), cuando inocularon R. similis con incrementos de densidades desde 0,14 a 2,24 nematodos por ml de sustrato, correspondiendo a 254 y 2.128 R. similis por vaso de 1,8 L, respectivamente, encontraron una reducción lineal del peso de las raíces. En ellas, por cada 1.000 nematodos inoculados se redujo el peso en 3,9 g (16%). Asimismo, Fallas, Sarah y Fargette (1995), inocularon 100 R. similis en plantas de Valery en vasos de 0,8 L, y encontraron una disminución en el peso de raíces entre 11 a 53% después de 12 semanas.
En cultivos como la uva (Vitisvinifera L.), Lider (1960) confirmó la resistencia a Meloidogyne de los portainjertos V. champini puros, Ramsey y Dogridge, y señala que C 1613 (Solonis x Othello), K 5A y 420 (V. berlandieri x V. riparia), posiblemente por su alto vigor, son capaces de desarrollarse normalmente y promover buenas producciones en los cultivares con que son injertados. Los portainjertos O39 16, C 1613, Kober 5BB y Rupestris St. George demostraron tener una moderada susceptibilidad a poblaciones chilenas de Meloidogyne hapla y M. incognita (Aballay, Baettig & Vieira, 1997).
En general, se puede concluir que las inoculaciones de 5.000 unidades infectivas del nematodo fueron óptimas para que las plantas alcanzaran su máximo índice de nudosidad, o en otras palabras que la población de nematodo alcanzará a hacer su máximo daño en las raíces. Este caso parece ser contrario al efecto sinérgico al que hacen referencia Siddiqui y Husain (1992) en el cual la co-infección de la planta por mayor cantidad de inóculo de uno o varios patógenos, origina mayor severidad de los síntomas en comparación con la ocasionada por cada agente individualmente.
En este experimento, la tasa de reproducción del nematodo, medida como la cantidad de huevos en raíces y presencia de juveniles en raíces y suelo, fue afectada por las altas cantidades de inóculo de Meloidogyne spp. Lo que concuerda con lo reportado por Rao e Israel (1972) y Sancho, Salazar y López (1987), quienes demostraron que las altas cantidades de inóculo pueden interferir con la tasa de multiplicación del nematodo en competencias por espacio y alimento.
En las raíces se observó la presencia de nudosidades o agallas, síntoma característico del ataque de Meloidogyne spp., que define la diferencia del comportamiento entre las plántulas inoculadas y las testigo. Este es un nematodo endoparásito que induce hipertrofia e hiperplasia celular lo que originan las agallas e inciden en mayor peso radicular. De acuerdo con Kweey Chong (1990) la cantidad de raíces infectadas que soporta un árbol depende del grado de infestación; cuando la cantidad de nematodos es baja se forman agallas de manera intercalada alrededor de la raíz y se suprime la ramificación y extensión de la misma; y en infestaciones severas de agallas individuales coalescen formando una masa de tejido grotesco (Figura 5). Según Taylor y Sasser (1978), las plantas afectadas por Meloidogyne spp. presentan inicialmente mayor peso radical debido a la presencia de nudosidades y agallas; pero después la raíz se va deteriorando poco a poco.

Reacción de la parte aérea de las variedades de guayabo al parasitismo de Meloidogyne incognita y M. javanica
Los resultados mostraron que la variedad de guayabo Común (Psidium guajava) sin inocular con Meloidogyne spp. (testigo) presentó los mayores valores en la materia seca de la parte aérea con 16,9g, altura inicial y final de la planta con 13,1 y 64,5cm, respectivamente; seguido de la variedad Pera (Palmira ICA-1) que se comportó estadísticamente igual en la misma variable (Tabla 3). Las anteriores variedades fueron estadísticamente diferentes al guayabo Agrio (Psidium friedrichsthalianum) y Peruano (Psidium cattleianum) quienes presentaron menor materia seca (Tabla 2). Según Ríos-Castaño y Salazar (1977), el guayabo Común está ampliamente distribuido por toda la América tropical y la mayor parte de la subtropical, de manera que el frutal se encuentra muy bien adaptado a estas condiciones climáticas que favorecen su crecimiento y desarrollo, las cuales corresponden con el clima tropical de la zona de estudio de esta investigación. En las variedades Peruana y Agria, los resultados en cuanto a altura inicial y final de la planta fueron inferiores a las otras variedades (Tabla 3), lo cual coincide con lo observado por Geilfus (1989) donde dice que este es un arbusto pequeño que puede alcanzar hasta los 7,6 m en condiciones de campo.

En la variable número de hojas en el tallo principal a los 80 días después de sembradas las plántulas, las variedades Común, Pera y Agria se comportaron estadísticamente igual, con valores de 16, 15 y 15, respectivamente; mientras que la variedad Peruana presentó el menor valor con 14. Para la variable número de brotes en el tallo principal al final de la toma de datos, se destacó la variedad Agria por registrar el mayor valor con 8 brotes, siendo estadísticamente diferente a las otras tres variedades, lo cual desde el punto de vista del manejo agronómico es indeseable, ya que es mayor la cantidad de mano de obra que se debe utilizar para el deschupone y se debe realizar constantemente; caso contrario a lo que ocurrió con la variedad Común, ya que además de presentar un crecimiento más rápido en la etapa de vivero, el número de brotes en el tallo principal fue cuatro veces menor al del guayabo Agrio (Tabla 2). Estos resultados concuerdan con los encontrados por Villota y Varón (1997) donde la variedad Agria fue la que presentó el mayor número de brotes y hojas.
Cuando las plantas de la variedad Pera no fueron inoculadas por el nematodo, presentaron la mayor materia seca de raíces con 16,6g, este valor disminuyó en 27,4%, 44,6% y 45,1% cuando las plantas fueron inoculadas con 1.000, 5.000 y 10.000 estados infectivos, respectivamente, del nematodo formador de nudos o agallas, M. incognita y M. javanica (Figura 5); en las plantas de la variedad Común sin inocular, la materia seca de raíces fue de 15,6g, la cual disminuyó en 35,29%, 52,9% y 47,45% cuando las plantas fueron inoculadas con 1.000, 5.000 y 10.000 estados infectivos, respectivamente, del mismo nematodo fitoparásito (Figura 5). En ambos materiales de guayabo nuevamente se encontró cómo el nematodo formador de nudos o agallas, complejo M. incognita y M. javanica, ocasionó pérdidas tan altas en la parte aérea de las plantas, llegando a afectar hasta la mitad de esta, 52%, en tan solo 130 días después de haber sido inoculadas.
Con los datos de la variable peso seco aéreo se realizaron análisis de regresión polinómica en función de la cantidad de inóculo de Meloidogyne spp. encontrándose una correlación directa entre estas variables. Similar a lo ocurrido con los datos de raíces, el comportamiento del peso seco aéreo en las variedades de guayabo Peruano y Agrio pudo explicarse mediante un modelo de regresión polinómico de orden 3, con coeficientes de determinación (R2) de 1 para ambas variedades (Figura 5A y 5B); indicando que la desviación de los datos con respecto a la curva fue cero, es decir, los datos se ajustan perfectamente al polinomio, mostrando nuevamente la alta confiabilidad de ellos. Asimismo, se mostró cómo la parte aérea de estas variedades no varió significativamente cuando fueron inoculadas por las tres concentraciones del complejo M. incognita y M. javanica, razón por la cual se permite concluir que no existió una correlación directa entre la cantidad de unidades infectivas del nematodo y la variable del peso seco aéreo en estas variedades de guayabo.
En las variedades Pera y Común los datos pudieron ajustarse a un modelo de regresión polinomial de orden 2 con coeficientes de determinación (R2) de 0,89 y 0,85, respectivamente (Figura 5C y 5D), los cuales se traducen en que 89% y 0,85% de los datos pudieron ser explicados por este modelo en ambas variedades. Lo anterior nuevamente mostró la alta confiabilidad de los resultados obtenidosen esta investigación, así como también, la relación inversa (interacción negativa) entre el aumento de la concentración de inóculo de Meloidogyne spp. y la disminución del peso seco aéreo de las plántulas de guayabo. Con estos resultados, se demostró cómo la materia seca del tejido aéreo de los materiales de guayabo Pera y Común son severamente disminuidos por el ataque del complejo M. incognita y M. javanica en el sistema radical de las plantas.
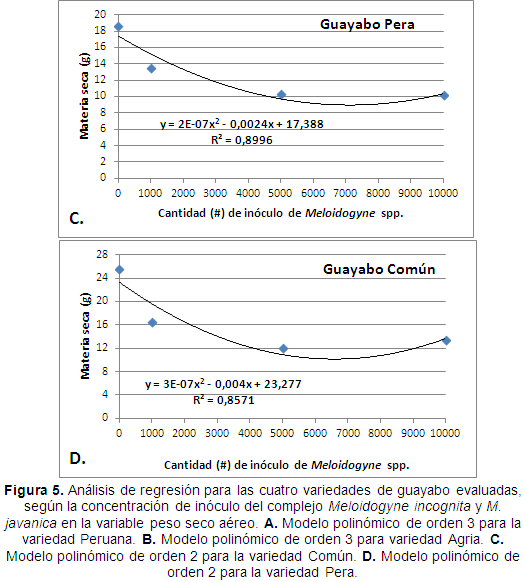
Los anteriores resultados concuerdan con lo encontrado por Cuadra yQuincosa (1982), quienes afirman que cuando las plantaciones de guayabo son inoculadas con huevos de Meloidogyne spp. se ven afectadas la parte aérea y radical, además en la parte aérea se observa clorosis total, como también enanismo y reducción del área foliar. Asimismo, en estudios realizados por Villota y Varón (1997), encontraron que todas las plántulas inoculadas con Meloidogyne spp. presentaron senescencia de hojas bajeras principalmente, clorosis y leve marchitamiento, posteriormente las hojas se cayeron prematuramente quedando las correspondientes al tercio superior.
La variedad Común sobresalió por tener la mayor altura inicial y final de la planta, y el mayor número de hojas en el tallo principal al inicio de la toma de datos con o sin inoculación del nematodo y a las tres concentraciones de inóculo evaluadas (Tabla 3). Sin embargo, cuando se evaluó el número de hojas en el tallo principal al final de la toma de datos y el número de brotes en el tallo principal al final de la toma de datos, la variedad Agria fue la que presentó los mejores resultados, los cuales fueron estadísticamente diferentes de las demás variedades (Tabla 3).
Franco y Mosquera (1993), estudiando los patosistemas del nematodo de la oca (Theca vermiculatusandinus), en cuatro cultivos andinos, Olluco (Ollucus tuberosas), Tarwi (Lupinus mutabilis), Quinua (Chenopodium quinoa) y Oca (Oxalis tuberoso), lograron determinar mediante análisis de regresión lineal múltiple, que la producción de esos tubérculos andinos, depende de una densidad de 70 nematodos en el suelo y por lo tanto conforme aumenta la densidad de nematodos, la producción disminuye.
Estudios realizados por Gómez et al. (2012), donde utilizaron regresión lineal para relacionar el tomate (Solanum lycopersicum L.) frente al ataque de Meloidogyne incognita, determinaron que entre el 60 y el 94% de la disminución del tamaño de las plantas estaba relacionado con el aumento de las poblaciones de M. incognita y que el crecimiento de todos los genotipos de tomate evaluados, se afectó por la presencia del nematodo, aún con las densidades de inóculo más bajas.
Según Cook y Starr (2006), la sensibilidad de un hospedante no solamente depende de su genotipo, sino también de cuántos nematodos fitoparásitos que la afectan. A densidades poblacionales altas, las plantas sufren una reducción considerable de su crecimiento y viceversa. Sin embargo, la sensibilidad también está sujeta a la influencia del ambiente.
CONCLUSIONESLas variedades de guayabo Agrio (Psidium friedrichsthalianum) y Peruano (Psidium cattleianum) se comportaron como resistentes e inmunes, respectivamente, al nematodo formador de nudos o agallas, complejo Meloidogyne incognita y M. javanica, al presentar bajos índices de nudosidad y reproducción, permitiendo ser utilizadas como portainjertos o patrones.
Los materiales de guayabo, Psidium guajava, variedades Común y Pera fueron altamente susceptibles al ataque del nematodo formador de nudos, complejo Meloidogyne incognita y M. javanica, con un mayor índice de nudosidad y reproducción del nematodo, comportándose como altamente susceptibles a este, a pesar de que presentaron buen comportamiento en su crecimiento vegetativo.
En el establecimiento de nuevos cultivos de guayabo y otras especies vegetales, la mayor fuente de inóculo y pérdidas para el agricultor, al igual que la diseminación de nematodos fitoparásitos, son las plantas parasitadas provenientes de almácigo, por lo que las medidas de manejo deben comenzar en este sitio como se demostró en esta investigación. Por consiguiente, las decisiones de manejo integrado de nematodos fitoparásitos deben basarse en el conocimiento de las especies de nematodos fitoparásitos, sus densidades poblacionales, fuente de inóculo en condiciones de almácigo y campo, y los mecanismos de dispersión, que son la base para seleccionar e implementar las medidas de manejo.
REFERENCIAS
• Aballay, E.; Baettig, R. y Vieira, A. (1997). Evaluación de la tolerancia de ocho portainjertos de vid al nematodo del nódulo de la raíz (Meloidogyne spp.). Aconex, 56, 15-21. [ Links ]
• Babatola, J. y Oyedunmade, E. (1992). Host-parasite relationships of Psidium guajava and Meloidogyne incognita. Hematología Mediterránea, 20, 233-235. [ Links ]
• Bolaños, M.M.; Ramírez, J.; Esquivel, F. y Martínez, E. (2011). Prácticas sostenibles para el manejo de nematodos fitoparásitos en cultivos de guayaba. Corporación Colombiana de Investigación Agropecuaria, Corpoica. [ Links ]
• Bourdelles, J.L. y Estanove, P. (1967). La goyabe aux Antilles. Fruits, 22, 397- 412. [ Links ]
• Bridge J., S. L. J. Page. 1980. Estimation of root-knot nematodes infestation levels on roots using a rating chart. Tropical pest management 26: 296-298. [ Links ]
• Carneiro, R.; Souza, M.G.; Cirotto, P.A.; Quintanilha, A. y Da Silva, D.B. (2007). Selecciones de Psidium spp. a la resistencia de Meloidogyne mayaguensis y su compatibilidad en injerto con Psidium guajava cv. Paluma. Embrapa, Recursos Genéticos de Biotecnología. [ Links ]
• Casassa, A.; Bravo, V.; Matheus, M.J.; González,C. yMarín, M. (2000). Resistencia de selecciones de guayabo (Psidiumguajava L.) al nemátodo agallador Meloidogyne incognita en el estado Zulia, Venezuela. Nematropica, 30(2), 117. [ Links ]
• Casassa, A.;Matheus, M.J.; Crozolli, R.;Bravo, V.y González, C. (1997). Respuesta de algunas selecciones de guayabo al nematodo Meloidogyne incognita en el municipio Mara del estado Zulia, Venezuela. Fitopatología Venezolana,10(1), 5-8. [ Links ]
• Cook, R. y Starr, J. (2006). Resistant Cultivars. En: Perry, R. y Moens, M. (editores), Plant nematology (pp. 370-389). UK: CAB International. [ Links ]
• Cozzoli, R. y González, A. (1989). Evaluación de resistencia a Tylenchulus semipenetrans en once patrones de cítricos. Agronomía Tropical, 39, 269-279. [ Links ]
• Cuadra, R. y Quincosa, A. (1982).Comportamiento de diferentes especies de Psidium como patrones para guayabo resistentes a Meloidogyne. Ciencias de la Agricultura (Cuba), 13, 32-33. [ Links ]
• Davide, R. y Marasigan, L. (1985). Yield loss assessment and evaluation of resistance of banana cultivars to the nematodes Radopholus similis Thorne and Meloidogyne incognita Chitwood. Phil Agri, 68, 335-349. [ Links ]
• Díaz-Silveira, M.F. (1975). El Psidium friedrichsthalianum como patrón para guayabo, resistente a los nematodos del género Meloidogyne spp. Revista de Agricultura (Cuba), 3, 80-85. [ Links ]
• Encuesta Nacional Agropecuaria (2012). Uso del suelo y Agrícola. Departamento Administrativo Nacional de Estadística DANE. Resultados ENA-2011. [ Links ]
• Fallas, G.; Sarah, J. y Fargette, M. (1995). Reproductive fitness and pathogenicity of eight Radopholus similisis olates on banana plants (Musa AAA cv. Poyo). Nematropica, 25(2), 135-141. [ Links ]
• Franco, J. y Mosquera, P. (1993). Patogenicidad del "nematodo de la oca" (Theca vermiculatusandinus) en cuatro cultivos andinos. Revista Latinoamericana de la Papa, 5(6), 30-38. [ Links ]
• García, M.A.; Lin, H. y Chang, D. (2003). El cultivo de la guayaba taiwanesa. San Andrés, SV, MAG. [ Links ]
• Geilfus, F. (1989). El árbol al servicio del agricultor: manual de agroforestería para el desarrollo rural, principios y técnicas (Vol. 1, Principios y Técnicas). Santo Domingo, R.D.: Enda-Caribe-Catie. [ Links ]
• Gómez, L.; Enrique, R.; Hernández-Ochandía, D.; Miranda, I.y Peteira, B. (2012). Susceptibilidad de genotipos de Solanum lycopersicum L. frente a Meloidogyne incognita Kofoid y White (Chitwood). Rev. Protección Veg., 27(2), 111-116. [ Links ]
• Gómez, S.; Villamizar, Q.; Prada, F.; Bayona, A.; Bautista, D. y Kopp, S. (1999). Desarrollo técnico y agroindustrial de la guayaba (Psidiumguajava L.) en Colombia. Informe Corpoica, Estación Experimental Cimpa (Barbosa, Santander). [ Links ]
• González, G. y Sourd, D. (1992). Ensayo de tres especies de Psidium y su tolerancia a nematodos. Ciencia, Técnica, Agricultura, Cítricos y otros frutales, 5(2), 13-25. [ Links ]
• González, G.E. (1986). Exploración fitopatológica y determinación de los principales artrópodos plaga que afectan al cultivo del guayabo en la región de Calvillo-Cañón del Juchipila. Informe anual de Inv. SARH-INIFAP-C. [ Links ]
• Gonzálvez, E.F. (1989). Los nematodos del género Meloidogyne Goldi en el cultivo de la guayaba y su control. Ciudad de la Habana: Instituto de Sanidad Vegetal. [ Links ]
• Greco, N.y Di Vito, M. (2009). Population dynamics and damage levels. En: Perry, R.; Moens, M. y Starr, J. (editores), Root-knot nematodes (pp. 246-269). CAB International. [ Links ]
• Hamilton, R.A. y Seagrave-Smith, H. (1959). Growing guava for processing. Hawaii, University of Hawaii. (Extension Bulletin, 63, 19). [ Links ]
• Hutchinson, J. (1973). The families of flowering plants (Third Edition). Oxford Univesity Press. Ely House, London W. [ Links ]
• Instituto Nacional de Nutrición. (2001). Tabla de composición de alimentos para uso práctico. Publicación No. 54. Serie Cuadernos Azules. Caracas: Autor. [ Links ]
• Jewkins, W.R. y Taylor, D.P. (1964). Plant nematology. New York: Reinhold Publishing Co. [ Links ]
• Kwee, L. y Chong, K. (1990). Kwee, L.T. and Chong, K.K. 1990. Guava in Malaysia: Production, pests and diseases, 1st ed. Tropical Press SDN. BHD. Kuala Lumpur. [ Links ]
• Lee, W.H. (1992). Sáquele jugo a sus frutas y verduras y mejore su salud. Cali: Editorial Norma. [ Links ]
• Lider, L.A. (1960).Vineyard trails in California with nematode-resistance rootstocks. Hilgardia, 30(4), 123-152. [ Links ]
• Lozano, J.C.; Toro, J.C.; García R.y Tafur R. (2002). Manual sobre el cultivo de Guayaba en Colombia. Fruticultura Colombiana. [ Links ]
• Luc, M.; Sikora, R.A. y Bridge, J. (2005). Plant Parasitic nematodes in subtropical and tropical agriculture (2nd Edition). CABI Publishing. [ Links ]
• Malo, S. y Campbell, C.W. (1972). The guava. Fruit Crops. Fact Sheet, 4. Gainsville, Florida: Cooperative Extension Service, University of Florida. [ Links ]
• Manica, I.; Icuma, I.M.; Junqueira, N.T.V.; Salvador, J.O.; Moreira, A. y Malavolta, E. (2000). Fruticultura Tropical: Goiaba. Cap. 6. Porto Alegre: Cinco Continentes. [ Links ]
• Matheus, J.; Suárez, Z.; Rosales, L.; Tong, F.;Cassasa, A.; Bravo, V. y Nava, A. (1999). Reacción histológica de selecciones de Psidium spp. a Meloidogyne incognita en Venezuela. Nematol. Medit., 27, 247-251. [ Links ]
• Medina, J.C.; García, L.M.; Kato, K.; De Martin, Z.; Vieria, L.F. y Ernesto, O.V. (1978). Goiaba: Da cultura au processamento e comercialização. Campinas: ITAL. [ Links ]
• Meredith J. 1973. Algunos métodos de campo y laboratorio para trabajar con nematodos. Maracaibo, Venezuela. 44 p. [ Links ]
• Mitkowski, A. y Abawi, G. (2003). Plant disease lessons: Root-knot nematode pathogen: Meloidogyne species. The American Phytopathological Society. [ Links ]
• Moens, T. y Araya, M. (2002). Efecto de Radopholus similis, Meloidogyne incognita, Pratylenchus coffeae y Helicotylenchus multicinctusen la producción de Musa AAA cv. Grande Naine. CORBANA, 28(55), 43-56. [ Links ]
• Moens, T.; Araya, M.; Swennen, R.; De Waele, D. y Sandoval, J. (2003). Growing medium, inoculum density, exposure time and pot volume: factors affecting the resistance screening for Radopholus similis in banana (Musa spp.). Nematropica, 33(1), 9-26. [ Links ]
• Molero, T.; Molina, J. y Cassasa-Padrón, M. (2010). Avances en el estudio genético de la resistencia de cultivares de Psidium spp. a Meloidogyne spp. en un bosque seco tropical. ISHS Acta Horticulturae 849: II International Symposium on Guava and other Myrtaceae. Vol. 1. [ Links ]
• Morton, J.F. (2000). Guava. In: Fruits of warm climates (pp. 356-363). Miami. Obtenido el 28 de diciembre de 2012, desde http://newcrop.hort.purdue.edu [ Links ]
• Murray, D. (1980). Uso de nematicidas en escala comercial en plantaciones bananeras del Atlántico. ASBANA, 4(13), 8-16. [ Links ]
• Navarro-Barthelemy, L.; Gómez, L.; Enrique, R.; González, F. y Rodríguez, M. (2009). Comportamiento de genotipos de tomate (Solanum lycopersicum L.) frente a Meloidogyne incognita (Kofoid y White) chitwood. Rev Protección Veg., 24(1), 54-57. [ Links ]
• Padilla, C.; López, R. y Vargas, E. (1980). Interacción entre Meloidogyne spp. y Fusarium oxysporium f. sp. pisi en arvejas. Agron. Costarr., 4(1), 55-60. [ Links ]
• Parra, R.E. (2005). Estudio de factibilidad para el montaje de una empresa industrial procesadora y comercializadora de frutas en el municipio de San José de Cúcuta. Universidad Francisco de Paula Santander. [ Links ]
• Pérez, J.M. (2000). Conferencia sobre fitonematología en el cultivo de la guayaba (Psidium guajava L.). Curso internacional sobre el cultivo de la guayaba. Ed. Instituto de Investigaciones de Cítricos y Otros Frutales. [ Links ]
• Perry, R. y Moens, M. (2006). Plant nematology. London: CAB International. [ Links ]
• Perry, R.; Moens, M. y Starr, J. (2009). Root knot nematodes. London: CAB International. [ Links ]
• Popenoe, W. (1974). Manual of Tropical and Sub-Tropical Fruits. New York: Macmillan co. [ Links ]
• Rahmat, A.; Abu Bakar, M.F.; Faezah, N. y Hambali, Z. (2004). The effects of consumption of guava (Psidium guajava) or papaya (Carica papaya) on total antioxidant and lipid profile in normal male youth. Asia Pac J Clin Nutr, 13(S), S106. [ Links ]
• Rao, Y. e Israel, P. (1972). Influence ofinoculum density on the final population of rootknot nematode (Meloidogyne graminicola) in rice. Indian Journal of Nematology, 2(1), 72-76. [ Links ]
• Ríos-Castaño, D. y Salazar, R. (1977). El cultivo de la guayaba. Manual de Asistencia técnica en frutales (Tomo II, pp. 223-248). Programa Nacional de hortalizas y frutales. ICA. Ministerio de Agricultura. [ Links ]
• Rodríguez, H.; Fernández, F.y Shesteperov A. (1985). Adverse effect of Meloidogyne infection on guava. Helminthological Abstracs 1988. Serie B. Vol. 57(2). [ Links ]
• Ruiz, O.J. (1980). Fitonematodos observados en el cultivo del guayabo y su control. Universidad Autónoma de Aguascalientes. Inédito. [ Links ]
• SAG (Secretaría de Agricultura y Ganadería, HN); DICTA (Dirección de Ciencia y Tecnología Agropecuaria, HN); PROMOSTA (Proyecto de Modernización de los Servicios de Transferencia de Tecnología Agrícola, HN) y Banco Interamericano de Desarrollo. (2005). El Cultivo de la Guayaba (Psidiumguajava) 5. HN. [ Links ]
• Samson, J.A. (1991). Fruticultura tropical. Trad. B. Gurza González. México, D.F.: Limusa. [ Links ]
• Sancho, L.; Salazar, L. y López, R. (1987).Efecto de la densidad inicial del inóculo sobre la patogenicidad de Meloidogyne salasi en tres cultivares de arroz. Agronomía Costarricense, 11(2), 233-238. [ Links ]
• Siddiqui, Z. y Husain, S. (1992). Interaction between Meloidogyne incognita race 3, Macrophomina phaseolina and Bradyrhizobium sp. in the root-rot disease complex of chickpea, Cicerarietinum. Fundamental and Applied Nematology, 15, 491-494. [ Links ]
• Sikora, R. y Fernández, E. (2005). Nematodeparasites of vegetables. En: Luc, M.;Sikora, R. y Bridge, J. (editores), Plant Parasitic Nematodes in Subtropical and Tropical Agriculture (pp. 319-392). CAB International. [ Links ]
• Singh, R.B.; Rastogi, S.S.; Singh, R.; Ghosh, S. y Niaz, M.A. (1992). Effects of guava intake on serum total and high- density lipoproteína cholesterol levels and on systemic blood pressure. Am J Cardiol, 70(15), 1287-91. [ Links ]
• Taylor, A.L. y Sasser, J.N. (1978). Biology, identification and control of root-knoot nematodes. United States of America. [ Links ]
• Villota, F. y Varón, F. (1997). Evaluación de materiales de guayaba (Psidium guajava L.) por su comportamiento al ataque de Meloidogyne incognita Raza 2. Fitopatología Colombiana, 21(2), 31-37. [ Links ]
• Yusof, R.M. y Said, M. (2004). Effect of high fibre fruit (Guava - Psidium guajava L.) on the serum glucose level in induced diabetic mice. Asia Pac J Clin Nutr, 13 (Suppl), S135. [ Links ]
• Zem, A. y Alves, E. (1983). Efeito de diferentes praticas sobre a população de Radopholus similis. En: Reunião de Nematologia No. 7. Soc. Brasil. Nemat. p. 215-225. [ Links ]













