Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Luna Azul
Print version ISSN 1909-2474
Luna Azul no.39 Manizales July/Dec. 2014
INTEGRATED MANAGEMENT OF PHYTOPARASITIC NEMATODES IN DOMINICO HARTÓN PLANTAIN (Musa AAB SIMMONDS) SEEDLINGS
Ricardo Andrés Valencia Serna1
Óscar Adrián Guzmán Piedrahita M.Sc.2
Bernardo Villegas Estrada, M.Sc.3
Jairo Castaño Zapata, Ph.D.4
1. Ingeniero Agrónomo, Correo electrónico: ravs_0285@hotmail.com
2,3. Profesor Asistente, Facultad de Ciencias Agropecuarias, Universidad de Caldas. Manizales, Caldas, Colombia. Correo electrónico: oscar.guzman@ucaldas.edu.co, bernardo.villegas@ucaldas.edu.co
4. Profesor Titular, Facultad de Ciencias Agropecuarias, Universidad de Caldas. Manizales, Caldas, Colombia. Correo electrónico: jairo.castano_z@ucaldas.edu.co
Recibido el 12 de septiembre de 2013 y aprobado el 28 de mayo de 2014, actualizado el 10 junio de 2014
RESUMEN
Como consecuencia de la alimentación de Radopholus similis, se generan daños en las raíces y el cormo que conllevan a un crecimiento deficiente de las plantas y reducción en rendimiento hasta 80%. Por tal motivo, el objetivo de esta investigación fue determinar el efecto de la integración de prácticas de manejo como limpieza sanitaria de cormos y biológicas como Micorrizas Arbusculares (MA), Purpureocillium lilacinum y Bacillus subtilis sobre el crecimiento de las plántulas de Dominico Hartón y la población de nematodos fitoparásitos. El experimento se realizó en la granja Montelindo de la Universidad de Caldas, a 1010 msnm, 23ºC de temperatura promedio y 1800 mm de precipitación. Los tratamientos fueron asignados en un diseño experimental completamente aleatorio, cada uno conformado por 20 cormos (unidades experimentales) sembrados en bolsas negras de 5 kg de capacidad, así: cormos con limpieza sanitaria sin aplicación de productos (T1), cormos con limpieza sanitaria + MA (T2), cormos con limpieza sanitaria + P. lilacinum (T3), cormos con limpieza sanitaria + B. subtilis (T4), y cormos con limpieza sanitaria + MA + P. lilacinum + B. subtilis (T5). El anterior procedimiento también se realizó a cormos tradicionales sembrados en suelo sin esterilizar (T6 a T10, respectivamente). En los tratamientos que fueron establecidos en suelo esterilizado y cormos con limpieza sanitaria, no hubo presencia de individuos de los principales géneros de nematodos fitoparásitos del plátano como Radopholus, Meloidogyne y Helicotylenchus. Los tratamientos en los cuales se utilizó suelo infestado y cormos con limpieza sanitaria, presentaron una disminución de hasta un 64% en la población de nematodos fitoparásitos en comparación con la inicial, aunque mostraron también una cantidad de nematodos menor al testigo. De estos tratamientos el que menor población presentó fue el T10 (Suelo infestado + cormos con limpieza sanitaria + MA + P. lilacinum + B. subtilis) con una población promedio de 472 nematodos fitoparásitos en 100 g de suelo. La integración de todas las medidas de manejo resultó más eficiente en el control de los nematodos fitoparásitos en plátano, con o sin la esterilización del suelo; y la limpieza sanitaria de cormos no afectó negativamente el desarrollo de las raíces ni de la parte aérea de las plantas, pues no se presentaron diferencias significativas respecto a los tratamientos donde se usaron cormos tradicionales.
PALABRAS CLAVE
Limpieza sanitaria de cormos, Radopholus< similis, Micorrizas Arbusculares, Purpureocillium lilacinum, Bacilus subtilis.
ABSTRACT
As a result of feeding of Radopholus similis, both roots and corms are damaged and this results in plant growth deficiency and yield losses up to 80%. Therefore, the objective of this study was to determine the effect of the integration of management practices such as corms sanitary cleaning and biological cleaning such as Arbuscular mycorrhizae (AM), Purpureocillium lilacinum and Bacillus subtilis on the development of Dominico Hartón plantain seedlings and phytoparasitic nematods populations. The experiment was conducted at the Universidad de Caldas Montelindo farm located at 1,010 m.a.s.l.., average temperature 23ºC and 1,800 mm rainfall. The treatments were assigned in a completely randomized block design, each one with 20 corms (experimental units) planted in 5 kg black plastic bags as follows: corms with sanitary seed cleaning without application of products (T1); corms with sanitary cleaning + AM (T2); corms with sanitary cleaning + P. lilacinum (T3); corms with sanitary cleaning + B. subtilis (T4); and corms with sanitary cleaning + AM + P. lilacinum + B. subtilis (T5). The described procedure was also applied to traditional corms planted in soil without sterilization (T6 to T10, respectively). In the treatments established in sterilized soil and cleaned corms, there was not presence of individuals of the main plant parasitic nematodes of plantain, such as, Radopholus, Meloidogyne and Helicotylenchus. Treatments with infested soil with nematodes and cleaned corms, showed a reduction in plant parasitic nematodes up to 64% compared with the initial population, although they also showed lower amount of nematodes than the control population. From these treatments, the one that had the lowest population of nematodes was the T10 (Infested soil + cleaned corms + AM + P. lilacinum + B. subtilis) with an average population of 472 phytoparasitic nematodes/100 g of soil). The integration of all management practices resulted in the most efficient way to control the plant phytoparasitic nematodes of plantain, with or without soil sterilization, and the corms sanitary cleanness did not affect either the root development or the aerial parts of the seedlings, since there were not significant differences with respect to the treatments using traditional corms.
KEY WORDS
Corms sanitary cleanness, Radopholus similis, Arbuscular Mycorrhizae, Purpureocillium lilacinum, Bacilus subtilis.
INTRODUCCIÓN
En Colombia actualmente hay sembradas 353.297 ha con el cultivo del plátano, con una producción de 2'815.693 t y un rendimiento promedio de 8 t.ha-1 (Agronet, 2012), convirtiéndose en un producto de gran importancia socioeconómica en el sector tradicional de economía campesina, generando 0,75 empleos ha.año-1, es decir, 282.490 empleos permanentes anualmente (Espinel et al., 2006).
El plátano y el banano han sido tradicionalmente propagados vegetativamente por cormos o partes de cormos, por lo que el material de siembra infectado ha sido el principal responsable de la diseminación a través del mundo de nematodos endoparásitos migratorios como Radopholus similis Cobb y Pratylenchus coffeae (Zimmermann, 1898) Filipjev & Schuurmans Stekhoven, alrededor del mundo (Loos, 1961; Sarah, Pinochet & Stanton, 1996; Gowen, Quénéhervé & Fogain, 2005). De tal manera que como muchas especies de plantas son transportadas por los humanos, los nematodos fitoparásitos y otros patógenos de las musáceas también han sido llevados con ellas (Sarah et al., 1996).
Como consecuencia de la alimentación de estos nematodos, se generan daños en las raíces y el cormo que conllevan a un crecimiento deficiente de las plantas, las hojas son más pequeñas y en menor número, los frutos tienen un peso reducido y las plantas se vuelcan debido a la pudrición del sistema radical (Montiel, Sosa, Medrano & Romero, 1997; Agrios, 2005). La reducción en la producción puede ser de 60% y 51% en la primera y segunda cosechas, respectivamente, si no se controla R. similis principal especie fitoparásita (Jones, 1996; Fogain, 2000). Según Moens, Araya, Swennen & Waeles (2003), la reducción en el rendimiento por R. similis llega hasta 80%.
Para manejar los nematodos fitoparásitos se pueden utilizar la rotación de cultivos y los nematicidas químicos como el Fenamiphos y el Carbofuran entre otros (Gowen & Quénéhervé, 1990), pero en áreas donde el plátano se cultiva de manera continua, la rotación de cultivos no puede ser practicada; al mismo tiempo, el precio de los nematicidas a menudo es demasiado alto para los agricultores con áreas de cultivo menores a 5 ha y la mayoría de estos productos son altamente tóxicos (González, Aristizábal & Aristizábal, 2007).
La reducción de las poblaciones de nematodos en el suelo antes de la siembra y el uso de material vegetal libre de nematodos, son factores de gran importancia para el manejo de los nematodos endoparásitos, especialmente R. similis. Cormos o hijuelos ligeramente infestados pueden ser tratados para eliminar los nematodos (Sarah et al., 1996); es por ello que la limpieza de los colinos mediante la técnica de "pelado", seguido por inmersión en agua caliente (52-55°C por 15-20 min) ha sido una práctica común y muy efectiva en América Central y en Australia. Sin embargo, los tratamientos con agua caliente requieren mano de obra abundante y control cuidadoso siendo la temperatura y el tiempo de exposición críticos para que sean efectivos y no causen daño a los cormos. También se puede desinfectar el material de siembra sumergiéndolo en una solución nematicida (2500 ppm) por 30 min (Sarah et al., 1996; Hauser, 2003; Guzmán & Castaño, 2004).
La selección de la fuente de cormos-semilla, el nuevo campo y el uso de insumos biológicos son esenciales para el manejo adecuado de los nematodos fitoparásitos. Estos últimos tienen varias ventajas tanto en el ámbito económico como en el ámbito ecológico, puesto que al utilizarlos se disminuyen los costos de producción y se reduce la contaminación del medio ambiente. Entre los insumos biológicos más utilizados se encuentran las Micorrizas Arbusculares (MA), y las Bacterias Promotoras de Crecimiento Vegetal (BPCV), las cuales contribuyen positivamente en la nutrición y crecimiento de las plantas, y al mismo tiempo, en el manejo de patógenos radicales y aéreos (Sánchez, 2007).
Como una medida para favorecer la absorción y asimilación de los nutrientes minerales del suelo están las MA que son un grupo de hongos habitantes del suelo que forman simbiosis con las raíces de las plantas (Cruz, Sánchez & Sieverding, 1989; Sieverding, 1991; Smith & Read, 1997; Ulloa & Hanlin, 2001; Rivillas, 2003). Las esporas o hifas de los hongos que forman MA se adhieren a las raíces, después de reconocerse bioquímicamente con la planta, colonizan las células de la corteza radical y luego penetran al interior de algunas de ellas, allí forman una estructura llamada arbúsculo, donde ocurre el mayor intercambio entre los dos simbiontes: la planta provee al hongo de fuentes de azúcares y este, a su vez, proporciona minerales a la planta, especialmente fósforo. La importancia de la MA radica en la absorción de nutrientes (Fósforo, Nitrógeno, Potasio, Calcio, Magnesio y otros elementos), en la resistencia al ataque de patógenos, en el reciclaje de nutrientes, etc. (Guzmán & Rivillas, 2007; Sánchez, 2007).
Las BPCV son bacterias de vida libre o asociativa que habitan la rizosfera y pueden estimular el crecimiento de las plantas a través de varios mecanismos como síntesis de sustancias reguladoras del crecimiento vegetal, fijación de nitrógeno, solubilización de nutrimentos, producción de sideróforos y control de fitopatógenos del suelo. Los microorganismos más estudiados pertenecen a los géneros Azospirillum, Azotobacter, Klebsiella, Beijerinckia, Pseudomonas y Bacillus; algunos de los cuales sobreviven en condiciones de estrés (Loredo, López & Espinosa, 2004). Las BPCV pueden ser de vida libre o asociativas, aerobias, anaerobias o anaerobias facultativas (Rodríguez, 1995).
Las BPCV generalmente se encuentran en la zona de influencia de las raíces como la rizosfera, siendo capaces de adherirse a ellas y colonizar la superficie radical como respuesta a los exudados radicales, así como de inducir la germinación de semillas y el desarrollo vegetal (Sánchez, 2007). Muchos de estos procariotas, producen y secretan en su sitio de crecimiento metabolitos estimuladores del crecimiento vegetal (fitohormonas) y ayudan en la fijación o solubilización de elementos del suelo (Nitrógeno o Fósforo) (Kloepper, Mahaffee, McInroy & Backman, 1991; Loredo et al., 2004). En otros casos actúan como competidores o antagonistas de patógenos del suelo, liberando a la planta de los efectos nocivos de estos con mecanismos de antibiosis, competencia o resistencia sistémica inducida (Jaizme & Rodríguez, 2004), y consecuentemente favoreciendo el desarrollo vegetal. Según Egamberdiyeva (2007), las BPCV son capaces de incrementar el crecimiento de las plantas, mejorando el crecimiento de las raíces, acelerando el proceso de germinación y la emergencia de las plántulas, ayudando en la respuesta a factores de estrés externos y condicionando la planta para contrarrestar el ataque de los patógenos.
El género Bacillus (Ehrenberg) Cohn, pertenece a la familia Bacillaceae, donde actualmente se incluyen más de 60 especies. Este género está formado por microorganismos bacilares Gram positivos, formadores de endosporas, quimioheterótrofos que normalmente son móviles debido a sus flagelos perítricos. Son anaerobios o aerobios facultativos y reaccionan positivamente a la prueba de la catalasa. Las células bacterianas de este género tienen un amplio tamaño que varía de 0,5 a 2,5 um de ancho y 1,2 a 10 um de largo. Este género se encuentra comúnmente en el suelo y en las plantas donde tiene un papel importante en el ciclo del carbono y el nitrógeno. Son habitantes comunes de aguas frescas y estancadas, son particularmente activos en sedimentos (Koneman, 2001).
Los mecanismos de acción de Bacillus spp. incluyen competencia por espacio y nutrientes, antibiosis e inducción de resistencia. Además, Bacillus tiene un efecto comprobado en la promoción de crecimiento de las plantas. La capacidad de Bacillus de formar esporas que sobreviven y permanecen metabólicamente activas bajo condiciones adversas, las hace apropiadas para la formulación de productos viables y estables para el control biológico. B. subtilis es uno de los más eficientes agentes de biocontrol, el cual exhibe actividad antagonista contra varios hongos y bacterias patogénicas. Este antagonismo se ha atribuido a la producción de antibióticos y a la capacidad de colonización en las plantas (Chaves, 2007).
B. subtilis es una bacteria Gram positiva, que produce endosporas termo resistentes y también resistentes a factores físicos perjudiciales como la desecación, la radiación, los ácidos y los desinfectantes químicos, además produce enzimas hidrofílicas extracelulares que descomponen polisacáridos y ácidos nucleicos permitiendo que el organismo emplee estos productos como fuente de carbono, produce antibióticos como la bacitracina, polimixina, gramicidina y circulina, fermenta la caseína y el almidón y sobrevive dentro de los límites de 55 a 70ºC. B. subtilis promueve el desarrollo de las plantas y previene las enfermedades originadas en el suelo causadas por Sclerotium rolfsii, Fusarium spp., Verticillium spp., Sclerotinia sclerotiorum, Phytophthora capsici, Pythium spp., el nematodo formador de nudos en raíces (Meloidogyne spp.) y Rhizoctonia solani, agente causante de la enfermedad denominada "Mal del talluelo" del algodonero (Cuervo, 2010).
Paecilomyces lilacinus (Thom) Samson reclasificado como Purpureocillium lilacinum (Thom) Luangsa-Ard et al. (2011), es un hongo que controla fitonematodos, principalmente especies del nematodo formador de nudos Meloidogyne spp. Este hongo parasita huevos, adultos y quistes de nematodos. También puede afectar nematodos móviles que están fuera de las raíces. De modo que puede infectar cualquiera de estos estadios del nematodo, causándoles la muerte o evitando que el nematodo complete su ciclo de vida, disminuyendo de esa manera las poblaciones en el campo. En ausencia de nematodos el hongo puede sobrevivir como saprófito en el suelo (FUNICA, 2009). En la naturaleza P. lilacinum se encuentra como habitante del suelo. Este hongo tiene la habilidad de sobrevivir en materia orgánica y siempre se encuentra presente en el campo principalmente en zonas húmedas y donde hay bastantes insectos plaga. P. lilacinum es también patógeno de insectos, pero su mayor relevancia es como patógeno de fitonematodos, ya que causa una tasa de mortalidad alta de estos, reduciendo sus poblaciones en los cultivos (FUNICA, 2009; Vergara, Guzmán & Leguizamón, 2012).
Por lo anterior, el objetivo de esta investigación fue determinar el efecto de la integración de prácticas de manejo (limpieza sanitaria de cormos) y biológicas (Micorrizas Arbusculares, Purpureocillium lilacinum y Bacilus subtilis) sobre el crecimiento de las plántulas y la población de nematodos fitoparásitos en condiciones de almácigo en la cultivariedad de plátano Dominico Hartón.
MATERIALES Y MÉTODOS
Localización
El ensayo se realizó sobre una losa de concreto para evitar la contaminación por nematodos, ubicada en la granja Montelindo de la Universidad de Caldas, vereda Santágueda, municipio de Palestina, departamento de Caldas, a una altitud de 1010 msnm, con temperatura promedio anual de 23ºC y precipitación anual de 1800 mm. Los análisis de población y caracterización de los nematodos fueron realizados en el Laboratorio de Fitopatología de la Facultad de Ciencias Agropecuarias de la Universidad de Caldas en Manizales.
Material vegetal
De lotes comerciales de plátano Dominico Hartón se recolectaron 240 cormos entre 1,0 y 1,5 kg de peso, y fueron acopiados en un sitio seco y fresco bajo sombra y evitando el contacto directo con el suelo para evitar su contaminación con nematodos; a 200 de ellos se les realizó limpieza sanitaria "pelado" con un cuchillo hasta eliminar completamente el tejido necrótico y garantizando que el cormo quedara completamente blanco. A los 40 cormos restantes no se les realizó ninguna práctica, siendo considerados como cormos tradicionales, solamente se les retiró las raíces.
Suelo
Se recolectó suelo de lotes infestados con nematodos fitoparásitos, una parte de este fue trasladado a una losa de concreto de 16 m2 y esterilizado con Dazomet (Basamid® GR) en dosis de 50 g.m-2, luego de aplicado el producto se cubrió con un plástico por espacio de 10 días para que este pudiese hacer efecto, después de este tiempo se retiró para dejar escapar los gases producidos por el Dazomet para evitar fitotoxicidad en los cormos. La otra parte del suelo recolectado se dejó infestado con nematodos para ser utilizado así. Al suelo infestado se le determinó la población de nematodos fitoparásitos antes y después de aplicado el Dazomet.
Microorganismos benéficos
• Micorrizas Arbusculares: Se utilizó una MA conocida en el comercio como Micorrizafer® en dosis de 100 g.planta-1. Estas se aplicaron al hoyo y al momento de la siembra para favorecer el contacto con las raíces de las plántulas de plátano cuando estas comienzan a crecer.
• Purpureocillium lilacinum: El producto comercial utilizado a base de Purpureocillium lilacinum fue Paecilotrópico® en dosis inundativa de 4 g.L de agua-2; este se aplicó a la siembra.
• Bacterias Promotoras de Crecimiento Vegetal: Se usó B. subtilis, en una concentración de 1 x 106 células ml-1; la cual fue suministrada por la Dra. Marina Sánchez de Praguer, Profesora Titular de la Universidad Nacional de Colombia, sede Palmira. B. subtilis fue aplicado al momento de la siembra.
Procedimiento
Se tomaron 120 bolsas negras de 5 kg de capacidad y se llenaron hasta aproximadamente la mitad de las mismas con el suelo esterilizado, luego se separaron en grupos de 20 bolsas para facilitar el montaje de cada tratamiento; posteriormente, se tomaron 100 cormos con limpieza sanitaria y se sembraron los correspondientes al tratamiento 1, a los cuales no se les aplicó ningún producto, después se establecieron los tratamientos 2 al 5 y 11 en suelo esterilizado (Tabla 1). Luego se recolectó suelo infestado con nematodos de uno de los lotes comerciales de plátano de la granja Montelindo de la Universidad de Caldas y se llenaron otras 120 bolsas con las mismas características a las anteriormente nombradas, se establecieron los tratamientos 6 al 10 y el 12 (Tabla 1), finalmente se procedió a rotular cada una de las bolsas con su respectivo tratamiento y con el número de la repetición. Después de la siembra, se aplicó riego al suelo para mantenerlo a capacidad de campo.
Cada cormo se consideró como unidad experimental. Se utilizó un diseño experimental completamente aleatorio con 20 repeticiones por tratamiento. Los tratamientos se describen en la Tabla 1.
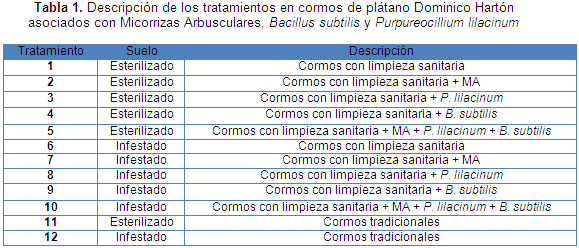
Variables de respuesta en condiciones de campo
Altura (cm) de plántulas (distancia desde el nivel del suelo hasta la base de la hoja bandera): A los 70 días se midió la altura de plántulas y brotación (%) (Plántulas efectivas/cormos sembrados).
Posteriormente se realizó un muestreo destructivo de las plantas de las cuales se separaron raíces, cormos y parte aérea, todo esto se empacó en bolsas de 2 kg de capacidad de color trasparente y se rotularon con el respectivo tratamiento y repetición.
Variables de respuesta en condiciones de laboratorio
Biomasa (materia seca de raíces y parte aérea): Para determinar el peso seco de las raíces y de la parte aérea de las plántulas de todos los tratamientos, fueron tomados los tallos del total de las plántulas de plátano Dominico Hartón y las raíces de 14 de ellas, las cuales se empacaron en bolsas de papel rotuladas con su respectivo tratamiento y el número de repetición de esta, después fueron llevadas a un horno, marca 1DIES, ubicado en el Laboratorio de Química de Suelos de la Universidad de Caldas a una temperatura de 80ºC por espacio de 72 h, después de este tiempo, todas las muestras de raíces y de la parte aérea se llevaron a una sala de pesado ubicada en el mismo laboratorio y mediante una balanza digital OHAUS Analytical Plus, se determinó el peso seco de cada una de las partes de la planta.
Luego de separados los cormos, las raíces y la parte aérea de las plántulas, se trasladaron las bolsas con las muestras al Laboratorio de Fitopatología del Departamento de Producción Agropecuaria de la Universidad de Caldas para su análisis, donde se realizó conteo e identificación de nematodos fitoparásitos en 100 g de suelo y de raíces, también se evaluó el efecto de los tratamientos sobre la materia seca de raíces y parte aérea y el porcentaje de colonización por micorrizas.
Población e identificación de géneros de nematodos fitoparásitos (cantidad de fitonematodos/100 g de suelo y raíces): la extracción de nematodos se realizó con base en el principio de flotación de los nematodos en azúcar descrito por Jenkins (1964), Meredith (1973) y Araya, Centeno & Carrillo (1995); para lo cual se procede de la siguiente manera: las raíces se lavaron con agua corriente, después de dejarlas secar a temperatura ambiente, se pesaron 30 g de ellas en una balanza, y con la ayuda de un cuchillo se cortaron transversalmente en trozos de 1 cm, que luego se homogenizaron. Estos trozos se colocaron en un vaso de licuadora Osterizer con 500 ml de agua y luego se licuaron, tres veces por un período de 10 s y entre cada lapso se dejaron reposar 5 s. El licuado se depositó en un tamiz de 250 um colocado sobre un tamiz de 106 um, y este sobre otro de 25 um. La muestra se lavó con agua a presión para que ocurriese el desprendimiento de los nematodos y del material que quedó en el tamiz de 25 um, luego se depositó todo el contenido, aproximadamente 25 ml, en tubos de centrifugación de 50 ml de capacidad. Seguidamente se agregaron a cada tubo 25 ml de sacarosa al 50% y se centrifugó a 3800 rpm durante 5 min en una centrífuga HERMEL, tipo Z400. Como consecuencia de la centrifugación hubo sedimentación de las partículas pesadas en el fondo del tubo. Los nematodos se ubicaron en una capa intermedia (gradiente de sacarosa). De cada tubo se extrajo toda el agua, donde se encontraba la interfase con los nematodos.
Después que los nematodos fueron extraídos, se depositaron en un tamiz de 25 um y se lavaron con abundante agua para evitar que el azúcar los afectara. Finalmente se recogieron en una caja Petri para realizar los conteos e identificación.
Tinción de raíces: se hizo con azul de tripano para determinar el porcentaje de colonización de las MA (Rivillas, 1995). Para ello se separaron aproximadamente 2 g de raíces, se lavaron con abundante agua y luego se colocaron en tubos de ensayo inicialmente con KOH al 2,5%, esto para aclarar el citoplasma y núcleo de las células, y se llevaron al baño María, marca INDULAB, por 1 h a una temperatura de 90ºC, después se adicionó a las raíces HCl al 2% y se dejaron a temperatura ambiente por 1 h más, con el fin de ablandar las paredes de las células de la raíz; luego se decantó el HCl y se lavaron las raíces nuevamente con agua, seguido a esto se adicionó azul de tripano al 0,05% y se colocaron en el baño María por 1 h a 90ºC, luego se retiraron las raíces y se llevaron a cajas Petri con glicerol al 50% para retirar el exceso de colorante. Por último se ubicaron las raíces en portaobjetos y se llevaron al microscopio marca NIKON, marca TS 2-T, para verificar la colonización por micorrizas.
Análisis estadístico: para cada práctica de manejo de los cormos, se calcularon los promedios y coeficiente de variación, así como el análisis de varianza para la variable de respuesta y para las variables complementarias. Asimismo, se establecieron correlaciones entre la variable de respuesta con cada una de las variables complementarias. Cuando el análisis de varianza mostró efecto de tratamientos, se aplicó la prueba de Tukey al 5% para establecer la diferencia entre los promedios de los tratamientos.
RESULTADOS Y DISCUSIÓN
Cantidad de nematodos fitoparásitos antes de la siembra. Antes de establecer el experimento se cuantificó la población de nematodos fitoparásitos existentes en el suelo recolectado del lote comercial de plátano Dominico Hartón que se utilizó para la investigación. La cantidad de nematodos fitoparásitos encontrada fue de 2.173 nematodos/100 g de suelo, de los cuales 928 nematodos correspondió a saprófitos, 423 a la especie Radopholus similis, 749 al género Helicotylenchus, 132 al género Meloidogyne y 85 al género Aphelenchus.
Para los tratamientos que se establecieron en suelo esterilizado, se cuantificó la población de nematodos fitoparásitos después de esterilizarlo con Dazomet, la cual fue cero.
Cantidad de nematodos fitoparásitos después de la siembra
Raíces. Al realizar el análisis estadístico y la prueba de comparación de medias de Tukey al 5% de probabilidad, la variable población de nematodos fitoparásitos en raíces, se observó diferencias significativas entre los tratamientos y una población de cero nematodos fitoparásitos en los tratamientos con suelo esterilizado, es decir, los cinco primeros tratamientos, mostraron la efectividad de la esterilización del suelo para el manejo de los nematodos fitoparásitos; es de anotar que aunque el T11 también fue con suelo esterilizado, se presentó una alta población de nematodos fitoparásitos debido a que se usó cormo tradicional sin limpieza sanitaria, es decir, contaminado con fitonematodos (Tabla 2).
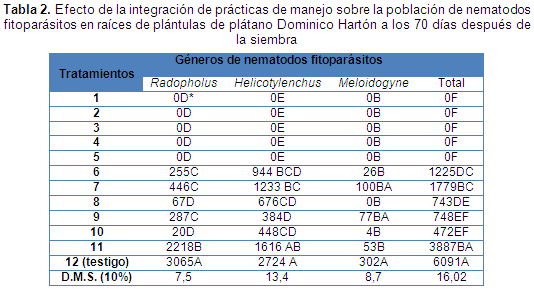
T1 (Suelo esterilizado + cormos con limpieza sanitaria). T2 (Suelo esterilizado + cormos con limpieza sanitaria + MA). T3 (Suelo esterilizado + cormos con limpieza sanitaria + P. lilacinum). T4 (Suelo esterilizado + cormos con limpieza sanitaria + B. subtilis). T5 (Suelo esterilizado + cormos con limpieza sanitaria + MA + P. lilacinum + B. subtlis). T6 (Suelo infestado + cormos con limpieza sanitaria). T7 (Suelo infestado + cormos con limpieza sanitaria + MA). T8 (Suelo infestado + cormos con limpieza sanitaria + P. lilacinum). T9 (Suelo infestado + cormos con limpieza sanitaria + B. subtilis). T10 (Suelo infestado + cormos con limpieza sanitaria + MA + P. lilacinum + B. subtilis). T11 (Suelo esterilizado + cormos tradicionales). T12 (Suelo infestado + cormos tradicionales). P.I. = Población inicial. * Promedios en cada columna seguidos de letras distintas denotan diferencias significativas entre tratamientos según la prueba de Tukey a un nivel de probabilidad del 5%.
En general, se observó que para los tratamientos que fueron establecidos en suelo esterilizado y cormos con limpieza sanitaria, no hubo presencia de individuos de las principales especies de los nematodos fitoparásitos del plátano como son Radopholus similis y Meloidogyne como tampoco se encontraron individuos del género Helicotylenchus.
Los tratamientos en los cuales se utilizó suelo infestado y cormos con limpieza sanitaria, presentaron una disminución de hasta un 64% en la población de nematodos fitoparásitos en comparación con la inicial, aunque mostraron también una cantidad de nematodos menor al testigo. De estos tratamientos el que menor población presentó fue el T10 (Suelo infestado + cormos con limpieza sanitaria + MA + P. lilacinum + B. subtilis) con una población promedio de 472 nematodos fitoparásitos en 100 g de suelo. Contrario a lo obtenido en el T12 (Suelo infestado + cormos tradicionales), y denominado como testigo, el cual presentó la mayor población de nematodos fitoparásitos con un promedio de 6.091 individuos en 100 g de raíces (Tabla 2).
El estudio demostró que las prácticas de manejo de nematodos son más eficientes si se integran, pues se obtienen mejores resultados y poblaciones de nematodos reducidas o nulas, además si se esteriliza el suelo se garantiza que no se van a presentar poblaciones de nematodos fitoparásitos en condiciones de almácigo; adicional a esto, realizar el pelado sanitario de cormos ayuda a disminuir el inóculo inicial de nematodos y así obtener plántulas de plátano más sanas, que posteriormente al ser llevadas a campo se va a reflejar en una mejor producción del cultivo.
Flores (2009), encontró que con la aplicación de P. lilacinum y materia orgánica se obtenían poblaciones bajas de nematodos fitoparásitos en cultivo de rosa, obteniendo un promedio de hasta 48 nematodos en raíces y 93 nematodos en suelo.
Sin embargo, González et al. (2007) encontraron, con la aplicación de P. lilacinum Cepa B, una tendencia creciente de la población de Helicotylenchus principalmente y con aumento continuo de individuos de este género durante 6 meses después del tratamiento. También observaron con la aplicación de P. lilacinum Cepa A, una tendencia creciente de la población de R. similis desde la primera aplicación y hasta la culminación del experimento.
Pérez, Sánchez & Fernández (1999) encontraron que al aplicar 200 g/planta de P. lilacinum, la población de R. similis pasó de 132 individuos a cero en 100 g de raíces después de 24 meses; resultados similares a los obtenidos en esta investigación donde se obtuvo una población final de cero individuos de R. similis con suelo esterilizado, partiendo de una población de 423 individuos en 100 g de raíces, mientras que con suelo infestado la población disminuyó a 67 individuos en 100 g de raíces.
Bolaños (2011) encontró que al aplicar micorrizas a razón de 495 esporas/10 g/sitio disminuyó la población de R. similis desde 172 nematodos hasta 46 nematodos en 100 g de raíces en un ciclo de cultivo. En esta investigación con la aplicación de micorrizas y con suelo esterilizado se logró bajar la población de este nematodo desde 423 individuos en 100 g de raíces, hasta cero en 100 g de raíces, contrario a lo ocurrido con suelo infestado, donde la población aumentó de 423 nematodos en 100 g de raíces al momento de siembra a 446 individuos en 100 g de raíces al final del experimento (70DDS).
Suelo. El análisis estadístico indicó que hubo diferencias significativas entre tratamientos, registrando nuevamente una población de cero nematodos en los primeros cinco tratamientos en donde se utilizó suelo esterilizado.
En estudios similares, Becerra, Castaño-Zapata & Villegas-Estrada (2010) encontraron que al aplicar 1 kg de Micorrizas + 5 g de Aldicarb, la población de nematodos fitoparásitos fue de 37 individuos/100 g de raíces y 6 individuos/100 g de suelo en promedio y que la supresión de nematodos con P. lilacinum fue más efectiva en presencia de MA con un promedio de 268 nematodos que en ausencia de esta tuvo 457 nematodos en promedio.
El comportamiento general de la población de nematodos fitoparásitos en suelo estuvo ligado al comportamiento poblacional encontrado en raíces, pues nuevamente los tratamientos que menor población promedio de nematodos presentaron, fueron los correspondientes a los establecidos con suelo esterilizado y cormos con limpieza sanitaria, y nuevamente el testigo fue el que presentó una población promedio superior al resto de los tratamientos con 1.753 nematodos fitoparásitos en 100 g de suelo, encontrándose también que la integración de las medidas de manejo resulta ser más eficiente e incluso en los tratamientos en que no se utilizó suelo esterilizado, como el T10 (Suelo infestado + cormos con limpieza sanitaria + MA + P. lilacinum + B. subtilis) el cual es la integración de todos los microorganismos benéficos, y fue el que presentó en promedio menor población de nematodos fitoparásitos del grupo de tratamientos que tenían suelo infestado con 253 nematodos fitoparásitos en 100 g de suelo (Figura 1).
Castrillón et al. (2002) encontraron que el producto biológico Biostat®, a base de Purpureocillium lilacinum, mostró ser eficaz en el control de nematodos fitoparásitos del plátano Musa AAB, al reducir las poblaciones de Helicotylenchus sp., Meloidogyne spp. y Radopholus similis y aumentar la microflora del suelo (hongos, bacterias y nematodos saprófitos).
Guzmán, Castaño-Zapata & Villegas-Estrada (2012) encontraron que al utilizar suelo esterilizado y cormos con limpieza sanitaria se logró obtener cormos libres de nematodos fitoparásitos, resultados que concuerdan con los obtenidos en esta investigación donde se obtuvieron cormos sin nematodos fitoparásitos con la utilización de suelo esterilizado y cormos con limpieza sanitaria.
Croshier, Montecinos, Jiménez & Gallo (1984) encontraron que al aplicar P. lilacinum, se logró obtener un parasitismo del 76% de los huevos de Meloidogyne spp. y así disminuyó la población de este nematodo en el mismo porcentaje; resultados similares se obtuvieron al aplicar P. lilacinum en esta investigación, pues se logró controlar el 100% de la población de este nematodo, tanto con suelo esterilizado como con suelo infestado (T3 y T8) partiendo de semilla sana.
Brotación (%). Se determinó mediante la siguiente fórmula: plántulas efectivas/cormos sembrados x 100. Los tratamientos T1 (Suelo esterilizado + cormos con limpieza sanitaria) y T6 (Suelo infestado + cormos con limpieza sanitaria) tuvieron ambos un porcentaje de brotación del 95%, con los demás tratamientos se obtuvo una brotación del 100%.
Resultados similares obtuvieron González-Cardona & Guzmán-Piedrahita (2011), donde la brotación de las plántulas tradicionales y con limpieza sanitaria de Dominico Hartón fue del 100%, mostrando también que a pesar de realizar esta práctica, en donde las raíces son retiradas del cormo en su totalidad, no afecta la brotación de las plántulas.
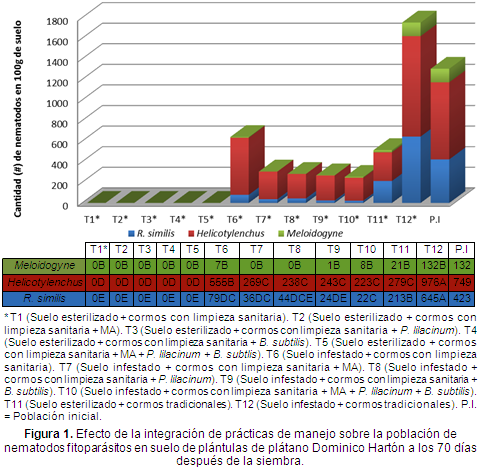
Altura de plántulas. Luego de realizar la prueba de comparación de medias de la altura de las plántulas, se concluyó que el tratamiento que tuvo una altura promedio mayor fue el T5 (Suelo esterilizado, cormos con limpieza sanitaria + MA + P. lilacinum + B. subtilis), con una altura promedio de 32,91 cm, seguido por el T12 (Suelo infestado, cormos tradicionales) con 32,67 cm y el T11 (Suelo esterilizado, cormos tradicionales) con 32 cm de altura (Figura 2), aunque la comparación de medias de Tukey al 5% de probabilidad mostró que no había diferencias entre las medias de las alturas de todos los tratamientos, esto posiblemente se debe a que todos los cormos utilizados y sembrados en el experimento fueron aproximadamente del mismo peso y bajo las mismas condiciones nutricionales. Las plántulas tuvieron mayor altura, probablemente fue porque no se les realizó la práctica de pelado a los cormos antes de la siembra y por ende no se les retiraron todas las raíces, condición que pudo haber ayudado a un mejor desarrollo de las plántulas aunque al tratamiento T5 (Suelo esterilizado + cormos con limpieza sanitaria + MA + P. lilacinum + B. subtlis) sí se le hizo limpieza sanitaria a los cormos, pero fue el tratamiento que contenía la integración de todas las medidas de manejo además del pelado de cormos.

Cano (2001) encontró que la altura de las plántulas inoculadas con MA fue mayor a la altura de plántulas que no fueron inoculadas, estas plántulas también fueron evaluadas en condiciones de almácigo y alcanzaron una altura promedio de 33 cm, resultados similares a los obtenidos en esta investigación donde la mayor altura fue de 32,91 cm y correspondiendo a uno de los tratamientos inoculados con MA (Figura 3).
Guzmán et al. (2012) encontraron que con el uso de suelo esterilizado y cormos con limpieza sanitaria sin inmersión en Aldicarb y también con cormos tradicionales con y sin inmersión en este producto, se obtuvo una altura superior de plántulas, que fue de 24,84 cm en promedio; resultados similares a los obtenidos en esta investigación, donde las plántulas provenientes de cormos con limpieza sanitaria y además con suelo esterilizado alcanzaron la mayor altura, seguido por plántulas de cormos tradicionales sembrados en suelo infestado con nematodos con un promedio de altura de 32,97 cm y 32,67 cm, respectivamente (Figura 3).
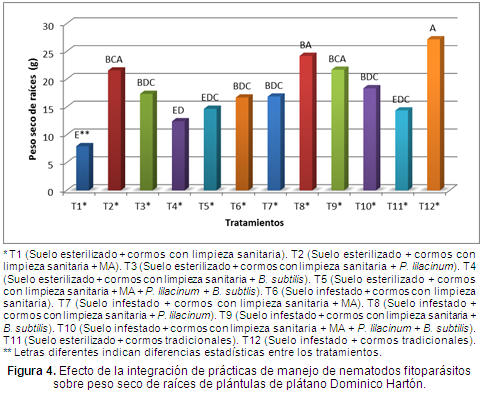
Materia seca de raíces. La comparación de medias de Tukey al 5% de probabilidad, indicó que las diferencias entre las medias eran significativas y además que el tratamiento que tuvo un peso seco de raíces promedio superior fue el T12 (Suelo infestado y cormos tradicionales), con un peso seco promedio de raíces de 27,17 g, denominado también como testigo; esto puede explicarse en el contexto de que este tratamiento no tuvo eliminación del total de las raíces, ni tampoco pelado del cormo que es donde se encuentran las reservas nutricionales de este (Díaz, Rivera & Durán, 2007) y por lo cual se obtuvo un desarrollo superior durante el experimento. En segundo lugar se ubica el tratamiento T8 (Suelo infestado + cormos con limpieza sanitaria + P. lilacinum) con un peso seco de raíces promedio de 24,19 g (Figura 4).
Los tratamientos T2 (Suelo esterilizado + cormos con limpieza sanitaria + MA) y T7 (Suelo infestado + cormos con limpieza sanitaria + MA), donde la única variación entre ambos es el tratamiento del suelo, muestra mejor resultado el establecido sobre suelo esterilizado el cual tuvo un peso seco de raíces superior en un 21,61% respecto al tratamiento 7 (Figura 4).
El tratamiento con menor peso seco promedio de raíces fue el T1 (Suelo esterilizado + cormos con limpieza sanitaria), con 7,94 g de peso (Figura 4); debido posiblemente a que la limpieza sanitaria de los cormos y la esterilización del suelo no son suficientes, siempre se debe buscar la adición de algún organismo como las MA (Rivillas, 2003) que ayuden a fijar los nutrientes y de esta forma contribuir a una mejor respuesta por parte de la plántula en cuanto a su desarrollo.
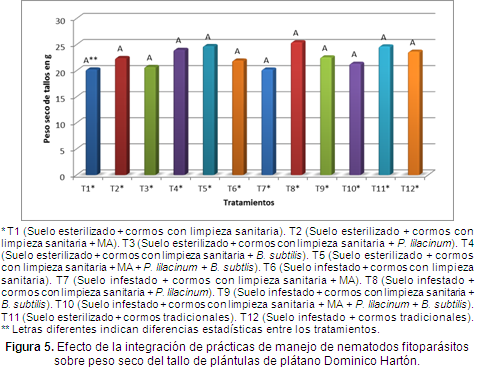
Materia seca de la parte aérea. Al realizar la comparación de medias de Tukey al 5% de probabilidad, no se presentaron diferencias entre las medias y el tratamiento con mayor peso seco promedio fue el T8 (Suelo infestado + cormos con limpieza sanitaria + P. lilacinum), con 25,45 g de peso seco promedio y con solo 5,45 g de diferencia con el tratamiento T7 (Suelo infestado + cormos con limpieza sanitaria + MA) que obtuvo el menor peso seco promedio (Figura 5).
En general, todas las plántulas tuvieron un crecimiento promedio igual, esta situación pudo presentarse debido a la igualdad de condiciones nutricionales del experimento.
Cano (2001) encontró que al adicionar MA a las plántulas de plátano, obtuvo un mayor peso seco de la parte aérea respecto a las que no se les adicionó MA, sin embargo en esta investigación las plántulas a las que se les adicionó MA, no tuvieron el mejor peso seco de la parte aérea, aunque el tratamiento que fue establecido con la mezcla de todas las medidas de manejo (manejo integrado) incluyendo la esterilización del suelo tuvo el segundo mejor peso seco de tallos.
Colonización de raíces por micorrizas arbusculares. El porcentaje de colonización de micorrizas en raíces permitió corroborar su efecto sobre los tratamientos donde se aplicó.
Los tratamientos T2, T5, T7 y T10 los cuales incluyeron la aplicación de MA presentaron los mayores porcentajes de colonización entre el 79% y el 85% (Figura 6), en los demás tratamientos también hubo colonización por micorrizas, pero no superaron el 24,4% debido a que se trata de micorrizas arbusculares nativas del suelo no esterilizado. En los tratamientos T1, T3 y T4, no se registró colonización por micorrizas por tratarse de suelo esterilizado (Figura 6).
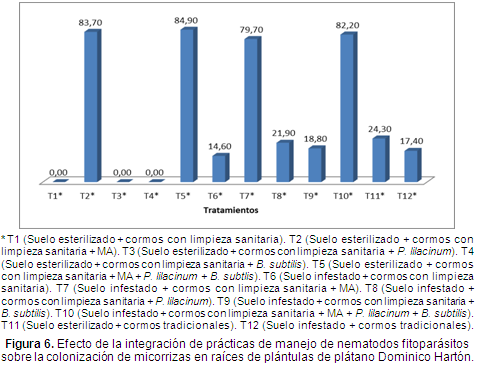
Cano (2001) encontró que la efectividad de las especies de micorrizas Glomus fasciculatum, G. fistolosum y G. manihotis, para colonizar las raíces de las plantas de banano Gross Michel fue alta, con promedios entre 79 y 85%, y en plántulas de plátano Dominico Hartón con un promedio del 84% de colonización; resultados que coinciden con los obtenidos en esta investigación, donde el porcentaje de colonización estuvo por encima del 79% y llegó hasta el 85%.
Gañán, Bolaños-Benavides & Asakawa (2011) encontraron que al aplicar MA en raíces de plátano Dominico Hartón, se alcanzó un porcentaje de colonización del 41%, a su vez que el porcentaje de peso fresco de raíces se incrementó en un 60% en ausencia de nematodos fitoparásitos; en esta investigación se logró obtener un porcentaje de colonización de hasta un 85% mientras, que para el testigo, sin la aplicación de MA, fue del 17,4%.
CONCLUSIONES
• La integración de todas las medidas de manejo resultaron más eficientes en el control de los nematodos fitoparásitos en plátano, con o sin la esterilización del suelo.
• Para obtener un mejor manejo de nematodos fitoparásitos en plátano en condiciones de almácigo, se debe esterilizar el suelo para garantizar que el parasitismo por nematodos fitoparásitos sea menor o no haya presencia.
• Los distintos tratamientos no mostraron diferencias significativas en cuanto a la altura de las plántulas, la aplicación o no de los diferentes medios de manejo no repercute en una mayor altura de plántulas.
• La limpieza sanitaria de cormos no afecta negativamente el desarrollo de las raíces ni de la parte aérea de las plantas, pues no se presentaron diferencias significativas respecto a los tratamientos donde se usaron cormos tradicionales.
• La aplicación de micorrizas arbusculares se refleja en un mejor desarrollo radical de las plantas, además de su colonización ayudan a disminuir el ataque de los nematodos fitoparásitos.
REFERENCIAS
• Agrios, G. (2005). Plant pathology. 5 ed. Nueva York: Elsevier Academic Press. [ Links ]• Agronet. (2012). Boletines estadísticos. Encuesta Nacional Agropecuaria. Recuperado de http://www.agronet.gov.co/www/htm3b/ReportesAjax/VerReporte.aspx [ Links ]
• Araya, M., Centeno, M. & Carrillo, W. (1995). Densidad poblacional y frecuencia de los nematodos parásitos de banano (Musa AAA) en nueve cantones de Costa Rica. CORBANA, 20(43), 6-11. [ Links ]
• Becerra, J. F., Castaño-Zapata, J. & Villegas-Estrada, B. (2010). Efecto de la micorrización sobre el manejo de nematodos en plántulas de plátano híbrido "FHIA-20AAB". Agronomía, 18(1), 7-18. [ Links ]
• Bolaños, M. (2011). Mejoramiento de la sanidad y competitividad del cultivo del plátano, mediante el desarrollo de nuevas estrategias del manejo del suelo y la nutrición. Informe técnico final. Corporación Colombiana de Investigación Agropecuaria - CORPOICA. [ Links ]
• Cano, M. A. (2001). Efecto de Glomus fasciculatum, Glomus fistulosum y Glomus manihotis en el crecimiento, desarrollo y nutrición de plantas de plátano y banano. Trabajo de grado para optar el título de Ingeniero agrónomo. Corporación Universitaria de Ciencias Aplicadas y Ambientales "U.D.C.A", Facultad de Ciencias Agropecuarias, Bogotá, D.C. [ Links ]
• Castrillón, C., Botero, M. J., Urrea, C. F., Cardona, J. E., Zuluaga, L. E., Morales, H. & Alzate, G. (2002). Manejo integrado de nematodos parásitos del plátano, con énfasis en microbiológicos. En Acorbat. Memorias XV reunión. Realizada en Cartagena de Indias, 27 de octubre - 02 de noviembre. [ Links ]
• Chaves, N. (2007). Utilización de bacterias y hongos endofíticos para el control biológico del nematodo Barrenador Radopholus similis (Cobb) Thorn. Tesis sometida a consideración de la Escuela de Posgrado, Programa de Educación para el Desarrollo y la Conservación del Centro Agronómico Tropical de Investigación y Enseñanza como requisito para optar por el grado de Magister Scientiae en Agricultura Ecológica. Turrialba - Costa Rica. [ Links ]
• Croshier, R., Montecinos, G., Jiménez, M. & Gallo, P. (1984). Efectividad de Paecilomyces lilacinum Thom. Samson, en el control del nematodo cecidógeno Meloidogyne javanica (Chitwood), 1949. IDESIA, 8, 27-31. [ Links ]
• Cruz, J. C., Sánchez, M. & Sieverding, E. (1989). Estudio de la simbiosis micorriza vesículo-arbuscular en el cultivo del café Coffea arabica Var. Caturra. Fitopatología Colombiana, 13(2), 56-64. [ Links ]
• Cuervo, J. (2010). Aislamiento y Caracterización de Bacillus spp. como fijadores biológicos de nitrógeno y solubilizadores de fosfatos en dos muestras de biofertilizantes comerciales. Pontificia Universidad Javeriana, Facultad de Ciencias Básicas, Bogotá, Colombia. [ Links ]
• Díaz, M. J., Rivera, C. M. & Durán, L. (2007). Cómo proteger de las plagas del suelo los cormos-semilla de plátano y banano. 1a ed. La Lima, Cortés, Honduras: FHIA, Departamento de Protección Vegetal. [ Links ]
• Egamberdiyeva, D. (2007). The effect of plant growth promoting bacteria on growth and nutrient uptake of maize in two different soils. Applied Soil Ecol., 36, 184-189. [ Links ]
• Espinel, C., Martínez, H., Peña, Y. 2006. La cadena del plátano en Colombia. Ministerio de Agricultura y Desarrollo Rural. Documento de trabajo No. 12. [ Links ]
• Flores, P. R. (2009). Control del nematodo Meloidogyne sp. en el cultivo de rosa (Rosa sp.) con aplicación del hongo Paecilomyces lilacinum y materia orgánica en la zona de Tabacundo provincia de Pichincha. Universidad Técnica de Babahoyo. Facultad de Ciencias Agropecuarias. Escuela de Ingeniería Agronómica. [ Links ]
• Fogain, R. (2000). Effect of Radopholus similis on plant growth and yield of plantain (Musa AAB). Nematology, 2, 129-133. [ Links ]
• Funica. (2009). Guía. Uso y manejo de Paecilomyces lilacinum en el control de nematodos de nematodos. Nicaragua. [ Links ]
• Gañán, L., Bolaños-Benavides, M. & Asakawa, N. (2011). Efecto de la micorrización sobre el crecimiento de plántulas de plátano en sustrato con y sin la presencia de nematodos fitoparásitos. Acta Agronómica, 60(4), 297-305. [ Links ]
• González, C., Aristizábal, M. & Aristizábal, J. C. (2007). Dinámica poblacional de nematodos fitopatógenos en plátano (Musa AAB) dominico hartón. Agronomía, 15(2), 25-31. [ Links ]
• González-Cardona, C. & Guzmán-Piedrahita, O. (2011). Efecto de la limpieza sanitaria de cormos y la fertilización orgánica sobre el crecimiento de plantas de Dominico Hartón (Musa AAB Simmonds) y su relación con nematodos fitoparásitos. Agronomía, 19(1), 42-56. [ Links ]
• Gowen, S. & Quénéhervé, P. (1990). Nematode of bananas, plantains and abaca. In Luc, M., Sikora, R. & Bridge, J. (Eds.). Plant Parasitic Nematodes in Subtropical and Tropical Agriculture (pp. 431-460). Londres: CAB International. [ Links ]
• Gowen, S., Quénéhervé, P. & Fogain, R. (2005). Nematodes Parasites of Bananas and Plantains. In In Luc, M., Sikora, R. & Bridge, J. (Eds.). Plant Parasitic Nematodes in Subtropical and Tropical Agriculture. (pp. 611-643). London, UK: CABI Publishing. [ Links ]
• Guzmán, O. & Castaño, J. (2004). Reconocimiento de nematodos fitopatógenos en plátano Dominico Hartón (Musa AAB Simmonds), África, FHIA-20 y FHIA-21 en la granja Montelindo, municipio de Palestina (Caldas), Colombia. Revista de la Académica Colombiana de Ciencias Exactas Físicas y Naturales, 28(107), 295-301. [ Links ]
• Guzmán, O., Castaño, J. & Villegas, B. (2012). Efecto de la limpieza sanitaria de cormos de plátano (Musa AAB Simmonds) sobre nematodos fitoparásitos. Revista U.D.C.A. Actualidad & Divulgación Científica, 15(1), 87-95. [ Links ]
• Guzmán, O. & Rivillas, C. (2007). Relación de Glomus manihotis y G. fasciculatum con el crecimiento de plantas de café y la severidad de la Mancha de hierro. Revista del Centro Nacional de Investigaciones de Café CENICAFÉ, 58(3), 236-251. [ Links ]
• Hauser, S. (2003). Plantain root nematodes: kill them simple. HFC - Soil Physics - Agronomy International Institute of Tropical Agriculture. IITA. Recuperado de http://invam.caf.wvu.edu/Myc_Info/Taxonomy/taxonomy.htm [ Links ]
• Jaizme, M. C. & Rodríguez, A. S. (2004). Uso de Micorrizas en banano: Logros y perspectivas Mycorrhizae and banana: Currents achievements and perspectives. XVI Reunión Internacional ACORBAT. p. 143-160. [ Links ]
• Jenkins, W. R. (1964). A rapid centrifugal flotation technique for separating nematodes from soil. Plant Disease Reporter, 48(9), 692. [ Links ]
• Jones, D. R. (1996). Opportunities for conventional breeding for resistance to nematodes of banana and plantain. In Frison, E. A., Horry, J. P. & De Waele, D. (Eds.). New frontiers in resistance breeding for nematode, Fusarium and Sigatoka (pp. 13-24). Proceedings, Kuala Lumpur, Malaysia. [ Links ]
• Kloepper, J. W., Mahaffee, W., McInroy, J. A. & Backman, P. A. (1991). Comparative analysis of methods for recovering plant growth-promoting rhizobacteria from roots. Can. J. Microbiol., 37, 953-957. [ Links ]
• Koneman, E. W. (2001). Diagnóstico microbiológico: Texto y atlas de color. Quinta Edición. Buenos Aires: Editorial Médica Panamericana. [ Links ]
• Loos, C. A. (1961). Eradication of the burrowing nematode, Radopholus similis from bananas. Plant Disease Reporter, 45(6), 457-461. [ Links ]
• Loredo, C., López, L. & Espinosa, D. (2004). Bacterias promotoras del crecimiento vegetal asociadas con gramíneas. Revista TERRA Latinoamericana, 22(2), 224-239. [ Links ]
• Luangsa-Ard, J., Houbraken, J., Van Doorn, T., Hong, S. B., Borman, A. M., Hywel-Jones, N. L. & samson, R. A. (2011). Purpureocillium, a new genus for the medically important Paecilomyces lilacinus. FEMS Microbiology Letters, 321(2), 141-149. [ Links ]
• Meredith, J. (1973). Algunos métodos de campo y laboratorio para trabajar con nematodos. Maracaibo, Venezuela. [ Links ]
• Moens, T., Araya, M., Swennen, R. & Waeles, D. (2003). Biodegradación acelerada de nematicidas en Musa. En Manejo convencional y alternativo de la Sigatoka negra, nematodos y otras plagas asociadas al cultivo de Musáceas en los trópicos (pp. 105-118). Actas del Taller "Manejo convencional y alternativo de la Sigatoka negra, nematodos y otras plagas asociadas al cultivo de Musáceas", celebrado en Guayaquil, Ecuador, 11-13 de agosto. Galileo Rivas y Franklin Rosales, editores. [ Links ]
• Montiel, C., Sosa, L., Medrano, C. & Romero, D. (1997). Nematodos fitoparásitos en plantaciones de plátano (Musa AAB) de la margen izquierda del río Chana. Estado Zulia, Venezuela. Departamento Fitosanitario. Facultad de Agronomía. Universidad de Zulia. Venezuela. pp. 245-251. [ Links ]
• Pérez, A., Sánchez, E. & Fernández, E. (1999). Uso de Paecilomyces lilacinum en cultivo estático para el control de nematodos parásitos en plátano en el sistema de riego por goteo. Centro Agrícola, 26(1), 5-10. [ Links ]
• Rivillas, C. A. (1995). The effects os arbuscular mycorrhizal fungi on two different coffe varieties from Colombia and their bichemical detection in roots. Kent, University of Kent. Research School Of Biosciences. (Tesis: Magister Science). [ Links ]
• ________. (2003). Las micorrizas arbusculares en el cultivo del café. En Enfermedades del cafeto en Colombia (pp. 64-74). Chinchiná, Colombia: Cenicafé [ Links ].
• Rodríguez, M. (1995). Microorganismos libres fijadores de nitrógeno. En Ferrera-Cerrato R. & J. Pérez M. (Eds.). Agromicrobiología: Elemento útil en la agricultura sustentable (pp. 105-126). Montecillo, México: Colegio de Postgraduados. [ Links ]
• Sánchez, M. (2007). Las Endomicorrizas: Expresión bioedáfica de importancia en el trópico. Palmira: Universidad Nacional de Colombia. [ Links ]
• Sarah, J. L., Pinochet, J. & Stanton, J. (1996). El nematodo Barrenador del Banano Radopholus similis Cobb. Plagas de Musa - Hoja Divulgativa No. 1. [ Links ]
• Sieverding, E. (1991). Vesicular-arbuscular mycorrhiza management in tropical agrosystems. Eschborn (Alemania), GTZ. 371p. Ing. (Schriftenreihe der GTZ No. 224). [ Links ]
• Smith, S. E. & Read, D. J. (1997). Mycorrhizal symbiosis. 2 ed. San Diego (Estados Unidos): Academic Press. [ Links ]
• Ulloa, M. & Hanlin, R. T. (2001). Illustrated dictionary of mycology. St. Paul (Estados Unidos): American Phytopatholocial Society. [ Links ]
• Vergara, D., Guzmán P., O. A. & Leguizamón, J. E. (2012). Efecto In vitro de Purpureocillium lilacinum (Thom) Luangsa-Ard et al. y Pochonia chlamydosporia (Goddard) Zare y Gams sobre el nematodo barrenador Radopholus similis (Cobb) Thorne. Agronomía, 20(2), 25-36. [ Links ]
Para citar este artículo: Valencia-Serna, R.A., Guzmán-Piedrahita, O.A., Villegas-Estrada, B., Castaño-Zapata, J. (2014). Manejo integrado de nematodos fitoparásitos en almácigos de plátano dominico hartón (Musa AAB Simmonds). Revista Luna Azul, 39, 165-185. Recuperado de http://lunazul.ucaldas.edu.co/index.php?option=content&task=view&id=954













