Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Luna Azul
versión impresa ISSN 1909-2474
Luna Azul no.40 Manizales ene./jun. 2015
https://doi.org/10.17151/luaz.2015.40.19
THE PROBLEM OF ENDOSULFAN : CHEMICAL, ANALYTICAL AND ENVIRONMENTAL ISSUES
Luz Adriana Betancur J.1
Rogelio Ocampo C.2
Luz Amalia Ríos V.3
1. Magíster en Química. Profesora Asistente, Departamento de Química, Universidad de Caldas, Manizales, Colombia. luz.betancur_ja@ucaldas.edu.co
2. Doctor en Ciencias Químicas. Profesor Titular, Departamento de Química, Universidad de Caldas, Manizales, Colombia. rogelio.ocampo@ucaldas.edu.co
3. Doctora en Ciencias Químicas. Profesora Asociada, Departamento de Química, Universidad de Caldas, Manizales, Colombia. amalia.rios@ucaldas.edu.co
Recibido el 18 de julio de 2013, aprobado el 22 de agosto de 2014, actualizado el 1 noviembre de 2014
RESUMEN
Introducción. Dado el carácter residual y el alto nivel de toxicidad del endosulfán, se ha incrementado la preocupación a nivel mundial por su impacto ambiental. Por eso la búsqueda de metodologías analíticas que permitan su detección y cuantificación es un tema de investigación vigente. Las propiedades del endosulfán y su patrón de degradación le confieren características que hacen muy compleja la problemática, al tiempo que el pesticida y sus metabolitos se expanden extensivamente por la atmósfera y contaminan tanto matrices lipofílicas como hidrofílicas. Objetivo. Llevar a cabo una revisión sobre las investigaciones más recientes acerca de la problemática del endosulfán, que incluye aspectos químicos, su problemática ambiental y técnicas inmunoquímicas para su análisis, tema en el que ha estado interesado nuestro grupo de investigación en la Universidad de Caldas. Método. El presente artículo de revisión analiza, cualitativamente, la literatura científica disponible en las bases de datos Science Direct, PubMed, Scielo y páginas Web oficiales, empleando como palabras de búsqueda: endosulfán, haptenos, análisis inmunoquímico del endosulfán, problemática ambiental del endosulfán, regulaciones internacionales sobre el endosulfán, normatividad vigente sobre el endosulfán, y métodos instrumentales de análisis. Resultados. Se obtuvo información pertinente relacionada con el objetivo propuesto, la cual se presenta en 3 secciones: aspectos químicos del endosulfán, problemática ambiental y técnicas inmoquímicas para su análisis. Conclusión. El endosulfán ha sido prohibido por los organismos internacionales. Sin embargo, el pesticida se continúa usando en algunos países y éste se difunde fácilmente hacia otras regiones, de tal manera que se ha convertido en un problema global. Hay investigaciones recientes sobre métodos de remediación química o biológica, pero los esfuerzos son modestos frente a la enorme problemática de este pesticida. En lo pertinente a análisis químicos de endosulfán, en los últimos 15 años se han investigado técnicas inmunoquímicas de análisis (basadas en haptenos), como alternativa a los métodos cromatográficos instrumentales.
PALABRAS CLAVE
Endosulfán, haptenos, análisis inmunoquímico del endosulfán, problemática ambiental del endosulfán, regulaciones internacionales sobre el endosulfán, normatividad vigente sobre el endosulfán, métodos instrumentales de análisis.
ABSTRACT
Introduction. Due to the residual character and high level of toxicity of endosulfan, worldwide concern for its environmental impact has increased. Therefore, the search for analytical methodologies that allow its detection and quantification continues to be a topic of current research. Endosulfan properties and its degradation pattern confer it characteristics that make very complex the problematic while the pesticide and its metabolites are extensively spread throughout the atmosphere and contaminate both lipophilic and hydrophilic matrixes. Objective. To conduct a review on some recent research about the endosulfan problematic including chemical aspects, environmental issues and immunochemical techniques for its analysis, which is an area of current interest in this research group at Universidad de Caldas. Method. This review article analyzes qualitatively scientific literature from Science Direct, PubMed, Scielo databases and official Web pages using key words such as endosulfan, endosulfan immunochemical analysis, endosulfan environmental problematic, endosulfan international regulations, endosulfan current normativity and instrumental methods for the analysis. Results. Relevant information related to the proposed objective was found which is presented in 3 sections: chemical aspects of endosulfan, environmental issues, and immunochemical techniques for its analysis. Conclusions. Endosulfan has been banned by international organizations. However, the pesticide is still being used in some countries and is easily spread to other regions, so that the problem became a global concern. There is some recent research on biological or chemical remediation techniques, but efforts seem insufficient in comparison to the enormous impact of the pesticide. In regard to Endosulfan chemical analyses, during the past 15 years immunochemical hapten-based analysis techniques have been investigated as alternatives to the instrumental chromatographic methods.
KEY WORDS
Endosulfan, haptenes, endosulfan immunochemical analysis, endosulfan environmental problematic, endosulfan international regulations, endosulfan current normativity, instrumental methods for the analysis.
INTRODUCCIÓN
Son numerosos los reportes científicos de los que se dispone actualmente sobre los aspectos técnicos del endosulfán y la problemática ambiental que ha resultado del amplio uso en el mundo. Numerosos documentos técnicos han sido producidos por asesores internacionales de la ONU, con información compilada sobre la química, aspectos médicos y protocolos aconsejables del manejo para la seguridad ambiental (IPCS-EHC, 1984; PISSQ, 1995). El endosulfán es un plaguicida organoclorado con una gran variedad de usos que desatienden las restricciones nacionales e internacionales. Ha sido especialmente aplicado para el control de áfidos, escarabajos, orugas, ácaros, barrenadores, chinches, polillas, moscas y otros insectos en diversos cultivos tales como café, algodón, cereales, té, legumbres y frutales. La preocupación a nivel mundial ha ido en aumento por el carácter residual y el alto nivel de toxicidad del endosulfán; al agudo impacto ambiental se suma el hecho de que algunos agricultores lo siguen usando a pesar de las restricciones gubernamentales, lo que constituye una seria amenaza a la seguridad alimentaria. Por lo anterior, continúan vigentes las investigaciones para la búsqueda de metodologías analíticas de detección y cuantificación en suelos, agua y productos agrícolas, y eventuales posibilidades de remediación. Las técnicas tradicionales de análisis de pesticidas que involucran procedimientos cromatográficos son de amplio dominio de la comunidad química mundial, aunque con las limitaciones propias de las herramientas instrumentales relacionadas con el costo, límites de detección y requerimientos de instalaciones. Como alternativa de análisis emergieron las técnicas inmunoquímicas, metodologías que han demostrado ser más simples y útiles como pruebas de campo para análisis masivo de muestras con menores costos y con tiempos de análisis razonablemente inferiores a los requeridos si se usan las técnicas cromatográficas instrumentales. En el proceso de investigación de estas metodologías, se requiere la síntesis química de derivados estructurales del plaguicida, llamados haptenos, los cuales se enlazan a moléculas proteicas que provoquen respuestas inmunes. Los respectivos anticuerpos son luego usados como plantillas para reconocer la presencia del plaguicida en las muestras de análisis.
Nuestro grupo de investigación ha venido trabajando en la búsqueda de nuevos haptenos de endosulfán, con la intención de ofrecer alternativas a los ya reportados en la literatura. En este artículo de revisión queremos presentar un recuento actualizado de los aspectos químicos del endosulfán, su problemática ambiental y métodos analíticos para su detección, incluidas las técnicas inmunoquímicas involucrando haptenos.
ASPECTOS QUÍMICOS DEL ENDOSULFÁN
Estructura química y propiedades
El endosulfán hace parte de una familia de compuestos organoclorados del grupo de los ciclodienos de fórmula C9H6Cl6O3S, cuyo nombre IUPAC es (1,4,5,6,7,7-hexacloro-8,9,10-trinorborn-5-en-2,3-ilenbismetilen)sulfito (PISSQ, 1995; Kumar & Philip, 2006). Su nombre químico es 6,7,8,9,10,10-hexachloro-1,5,5a,6,9,9a-hexahidro-6,9-metano-2,4,3-benzodioxatiepin-3-óxido. Es una sustancia cristalina formada por dos estereoisómeros a y B en relación 7:3 (estructuras 1 y 2 respectivamente, en la Figura 1).

En su estructura química se destaca un núcleo clorado derivado del hexaclorociclopentadieno, porción estructural responsable en gran medida del impacto ambiental adverso que se le conoce, y que le confiere poca solubilidad en agua (menos de 0,5 mg.L-1, con leve tendencia a incrementar con el aumento del pH) y alta solubilidad en la mayoría de los solventes orgánicos (Schmidt, Hapeman, Fettinge, Rice & Bilboulian, 1997). Las propiedades fisicoquímicas de los dos estereoisómeros son muy similares entre sí (Weber et al., 2010); es destacable su semivolatilidad y alta presión de vapor (Shen & Wania, 2005) y su gran estabilidad en el aire, lo que facilita su presencia como contaminante atmosférico y su difusión a otras regiones de la geografía mundial, transferencia que ocurre primariamente desde las plantas y la superficie del agua (Muir, Teixeira & Wania, 2004). En la Tarjeta Internacional sobre la Seguridad de las Sustancias Químicas (PISSQ, 1995) y Convenio de Rotterdam 2011 se encuentran tabulados los detalles técnicos más relevantes del endosulfán y aspectos médicos.
Síntesis comercial del endosulfán
La síntesis comercial de endosulfán más conocida se lleva a cabo a través de dos etapas: (1) la reacción de Diels-Alder del hexaclorociclopentadieno 3 con cis-2-buten-1,4-diol 4 en xileno dando lugar a la mezcla de los dos estereoisómeros a y B del respectivo aducto cis-diol (productos 5 y 6); (2) la reacción de la mezcla estereoisomérica del cis-diol resultante (5 y 6) con cloruro de tionilo para formar el producto final (Figura 2) (Forman, Dubertaki, Cohen & Olefson, 1965).

Metabolitos del endosulfán
La transformación aeróbica del endosulfán 1 y 2 se produce a través de la oxidación mediada biológicamente. Se degrada rápidamente hasta sus metabolitos y persiste por más tiempo bajo condiciones de mayor acidez. El metabolito principal que se forma es el endosulfán-sulfato 7 (isómeros a y B), que luego se degrada lentamente a los metabolitos más polares: endosulfán-diol 8 (isómeros a y B), endosulfán-éter 9 (isómeros a y B) y endosulfán-lactona 10 (isómeros a y B) (Walse, Scott & Ferry, 2003). En la evaluación de riesgos emitida por la Unión Europea, se cita el patrón de degradación ilustrado en la Figura 3. También se produce sulfato de endosulfán por degradación anaeróbica más lenta que la aeróbica (Convenio de Rotterdam, 2011).
Los isómeros (a y B) se transforman en los respectivos derivados endosulfán-diol 8, ya sea directamente o a través de endosulfán-sulfato 7. Luego los isómeros a y B endosulfán-diol se degradan en un conjunto de metabolitos relacionados, que incluyen: endosulfán-éter 9, endosulfán-ácido hidroxicarboxílico y endosulfán-lactona 10 y endosulfán-hidroxiéter 11 (Ciglasch, Busche, Amelung & Trotrakool, 2008).

El tiempo que tarda la descomposición de una sustancia hasta un 50% del valor inicial se conoce como valor DT50. En condiciones de laboratorio, el valor DT50 reportado para la degradación aeróbica de los isómeros a + B del endosulfán en el suelo oscila entre 25 y 128 días. El respectivo valor DT50 para el endosulfán-sulfato está en el rango de 123 a 391 días, generando niveles altos de endosulfán-diol y endosulfán-lactona. Este último metabolito presenta los mismos valores de concentración sin efecto observado (NOEC) que los isómeros del endosulfán. El endosulfán-lactona se puede producir tanto por la degradación del ácido carboxílico como del hidroxiéter. Según lo explica el informe del Comité de Examen de los Contaminantes Orgánicos Persistentes sobre la labor de su quinta reunión titulado "Perfil de riesgos del endosulfán" (SC, 2009):
[…] si la toxicidad de cada uno de estos metabolitos se integra al proceso de degradación/metabolismo, se tendrá como resultado una curva bifásica (lo cual demuestra que el compuesto se degrada con dos velocidades diferentes, una fase rápida y otra fase lenta). En el paso inicial de la degradación del endosulfán a endosulfán-sulfato se incrementa el potencial de bio-acumulación, manteniendo constante o disminuyendo ligeramente la toxicidad. Pero en los pasos siguientes de degradación que conducen a la formación del endosulfan-lactona, se aumenta tanto la toxicidad como el potencial de bio-acumulación. Por lo anterior, cuando se realizan análisis para la detección y cuantificación de este plaguicida, se necesita hacer también la búsqueda de cada uno de los metabolitos derivados de su degradación, dando como resultado un proceso analítico complejo y dispendioso.
En el citado informe se encuentra una discusión muy completa sobre esta problemática, y las cifras pertinentes (SC, 2009).
Métodos instrumentales de análisis del endosulfán
La técnica instrumental más utilizada durante años para la determinación de plaguicidas como el endosulfán es la cromatografía de gases, con detector de captura de electrones. Recientemente se reportó el análisis de endosulfán en muestras biológicas (Hoang, Rand, Gardinali & Castro, 2011), mediante un protocolo experimental que se resume en los siguientes pasos: (1) maceración y homogeneización de tejidos, y extracción con diclorometano; (2) limpieza de las muestras mediante cromatografía de columna (con silica-alumina combinada como fase estacionaria) y cromatografía de permeación en geles; (3) análisis de extractos por cromatografía de gases con captura de electrones, usando columna capilar de silica fundida. Un protocolo similar, con modificaciones, fue usado para los estudios de biodegradación bacteriana de endosulfán en fincas cafeteras de Chinchiná, Colombia (Castillo, Romero & Casas, 2011) y otro estudio sobre análisis del pesticida en plantas medicinales (Matos-Lino & Noronha-da Silveira, 1997). El pre-tratamiento y limpieza de muestras a menudo requiere procedimientos de extracción líquido-líquido en combinación con extracción en fase sólida. A partir de algunos estudios científicos, se infiere que es aconsejable refinar los análisis mediante técnicas de calibración de la matriz que contiene el analito (Jiménez, Bernal, Del Nozal & Alonso, 2004). Dado que el agua es una de las matrices más complejas para detección y cuantificación del endosulfán y de otros contaminantes orgánicos persistentes (COPs), recientemente se publicó una nueva metodología analítica para su análisis en medios acuosos (Muir & Lohmann, 2013).
Para el análisis de endosulfán y sus metabolitos, también es operativa la cromatografía de gases acoplada a espectrometría de masas, especialmente si se desea caracterizar en la muestra analitos o metabolitos desconocidos. El análisis de metabolitos de endosulfán en orina humana (Martínez-Vidal, Arrebola, Fernández-Gutiérrez & Rams, 1998), y la determinación de organoclorados en suelo (Batta, Zatar & Sadeq, 2006; Rashid, Nawaz, Barker, Ahmad & Ashraf, 2010), fueron llevados a cabo mediante cromatografía de gases - espectrometría de masas tándem. Muchos de los estudios analíticos están enfocados a mejorar los niveles de detección y las interferencias de la matriz, en balance con una mayor rapidez de los análisis.
Los análisis de endosulfán y sus metabolitos en agua y suelo también han sido llevados a cabo por HPLC en fase reversa en columna C18, eluyendo con mezclas acuosas binarias de acetonitrilo o metanol, y con detector UV-Vis a 214 nm (Siddique, Zahir & Frankenberger jr., 2003). Los porcentajes de recuperación de a y B-endosulfán en muestras experimentales fueron muy variados, y fluctuaron entre 4% y 91%. De manera similar, se ha usado cromatografía líquida en fase reversa, acoplada a cromatografía de gases, para análisis automático de endosulfán en vinos (Hyötyläinen, Jauho & Riekkola, 1998), aceite de oliva (Díaz-Plaza, Cortés, Vázquez & Villén, 2007) y plátanos (Paranthaman, Sudha & Kumaravel, 2012).
La gran utilidad de las técnicas cromatográficas instrumentales y su precisión son ampliamente reconocidas, pero también son evidentes sus limitaciones en términos de costos, tiempos de análisis y condiciones logísticas o infraestructura requeridas para la preparación, extracción y purificación exhaustiva de las muestras, que demandan instrumentos de alto costo y solventes orgánicos o gases de elevada pureza (Galeano, Guiberteani & Salinas, 1992; Quintanilla, Lebrón & Polo, 1992). Estas limitaciones descartan la posibilidad de aplicar las técnicas cromatográficas en pruebas rápidas de campo o para un número elevado de muestras. Por ello se han desarrollado e implementado nuevas metodologías analíticas y técnicas inmunológicas que permiten el análisis rápido de estos residuos, como se discute en el apartado: Técnicas inmunoquímicas de análisis para el endosulfán.
PROBLEMÁTICA AMBIENTAL
El endosulfán es un pesticida global, y como tal impacta un número muy alto de países del mundo. Weber y cols., publicaron una completa revisión de la problemática ambiental, incluidos patrones de uso, distribución geográfica de la contaminación con este insecticida y matrices donde más se ha encontrado este contaminante (Weber et al., 2010). El endosulfán se encuentra catalogado como el hidrocarburo clorado más extensamente usado a nivel mundial y actualmente es considerado como una de las causas más importantes de envenenamiento por plaguicida en muchos países. La persistencia ambiental de estas sustancias, y su amplia presencia en muchas regiones, se agrava por el transporte a largo alcance que ocurre de unos sitios a otros como resultado de la volatilización de estos materiales. Como prueba de ello, un estudio demuestra que los niveles ambientales de endosulfán cambian con las estaciones climáticas, de tal manera que las concentraciones atmosféricas en el lago Chaou (China) son menores en el invierno (Ouyang et al., 2012). Sobre persistencia, bioacumulación y otras características de este pesticida hay mediciones recientes (Becker, Scheringer, Schenker & Hungerbühler, 2011). Debido a que es tóxico, bioacumulable y persistente (Quijano, 2000), el endosulfán está prohibido en 82 países mientras en otros 12 no está permitido pero tampoco tiene prohibición legal. A pesar del anuncio del Programa de las Naciones Unidas para el Medio Ambiente (PNUMA) de incorporar el endosulfán a la lista de contaminantes orgánicos prohibidos (Convención de Estocolmo, 2011), el pesticida aún es usado. Esto fue demostrado recientemente en un estudio de contaminantes en el Lago Qarun en Egipto, ya que el estudio de los contenidos indicaban usos recientes y descargas frescas al lago (Barakat, Khairy & Aukaily, 2013). Por su parte Argentina y otros países han extendido legalmente su uso hasta el año 2016 (SC, 2011). Colombia adhirió a la Convención de Estocolmo el 23 de mayo de 2001 y lo ratificó el 22 de octubre de 2008, pero algunos sectores de la población aún lo usan.
La toxicidad de los pesticidas, y preponderantemente el endosulfán, se ha estudiado en especial en anfibios, particularmente en Rana pipiens y en Hyla versicolor, y se ha demostrado que puede originar una alta tasa de mortalidad aun en concentraciones extremadamente bajas (de menos de 1 ppb), aunque la mortalidad difiere ampliamente entre las especies de anfibios (Berrill, Coulson, McGillivray & Pauli, 1998; Jones, Hammond & Relyea, 2009). En una concentración de 6 ppb, el endosulfán añadido a mesocosmos de humedales causó el 84% de mortalidad en renacuajos de Rana pipiens pero no tuvo efecto sobre Hyla versicolor (Relyea & Jones, 2009). Adicionalmente se reportó que causó efectos sustanciales en otras especies, encontrándose un desfase entre el tiempo de exposición y el tiempo de la muerte. A diferencia de los efectos tóxicos atribuidos a factores como la bioacumulación (Hopkins, Mendonca, Rowe & Congdon, 1998) o disrupción endocrina (Hayes et al., 2002), el endosulfán puede causar la muerte de los renacuajos varios días después de que la exposición ha finalizado (Jones et al., 2009). Los estudios citados sugieren que pueden existir patrones filogenéticos en la sensibilidad de los anfibios a endosulfán y en la existencia de los efectos retardados de mortalidad (Jones, Hammond & Relyea, 2010). Un reporte reciente demostró también acción disruptiva del eje reproductivo de algunos peces en Suramérica, con efectos en la glándula pituitaria, gónadas y células de Sertolli, y afectación de la hormona estimulante del folículo y de la esteroidogénesis después de una exposición prolongada al pesticida (Da Cuña et al., 2013).
Aspectos médicos o clínicos
Es bien sabido que el endosulfán puede ingresar al sistema sanguíneo por tres vías: inhalación, absorción dérmica o asimilación gástrica que resulta del consumo de alimentos contaminados o ingestión accidental. Según el Programa Internacional de Seguridad para las Sustancias Químicas, guía número 17 (PISSQ, 1995)4 y el documento de la Convención de Estocolmo 2011, la intoxicación aguda puede producir alteraciones neurológicas (irritabilidad, inquietud, espasmos musculares o convulsiones) o inclusive provocar la muerte; los primeros síntomas de intoxicación accidental o inhalación incluyen mareos, náusea, cefalea, vómito, debilidad en las piernas, edema pulmonar y cianosis (IPCS-EHC, 1984).
Se han reportado diversos casos de envenenamiento agudo al ingerir o respirar niveles elevados de endosulfán dado que se puede afectar directamente el sistema nervioso central y causar hasta la muerte. Los estudios de toxicidad aguda y crónica en animales de laboratorio indican que el endosulfán causa efectos neurotóxicos, especialmente convulsiones por sobreestimulación del sistema nervioso central (Soto, Chung & Sonnenschein, 1994). En estudios experimentales con vertebrados terrestres (anfibios, aves y ratas), se ha demostrado que una ingesta diaria de hasta 0,6 mg de endosulfán/kg de peso corporal no produce efectos observables (mortalidad, cambios de comportamiento, u otros), pero sí una disminución del peso corporal, glomerulonefritis marcada y progresiva y aneurismas vasculares (SC, 2009).
Estudios en ratas de laboratorio han demostrado que los posibles mecanismos de neurotoxicidad incluyen alteración de los niveles de neurotransmisores en las áreas cerebrales, especialmente dopamina, serotonina y norepinefrina a nivel del sistema aminérgico del cuerpo estriado, y la interferencia con la unión de los neurotransmisores a sus receptores (Lafuente & Pereiro, 2013). Lafuente & Pereiro realizaron estudios experimentales de exposición de ratas de laboratorio en estado de gravidez a la acción del endosulfán, para conocer el efecto sobre los embriones después de la lactancia materna, 60 días contados a partir de su nacimiento; concluyeron que el efecto neurotóxico era mayor en machos que en hembras.
En otros estudios toxicológicos, se detectaron daños en hígado, riñón, vasos sanguíneos y en los parámetros hematológicos luego de la exposición repetida al endosulfán (Hernández, Serrano & Olea, 2002; Mor & Ozmen, 2003). En estudios recientes sobre prevalencia de cáncer hematológico en niños en la India, se encontró que los pacientes tenían niveles detectables de endosulfán en la médula ósea (10 ng/ml) comparados con aquellos sanos. Todos los niños que presentaron niveles detectables de endosulfán, pertenecían a zonas expuestas al pesticida (Rau, Coutinho, Abavratha, Rau & Warrior, 2012).
En una investigación reciente se estudió el contenido de Contaminantes Orgánicos Persistentes, COPS, en madres gestantes expuestas a contaminación con estas sustancias y la cantidad que podría transferirse al feto (Dewan, Jain, Gupta & Banerjee, 2013). Se reportó que el contenido era mayor (en su respectivo orden descendente) en la sangre materna, placenta, cordón umbilical, y leche materna, y que la barrera placentaria permitía la transferencia parcial de estos contaminantes al feto, afectando su desarrollo antropométrico, reduciendo el peso al nacer, la longitud, la circunferencia de la cabeza y del pecho y el índice ponderal.
A nivel experimental en peces cíclidos de la especie Australoheros facetus, se demostró un marcado efecto del endosulfán en el cerebro, hígado y otros órganos, con un efecto genotóxico muy significativo después de exposición a concentraciones subletales (Crupkin et al., 2013). En este mismo estudio se comprobó un incremento en los niveles de peróxido de hidrógeno (H2O2) e inhibición dependiente de la concentración a nivel de los siguientes sistemas enzimáticos: superóxido dismutasa, catalasa y glutatión reductasa. Adicionalmente se comprobó el incremento de sustancias reactivas del ácido tiobarbitúrico. El efecto genotóxico se detectó por el incremento de la frecuencia en anormalidades nucleares y de micronúcleos.
Las funciones reproductivas en machos también podrían verse afectadas por exposición a endosulfán, tal como fue demostrado en ratas machos cuyo conteo espermático resultó menor en pruebas experimentales (Sinha, Narayan, Sankar & Saxena, 1995). La disminución de la función testicular fue acompañada de un incremento en la actividad de enzimas testiculares específicas marcadoras (sorbitol deshidrogenasa, deshidrogenasa láctica, gamma glutamil transpeptidasa y glucosa-6-fosfato deshidrogenasa).
Existe un reporte reciente (Denoël et al., 2013) que describe los primeros avances en la exploración de una metodología de uso potencial en medicina, todavía en fase experimental con anfibios. Se trata de un estudio objetivo (y cuantitativo) del comportamiento que provoca el endosulfán y otros pesticidas, mediante patrones de seguimiento debidamente rastreados y digitalizados. Con estos patrones de movimiento se levanta un registro instrumental gráfico que sirve como una huella electrónica del comportamiento de los animales, asociado al nivel de exposición al pesticida. El patrón electrónico levantado contiene información sobre las formas y alcance del movimiento, velocidad promedio de nadado y tendencia al uso del espacio disponible. Con este estudio, Denoël y cols., anticipan que el registro análogo para un paciente contaminado con endosulfán dé cuenta del grado y severidad de la contaminación.
Problemática agrícola
Como Contaminante Orgánico Persistente (COP), el endosulfán se incorpora directamente en el ambiente acuático por medio de las aguas lluvias y de riego en los cultivos, afectando las especies que allí se encuentran, acumulándose en los tejidos de los peces y otros organismos. Sus efectos sobre los vertebrados e invertebrados acuáticos se empiezan a hacer visibles aun en concentraciones tan bajas como 5 ug L-1. Su tiempo de vida media en agua varía entre 3 y 7 días hasta cerca de 5 meses, dependiendo de la cantidad de oxígeno disuelto, la turbidez y el pH de los otros contaminantes del medio (Capkin, Altinok & Karahan, 2006). El endosulfán-sulfato, principal producto de la degradación, es igualmente tóxico y más persistente en el medio ambiente que sus compuestos de origen (Siang, Yee & Seng, 2007).
Aunque el endosulfán no desciende en gran medida hacia las aguas subterráneas, se escurre luego de las fumigaciones y ha sido detectado en estratos profundos del terreno, en concentraciones que van desde 0,008 a 0,053 ug L-1, hasta 20 días después de la última fumigación (Kaushik & Kaushik, 2007). La Agencia de Protección Ambiental de Estados Unidos (US EPA) recomienda que los niveles de endosulfán en los ríos, lagos y arroyos no debe exceder 74 ppb (Park, Hempleman & Propper, 2001).
Los COPs tienen el potencial de distribuirse por todo el mundo alcanzando regiones tan remotas como las regiones Árticas (Li, 2005; Weber et al., 2010), dando lugar a efectos de bioconcentración a lo largo de la cadena trófica, con la consiguiente exposición de largo plazo para las poblaciones humanas y la vida silvestre. Por tanto, las concentraciones que se suponen aceptables a nivel local, no deberían considerarse aceptables para la evaluación de los COPs en los programas de reglamentación de los plaguicidas. En el caso particular del endosulfán, habría que agregar dos motivos de preocupación al del potencial de bioconcentración: a) el potencial de biomagnificación en las cadenas tróficas constituidas por organismos de respiración aérea y b) el desconocimiento de las consecuencias, a largo plazo, de una cantidad de metabolitos que conservan la estructura química básica del endosulfán (Sutherland, Home, Weir, Russel & Oakeshott, 2004). Un análisis del uso y de las emisiones mundiales de endosulfán y su relación con la concentración del mismo en el aire (Li, 2005), reporta que la tendencia general del uso de este plaguicida a nivel mundial aumentó desde el primer año en que se aplicó por primera vez hasta, al menos, los últimos años del decenio de 1990.
Regulaciones
El endosulfán se desarrolló a comienzos de los cincuenta y en la actualidad está prohibido su uso; sin embargo, todavía se utiliza en diferentes regiones del mundo. La India, por ejemplo, está catalogada como el productor y exportador más importante del mundo (9900 toneladas anuales). Le siguen Alemania (4000 toneladas anuales) y China (2400 toneladas anuales) (Yuquan, Kane, Tatsuya, Toru & Takeshi, 2000). Este plaguicida salió al mercado en una época en que era escasa la conciencia ambiental, y se disponía de muy poco conocimiento del destino final de este compuesto y sus metabolitos. Para ese entonces, los estudios toxicológicos y los trabajos de monitoreo eran muy escasos y no era obligatorio hacerlos. Se registró en el año 1954 y en Estados Unidos se formuló inicialmente para el control de insectos en agricultura. Sin embargo, debido a sus efectos tóxicos, la Organización Mundial de la Salud (WHO) y la Agencia de Protección Ambiental de los Estados Unidos (USEPA) lo han clasificado como un pesticida de clase I, "Altamente Tóxico" y nocivo para la salud humana.
En Colombia, el endosulfán se encontraba restringido de manera exclusiva al control de la broca del café. Pero, debido a su alta peligrosidad, mediante Resolución 01669 de mayo 27 de 1997 el Ministerio de Salud prohibió su uso, venta y comercialización. Esta decisión fue ratificada por el Consejo de Estado según Sentencia No. 5483 de marzo 23 de 2001. Un estudio detallado sobre la toxicidad del endosulfán fue realizado en un trabajo de grado de la Universidad de La Salle mediante la técnica TCLP (Toxicity Characteristic Leaching Procedure), además que compila la normatividad nacional e internacional pasada y vigente (Niño-Salamanca & Torres-Chisino, 2009). A pesar de estas prohibiciones, el endosulfán aún se utiliza en nuestro país de manera clandestina; en 2010 el Instituto Colombiano Agropecuario (ICA) y la DIAN, seccional Caldas, decomisaron endosulfán en un municipio de Caldas. La tesis de grado acabada de citar (Niño-Salamanca & Torres-Chisino, 2009) se constituye en un documento muy completo sobre la realidad nacional en todo lo referente a la problemática del endosulfán.
Algunos estudios de remediación química o biológica
Es ineludible la realidad de la presencia expandida del endosulfán en infinidad de matrices y en el mundo entero, y la humanidad debe afrontarlo, además de continuar con los esfuerzos de evitar el uso indiscriminado. La detección, cuantificación y efectos de este insecticida son problemáticas que vienen siendo abordadas por la comunidad científica, pero también se hace imprescindible buscar herramientas para transformarlo en nuevos metabolitos biodegradables, ya que el núcleo clorado de su estructura y la porción sulfito de la molécula han limitado su biodegradabilidad. Aún son escasos los trabajos de investigación en el campo de la remediación química o biológica. Dentro de los reportes más destacables pueden citarse los estudios de decloración reductiva de endosulfán en fase acuosa usando sistemas bimetálicos a base de paladio y magnesio (Thangadurai & Suresh, 2013) o mediante el uso de zeolitas (Yonli, Batonneau-Gener & Koulidiati, 2012).
Adicionalmente, se conoce un estudio de transformación biológica de la porción sulfito del insecticida, con un logro del 83% de degradación después de 27 días, y con una producción de 6 mg.kg-1 de endosulfán diol (menos tóxico) usando el basidiomiceto Bjerkandera adusta (Rivero, Niell, Cesio, Cerdeiras & Heinzen, 2012). De manera similar se han hecho intentos importantes de promover la degradación de endosulfán mediante el uso del hongo Trichoderma harzianum (Alarcón, Argumedo-Delira, Ferreira-Cerrato & Peña-Cabriales, 2009), Aspergillus sydoni (Goswami, Vig & Singh, 2009) o bacterias del suelo (Awasthi, Manickam & Kumar, 1997; Sutherland et al., 2000; Hussain, Arshad, Saleem & Khalid, 2007; Kumar, Lakshmi & Khana, 2008). Las bacterias estudiadas con este propósito fueron principalmente Ochrobacterum sp., Arthrobacter sp., y Burkholderia sp., con porcentajes de biodegradación reportadas de entre 4% y 91%, aunque en algunos casos el endosulfán fue oxidado a endosulfán sulfato y luego convertido a otros metabolitos no conocidos (Kumar et al., 2008). Un estudio similar demostró que cepas bacterianas Gram negativas del género Azotobacter sp., aisladas de fincas cafeteras de Chinchiná (Colombia), tienen la potencialidad de convertirse en biocatalizadores para degradación de endosulfán (Castillo et al., 2011).
Recientemente se ha sugerido la utilidad de sistemas adsorbentes de endosulfán a base de silica y [4]-calixareno como agentes para remediación que, si bien no transforman químicamente la molécula, la atrapan en medios acuosos y la remueven (Memon, Memon, Memon & Latif, 2011). También se ha investigado la absorción y remoción de endosulfán ensayando materiales vegetales de desecho como canutos de bambú, semillas de aguacate, aceitunas, maní, aserrín y otros (El Bakouri, Morillo, Usero & Ouassini, 2008). Esta técnica de eco-remediación ha dado lugar a valores de remoción de hasta 82% de endosulfán sulfato en soluciones acuosas cuya concentración de este metabolito es de 0,5 ug.L-1.
TÉCNICAS INMUNOQUÍMICAS DE ANÁLISIS PARA EL ENDOSULFÁN
Generalidades de las técnicas de inmunoensayo
Las moléculas de alto peso molecular se comportan como antígenos porque son reconocidas por el sistema inmunitario de los organismos vivos, y algunas de ellas (conocidas como inmunógenos) estimulan la generación de anticuerpos de defensa. Las moléculas orgánicas de bajo peso molecular no tienen esta propiedad, salvo que se encuentren enlazadas a un inmunógeno. Estas moléculas pequeñas –conocidas como haptenos– una vez se conjugan a una macromolécula, generalmente de naturaleza proteica, provocan respuestas inmunológicas, de tal manera que los anticuerpos resultantes pueden utilizarse como reactivos de detección de la molécula original mediante inmunoensayos. Las proteínas generadoras de inmunorrespuestas, que más comúnmente se usan para enlazar haptenos con fines de inmunoensayo son: la seroalbúmina bovina (BSA), ovoalbúmina (OVA), conalbúmina (CONA), tiroglobulina (TG) y el fibrinógeno (Abad et al., 1997; Sherry, 1997).
El enlazamiento a la proteína requiere la existencia de grupos funcionales en el hapteno; en caso de ser un hapteno carente de grupos funcionales, se hace necesario sintetizar un hapteno análogo o molécula mimética del analito, químicamente parecida a la molécula original pero con presencia de grupos funcionales (Sherry, 1997). El diseño de haptenos análogos es uno de los aspectos clave en la generación específica de anticuerpos para el reconocimiento y cuantificación de moléculas pequeñas a través de inmunoensayos (Abad et al., 1997).
La elevada especificidad de los anticuerpos para unirse a los antígenos determina que los anticuerpos se conviertan en reactivos muy útiles para la detección, purificación y cuantificación de gran cantidad de analitos. La detección y en la mayoría de las ocasiones, la purificación de cada antígeno, requiere la producción de un anticuerpo específico. Debido a que se producen anticuerpos frente a cualquier tipo de macromolécula (o frente a una sustancia química pequeña conjugada a una proteína), pueden usarse técnicas basadas en el reconocimiento inmunológico antígeno-anticuerpo para prácticamente cualquier tipo de molécula en solución o a nivel celular (Vanderlaan, Watkins & Stanker, 1988).
Los métodos analíticos de inmunoensayo son altamente selectivos y sensibles, rápidos, simples y económicos, por tanto los esfuerzos para la purificación de la muestra se pueden reducir de manera muy significativa, lo que los convierte en herramientas muy convenientes para el estudio de gran cantidad de muestras en un período corto de tiempo (Kaurman & Clower, 1991).
El desarrollo de un inmunoensayo comprende cinco fases: i) diseño del hapteno; ii) síntesis del hapteno; iii) conjugación del hapteno a la proteína; iv) inmunización adecuada del huésped; y v) análisis de los anticuerpos en el suero sanguíneo a lo largo del tiempo (Wang, Yang, Shang, Ma & Sun, 2005; Dewen, Yang & Jinyi, 2007).
En las técnicas inmunológicas pueden emplearse tanto anticuerpos policlonales (poblaciones complejas formadas por distintos tipos de anticuerpos) como anticuerpos monoclonales (moléculas idénticas que poseen la misma especificidad). La técnica de producción de cantidades prácticamente ilimitadas de anticuerpos monoclonales, para una determinada región de un antígeno ha tenido un extraordinario impacto sobre la investigación en diferentes campos que requieren anticuerpos como reactivos (Hennion & Barcelo, 1988; Hock, Dankwardt, Kramer & Marx, 1995).
Inmunoensayos usando haptenos análogos al endosulfán
Como se puede apreciar en las estructuras 1 y 2 (Figura 1), los dos estereoisómeros del endosulfán carecen de grupos funcionales para su enlazamiento a proteínas inmunogénicas, por lo cual se requieren haptenos análogos. En la literatura se encuentran pocos estudios de inmunoensayos específicos para el endosulfán, debido fundamentalmente a dificultades en las etapas de síntesis de los haptenos análogos (Dreher & Podrastzki, 1988; Lee, Skerritt & McAdam, 1995; Abad et al., 1997; Lee et al., 1997; Manclus et al., 2004; Dewen et al., 2007).
El grupo funcional presente en el hapteno análogo o mimético determina la selección del método de conjugación empleado. Algunos de los procedimientos más citados en la literatura, implican modificaciones sintéticas como la incorporación en la estructura bien sea del hapteno o de la proteína, de grupos amino (-NH2), carboxilo (-COOH), hidroxilo (-OH) y sulfhidrilo (-SH). Para realizar una efectiva conjugación entre el hapteno y la proteína es importante caracterizar el conjugado hapteno-proteína y determinar la densidad del hapteno en la proteína (número de moléculas del hapteno por número de moléculas de la proteína portadora). Esto se puede lograr mediante técnicas espectrofotométricas para la evaluación de la disponibilidad de los grupos amino antes y después de la conjugación (McAdam, Hill, Beasley & Skerrit, 1992).
Se han reportado pocos trabajos sobre el diseño y síntesis de haptenos del endosulfán y su utilización en técnicas inmunoquímicas. Algunas de las síntesis más exitosas contienen un anillo de ciclopentano a través del cual se conecta el brazo espaciador para la conjugación con la proteína. Desde el trabajo pionero de Langone & Van Vunakis en 1975, quienes diseñaron un radio-inmunoensayo para el dieldrín y aldrín, se han venido publicando reportes sobre la detección inmunoquímica de ciclodienos (Langone & Van Vunakis, 1975). En 1988 el grupo de Dreher implementó un inmunoensayo para la detección de endosulfán. La síntesis del hapteno se realizó mediante esterificación del endosulfán-diol con anhídrido succínico (Figura 4). El brazo espaciador de hemisuccinato, se acopló a la proteína acarreadora, pero el inmunoensayo no resultó lo suficientemente sensible para el análisis del pesticida en agua (Dreher & Podrastzki, 1988).
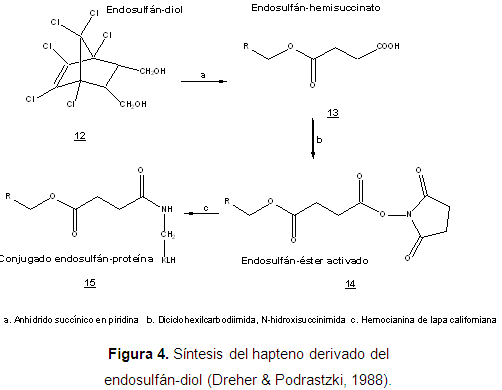
En 1988, Bushway y cols., desarrollaron un inmunoensayo para la detección del clordano, pesticida también del grupo de los ciclodienos. Este ensayo presentó tal grado de reacción cruzada con el endosulfán, que se utilizó para cuantificar este último, con un límite de detección de 1,0 ppb, pero tanto en este ensayo como en el anterior, no fue posible discriminar la presencia de endosulfán-diol (Bushway, Pask, King, Perkins & Ferguson, 1988). Otro inmunoensayo reportado para la detección del endosulfán, fue desarrollado por Reck & Frevert en 1990, empleando diferentes brazos espaciadores sobre el endosulfán-diol. Este inmunoensayo presentó una inhibición sensible, aunque el tiempo de reacción resultó ser demasiado largo, involucrando varias etapas de incubación (Reck & Frevert, 1990).
En 1991 Stanker y cols., desarrollaron un inmunoensayo para el endosulfán, empleando anticuerpos monoclonales partiendo de derivados del clordano para el análisis de residuos de ciclodienos en grasas. Este ensayo presentó falta de sensibilidad y reacciones cruzadas con otros metabolitos del endosulfán (Stanker, Watkins, Vanderlaan, Ellis & Rajan, 1991). Por su parte, Lee y cols., desarrollaron un inmunoensayo para la detección de residuos del endosulfán presentes en agua y suelo. Para generar los anticuerpos sensibles y selectivos para los metabolitos del endosulfán, fue necesario llevar a cabo la síntesis de tres haptenos. Uno de los haptenos se preparó por derivatización del endosulfán-diol, mientras que los otros dos haptenos se derivaron de anillos rígidos de 5 miembros adyacentes al anillo hexaclorociclopentadieno (ciclodieno). Los ensayos óptimos tienen un límite de detección de 0,2 ppb del endosulfán y en este ensayo se detectó en el rango 0,2-10 ppb (Lee et al., 1995).
El inmunoensayo desarrollado por el grupo de Manclus en 2004, presenta la síntesis de haptenos que comparten estructuras comunes a los insecticidas ciclodiénicos y difieren en el brazo espaciador que lo ancla a las proteínas transportadoras. En la síntesis de estos haptenos, la primera reacción, en todos los casos fue una adición de Diels-Alder del dieno hexaclorociclopentadieno, con un dienófilo particular para cada hapteno (Manclus et al., 2004). En la síntesis de los haptenos CCD1 y CCD4 (Figura 5), el alqueno (dienófilo) ya contenía en su estructura un espaciador con un grupo carboxilo, el cual se empleó para realizar el acoplamiento con la proteína. En la síntesis de los haptenos CCD2 y CCD3 el grupo carboxilo se introdujo por medio de una succinilación (Figura 5).
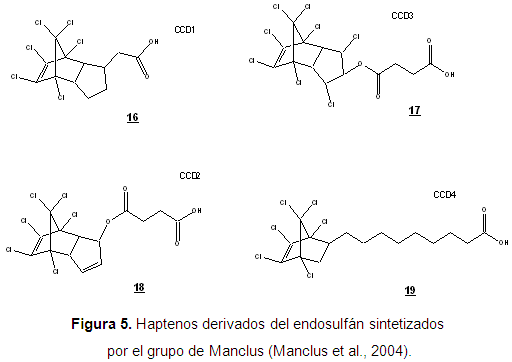
Nuevos intentos en la búsqueda de haptenos del endosulfán
Dado que el endosulfán carece de grupos funcionales en su estructura, los haptenos de este pesticida que ya son conocidos en la literatura, realmente son símiles moleculares pero no contienen de manera exacta su estructura. Nuestro grupo de investigación tiene en curso un trabajo para sintetizar un hapteno que corresponde a uno de los metabolitos del endosulfán. Esperamos que, una vez enlazado al sistema inmunogénico y producidos los anticuerpos, los mismos tendrán una significativa capacidad de reconocimiento del endosulfán. Las etapas de nuestro trabajo sintético incluyen: (i) exploración de la reacción Diels-Alder del hexaclorociclopentadieno con una molécula similar a la porción no clorada de uno de los metabolitos del endosulfán, con cola funcionalizada protegida; (ii) desprotección del grupo funcional y aprovechamiento del mismo para enlazar la proteína inmunogénica. Dadas las restricciones para acarreo y manipulación del hexaclorociclopentadieno (restricciones derivadas del riesgo ambiental que representa), se realizaron cálculos computacionales para predecir la viabilidad termodinámica y cinética de estas reacciones, como condición previa a la experimentación correspondiente. Los resultados de este cálculo serán sometidos para publicación próximamente (Betancur, 2010).
CONCLUSIONES
Además de brindar información compilada y actualizada de algunos de los aspectos técnicos del endosulfán relacionados con sus propiedades, métodos de análisis, implicaciones médicas y ecológicas en general, y retos investigativos de remediación, este trabajo de revisión tiene la intencionalidad de contribuir a despertar en la comunidad la conciencia del impacto y amenazas de este pesticida. Por tener un cierto grado de solubilidad en agua (aunque muy poca), será siempre probable la existencia de al menos trazas en los sistemas acuosos (ríos, mares, sistemas biológicos y alimentos), suelos y ecosistemas en general. Por su relativa volatilidad, está siempre latente (y es real) el riesgo de que se propague a otras latitudes, de tal manera que es entendible la presencia de este contaminante en lugares supuestamente aislados de esta amenaza. Por todo esto, la problemática del endosulfán no está circunscrita solamente de manera local a los sitios donde más se usa, sino que es un tema de cobertura global. Por degradarse a otros metabolitos que conservan en su estructura el núcleo clorado, y por tanto con perfil de toxicidad comparable a la de la molécula original (o inclusive mayor en algunos casos), el aspecto químico analítico se hace más complejo. Dado que el pesticida de partida es realmente una mezcla de compuestos, sumado a lo complejo de los resultados del metabolismo, las técnicas de análisis deben tener la potencialidad de detectar y cuantificar no solamente las moléculas originales sino también los metabolitos resultantes, tanto los conocidos como los desconocidos. Porque no hay suficiente conciencia en toda la población respecto a la necesidad de restringir o proscribir su uso, será muy difícil disminuir los niveles de contaminación en todo el mundo. Por todo ello, la conjunción de varios problemas de difícil manejo atinentes al endosulfán, la necesidad de que se hagan estudios permanentes de las implicaciones médicas y ecológicas, su fuerte impacto en la seguridad alimentaria, y el reto mayúsculo de encontrar formas efectivas (y a gran escala) de remediación química o biológica, sigue y seguirá vigente el interés por mantener activas las temáticas de investigación alrededor de este contaminante.
Las técnicas inmunoquímicas se han perfilado como una alternativa importante a los procesos de análisis, y nuestro grupo de investigación está comprometido con ofrecer algunas contribuciones. Hay muy pocos reportes sobre cuantificación de otros metabolitos derivados del endosulfán, como la endosulfán-lactona, y este es un tópico particular en el que estamos investigando. Sin embargo, detectar y cuantificar el pesticida es solo una pequeña arista de un universo de aspectos problemáticos, que requiere la atención de la comunidad científica mundial y de los Gobiernos, deseablemente como política de Estado.
REFERENCIAS
• Abad, A., Manclus, J.J., Mojarrad, F., Mercader, J.V., Miranda, M.A., Primo, J. & Guardiola, V. (1997). Hapten synthesis and production of monoclonal antibodies to DDT and related compounds. Journal of Agricultural and Food Chemistry, 45, 3694-3702. [ Links ]• Alarcón, A., Argumedo-Delira, R., Ferreira-Cerrato, R. & Peña-Cabriales, J. (2009). El género fúngico Trichoderma y su relación con contaminantes orgánicos e inorgánicos. Revista Internacional de Contaminación Ambiental, 25(4), 257-269. [ Links ]
• Awasthi, N., Manickam, N. & Kumar, A. (1997). Biodegradation of endosulfan by a bacterial coculture. Bulletin of Environmental Contamination and Toxicology, 59, 928-934. [ Links ]
• Barakat, A.O., Khairy, M. & Aukaily, I. (2013). Persistent organochlorine pesticide and PCB residues in surface sediments of Lake Qarun, a protected area of Egypt. Chemosphere, 90, 2467-2476. [ Links ]
• Batta, Y., Zatar, N. & Sadeq, N. (2006). Detection of endosulfan residues in soil of Western Jordan Valley. Jordan Journal of Agricultural Sciences, 2(1), 57-64. [ Links ]
• Becker, L., Scheringer, M., Schenker, U. & Hungerbühler, K. (2011). Assessment of the environmental persistence and long-range transport of endosulfan. Environmental Pollution, 159, 1737-1743. [ Links ]
• Berrill, M., Coulson, D., McGillivray, L. & Pauli, B. (1998). Toxicity of endosulfan to aquatic stages of anuran amphibians. Environmental Toxicology and Chemistry, 17, 1738-1744. [ Links ]
• Betancur, L.A. (2010). Síntesis de un nuevo hapteno del endosulfán: aproximación teórica y experimental. Tesis de Maestría, Universidad de Caldas, Manizales, Colombia. [ Links ]
• Bushway, R.J., Pask, W.M., King, J., Perkins, B. & Ferguson, B.S. (1988). Determination of chlordane in soil by enzyme immunoassays. First International Symposium U.S. Environmental Protection Agency. pp. 433-437. [ Links ]
• Capkin, E., Altinok, I. & Karahan, S. (2006). Water quality and Fish size affect toxicity of endosulfan, an organochlorine pesticide to rainbow trout. Chemosphere, 64(10), 1793-1800. [ Links ]
• Castillo, J.M., Romero, E. & Casas, J. (2011). Isolation of an endosulfan-degrading bacterium from a coffee farm soil: Persistence and inhibitory effect on its biological functions. Science of the Total Environment, 412-413, 20-27. [ Links ]
• Ciglasch, H., Busche, J., Amelung, W. & Trotrakool, S. (2008). Field aging of insecticiedes after repeated application to a northern Thailand ultisol. Journal of Agricultural and Food Chemistry, 56(20), 9555-9562. [ Links ]
• Iglasch, H., Busche, J., Amelung, W., Trotrakool, S. & Kaupenjohann, M. (2006). Insecticide dissipation after repeated field application to a northern Thailand Ultisol. Journal of Agricultural and Food Chemistry, 54(22), 8551-8559. [ Links ]
• Convenio de Estocolmo. (2011). http://chm.pops.int/Home/tabid/2121/mctl/ViewDetails/EventModID/871/EventID/514/xmid/6921/Default.aspx. [ Links ]
• Convenio de Rotterdam. (2011). Documento de orientación para la adopción de decisiones: Endosulfán. Octubre de 2011. 28p. [ Links ]
• Crupkin, A.C., Carriquiriborde, P., Mendieta, J., Panzeri, A.M., Ballesteros, M.L., Miglioranza, K.S.B. & Menone, M.L. (2013). Oxidative stress and genotoxicity in the South American cichlid, Australoheros facetus, after short-term sublethal exposure to endosulfan. Pesticide Biochemistry and Physiology, 105, 102-110. [ Links ]
• Da Cuña, R.H., Pandolfi, M., Genovese, G., Piazza, Y., Ansaldo, M. & Lo Nostro, F.L. (2013). Endocrine disruptive potential of endosulfan on the reproductive axis of Cichlasoma dimerus (Perciformes, Cichlidae). Aquatic Toxicology 126, 299-305. [ Links ]
• Denoël, M., Libon, S., Kestemont, P., Brasseur, C., Focant, J.F. & De Paw, E. (2013). Effects of sublethal pesticide exposure on locomotor behavior: A video-tracking analysis in larval amphibians. Chemosphere, 90, 945-951. [ Links ]
• Dewan, P., Jain, V., Gupta, P. & Banerjee, B.D. (2013). Organochlorine pesticide residues in maternal blood, cord blood, placenta, and breastmilk amd their relation to birth size. Chemosphere, 90, 1704-1710. [ Links ]
• Dewen, T., Yang, H. & Jinyi, W. (2007). Recent Adavances in the synthesis of artificial antigen and its appication in the detection of pesticide residues. American Journal of Agricultural and Biological Sciences, 2(2), 83-93. [ Links ]
• Díaz-Plaza, E.M., Cortés, J.M., Vázquez, A. & Villén, J. (2007). Automated determination of pesticide residues in olive oil by on-line reversed-phase liquid chromatography-gas chromatography using the trough oven transfer adsorption desorption interface with electron-capture and nitrogen-phosphorus detectors operating simultaneously. Journal of Chromatography A, 1174(1-2), 145-150. [ Links ]
• Dreher, R.M. & Podrastzki, B. (1988). Development of an enzyme immunoassay for endosulfan and its degradation products. Journal of Agricultural and Food Chemistry, 36(5), 1072-1075. [ Links ]
• El Bakouri, H., Morillo, J., Usero, J. & Ouassini, A. (2008). Potential use of organic waste substances as an ecological technique to reduce pesticide ground water contamination. Journal of Hydrology, 353, 335-342. [ Links ]
• Forman, S.E., Dubertaki, A.J., Cohen, M.V. & Olefson, R.A. (1965). Conformational equilibrium in cyclic sulfites and sulfates. The configuration and conformations of the two isomeric Thiodans. Journal of Organic Chemistry, 30, 169-175. [ Links ]
• Galeano, T., Guiberteani, A. & Salinas, F. (1992). Rapid determination of alpha endosulfan and beta endosulfan in formulations and potatoes by high-performance liquid chromatography. Analytical Letters, 25, 797-1804. [ Links ]
• Goswami, S., Vig, K. & Singh, K. (2009). Biodegradation of a and B endosulfan by Aspergillus sydoni. Chemosphere, 75, 883-888. [ Links ]
• Hayes, T.B., Collins, A., Lee, M., Mendoza, M., Noriega, M., Stuart, A. & Vonk A. (2002). Hermaphroditic, demasculinized frogs after exposure to the herbicide atrazine at low ecologically relevant doses. Proceedings of the National Academy of Sciences of the United States of America, 99, 5476-5480. [ Links ]
• Hennion, M.C. & Barcelo, D. (1988). Strengths and limitations of immunoassays for effective and efficient use for pesticides analysis in water samples: A review. Analytica Chimica Acta, 362, 3-34. [ Links ]
• Hernández, F., Serrano, R. & Olea, N. (2002). Multiresidue determination of endosulfan and metabolic derivatives in human adipose tissue using automated liquid chromatographic cleanup and gas chromatographic analysis. Journal of Analytical Toxicology, 26(2), 94-103. [ Links ]
• Hoang, T.C., Rand, G.M., Gardinali, P.R. & Castro, J. (2011). Bioconcentration and depuration of endosulfan sulfate in mosquito fish (Gambusia affinis). Chemosphere, 84, 538-543. [ Links ]
• Hock, B., Dankwardt, A., Kramer, K. & Marx, A. (1995). Immunochemical Techniques: Antibody Productions for Pesticides Analysis. A Review. Analytica Chimica Acta, 311, 393-406. [ Links ]
• Hopkins, W.A., Mendonca, M.T., Rowe, C.L. & Congdon, J.D. (1998). Elevated trace element concentrations in southern toads, Bufo terrestris, exposed to coal combustion waste. Archives of Environmental Contamination and Toxicology, 35, 325-329. [ Links ]
• Hussain, S., Arshad, M., Saleem, M. & Khalid, A. (2007). Biodegradation of a- and B-endosulfan by soil bacteria. Biodegration, 18, 731-740. [ Links ]
• Hyötyläinen, T., Jauho, K. & Riekkola, M.L. (1998). Analysis of pesticides in red wines by on-line coupled reversed-phase liquid chromatography-gas chromatography with vaporiser/precolumn solvent split/gas discharge interface. Journal of Chromatography A, 813(1), 113-119. [ Links ]
• IPCS-ECH. (1984). International Programme on Chemical Safety. Environmental Health Criteria 40: Endosulfan. Geneva: World Health Organization. [ Links ]
• Jiménez, J.J., Bernal, J.L., Del Nozal, M.J. & Alonso, C. (2004). Liquid–liquid extraction followed by solid-phase extraction for the determination of lipophilic pesticides in beeswax by gas chromatography–electron-capture detection and matrix-matched calibration. Journal of Chromatography A, 1048, 89-97. [ Links ]
• Jones, D.K., Hammond, J.I. & Relyea, R.A. (2009). Very highly toxic effects of endosulfan across nine species of tadpoles: lag effects and family-level sensitivity. Environmental Toxicology and Chemistry, 28, 1939-1945. [ Links ]
• ________. (2010). Roundup and amphibians: the importance of concentration, application time, and stratification. Environmental Toxicology and Chemistry, 29, 2016-2025. [ Links ]
• Kaurman, B.M. & Clower, M.J. (1991). Immunoassay of pesticides. Journal of the Association of Official Analytical Chemists, 74(2), 239-247. [ Links ]
• Kaushik, P. & Kaushik, G. (2007). Assessment of structure and toxicity correlation in organochlorine pesticides. Journal of Hazardous Materials, 143, 102-111. [ Links ]
• Kumar, M., Lakshmi, C.V. & Khana, S. (2008). Biodegradation and bioremediation of endosulfan contaminated soil. Bioresource Technology, 99, 3116-3122. [ Links ]
• Kumar, M. & Philip, L. (2006). Bioremediation of endosulfan contaminated soil and water optimization of operating condition in laboratory scale reactors. Journal of Hazardous Materials B, 136, 354. [ Links ]
• Lafuente, A. & Pereiro, N. (2013). Neurotoxic effects induced by endosulfan exposure during pregnancy and lactation in female and male rat striatum. Toxicology, 311(1-2), 35-40. [ Links ]
• Langone, J. & Van Vunakis, H. (1975). Radioimmunoassays for dieldrin and aldrin. Research Communications in Chemical Pathology and Pharmacology, 10, 163-171. [ Links ]
• Lee, N., Beasle, H.L., Kimber, S.W.L., Silburn, M., Woods, N., Skerritt, J.H. & Kennedy, R. (1997). Application of Immunoassays to Studies of the Environmental Fate of Endosulfan. Journal of Agricultural and Food Chemistry, 45 , 4147-4155. [ Links ]
• Lee, N., Skerritt, J.H. & McAdam, D.P. (1995). Hapten Synthesis and Development of ELISAs for Detection of Endosulfan in Water and Soil. Journal of Agricultural and Food Chemistry, 43, 1730-1739. [ Links ]
• Li, Y.F. (2005). Sources and Pathways of selected organochlorine pesticides to the Artic and the effect of pathway divergence on HCH trends in biota: A review. Science of the Total Environment, 342, 87-106. [ Links ]
• Manclus, J., Abad, A., Lebedev, M.Y., Mojarrad, F., Mickovaa, B., Mercader, J.V., Primo, J., Miranda, M.A. & Montoya, A. (2004). Development of a monoclonal immunoassay selective for chlorinated cyclodiene insecticides. Journal of Agricultural and Food Chemistry, 52, 2776-2784. [ Links ]
• Martínez-Vidal, J.L., Arrebola, F.J., Fernández-Gutiérrez, A. & Rams, M.A. (1998). Determination of endosulfan and its metabolites in human urine using gas chromatography–tandem mass spectrometry. Journal of Chromatography B, 719, 71-78. [ Links ]
• Matos-Lino, C. & Noronha-da Silveira, M.I. (1997). Extraction and clean-up methods for the determination of organochlorine pesticide residues in medicinal plants. Journal of Chromatography A, 769, 275-283. [ Links ]
• McAdam, D.P., Hill, A.S., Beasley, H.L. & Skerrit, J.H. (1992). Mono and polyclonal antibodies. Approaches to hapten-protein conjugations. Journal of Agricultural and Food Chemistry, 40, 1466-1470. [ Links ]
• Memon, S., Memon, N., Memon, S. & Latif, Y. (2011). An efficient calix[4]arene based silica sorbent for the removal of endosulfan from water. Journal of Hazardous Materials, 186, 1696-1703. [ Links ]
• Mor, F. & Ozmen, O. (2003). Acute endosulfan poisoning in cattle. Veterinary and Human Toxicology, 45(6), 323-324. [ Links ]
• Muir, D. & Lohmann, R. (2013). Water as a new matrix for global assessment of hydrophilic POPs. Trends in Analytical Chemistry, 46, 162-172. [ Links ]
• Muir, D.C.G., Teixeira, C. & Wania, F. (2004). Empirical and modeling evidence of regional atmospheric transport of current-use pesticides. Environmental Toxicology and Chemistry, 23, 2421-2432. [ Links ]
• Niño-Salamanca, L.C. & Torres-Chisino, N. (2009). Determinación de la característica de toxicidad del endosulfán mediante la técnica TCLP (Toxicity Characteristic Leaching Procedure). Trabajo de grado, Universidad de La Salle, Bogotá, Colombia. [ Links ]
• Ouyang H., He, W., Qin, N., Kong, X., Liu, W., Wang, Q. & Jiang Y. (2012). Levels, Temporal-Spatial Variations, and Sources of Organochlorine Pesticides in Ambient Air of Lake Chaohu, China. The Scientific World Journal, Article ID 504576, 12 pages. doi:10.1100/2012/504576. [ Links ]
• Paranthaman, R., Sudha, A. & Kumaravel, S. (2012). Determination of pesticide residues in banana by using High Performance Liquid Chromatografphy and Gas chromatography-mass spectrometry. American Journal of Biochemistry and Biotechnology, 8(1), 1-6. [ Links ]
• Park, D., Hempleman, S.C. & Propper, C.R. (2001). Endosulfan exposure disrupts pheromonal systems en the red-spotted newt: a mechanisms for subtle effects of environmental chemicals. Environmental Health Perspectives, 109(7), 669-673. [ Links ]
• PISSQ. (1995). Centro Panamericano de Ecología Humana y Salud, División de Salud y Ambiente, Organización Panamericana de la Salud, Organización Mundial de la Salud. Programa Internacional de Seguridad para las Sustancias Químicas: Endosulfán, Guía para la Salud y la Seguridad No. 17, Metepec, Mexico. [ Links ]
• Quijano, R.F. (2000). Risk Assessment in a third world reality: An Endosulfan case History. International Journal of Occupational and Environmental Health, 6(4), 312-317. [ Links ]
• Quintanilla, J.E., Lebrón, R. & Polo, L.M. (1992). Comparative study of clean-Up and fractionation methods for the determination of organochlorine pesticides in lipids by gas chromatography. Journal of Chromatography, 591, 303-311. [ Links ]
• Rashid, A., Nawaz, S., Barker, H., Ahmad, I. & Ashraf, M. (2010). Development of a simple extraction and clean-up procedure for determination of organochlorine pesticides in soil using gas chromatography-tandem mass spectrometry. Journal of Chromatography A, 1217, 2933-2939. [ Links ]
• Rau, A.T., Coutinho, A., Abavratha, K.S., Rau, A.R. & Warrior, R.P. (2012). Pesticide (Endosulfan) Levels In The Bone Marrow Of Children With Hematological Malignancies. Indian Pediatrics, 49(2), 113-117. [ Links ]
• Reck, B. & Frevert, J. (1990). Competitive and inhibition type immunoassay for determination of endosulfan. In Immnunochemical Methodos for Environmental Analysis. Eds. American Chemical Society Symposium Series No. 442, 193-198. [ Links ]
• Relyea, R.A. & Jones, D.K. (2009). The toxicity of roundup original max to 13 species of larval amphibians. Environmental Toxicology and Chemistry, 28, 2004-2008. [ Links ]
• Rivero, A., Niell, S., Cesio, V., Cerdeiras, M.P. & Heinzen, H. (2012). Analytical methodology for the study of endosulfan bioremediation under controlled conditions with white rot fungi. Journal of Chromatography B, 907, 168-172. [ Links ]
• SC. (2009). Convenio de Estocolmo sobre contaminantes orgánicos persistentes. "Perfil de riesgo del endosulfán". Recuperado de http://chm.pops.int/Portals/0/download.aspx?d=UNEP-POPS-POPRC.5-10-Add.2.Spanish.pdf [ Links ]
• ________. (2011). Stockholm Convention on POPs. Recuperado de http://www.iisd.ca/chemical/pops/poprc4 [ Links ]
• Schmidt, W.F., Hapeman, C.J., Fettinge, J.C., Rice, C.P. & Bilboulian, S. (1997). Structure and asymmetry in the isomeric conversion of B- to a-endosulfan. Journal of Agricultural and Food Chemistry, 45(4), 1023-1026. [ Links ]
• Shen, L. & Wania, F. (2005). Compilation, evaluation, and selection of physical-chemical property data for organochlorine pesticides. Journal of Chemical & Engineering Data, 50(7), 42-68. [ Links ]
• Sherry, J. (1997). Environmental Immunoassays and other Bioanalytical Methods: Overview and Update. Chemosphere, 34, 5-7. [ Links ]
• Siang, H.Y., Yee, L.M. & Seng, C.T. (2007). Acute toxicity of organochlorine insecticide endosulfan and its effect on behaviour and some haematological parameters of Asian swamp eel. Pesticide Biochemistry and Physiology, 53, 8946. [ Links ]
• Siddique, T., Zahir, Z.A. & Frankenberger jr., W.T. (2003). Reversed-phase liquid chromatographic method for analysis of endosulfan and its major metabolites. Journal of Liquid Chromatography & Related Technologies, 26(7), 1069-1082. [ Links ]
• Sinha, N., Narayan, R., Shanker, R. & Saxena, D.K. (1995). Endosulfan-induced biochemical changes in the testis of rats. Veterinary and Human Toxicology, 37(6), 547-549. [ Links ]
• Soto, A.M., Chung, K.L. & Sonnenschein, C. (1994). The pesticides endosulfan, toxaphene, and dieldrin have estrogenic effects on human estrogensensitive cells. Environmental Health Perspectives, 102(4), 380-383. [ Links ]
• Stanker, L.H., Watkins, B., Vanderlaan, M., Ellis, R. & Rajan, J. (1991). Analysis of heptachlor and related cyclodiene insecticides in food products. In Immunoassays for trace chemical analysis. American Chemical society Symposium Series No. 45, 108-123. [ Links ]
• Sutherland, T.D., Horne, I., Lacey, M.J., Harcourt, R.L., Russell, R.J. & Oakeshott, J.G. (2000). Enrichment of an endosulfan-degrading mixed bacterial culture. Applied and Environmental Microbiology, 66(7), 2822-2828. [ Links ]
• Sutherland, T.D., Home, I., Weir, K.M., Russel, R.J. & Oakeshott, J.G. (2004). Toxicity and residues of endosulfan isomers. Reviews of Environmental Contamination and Toxicology, 183, 99-113. [ Links ]
• Thangadurai, P. & Suresh, S. (2013). Reductive transformation of endosulfan in aqueous phase using magnesium-palladium bimetallic systems: A comparative study. Journal of Hazardous Materials, 246-247, 245-256. [ Links ]
• Vanderlaan, M., Watkins, B.E. & Stanker, L.H. (1988). Environmental monitoring by immunoassay. Environmental Science and Technology, 22, 247-254. [ Links ]
• Wang, S.J., Yang, C.L., Shang, Y.F., Ma, L.P. & Sun, H.W. (2005). Application and prospect of immunoassay in the detection of pesticide residues. Agricultural Sciences, 4, 72-75. [ Links ]
• Walse, S., Scott, G. & Ferry, J. (2003). Stereoselective degradation of aqueous endosulfan in modular esturarine mesocosms: Formation of endosulfan hydrocarboxylate. Journal of Environmental Monitoring, 5, 373-379. [ Links ]
• Weber, J., Halsall, C.J., Muir, D., Teixeira, C., Small, J., Solomon, K., Hermanson, M., Hung, H. & Bidleman, T. (2010). Endosulfan, a global pesticide: A review of its fate in the environment and occurrence in the Arctic. Science of the Total Environment, 408, 2966-2984. [ Links ]
• Yonli, A., Batonneau-Gener, I. & Koulidiati, J. (2012). Adsorptive removal of a-endosulfan from water by hydrophobic zeolites. An isothermal study. Journal of Hazardous Materials, 203-204, 357-362. [ Links ]
• Yuquan, L., Kane, H.M., Tatsuya, T., Toru, T. & Takeshi, S. (2000). Genotoxic effects of a-Endosulfan & B-Endosulfan on Human HEPG2 cells. Environmental Health Perspectives, 108(6), 559-561. [ Links ]
4. Versión traducida del original en inglés: Endosulfan. Health and Safety Guide Nº 17. World Health Organization 1988.
Para citar este artículo: Betancur, L.A., Ocampo, R. & Ríos, L.A. (2015). La problemática del endosulfán: aspectos químicos, analíticos y ambientales. Revista Luna Azul, 40, 293-313. Recuperado de http://lunazul.ucaldas.edu.co/index.php?option=content&task=view&id=1013













