Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Luna Azul
Print version ISSN 1909-2474
Luna Azul no.42 Manizales Jan./June 2016
https://doi.org/10.17151/luaz.2016.4
DOI: 10.17151/luaz.2016.4
ADSORPTION OF NI (II) BY PRETREATED YAM PEELS (Dioscorea rotundata) AND OIL PALM PULP (Elaeis guineensis)
Candelaria Tejada Tovar1 Angel Villabona Ortiz2 Erika Ruiz Paternina3
1 Magíster en Ingeniería ambiental y Magister en Educación. Docente asociado del programa de Ingeniería Química, Universidad de Cartagena. Cartagena, Colombia. candelariatejada@yahoo.com
2 Magister en Ingeniería ambiental. Docente titular del programa de Ingeniería Química, Universidad de Cartagena. Cartagena, Colombia. angelvillabona@yahoo.es
3 Joven investigador del programa de Ingeniería Química, Universidad de Cartagena. Convenio COLCIENCAS No 0722-2013. Cartagena, Colombia. Estudiante de maestría en tecnologías urbanas sostenibles. Universidad de Buenos Aires. Argentina. erikbeatriz@gmail.com
Recibido 5 de junio de 2014, aprobado el 21 de abril de 2015 y actualizado el 22 de octubre de 2015
RESUMEN
El níquel es un metal pesado altamente contaminante que por sus efectos toxicológicos es materia de gran preocupación, por lo que toma importancia la búsqueda de alternativas para su remoción, siendo la adsorción una alternativa aplicable para la remoción metálica, interesante por su eficiencia y bajo costo. Se propone así la adsorción de Ni (II) usando dos materiales de desecho altamente disponibles en la región Caribe colombiana: cáscaras de ñame y bagazo de palma, ambas biomasas tratadas con ácido cítrico. Los experimentos fueron llevados a cabo en sistema batch en solución acuosa de níquel a una concentración de 100 ppm. La concentración residual de la solución fue medida mediante espectroscopia de absorción atómica, encontrando que el proceso de adsorción es altamente dependiente del pH, con un valor óptimo de 6. Por otra parte, se encontró que el Ni (II) presenta una sorción rápida los primeros 50 minutos, además el modelo de Elovich fue el de mejor ajuste. La capacidad máxima de adsorción según la isoterma de Langmuir fue de 68,14; 47,93; 103,3 y 58,7 mg/g para las cáscaras de ñame y el bagazo de palma sin modificar, y modificados químicamente respectivamente, mostrando el valor potencial del uso de estos biomateriales en la remoción de Ni (II) presente en soluciones acuosas.
PALABRAS CLAVEBioadsorción, níquel, remoción, tratamiento químico.
ABSTRACTNickel is a highly polluting heavy metal which, because of its toxicological effects, is a matter of great concern and the reason why the search for alternatives for its removal, being adsoption an applicative alternative for metal removal which is considered interesting due to its efficiency and low cost. In this way, the Ni (II) adsoption is proposed using two highly available waste materials in the Colombian Caribbean region: yam peels and oil palm pulp, both biomaBes treated with citric acid. The experiments were carried out in batch system using nickel aqueous solution at a concentration of 100 ppm. The residual concentration of the solution was measured by atomic absorption spectroscopy, and it was found that the adsorption proceB is highly dependent of pH with an optimum value of 6. What is more, it was found that Ni (II) presents a quick sorption the first 50 minutes, and Elovich model showed the best fit. The maximum adsorption capacity according to Langmuir isotherm was 68.14, 47.93, 103.3 and 58.7 mg/g for unmodified chemically modified yam peels and oil palm pulp respectively showing a potential value of use of these biomaterials in the removal of Ni (II) present in aqueous solutions.
KEY WORDS: Bioadsorption, nickel, removal, chemical treatment.
INTRODUCCIÓN
El níquel existe principalmente como Ni (II) en soluciones acuosas, causando graves problemas de envenenamiento a diversas formas de vida por su alta neurotoxicidad, además de ser asociado a serios efectos en la salud como dermatitis, nausea, bronquitis y cáncer (Dimirkou, 2007). Las altas concentraciones de níquel en el ambiente pueden ser debido a las aguas residuales industriales, domésticas, efluentes de escurrimiento, o ya sea procedentes de la atmósfera o litosfera, siendo las industrias relacionadas con la galvanoplastia, producción de pinturas, drogas, explotación minera, catalizadores, baterías, y la creciente demanda de estas, las principales causantes del problema de contaminación con níquel. Los efluentes de este tipo de industrias superan ampliamente la concentración máxima permitida según la Organización Mundial de la Salud que es de solo 0,02 mg/L de níquel en soluciones acuosas (Malamis y Katsou, 2013).
Es así como, la eliminación de Ni (II) en aguas residuales con el fin de reducir su concentración, se hace necesaria. En este contexto, la remoción de metales pesados puede realizarse por varios métodos como la precipitación, ósmosis inversa, intercambio iónico, electrodeposición, adsorción, extracción con solventes, y ultrafiltración (Ma et al., 2014). De estos la adsorción, específicamente usando biomasa residual, resulta atractiva por su relativa simplicidad de operación, bajo costo, y alta efectividad (Cheng et al., 2012; Zhu et al., 2012).
La literatura existente sobre la remoción de Ni (II) por diversos adsorbentes de soluciones acuosas, en comparación con los datos disponibles para otros metales pesados tales como el Hg (II), Cd (II), Pb (II) y Cr (VI), es poca. Dentro de estos estudios se pueden mencionar los realizados por Krishnan, Sreejalekshmi y Baiju (2011), del centro para los estudios de la tierra en India, en el que se estudió la adsorción de Ni (II) con bagazo de caña pretratando la biomasa con acetona, HCl y finalmente con NaOH para neutralizar el residuo ácido. Se encontró que el pH óptimo de operación fue de 6,5 y la adsorción del 92,3% (Krishnan et al., 2011), estos resultados no difieren significativamente de los obtenidos por García y colaboradores en 2011 los cuales usaron cáscara de moringa y carbón activado con ácido fosfórico obtenido de la misma planta para la adsorción de níquel, encontrando que para la cáscara la adsorción fue del 87% y para el carbón activado del 93%, además se determinó que el pH óptimo fue de 9,82 (García, Arnal y Alandia, 2011), mientras que Aravind y colaboradores en 2013 usaron guandul (Cajanus cajan), determinando la concentración residual del metal por espectrofotometría, los autores concluyeron que el pH óptimo fue de 8,0 siendo la máxima capacidad de adsorción de 19,23 mg/g (Aravind et al., 2013). En el presente artículo, se estudia la remoción de níquel usando biomasas residuales propias de la región Caribe colombiana: cáscaras de ñame y bagazo de palma africana, aplicando además un tratamiento químico a estas con ácido cítrico con el fin de evaluar la eficiencia del proceso.
MATERIALES Y MÉTODOSPreparación del adsorbente
El bagazo de palma africana fue obtenido como residuo del proceso en una planta extractora de aceite de palma ubicada en el departamento de Bolívar (Colombia), mientras que las cáscaras de ñame fueron obtenidas en empresas de alimentos en la ciudad de Cartagena. Estas fueron lavadas con agua destilada, realizando cuatro lavados de las mismas para retirar toda clase de impurezas. Luego fueron secadas por 24 horas en horno a una temperatura de 90°C, posteriormente fueron reducidas de tamaño y tamizadas, seleccionando el tamaño de partícula de 1 mm.
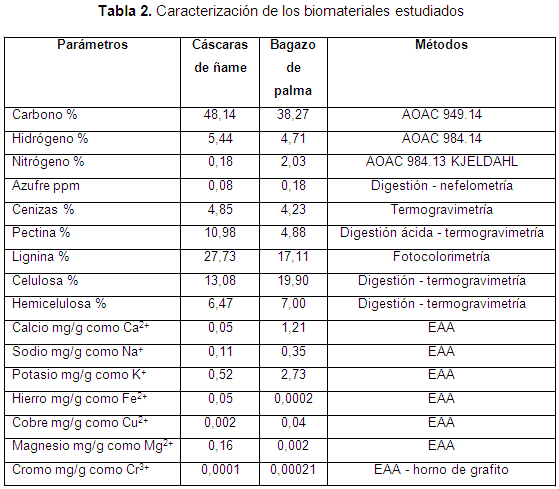
Una vez preparados los materiales adsorbentes se procedió a la caracterización fisicoquímica de los mismos. Esta caracterización consistió en determinar los elementos: carbono, hidrógeno, nitrógeno, azufre, sodio, potasio, hierro, cobre, magnesio, cromo y compuestos orgánicos presentes en estos por diferentes métodos analíticos, tal como se detalla en los resultados de la presente investigación.
Se realizó también un análisis FTIR a cada una de las biomasas, antes y después de la modificación química, y luego del proceso de remoción metálica para identificar los grupos funcionales que intervienen en la adsorción. Los adsorbentes fueron secados a 50°C por 24 horas. El adsorbente fue encapsulado en pellets de KBr, para ser analizados en espectrofotómetro en el rango 4000-400 cm-1.
Modificación química
Ambas biomasas fueron tratadas químicamente por dos horas a una temperatura de 60°C con ácido cítrico 0,6 M usando 40 g de biomasa con 200 ml de la solución. Luego, estos biomateriales fueron lavados con agua destilada para retirar restos de ácido, y secados a 55°C por 24 horas (Altun y Pehlivan, 2012; Pitsari, Tsoufakis y Loizidou, 2013). En general, el mecanismo de esta modificación se basó en el proceso de carboxilación de los materiales, con el fin de aumentar la posibilidad de enlace con el ion metálico.
Experimentos de adsorción
Inicialmente, los experimentos de adsorción fueron realizados con la biomasa sin modificar para determinar el pH óptimo de adsorción, se tomaron para esto tres valores (2, 4 y 6), el tamaño de partícula fue fijado en 1 mm, tomado como referencia de experimentaciones anteriores. Todos los experimentos fueron llevados a cabo a temperatura ambiente (25°C) en un shaker a 150 rpm. La cinética del proceso se llevó a cabo con cada biomasa en estudio al valor de mejor pH encontrado, y fue ajustada a los modelos cinéticos de la Tabla 1.
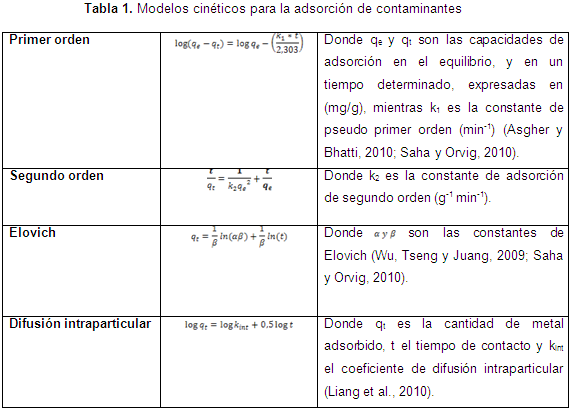
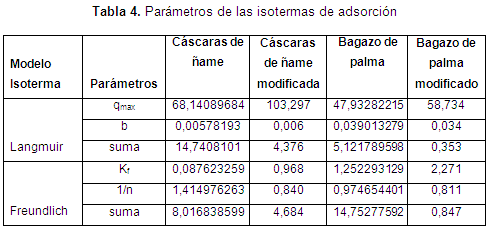
Además, para obtener información sobre la cantidad de adsorbato que puede retener un adsorbente, como función de sus características y de la concentración del adsorbato a temperatura constante, se utilizan las isotermas de adsorción. En el presente estudio, el tratamiento de los datos experimentales se realizó con las isotermas de Langmuir y Freundlich, a 25-50-75-100 ppm de níquel en solución acuosa. La ecuación de Langmuir se expresa como:
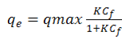
Donde qe es la concentración del metal adsorbido en el bioadsorbente, Cf es la concentración residual del metal en solución, qmax es la adsorción máxima correspondiente a los sitios de saturación, y K es la relación entre la tasas de adsorción/desorción (Njikam y Schiewer, 2012; Rezvani, Jahanshahi y Najafpour, 2014). Mientras el modelo de Freundlich se representa como:
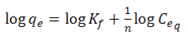
Donde Kf es la constante de Freundlich, n representa la intensidad de adsorción, qe es la cantidad de metal adsorbido en el equilibrio, y Ceq es la concentración residual del metal en solución (Krishnani, Meng y Dupont, 2009).
El análisis de Ni (II) se realizó mediante espectroscopia de absorción atómica de la solución al final del proceso. El análisis estadístico, y ajuste de los datos a los modelos trabajados, se realizó haciendo uso de la herramienta Solver de Excel.
RESULTADOS Y DISCUSIÓNEn la Tabla 2 se muestran los resultados obtenidos de la caracterización de los materiales trabajados, de la cual se observa que el carbono es el elemento con mayor porcentaje en ambas biomasas, haciéndolas también atractivas para su uso como material combustible. Además, se confirma la presencia de lignina, celulosa y hemicelulosa en ambos adsorbentes, por lo cual se espera una alta eficiencia de adsorción del níquel, puesto que estos polímeros son conocidos por la gran cantidad de grupos hidroxilos y fenol que pueden favorecer la adsorción de metales pesados. Asimismo, se observa que en las cáscaras de ñame hay mayor presencia de lignina que en el bagazo de palma, por lo cual la eficiencia de remoción puede ser mayor en este material (Krishnani et al., 2008). Cabe destacar que la suma de los porcentajes en la Tabla 2 no suma 100 al ser diferentes tipos de análisis que algunas veces abarcan los mismos compuestos.
En la Figura 1, se muestra el análisis FTIR de las cáscaras de ñame, el bagazo de palma, y la modificación con ácido cítrico de los mismos, antes de la adsorción de Ni (II).
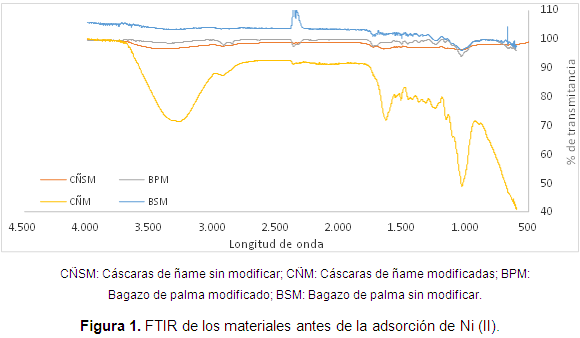
En el bagazo de palma sin modificar se observan ligeros picos entre 3500 y 3000 atribuibles a la presencia de ácidos carboxílicos, además se muestran los picos entre 1600 y 1700 cm-1 que corresponden a la señal del grupo carbonilo C=O, y a la presencia C=H de anillos aromáticos en la lignina. La vibración alrededor de 1450 a 1540 cm-1 podría atribuirse a los grupos alifático y aromático, y a la deformación de los grupos metil, metileno y metoxi. Por último, la banda en el rango entre 1050 y 1450 cm-1 puede ser asignada a la vibración de los ácidos carboxílicos y alcoholes, mientras que el espectro del bagazo modificado, conserva los grupos hidroxilos correspondientes a la banda de adsorción entre 3300 y 3560 cm-1, aunque además se observan unos picos de 3000 a 2800 cm-1 correspondientes a la vibración de C-H, y a 2360 que indica el grupo funcional de ácidos carboxílicos.
En el análisis FTIR de las cáscaras de ñame sin modificar se observa la banda del grupo O-H de 3668 a 3400 cm-1 correspondiente al ácido carboxílico, mientras que la frecuencia de 2300 puede ser atribuida al grupo de los ácidos carboxílicos, la de 1732 al grupo carbonilo C=O, la absorción a 1450 cm-1 se asigna a un grupo metoxi de la lignina, el estiramiento de ácido carboxílico C-O se atribuye por la banda colocada en 1200 cm-1, y por último se observa la vibración a 1033 cm-1 correspondiente a la vibración de un grupo alcohólico C-OH, en este caso de un posible alcohol secundario. En el análisis FTIR de las cáscaras de ñame modificadas con ácido cítrico, se observa la banda característica 3200 cm-1 del grupo O-H del ácido carboxílico. La banda a 1634 cm-1 que revela la presencia del enlace C=C característico del anillo fenilo de la lignina. La banda a 1516 cm-1 puede ser debido al estiramiento C=O del grupo carbonilo de la biomasa. Mientras que el estiramiento de ácido carboxílico C-O se atribuye a la banda colocada en 1244 cm-1. Al mismo tiempo, el estiramiento C-O de un grupo alcohólico puede ser confirmado debido a la presencia de una banda a 1030 cm-1.
En general, se muestra la inserción de grupos carboxilo e hidroxilo en las biomasas luego de la modificación, lo que se espera mejore significativamente la adsorción de níquel, puesto que estos grupos han sido relacionados con el aumento en la adsorción del metal en estudio.
Efecto del pH de la solución
Es bien conocido que la distribución de fase acuosa de las especies de soluto es dependiente del pH de la solución. Por tanto, se hicieron las pruebas de adsorción a tres valores de pH para determinar el valor de pH favorable para el proceso de adsorción, los resultados se muestran en la Figura 2.
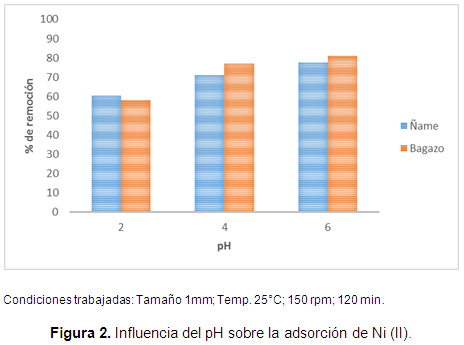
De acuerdo a la Figura 2, la adsorción de Ni (II) en ambas biomasas muestra un ligero aumento en el porcentaje de adsorción a medida que se aumenta el pH hasta 6. Encontrando un máximo del 77 y 81% de remoción para las cáscaras de ñame y el bagazo de palma, respectivamente, a una concentración inicial de 100 mg/L y 5 g/L de relación biomasa/metal.
Se concluye que la variación de adsorción a diferentes pH de la solución puede ser influenciada por la especiación de metal en solución, y el potencial zeta. Es decir, se supone que a pH de 6 la densidad de carga superficial debe ser aproximadamente cero, y por tanto la superficie está llevando carga positiva por debajo de este, y negativa por encima. Por esta razón, se da una adsorción menor por debajo de este pH, debido a la repulsión de las especies de Ni (II) por la carga positiva de los adsorbentes, mientras que al estar la superficie cargada negativamente es posible mejorar la atracción con la especie metálica. No se hicieron análisis a pH superiores a este, ya que es bien conocido que aproximadamente después de 7,5 la cantidad de adsorción se disminuye debido a la precipitación por la formación de Ni (OH)2.
Cinética de adsorción y equilibrios
Con el fin de estimar la capacidad de adsorción de las biomasas estudiadas, es importante permitir un tiempo suficiente para que el sistema experimental pueda alcanzar el equilibrio. En la Figura 3 se grafica el equilibrio para cada biomasa.
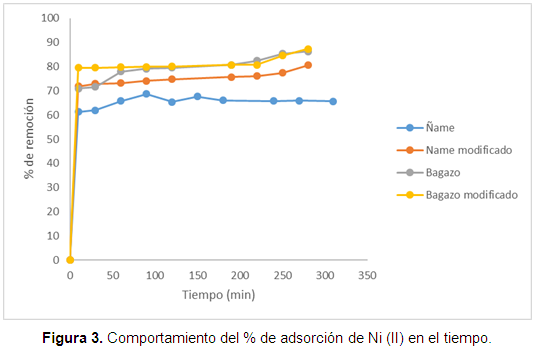
En la Figura 3 se observa que el bagazo modificado muestra mejores resultados que el ñame, aunque la diferencia en el porcentaje de remoción no supera el 10%. Otra conclusión que puede obtenerse es que en general la remoción metálica aumenta con el tiempo de contacto, pero bastan los primeros 50 minutos de adsorción para superar el 70% del metal removido. Además, se establece que después de este tiempo las biomasas parecen saturarse. Se infiere, además, que la remoción en el bagazo modificado no se mejora significativamente si se compara con el material sin modificación, esto puede deberse a que al realizar la modificación con ácido cítrico el cambio de los grupos funcionales no es evidente. Se analizaron, además, los cambios en el FTIR después de la remoción, los resultados se muestran en la Figura 4.
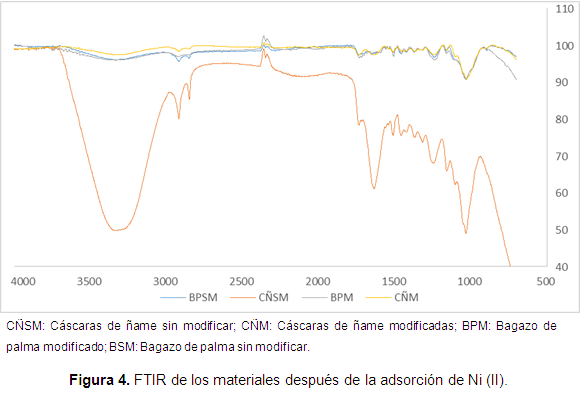
Al comparar las cáscaras de ñame y el bagazo de palma sin modificar antes y después del proceso, se observa una mayor intensidad y un cambio de la banda de 3400 a 3300 cm-1, correspondiente al estiramiento del grupo hidroxilo, además desaparece la banda a 2360 cm-1 que indica la participación de los ácidos carboxílicos, lo cual nos permite establecer la participación de los grupos hidroxilo y carboxilo en la adsorción de níquel sobre estos materiales.
En el FTIR del bagazo modificado después de la adsorción de níquel, se observa la aparición de nuevas bandas a 3750 y 3674 cm-1, además de una mayor intensidad de la banda a 3334 cm-1, todas correspondientes al estiramiento del grupo hidroxilo. Asimismo, se comprueba la participación del ácido carboxílico en la adsorción debido a la mayor intensidad del estiramiento de ácido carboxílico C-O correspondiente a la banda colocada a 1200 cm-1. Además, se observa la participación del grupo hidroxilo, por la mayor intensidad en la vibración a 1032 cm-1 correspondiente a la vibración de un grupo alcohólico C-OH.
En las cáscaras de ñame modificadas se observa la participación del grupo O-H del ácido carboxílico en la adsorción, al observar un cambio en la banda que aparece a 3330 cm-1. Además, del cambio significativo de la banda a 1030 cm-1 que corresponde al estiramiento C-O de un grupo alcohólico.
En general, se establece la participación de los grupos hidroxilo y carboxilo en la adsorción de níquel sobre estos materiales, ya sea modificados o no.
En cuanto al ajuste de la cinética, en las Figuras de la 5 a la 8, se observan los ajustes de los modelos cinéticos a los datos experimentales. En la Tabla 4 se muestran los parámetros y la suma de errores, determinando que el modelo de Elovich es el que mejor se ajusta a los datos experimentales, puesto que el valor de la suma de errores al cuadrado calculado con la herramienta Solver de Excel es el menor. Esto nos indica que el mecanismo controlante de la adsorción es una reacción de segundo orden, y además muestra que la superficie catalítica de los materiales modificados es heterogénea. En este modelo a se relaciona con la energía de quimisorción y B con la superficie cubierta. Como puede observarse en la Tabla 4, los valores de la velocidad inicial de adsorción, al igual que B, son más grandes para el bagazo, lo que muestra que la biomasa es tomada más rápidamente por este material, y además presenta mayor superficie para la toma del mismo.
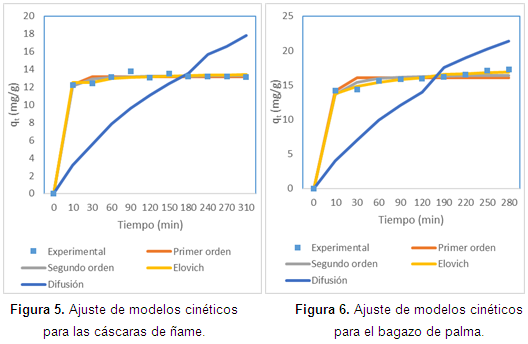
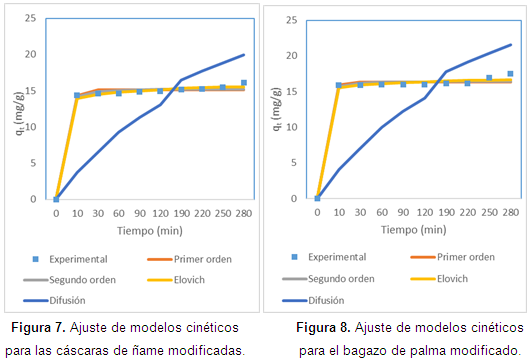
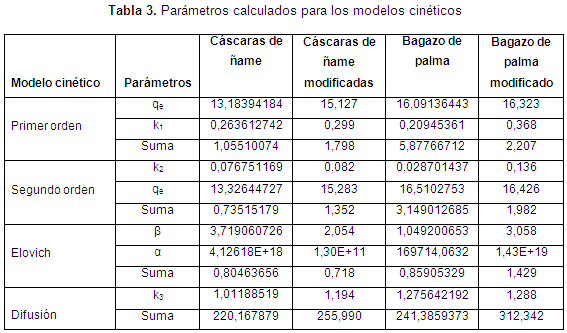
De las isotermas de adsorción y los parámetros obtenidos, mostrados en la Tabla 4, se establece una alta correlación de los datos experimentales con los modelos de Langmuir y Freundlich para el bagazo modificado, para los demás biomateriales es el de Langmuir el que mejor predice. Así, se puede concluir que el enlace se da principalmente por fuerzas físicas, mientras que la adsorción está limitada a la formación de una monocapa, en la cual no se considera ninguna reacción de desorción que pueda tener lugar durante el proceso de remoción. Se establece una capacidad máxima de 103,3 mg/g y 58,73 mg//g para el bagazo y las cáscaras de ñame modificadas, respectivamente, estableciendo que son materiales que podrían ser usados para la remoción de este metal, ya que al comparar la capacidad máxima con otros trabajos, se superan ampliamente los resultados reportados. Usando bagazo de caña los autores reportan una relación máxima de 2,76 mg/g (Krishnani et al., 2009), bagazo de arroz 5,52 mg/g (Krishnani et al., 2008) y con cáscaras de nueces 18,86 mg/g (Kumar et al., 2011).
Asimismo, se establece que el mecanismo de carboxilación trabajado es eficiente por cuanto se mejora la capacidad de los biomateriales al tratarlos químicamente con ácido cítrico. Este procedimiento se basa en la formación de un anhidro entre dos grupos carboxílicos adyacentes, resultado de la pérdida de una molécula de agua durante el calentamiento del ácido cítrico y la respectiva biomasa, que luego reacciona con un grupo hidroxilo de la celulosa de la biomasa para formar un éster, y así aumentar la posibilidad de enlace con el ion metálico (Altun y Pehlivan, 2012), tal como se mostró en el presente estudio.
En general, se establece que los materiales en estudio pueden ser usados para la remoción de Ni (II) en efluentes industriales, lo cual además de aliviar el problema de contaminación generado por la disposición de este tipo de efluentes en cuerpos de agua naturales, permite el uso de materiales que actualmente son considerados como desechos, tal como el bagazo de palma y las cáscaras de ñame, y que se convierten en un problema adicional para el ambiente. Se sugiere, además, el uso de estos biomateriales para la adsorción de otro tipo de contaminantes en sistemas acuosos.
CONCLUSIONESLos experimentos de adsorción mostraron la eficacia del bagazo de palma africana y las cáscaras de ñame para la eliminación de Ni (II) a partir de soluciones acuosas, sugiriendo un uso alternativo a materiales de desecho. La máxima adsorción de Ni (II) se observó a un pH 6. Se observa que la modificación de las biomasas mejora la toma del metal, además de la caracterización se establece que los grupos hidroxilo y carboxilo son los que participan en la remoción de níquel. Asimismo, aunque según los experimentos cinéticos el bagazo de palma modificado remueve mayor concentración del metal, las cáscaras de ñame modificadas presentan una mayor capacidad de remoción metálica (103,3 mg/g), frente a 58,7 del bagazo. La cinética de Elovich y el modelo de isotermas de Langmuir explican precisamente la cinética y datos de equilibrio, respectivamente.
REFERENCIAS
• Altun, T. y Pehlivan, E. (2012). Removal of Cr(VI) from aqueous solutions by modified walnut shells. Food Chemistry, 132, 693-700. [ Links ]
• Aravind, J., Muthusamy, S., Sunderraj, S., Chandran, L. y Palanisamy, K. (2013). Pigeon pea (Cajanus cajan) pod as a novel eco-friendly biosorbent: a study on equilibrium and kinetics of Ni(II) biosorption. International Journal of Industrial Chemistry, 4(25), 1-9. [ Links ]
• Asgher, M. y Bhatti, H.N. (2010). Mechanistic and kinetic evaluation of biosorption of reactive azo dyes by free, immobilized and chemically treated Citrus sinensis waste biomaB. Ecological Engineering, 36, 1660-1665. [ Links ]
• Cheng, Z. H., Gao, Z. X., Ma, W., Sun, Q., Wang, B. D. y Wang, X. G. (2012). Preparation of magnetic Fe3O4 particles modified sawdust as the adsorbent to remove strontium ions. Chem. Eng. J., 209, 451-457. [ Links ]
• Dimirkou, A. (2007). Uptake of Zn2+ ions by a fully iron-exchanged clinoptilolite. Case study of heavily contaminated drinking water samples. Water Res, 41, 2763-2773. [ Links ]
• García, B., Arnal, J. y Alandia, S. (2011). Estudio de la descontaminación de efluentes líquidos con elevada concentración de metales pesados mediante bioadsorbentes de Moringa oleífera. XVI Congreso Internacional de Ingeniería de Proyectos. Valencia, España. [ Links ]
• Krishnan, K., Sreejalekshmi, K. y Baiju, R. (2011). Nickel(II) adsorption onto biomaB based activated carbon obtained from sugarcane bagaBe pith. Bioresource Technology, 102, 10239-10247. [ Links ]
• Krishnani, K. K., Meng, X. y Dupont, L. (2009). Metal ions binding onto lignocellulosic biosorbent. J. Environ. Sci. Heal., Part A, 44 (7), 688-699. [ Links ]
• Krishnani, K. K., Meng, X., Christodoulatos, C. y Boddu, V. M. (2008). Biosorption mechanism of nine different heavy metals onto biomatrix from rice husk. J. Hazard. Mater., 153, 1222-1234. [ Links ]
• Kumar, P. S., Ramalingamb, S., Kiruphac, S. D., Murugesanc, A., Vidhyadevic, T. y Sivanesan, S. (2011). Adsorption behavior of nickel(II) onto cashew nut shell: Equilibrium, thermodynamics, kinetics, mechanism and proceB design. Chemical Engineering Journal, 167, 122-131. [ Links ]
• Liang, S., Guo, X., Feng, N. y Tian, Q. (2010). Isotherms, kinetics and thermodynamic studies of adsorption of Cu2+ from aqueous solutions by Mg2+/K+ type orange peel adsorbents. Journal of Hazardous Materials, 174, 756-762. [ Links ]
• Ma, W., Zong, P., Cheng, Z., Wang, B. y Sun, Q. (2014). Adsorption and bio-sorption of nickel ions and reuse for 2-chlorophenol catalytic ozonation oxidation degradation from water. Journal of Hazardous Materials, 266, 19-25. [ Links ]
• Malamis, S. y Katsou, E. (2013). A review on zinc and nickel adsorption on natural and modified zeolite, bentonite and vermiculite: Examination of proceB parameters, kinetics and isotherms. Journal of Hazardous Materials, 252-253, 428-461. [ Links ]
• Njikam, E. y Schiewer, S. (2012). Optimization and kinetic modeling of cadmium desorption from citrus peels: A proceB for biosorbent regeneration. Journal of Hazardous Materials, 213-214, 242-248. [ Links ]
• Pitsari, S., Tsoufakis, E. y Loizidou, M. (2013). Enhanced lead adsorption by unbleached newspaper pulp modified. Chemical Engineering Journal, 223, 18-30. [ Links ]
• Rezvani, A., Jahanshahi, M. y Najafpour, G. D. (2014). Characterization and evaluation of the novel agarose–nickel composite matrix for poBible use in expanded bed adsorption of bio-products. Journal of Chromatography A, 1331, 61-68. [ Links ]
• Saha, B. y Orvig, C. (2010). Biosorbents for hexavalent chromium elimination from industrial and municipal effluents. Coordination Chemistry Reviews, 254, 2959-2972. [ Links ]
• Wu, F. C., Tseng, R. L. y Juang, R. C. (2009). Characteristics of Elovich equation used for the analysis of adsorption kinetics in dye-chitosan systems. Chemical Engineering Journal, 150, 366-373. [ Links ]
• Zhu, Y. Q., Quan, X., Chen, F. J., Fan, X. F. Y. y Feng, J. (2012). CeO2-TiO2 coated catalytic membrane for treatment of tetracycline in drinking water using a combined membrane and ozone system. Sci. Adv. Mater., 4, 1191-1199. [ Links ]
Para citar este artículo:
Tejada Tovar, C., Villabona Ortiz, A. y Ruiz Paternina, E. (2016). Adsorción de Ni (ii) por cáscaras de ñame (Dioscorea rotundata) y bagazo de palma (Elaeis guineensis) pretratadas. Revista Luna Azul, 42, 30-43. Recuperado de http://200.21.104.25/lunazul/index.php?option=com_content&view=article&id=126














