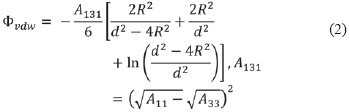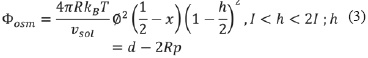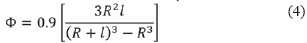Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Entre Ciencia e Ingeniería
Print version ISSN 1909-8367
Entre Ciencia e Ingenieria vol.9 no.18 Pereira July/Dec. 2015
Modelado de la energía de interacción de nanopartículas de sílice preparadas en microemulsiones1
Modeling the interaction energy of silica nanoparticles prepared in microemulsions
D.F. Tirado*, D. Acevedo** y A.P. Herrera***
1 Producto derivado del proyecto de Investigación "Análisis de la Estabilidad Coloidal de Nanopartículas Sintetizadas por el Método de Ultrasonido", perteneciente al Grupo de Investigación Nanomateriales Multifuncionales, adscrito a la Facultad de Ingeniería, Programa de Ingeniería Química de la Universidad de Cartagena, Colombia.
* D.F. Tirado, Investigador Grupo de Investigación NUSCA, MS. (c) Ingeniería Ambiental, Universidad de Cartagena, Cartagena (Colombia); email: dtiradoa@unicartagena.edu.co.
** D. Acevedo, Ph.D Ingeniería de Alimentos, Docente del Programa de Ingeniería de Alimentos, Universidad de Cartagena, Cartagena (Colombia); email: diofanor3000@gmail.com.
*** A. Herrera, Ph.D Ingeniería Química, Docente del Programa de Ingeniería Química, Universidad de Cartagena, Cartagena (Colombia); email: aherrerab2@unicartagena.edu.co.
Recibido Junio 20 de 2015 - Aceptado Septiembre 23 de 2015
Resumen
Se modeló la energía de interacción de nanopartículas de sílice preparadas en microemulsiones de fase orgánica, usando la teoría DLVO para partículas esféricas de igual tamaño. Los surfactantes comerciales seleccionados fueron la sal sódica del sulfosuccinato de bis-(2-etilhexilo) (AOT) y Tritón X-100 [p-(1, 1, 3,3-tetrametilbutil) fenílico] (TX100). Los sistemas coloidales estudiados fueron ciclohexano/ AOT, ciclohexano/TX-100, isooctano/AOT, e isooctano/TX 100. Las curvas de energía total de interacción se construyeron para varios diámetros de nanopartículas en función de su distancia de separación. Los resultados fueron comparados con la energía termal del sistema, encontrando mayor estabilidad coloidal para el modelo de nanopartículas de sílice cubiertas con el surfactante TX-100 y suspendidas en ciclohexano. Por último se esperaría que la combinación de los compuestos químicos ciclohexano/TX-100 permita la formación de micelas inversas que sirvan tanto para la formación de nanopartículas de sílice proporcionando un medio para el control de tamaño, así como un sistema con buena estabilidad coloidal.
Palabras clave: estabilidad coloidal, nanopartículas, sílice, microemulsiones, teoría DLVO.
Abstract
The interaction energy of silica nanoparticles prepared in microemulsions of organic phase was modeled, using the DLVO theory for spherical particles of equal size. For this purpose, the effect of the organic solvent and the surface active agent (surfactant) used for the coating of the nanomaterials was evaluated. The selected commercial surfactants were the sodium bis-(2-ethylhexyl) sulfosuccinate (AOT) and the p-(1, 1, 3, 3-tetramethylbutyl) phenyl (TX-100). The colloidal systems studied were cyclohexane/AOT, cyclohexane/TX-100, isooctane/AOT, and isooctane/TX-100. Curves of total energy contribution were analyzed considering the interaction energy of van der Waals attraction and repulsion energy due to osmotic layer covering surfactant molecules to the nanoparticles. From these analyzes the curves of total energy for several diameters of nanoparticles as a function of their separation distance were built. These results were compared with the thermal energy of the system, indicating greater stability for the colloidal silica nanoparticles model covered with the TX-100 surfactant and suspended in the organic medium cyclohexane. Thus, it could be expected that the combination of the chemical compounds cyclohexane/TX-100 allow the formation of reverse micelles, which serve for the synthesis of silica nanoparticle providing control size, as well as a system with a good colloidal stability.
Key words: colloidal stability, nanoparticles, silica, microemulsions, DLVO theory.
I. INTRODUCCIÓN
La nanotecnología está presente en diferentes campos científicos como las ciencias físicas, químicas, biológicas y de ingeniería, donde se están desarrollando nuevas técnicas para el control de átomos y moléculas [1]. Las nanopartículas en la nanotecnología se definen como pequeños objetos que se comportan como una unidad completa en términos de sus propiedades de transporte y aplicación potencial. Las nanopartículas de la naturaleza ya sean simples o compuestas son materiales que pueden ser utilizados en numerosas aplicaciones físicas, biológicas, biomédicas y farmacéuticas [2].
En el presente trabajo se modeló la estabilidad coloidal de nanopartículas de sílice a partir de la energía de interacción, para un sistema de micelas inversas compuestas por un solvente orgánico y un surfactante con terminaciones hidrofílicas e hidrofóbicas. Para este propósito, se utilizó la teoría DLVO (llamada así por Derjaguin, Landau, Verwey y Overbeek) para calcular la energía de interacción total entre pares de partículas como una función de su tamaño y distancia de separación [3]. Este modelo considera que las nanopartículas de sílice tienen forma esférica y se encuentran cubiertas por una monocapa de moléculas del surfactante, cuya cadena hidrofóbica se extiende completamente al medio orgánico solvente, existiendo así una buena afinidad química entre las moléculas del surfactante y las del solvente.
La energía de interacción total (Φtoral) entre dos nanopartículas se puede calcular a partir de la contribución de las fuerzas de atracción y repulsión [4]. Entre estas, se destaca la fuerza de atracción de van der Waals (ΦvdW), la cual es dependiente del radio de las partículas (Rp), la distancia de separación centro a centro (d), y la constante de Hamaker (A), representando éste último parámetro la atracción partícula-solvente-partícula [5, 6]. Por otra parte, las fuerzas de repulsión consideran principalmente la contribución osmótica (Φosm) proporcionada por las moléculas de surfactantes que rodean a las nanopartículas. El principio de repulsión se basa en el efecto de impedimento estérico que ocurre cuando dos nanopartículas se aproximan, ocasionando el solapamiento de las cadenas de surfactantes y por ende la repulsión de las partículas al no poder ocupar dos moléculas de surfactante un mismo espacio [4].
La energía de interacción total del sistema se representa entonces como la suma de las contribuciones de van der Waals y osmóticas, las cuales pueden modelarse como una función del tamaño de las partículas y su distancia de separación, tal como lo describen las ecuación (1) a (5):
Donde el subíndice 131 en la constante de Hamaker se refiere la atracción partícula-solvente-partícula, representado por los términos A11 (interacción partícula-partícula) y A33 (interacción entre dos moléculas de solvente). En adición, el componente de repulsión osmótica (Φosm) depende de las propiedades termodinámicas del sistema y las características físico-químicas de las moléculas de surfactante y solvente, tales como el volumen molecular del solvente (υsolv), la fracción de volumen ocupado por la molécula de surfactante (ϕ), la temperatura del sistema (T), la constante de Boltzmann (KB = 1.38x10-23JK-1)), la longitud de la cadena de surfactante (l), la distancia de separación partícula-partícula (h), el parámetro de interacción Flory-Huggins (χ), el volumen molar del solvente (υ3 υ3), la constante de los gases ideales (R) y el parámetro de solubilidad de Hildebrand (δi) [5].
Las nanopartículas de sílice (SiO2), están siendo altamente utilizadas en el campo biológico, como medios para producir biosensores, bioimágenes, dispositivos para el diagnóstico de enfermedades e incluso para encapsulación y liberación de fármacos. Este tipo de aplicaciones son posibles teniendo en cuenta que las nanopartículas de sílice son biológicamente inertes, estables y biocompatibles; además la química de las superficies de este tipo de materiales está tan bien documentada desde el punto de vista de reacciones químicas, que es posible realizar modificaciones usando precursores organosilanos que permitan unir de manera covalente cualquier otro grupo funcional a la superficie de las nanopartículas [7]. El tamaño promedio obtenido en algunos estudios para las nanopartículas de sílice varía entre los 25 y 200nm [7, 8, 9].
Se puede modificar el sistema coloidal con el fin de aumentar o disminuir la barrera energética que afecta de manera directa, la estabilidad del sistema. Varios métodos pueden ser usados para este propósito, tales como cambios de solvente y agente tensoactivo utilizado para formar las micelas inversas [7]. Teniendo en cuenta lo anterior, esta investigación tuvo como objetivo principal modelar la energía total de interacción entre nanopartículas de sílice preparadas en microemulsiones para determinar la estabilidad coloidal del sistema según las predicciones de la teoría DLVO. Para esto, se variaron los tipos de solventes orgánicos y agentes tensoactivos que pueden utilizarse en la formación de las nanopartículas por el método de micelas inversas.
II. METODOLOGÍA
A. Materiales seleccionados
Los solventes orgánicos seleccionados fueron Ciclohexano e Isooctano; y los agentes tensoactivos fueron la sal sódica de sulfosuccinato de bis-(2-etilhexilo) (AOT) y p-(1, 1, 3,3-tetrametilbutil) fenílico (TX-100). Estos compuestos químicos fueron escogidos teniendo en cuenta trabajos previos reportados para la síntesis de nanopartículas por el método de micelas inversas [5, 7]. Los sistemas coloidales estudiados fueron Ciclohexano/AOT, Ciclohexano/TX-100, Isooctano/AOT e Isooctano/TX-100. Se analizaron las curvas de contribución de energía total de interacción y las curvas de energía total de interacción en función de la distancia de separación para varios diámetros de partícula. Todas las simulaciones fueron desarrolladas a una temperatura de 25°C (298,15K).
Para este modelo se escogieron nanopartículas de sílice con diámetro de partícula de 30nm, 50nm y 100nm, que son los valores promedio reportados en algunos estudios para las nanopartículas de sílice [7, 8, 9].
B. Fuentes de información
Los datos necesarios en el modelo DLVO para cada sistema coloidal fueron adquiridos de las fuentes mostradas en la Tabla I.
III. RESULTADOS Y DISCUSIÓN
A.1. Sistema Ciclohexano/AOT
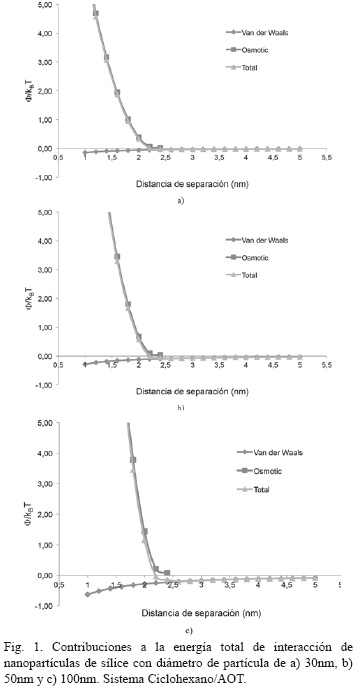
En la Fig. 1, se muestran las contribuciones de las fuerzas de van der Waals y osmóticas a la energía total de interacción para el sistema ciclohexano/AOT, las cuales se calcularon como una función de la distancia de separación entre partículas y el tamaño de las nanopartículas. Con los tamaños de partícula que se observan en la Fig. 1, se evidencia que las interacciones estéricas priman sobre las de van der Waals, lo cual indica que el sistema es estable, al existir impedimento en la unión de las nanopartículas, y por ende evitando su aglomeración y posterior precipitación [12]. A medida que aumentan los tamaños de partículas, se evidencia un aporte de las interacciones de van der Waals, las cuales son responsables de la atracción partícula-partícula. A partir de estos resultados se observó que el punto más bajo de la energía local no alcanza a superar el valor de -1.5KBT, por lo cual puede asumirse que la energía térmica no provoca la aglomeración de nanopartículas para los tamaños evaluados [3].
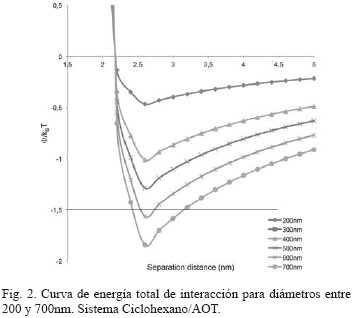
En la Fig. 2 se aprecian las curvas de energía total de interacción para diámetros de partículas comprendidos entre 200 y 700nm. En la Fig. 2, se observa que partículas con tamaños superiores a 500nm exhiben una pobre estabilidad coloidal, la cual puede llevar a la precipitación de las nanopartículas del medio de suspensión [5]. Sin embargo, este es un diámetro de nanopartícula muy grande y poco alcanzado en los métodos de síntesis por micelas inversas [8], [7], [9].
A. 2. Sistema Ciclohexano/TX-100
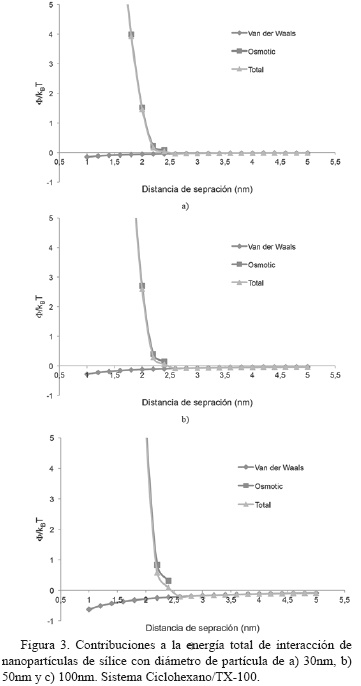
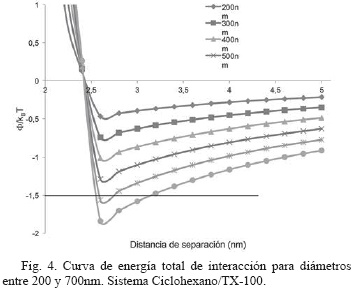
Las curvas de energía total de interacción y las contribuciones de atracción y repulsión del sistema Ciclohexano/TX-100 (Fig. 3 y 4), tienen similar comportamiento a las curvas obtenidas para el sistema Ciclohexano/AOT para el rango de tamaños de nanopartículas de sílice estudiados; aunque se evidencia que el nuevo surfactante ensayado aumenta levemente la estabilidad coloidal del sistema [16].
A. 3. Sistema Isooctano/AOT
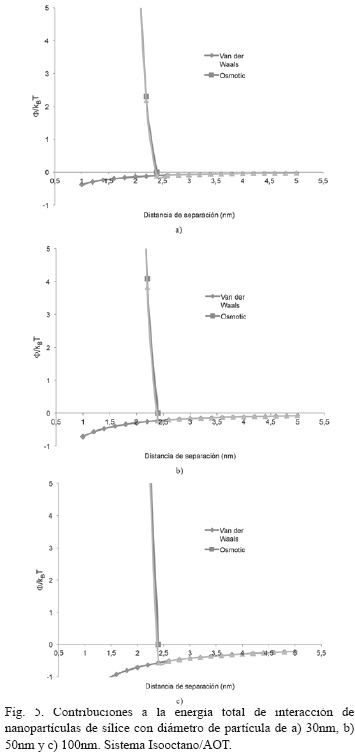
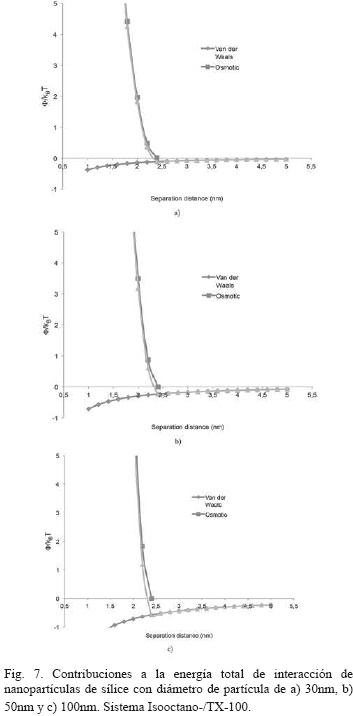
En la Fig. 5, se aprecian las contribuciones a la energía total de interacción de nanopartículas de sílice con diámetro de partícula de 30nm, 50nm y 100nm para el sistema Isooctano/AOT. Se evidencia que el sistema coloidal escogido presentó más contribuciones atractivas con respecto a los sistema Ciclohexano/AOT y Ciclohexano/ TX-100, lo cual podría indicar que el solvente Ciclohexano es el responsable de otorgarle mayor estabilidad coloidal al sistema de nanopartículas de sílice [18] y que además el sistema funciona aún mejor con el TX-100.
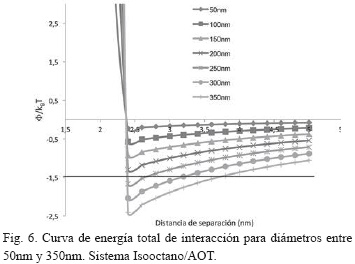
La curva de energía total de interacción para diámetros entre 50nm y 350nm en el sistema Isooctano/AOT (Fig. 6), indican que la estabilidad coloidal se pierde cuando las nanopartículas de sílice alcanzan un diámetro de partícula de 250nm. Este tamaño, sigue siendo muy grande para nanopartículas de este tipo, aunque es menor comparado a los sistemas que involucran al Ciclohexano como solvente, lo cual es un indicio del mejor comportamiento coloidal del solvente Ciclohexano para las nanopartículas de sílice [5, 7].
A. 4. Sistema Isooctano/TX-100
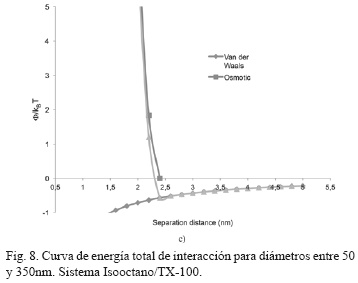
Las Fig. 7 y 8, indican los mismos puntos bajos de energía local (-1.5KBT) para los sistemas Isooctano/AOT e Isooctano/TX-100, pero con diferente recorrido en las curvas estéricas, lo cual da una muestra de un pequeño aporte del nuevo surfactante usado. Lo anterior, concuerda con el sistema anterior, indicando que el mayor carácter hidrofóbico del agente tensoactivo TX-100, mejora la estabilidad del sistema coloidal [17, 19].
IV. CONCLUSIONES
Los resultados de esta investigación señalan que la mayor estabilidad coloidal para el sistema de nanopartículas de sílice se da cuando este nanomaterial es cubierto con el surfactante TX-100 y suspendidas en el solvente orgánico ciclohexano, por lo que se esperaría que la combinación de los compuestos químicos ciclohexano/TX-100 permitan la formación de micelas inversas que sirvan para la formación de nanopartículas de sílice proporcionando un medio para el control de tamaño y un sistema con buena estabilidad coloidal.
AGRADECIMIENTOS
Los autores agradecen a la Universidad de Cartagena por la beca otorgada al Ing. Diego Felipe Tirado para realizar sus estudios de Maestría en Ingeniería Ambiental en la Facultad de Ingeniería de dicha Alma Máter.
REFERENCIAS
[1] K. Margulis-Goshen, and K. Magdassi, Organic nanoparticles from microemulsions: Formation and applications, Current Opinion in Colloid & Interface Science vol. 17, no.5., pp. 290-296, Oct. 2012. [ Links ]
[2] M. Ahmad, M. Younus, and M. Ali, Microemulsion method: A novel route to synthesize organic and inorganic nanomaterials: 1st Nano Update, Arabian Journal of Chemistry, vol. 5, no.4. pp. 397–417, Oct. 2012. [ Links ]
[3] C. Barrera, A. P. Herrera, N. Bezares, E. Fachini, R. Olayo-Valles, J. P. Hinestroza, and C. Rinaldi, Effect of poly(ethylene oxide)-silane graft molecular weight on the colloidal properties of iron oxide nanoparticles for biomedical applications, Journal of colloid and interface science, vol. 377, no.1., pp. 40-50. Jul. 2012 [ Links ]
[4] S. R. Rao, Surface Chemistry of Froth Flotation, Vol. I, New York, Fundamentals Springer Science & Business, Kluwer Academic/ Plenium Publishers, 2013, pp. 15-17. [ Links ]
[5] A. Herrera, O. Resto, J. G. Briano, and C. Rinald, Synthesis and agglomeration of gold nanoparticles in reverse micelles, Nanotechnology, vol. 16, no.7., pp. 618-625, Jun. 2005. [ Links ]
[6] C. H. Achebe, and S. N. Omenyi, Mathematical Determination of the Critical Absolute Hamaker Constant of the Serum (As an Intervening Medium) Which Favours Repulsion in the Human Immunodeficiency Virus (HIV)-Blood Interactions Mechanism, Proceedings of the World Congress on Engineering Vol II, London, U.K, 2013. [ Links ]
[7] N. Jaramillo, C. Paucar, and C. García, Influence of the reaction time and the Triton x-100/Cyclohexane/Methanol/HO ratio on the morphology and size of silica nanoparticles synthesized via sol-gel assisted by reverse micelle microemulsion, Journal of Materials Science vol. 49, no.9, pp. 3400-3406, May. 2014. [ Links ]
[8] K. In-Yong, E. Joachim, H. Choi, and K. Kim, K, Toxicity of silica nanoparticles depends on size, dose, and cell type. Nanomedicine: Nanotechnology, Biology and Medicine vol. 11, no.6, pp. 1407–1416. Aug. 2015. [ Links ]
[9] M. C. Llinás, and D. Sánchez-García, Nanopartículas de sílice: preparación y aplicaciones en biomedicina, Afinidad vol. 71, no.565, pp. 20-31, Dic. 2014. [ Links ]
[10] V. Médout-Marére, A Simple Experimental Way of Measuring the Hamaker Constant A11 of Divided Solids by Immersion Calorimetry in Apolar Liquids, Journal of Colloid and Interface Science, vol. 228, no.2, pp. 434–437, Aug. 2000. [ Links ]
[11] S. Eichenlaub, C. Chan, and S. P. Beaudoin, Hamaker Constants in Integrated Circuit Metalization, Journal of Colloid and Interface Science, vol. 248, pp. 389–397, Apr. 2002. [ Links ]
[12] J. B. Rosenholm, K. E. Peiponen, and E. Gornov, Materials cohesion and interaction forces, Advances in Colloid and Interface Science, vol. 141, no.(1–2), pp. 48–65, Sep. 2008 [ Links ]
[13] T. F. Tadros, Rheology of Dispersions Principles and Applications, Wiley-VCH, United Kingdom, 2011, p. 25. [ Links ]
[14] R. Porcel, A. B. Jódar, M. A. Cabrerizo, R. Hidalgo-Alvarez, and A. Martín-Rodríguez, Sequential Adsorption of Triton X-100 and Sodium Dodecyl Sulfate onto Positively and Negatively Charged Polystyrene Latexes, Journal of Colloid and Interface Science, vol. 239, pp. 568–576, Jul. 2001. [ Links ]
[15] M. A. La-Scalea, C. M. S. Menezes, and E. I. Ferreira, Molecular volume calculation using AM1 semi-empirical method toward diffusion coefficients and electrophoretic mobility estimates in aqueous solution, Journal of Molecular Structure: THEOCHEM, vol. 730, no.1, pp. 111-120, Oct. 2005. [ Links ]
[16] A. R. Mustafina, J. G. Elistratova, O. D. Bochkova, V. A. Burilov, S. V. Fedorenko, A. I. Konovalov, and S. Y. Soloveva, "Temperature induced phase separation of luminescent silica nanoparticles in Triton X-100 solutions," Journal of colloid and interface science, vol. 354, no.2, pp. 644-649. Feb. 2011. [ Links ]
[17] L. P. Singh, S. K. Bhattacharyya, R. Kumar, G. Mishra, U. Sharma, G. Singh, and S. Ahalawat, Sol-Gel processing of silica nanoparticles and their applications. Advances in colloid and interface science, vol. 214, pp. 17-37, Dec. 2014. [ Links ]
[18] C. Barrera, A. P. Herrera, and C. Rinaldi, "Colloidal dispersions of monodisperse magnetite nanoparticles modified with poly (ethylene glycol)," Journal of colloid and interface science, 329(1), 107-113, Jan. 2009. [ Links ]
[19] A. A. Araújo, E. L. Barros, O. C. Filho, y E. L. Foletto, "Determinación de los parámetros del modelo de flory-huggins para estimación del punto de nube de surfactantes no iónicos," Información Tecnológica, vol. 25, no.2, pp. 165-174, Dic. 2014. [ Links ]
Diofanor Acevedo Correa es Químico e Ingeniero de Alimentos de la Universidad de Cartagena-Colombia. Especialista en Ciencia y Tecnología de Alimentos, Universidad Nacional (Colombia). Ph.D Ingeniería de Alimentos Universidad del Valle-Colombia. Actualmente es Docente de planta de la Universidad de Cartagena e Investigador del grupo NUSCA. Correo electrónico: .
Diego Felipe Tirado Armesto es Ingeniero de Alimentos de la Universidad de Cartagena-Colombia. MS.c (c) Ingeniería Ambiental, Universidad de Cartagena. Desde el 2012 hace parte del Grupo de Investigación Nutrición. Calidad y Salud Alimentaria (NUSCA). Correo electrónico: .
Adriana Herrera Barros es Ingeniera Química de la Universidad del Atlántico-Colombia, Magister y Ph.D en Ingeniería Química, Universidad de Puerto Rico, Mayagüez. Actualmente es Docente de Planta de la Universidad de Cartagena, Jefa del Departamento de Investigaciones de la Facultad de Ingeniería y Líder del Grupo de Investigación Nanomateriales Multifuncionales. Correo electrónico: .