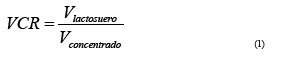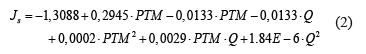I. INTRODUCCIÓN
El lactosuero (LS) es el fluido que se separa de la cuajada en la fabricación del queso o productos similares [1]. Aproximadamente 90% del total de la leche utilizada en la elaboración del queso se elimina como LS, siendo este uno de los materiales más contaminantes que existen en la industria alimentaria. El alto poder contaminante deriva del elevado contenido de materia orgánica, y es su riqueza en lactosa la principal responsable del mismo, debido a su capacidad para actuar como sustrato de fermentación microbiana [2]. La Demanda Bioquímica de Oxígeno (DBO) del LS varía entre 20 000 y 50 000 mg de O2/L [3]. En otras palabras, cerca de 250 a 300 mL de suero sin depurar equivale a las aguas negras producidas en un día por una persona [4,5].
Por esta razón, los gobiernos de varios países exigen a las industrias de derivados lácteos una producción limpia [6], y las políticas gubernamentales son cada vez más estrictas al respecto [7-9]. Sin embargo, para Jelen [5] esta preocupación por la producción ecológica de los alimentos e ingredientes alimentarios puede ser una posible oportunidad para la revitalización de algunos procesos de transformación de LS, abandonados en el pasado debido a la no viabilidad económica [9].
Por otra parte, existe suficiente evidencia científica que respalda las muchas propiedades físicas, químicas, nutricionales y biológicas de las proteínas y otros componentes del LS [10]. Si se considera como alimento, su valor nutritivo es elevado. Este producto retiene cerca de 55% del total de ingredientes de la leche como la lactosa, proteínas solubles, lípidos, vitaminas y sales minerales [1,11]. Esto ha generado un interés particular por la inclusión del LS en diversos productos alimenticios [12].
Paralelamente, el mercado es cada vez más sofisticado y receptivo a la utilidad de los componentes del LS. Esto ha hecho que actualmente sea el coproducto de la industria láctea de mayor importancia y su producción mundial crezca más del 2% anual [10]. De sus componentes, las proteínas del LS presentan un interés particular por su composición en aminoácidos esenciales y sus excelentes propiedades funcionales [13].
El LS debe su reconceptualización de desecho a coproducto, a la tecnología de membranas (TM). Mediante la aplicación de la TM, principalmente la ultrafiltración (UF), el LS se puede concentrar para producir proteínas concentradas de suero (Whey Protein Concentrates - WPC) y aislados proteicos de suero (Whey Protein Isolates - WPI), así como fraccionar y purificar para obtener α-lactoalbúmina (α-La) y β-lactoglobulina (β-Lg) [14,15]. Por tanto, las proteínas de suero son una fuente considerable de ingresos para las compañías lácteas [16]. En este sentido, el objetivo de la presente revisión es exponer la ventaja de utilizar la TM en la obtención de proteínas de LS.
II. LACTOSUERO
La cantidad y composición del LS es muy variable ya que depende de diversos factores, por ejemplo: 1) El tipo de queso (4 L/kg de queso en quesos frescos y hasta 11,3 L/kg de queso para quesos madurados); 2) el tratamiento térmico de la cuajada que puede disminuir el porcentaje de proteína del suero resultante; 3) la forma de coagulación (ácida o enzimática); 4) el cuajo empleado (microbiano. quimosina o mezclas quimosina/pepsina), que aporta amargor residual al LS por inactivación incompleta de las enzimas proteolíticas [17].
De acuerdo con el origen se clasifica en: LS dulce, es el líquido sobrante de la precipitación de las proteínas por hidrólisis específica de la k-caseína, por coagulación enzimática. Con pH próximo al de la leche inicial y sin variación de la composición mineral. El LS ácido, es el líquido sobrante obtenido después de la coagulación ácida o láctica de la caseína. Presenta un pH cercano a 4,5 debido a la producción de ácido láctico y alto contenido de minerales (más del 80% de los minerales de la leche de partida) [9].
De forma general, el LS contiene los componentes solubles de la leche. En el caso del queso fresco: 4,9% de lactosa, 0,9% de proteína, 0,6% de cenizas y 0,3% de grasas, de 6 a 7 g/kg de proteínas [18-22].
A. Proteínas séricas
Las principales proteínas séricas son altamente estructuradas y, por lo tanto, son susceptibles de ser desnaturalizadas. Están divididas en, aproximadamente: 55 - 65% β-Lg; 15 - 25% α-La; 10 - 15% inmunoglobulinas; 5 - 6% seroalbúmina (BSA); 10 - 20% proteosas-peptonas; una pequeña cantidad de caseína soluble (1 - 2%), proteínas menores (<0,5%) y algunos péptidos [18-23]. Sus usos son diversos, por ejemplo: β-Lg se puede usar como emulsificante, espumante y gelificante; α-La tiene varias aplicaciones farmacéuticas, se agrega a las fórmulas infantiles, puede reemplazar la albúmina de huevo en los productos alimenticios; se utiliza como aditivo en bebidas energéticas o en productos a base de carne y pescado; la BSA (66 kDa) puede usarse como espumante y gelificante en alimentos para humanos; la lactoferrina (86 kDa) se agrega a las fórmulas infantiles, se utiliza en cosméticos para la protección de la piel y como antibacteriano en el conservante de la carne y en la alimentación parenteral [16], [24-27].
1. Lactoglobulina
La β-Lg es la proteína más abundante en el LS bovino, en el que alcanza concentraciones de 2 a 4 mg/mL, representando alrededor de la mitad de las proteínas del LS. En términos de masa, constituye cerca del 50% de las proteínas del LS. Está presente también en la leche de otras especies, como la equina y la porcina, pero no se encuentra en la leche humana. Está formada por una sola cadena de 162 aminoácidos, con un peso molecular aproximado de 36 kDa, en forma de dímero. Su secuencia se conoce desde 1976. La β-Lg en su estructura nativa, presenta capacidad de retención de agua muy moderada, del orden de 0,04 g/g de proteína [16], [28], [29].
La β-Lg de los rumiantes (no así la de otras especies) se presenta en forma de dímeros con los monómeros unidos de forma no covalente. Estos dímeros se forman entre pH 7,5 y pH 5,2, el punto isoeléctrico de la β-Lg. Por encima de pH 7,5 y por debajo de pH 3,5, la β-Lg se encuentra en forma de monómeros, mientras que entre pH 5,2 y pH 3,5 se encuentra en forma de octámeros [16], [28], [29].
La estructura terciaria de los monómeros de la β-Lg es mantenida por dos puentes disulfuro. También existe un grupo tiol libre, el correspondiente a la cisteína que ocupa el lugar 121 en la secuencia. Este tiol es muy importante en la asociación de la -Lg con otras moléculas, especialmente con la κ-caseina. Esta asociación tiene una gran influencia en la coagulación de la leche inducida por la quimosina. Los puentes disulfuro son también bastante reactivos, y dan lugar a reacciones de intercambio de sulfidrilos. La β-Lg se desnaturaliza con relativa facilidad por el calor, especialmente en ausencia de ligandos asociados [16], [28], [29].
La β-Lg es capaz de interaccionar con distintas moléculas hidrofóbicas, especialmente el retinol y los ácidos grasos. Esta propiedad, además de estar probablemente relacionada con su función biológica, hace que tenga buenas propiedades emulsionantes. Además, la β-Lg es la más hidrofóbica de las proteínas comunes del LS [16], [28], [29].
2. Lactoalbúmina
La α-La es una proteína que se encuentra en la leche de casi todas las especies. Esta proteína constituye cerca del 20% de la masa de las proteínas del LS. Es la segunda proteína en concentración en el LS bovino (entre 1 y 1,5 mg /mL), y la más abundante en el LS humano. La α-la es una proteína formada por una sola cadena polipeptídica de 123 componentes aminoacídicos. Contiene cuatro puentes disulfuro y es una glicoproteína que tiene cantidades variables de carbohidrato. Su estructura terciaria, muy compacta, globular, es mantenida por los puentes disulfuro, con una zona de hélice α y otra de hojas plegadas β. Es una proteína ácida con un punto isoeléctrico de alrededor de 4,8. Tiene un peso molecular aproximado de 14 kDa. Es mucho más flexible, aunque sus puentes disulfuro la mantienen en forma de un elipsoide compacto. Tiene mayor capacidad de retención de agua (0,06g/g de proteína) [29,30]
La α-La tiene un ion calcio unido, que es imprescindible en el mantenimiento de su estructura y de su actividad como reguladora de la galactosiltransferasa. La eliminación del calcio produce la estructura llamada "molten globule", un estado intermedio que ha sido muy utilizado como modelo en la desnaturalización de proteínas. Este estado, con la proteína en forma "apo", es mucho menos resistente que la forma saturada con calcio a agentes desnaturalizantes, como el calentamiento [29,31].
III. TECNOLOGÍA DE MEMBRANAS
La TM es un método de filtración de solutos disueltos en un fluido, cuyo fundamento es la separación por la diferencia de los pesos moleculares y el tamaño de partícula. La industria láctea ha utilizado el procesamiento de membranas desde su introducción en la industria alimentaria, a fines de la década de 1960, para clarificar, concentrar y fraccionar una variedad de productos lácteos [14]. El uso de UF y ósmosis inversa para concentrar LS fue una de las primeras aplicaciones de membranas en esta industria [15].
A. Microfiltración (MF)
La MF separa partículas con un tamaño comprendido entre 0,05 y 10 µm, a presiones comprendidas entre los 0,5 y 3 bar. Usualmente se usa para retener sólidos en suspensión, por lo tanto, se emplea como etapa de limpieza, de concentración o como pretratamiento [32]. La MF, en ciertas circunstancias, permite eliminar completamente bacterias y esporas (de tamaño: ⁓0,4 a 2 μm) de la leche y derivados lácteos para extender su vida útil, convirtiéndose en una alternativa a la ultrapasteurización [33,34]. Al aplicar la MF se puede: 1) Trabajar a temperatura más baja y, por lo tanto, evitar el sabor a cocido que se produce en el procesamiento UHT de productos lácteos de larga duración. 2) Eliminar células muertas con sus enzimas potencialmente activas que pueden causar alteraciones en las leches líquidas durante el almacenamiento [35]. 3) Aplicarse en la producción de derivados lácteos, por ejemplo, se utiliza para eliminar bacterias, esporas y grasa en la producción de WPC y WPI, logrando productos de alta calidad. Además, al aplicar MF, el tratamiento térmico del WPC y WPI se mantiene al mínimo, lo que preserva las propiedades funcionales (gelificantes, emulsionantes y espumantes) de las proteínas del LS [15].
Por otra parte, la presencia de grasa en el LS disminuye las propiedades funcionales y vida de anaquel. Para eliminar la grasa residual del LS se han desarrollado varios métodos [36]. El proceso más común aprovecha la capacidad de los fosfolípidos para agregarse en presencia de calcio, bajo un tratamiento térmico moderado durante 8 min a 50°C. Este proceso se denomina precipitación termocálcica. El LS desgrasado se obtiene como permeado de MF utilizando membranas con un tamaño de poro de 0,14 mm [37]. El retenido, rico en fosfolípidos, puede usarse como agente emulsionante en alimentos y cosméticos. El WPC desgrasado tiene una capacidad de espuma similar a la de la clara de huevo y el mismo contenido de proteína. Sus aplicaciones pueden ser como materia prima en la producción de pasteles y helados [12].
B. Ultrafiltración (UF)
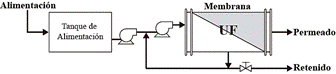
La UF es un proceso de separación a través de membranas de poros muy finos cuyo rango está entre 10 y 1000 Å [38]. La UF permite concentrar grandes moléculas y macromoléculas de peso molecular entre 1 y 200 kDa, entre las que se encuentran las del LS (ver Fig. 1); por lo cual la membrana tiene un diámetro aproximado de poro de 0,01µm [39].
El límite del peso molecular de la membrana se define como el peso molecular de las proteínas globulares que son retenidas en un 90% por la membrana. La regla general (regla del dedo pulgar) es que la masa molecular debe diferir por un factor de 10 para lograr una buena separación [40]. Las moléculas que no atraviesan la membrana se conocen como material retenido o concentrado. Los materiales disueltos de bajo peso molecular pasan a través de la membrana por acción de una fuerza impulsora de presión hidrostática relativamente baja (100 - 1000 kPa); esta corriente que se forma se conoce como permeado o filtrado [41]. La UF se ha empleado con éxito en el fraccionamiento de leche, suero y proteínas [42-44].
Por ejemplo, el permeado de la MF puede procesarse por UF para producir WPC de alta calidad. Estos concentrados de proteínas se pueden separar adicionalmente en lactoferrina, β-Lg y α-Lb mediante cromatografía de intercambio iónico. Tanto la β -Lg como la a-La tienen grandes mercados potenciales. La β -Lg puede usarse como un agente gelificante y la a-La, que es rica en triptófano, puede usarse en la producción de péptidos con propiedades fisiológicas. Otra aplicación puede ser la producción de leche para bebés [15].
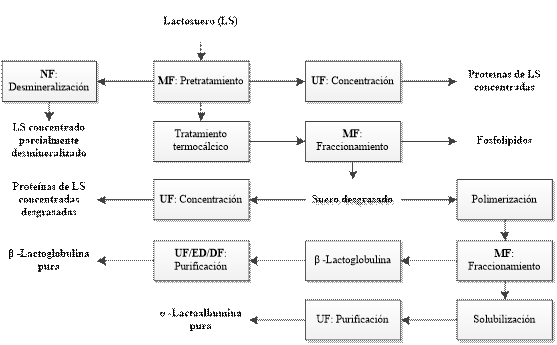
Sin embargo, debido a la complejidad del LS, es necesario usar diferentes procesos de TM y otras operaciones unitarias para producir un producto específico, como se observa en la Fig. 2, elaborada con base en [15], [45]. Por ejemplo, la producción de WPC con 35-85% de proteína en el total de sólidos puede lograrse mediante la combinación de UF y Diafiltración (DF). Por otra parte, es posible mejorar la selectividad de un proceso de UF de LS ajustando el pH y el contenido de sal para influenciar la interacción electrostática y estérica [16].
C. Nanofiltración (NF)
La NF separa partículas con diámetro de poro inferior a 0,001µm (1nm). Retiene lactosa y otros componentes de gran tamaño, permitiendo permear solo iones minerales monovalentes y agua [46]. La NF permite concentrar y desmineralizar parcialmente el LS líquido. Debido a la selectividad de las membranas, la mayoría de los iones monovalentes, los ácidos orgánicos y parte de la lactosa pasarán a través de la membrana. Aproximadamente, el nivel máximo de desmineralización es del 35% de reducción del contenido de ceniza con un factor de concentración de 3,5 a 4,0. Al aplicar un paso de DF es posible aumentar el nivel de desmineralización hasta en un 45%. [15]. Un beneficio adicional de la NF es que reduce el consumo de energía y el producto de desmineralización parcial se puede secar por pulverización y usarse como aditivo alimentario o en la formulación de piensos [16].
IV. OBTENCIÓN DE α-la y β-lg A PARTIR DEL Ls
La obtención de las proteínas y péptidos del LS puede lograrse mediante la separación de sus solutos disueltos por medio de una membrana de UF. En la literatura científica se presentan diversas configuraciones y tipos de membranas utilizadas, pero el empleo de metodologías diferentes conduce a que los rendimientos en el permeado y retenido varíen. Sin embargo, los factores críticos del método de UF, tales como la presión transmembranaria (PTM), el pH y la temperatura deben ser siempre valores muy similares en cualquier proceso de fraccionamiento. En la Fig. 3 se presenta un diagrama general de flujo de la UF de LS, modificado de [47], [48]. . En esta se observa que el permeado se retira continuamente y parte del retenido es recirculado continuamente durante el proceso.
De acuerdo con [15], las proteínas purificadas de α-La y β-Lg pueden obtenerse a partir del LS desgrasado, a un pH bajo (4,0 a 4,5) y un tratamiento térmico moderado durante 30 min a 55°C. Con este tratamiento la α-La polimeriza de forma reversible atrapando a la mayoría de los lípidos residuales y otras proteínas del LS, con la excepción de la β-Lg. El fraccionamiento de la β-Lg a partir de las proteínas restantes se puede realizar mediante MF con un tamaño de poro de 0,2 mm o por centrifugación. La fase soluble resultante, rica en β-Lg, puede purificarse adicionalmente mediante UF junto con electrodiálisis (ED) o DF. La purificación de α-La del retenido de MF puede lograrse mediante solubilización a pH neutro y posterior UF usando una membrana con un MWCO (Molecular weight cut-off) de 50 kDa.
Según [49], se pueden fraccionar las proteínas del LS mediante membranas de electro-acidificación bipolar (BMEA), sometiendo una dilución de proteína aislada de suero (WPI), de pH entre 6,8 - 7 a un proceso de acidificación química o electroquímica; donde se obtiene un precipitado que luego de ser centrifugado durante 10 min a 4°C a 500×g, y liofilizado durante 24 h, se almacena a 4°C antes de determinar la cantidad total de proteínas. La muestra se analiza mediante la técnica de cromatografía líquida de alta eficacia (HPLC), donde se demuestra la facilidad con la que la BMEA separa las proteínas del suero, ya que con una concentración inicial de WPI al 5% se puede separar una fracción del 98% de β-Lg pura, mientras que con una WPI del 10% se puede separar una fracción del 97,3% de β-Lg y 2,7% de α-La, para una pureza total del 98%.
Muchos trabajos de investigación han centrado sus esfuerzos en encontrar la mejor relación a la cantidad de péptidos obtenidos con TM. Por ejemplo, [50] propuso el método de circulación en ambos sentidos (flujo contracorriente) con el fin de lograr extraer en una sola corrida los componentes requeridos; a esta técnica la denominó HPTTF (High-performance tangential flow filtration). Lo novedoso de este procedimiento fue que el autor no usó membranas modificadas y, por tanto, sus resultados fueron sustentados tan solo en el ajuste del pH al punto isoeléctrico de la proteína requerida.
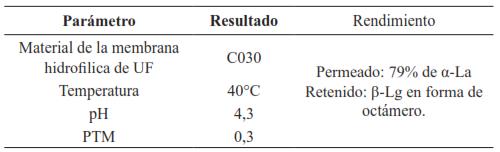
Por su parte, Metsämuuronen y Nyström [51] obtuvieron mejores resultados que Zydney [50]. Los parámetros usados por ellos se resumen en la Tabla I. De esta investigación se llegó a la conclusión que la baja PTM favorece el proceso de filtración, ya que reduce la incidencia del fenómeno de polarización por concentración, y garantiza un flujo semiconstante de permeado.
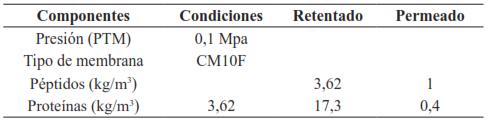
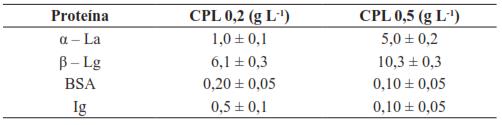
Sin embargo, Lucas, et al. [52] demostraron que se puede separar la α-La de la β-Lg, a partir de proteínas concentradas de suero (WPC 90%) mediante una membrana inorgánica de UF modificada químicamente con polietilenimina (40000 g mol-1) a pH neutro. Dicha membrana adquiere una carga iónica positiva que le permite interaccionar fuertemente con la β-Lg; pudiendo así separarla de la α-La. En la Tabla II se presenta la concentración de proteínas obtenida, según Lucas, et al. [52].
Tabla II Concentración de proteínas en la alimentación (CPL), luego del pre tratamiento en polvo (CPL 0.2) o líquido (CPL 0.5)
De igual forma, Konrad y Kleinschmidt [53], a partir de LS dulce, lograron extraer α-La, entre el 36 y el 44% de pureza, luego de someter la corriente de alimentación a procesos previos de separación, tal como DF. Las variables de proceso usadas fueron pH de 6,7, temperatura de 45°C y PTM de 2 bares; la investigación concluyó que el pH es el factor determinante en el aislamiento de la proteína en cuestión, resultando congruente con los reportados por Almécija, et al. [54] y Lucas, et al. [52].
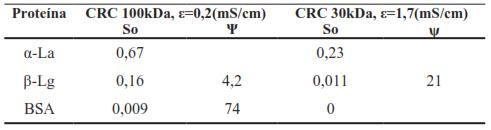
Por su parte, Cheang y Zydney [55], evaluaron una forma diferente de obtener proteínas y péptidos usando membranas de UF y DF de 30 y 100 kDa, respectivamente, ordenadas en serie, con las cuales lograron obtener una buena cantidad de proteínas. Estos resultados se muestran en la Tabla III.
Donde ε, es la conductividad; BSA, es la albumina bobina sérica; ψ es la selectividad y So es el coeficiente de tamizado.
Con estos antecedentes, en algunas investigaciones posteriores combinaron técnicas de filtración para establecer cuál de estas ofrecen mejores resultados en el aprovechamiento de los péptidos. Por ejemplo, Butylina, et al. [56] trabajaron usando los métodos de UF y la NF. Concluyeron que hay mayor cantidad de péptidos en el retenido que en el permeado. En la Tabla IV se presentan los resultados obtenidos por estos autores:
Asimismo, Kanani, et al. [57] estudiaron la influencia de la forma de los poros con la cantidad de proteínas permeadas. Establecieron que los poros en forma de rejilla en el proceso tienen mayor coeficiente de tamizado y menor resistencia al flujo, que los poros en forma cilíndrica, y que entre mayor sea la distribución de estos, menor será la selectividad de la membrana. Con lo cual sienta un precedente en la elección del tipo de membrana a usar y de los parámetros más adecuados para garantizar un buen rendimiento en los procesos de obtención.
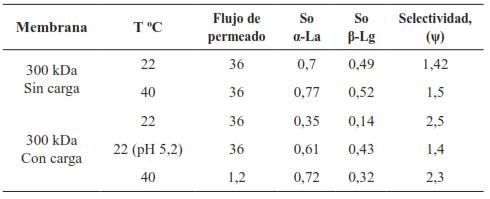
Sin embargo, Arunkumar y Etzel [58] concluyeron que la mejor condición para fraccionar α-La de la β-Lg es a pH de 4,3 y conductividad de 8 mS/cm (ψ=5,7), usando una membrana de 300 kDa de carga positiva, porque el punto isoeléctrico (5,2) de la β-Lg es más grande que el de la α-La (4,4). Adicionalmente, la β-Lg lleva una carga neta positiva a pH de 4,3, mientras que la carga de la α-La es cercana a cero, ello hace que preferiblemente la α-La permee la membrana y la β-Lg sea retenida. De otro modo, observaron que la selectividad aumenta con la conductividad que se atribuye a la diferencia entre la carga neta de la α-La y β-Lg, requiriendo mayor cantidad de sal para aumentar el coeficiente de tamizado de la β-Lg comparado con la α-La. Sus resultados se muestran en la Tabla V.
V. EJEMPLO PROCESO DE OBTENCIÓN DE LAS PROTEÍNAS
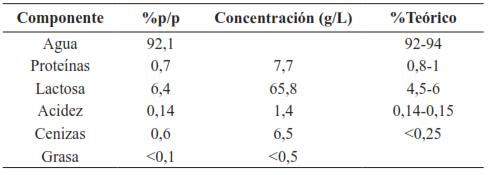
A manera de ejemplo de un proceso de UF, se presenta el proceso de obtención de proteínas de LS realizado en la Universidad del Valle, por [59], quien empleó una membrana de 10 kDa con un área de filtración de 0,5 m2. Para el proceso de UF preparó 18 L de LS con 1500 g de LS deshidratado, obteniendo la siguiente composición:
En la investigación se empleó un diseño experimental central compuesto de dos factores (Q y TMP) y dos niveles por cada factor (Q: 200 L/h, 300 L/h) y (TMP: 10 psi, 20 psi), además de tres réplicas en el punto central, realizadas de forma intercalada (una al inicio, otra en la parte central y la última al final de la experimentación), para asegurar la replicabilidad de los resultados.
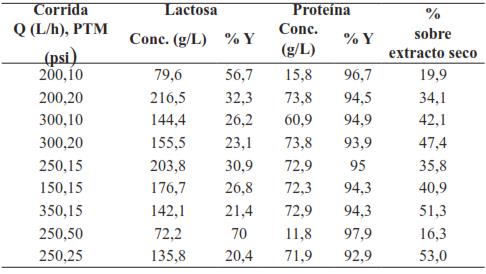
El procedimiento consistió en hacer pasar la corriente a través del sistema de UF compuesto por un módulo de filtración Pellicon de Millipore que contiene un casette de membranas planas (17,8 cm de ancho, 21 cm de largo, 2,16 cm de grosor) Biomax de polietersulfón modificado, dispuestos en paralelo y separados por pantallas de polipropileno, hasta obtener un VCR de 10, es decir, hasta que el volumen del concentrado fue una décima parte del volumen inicial del lactosuero (16,2 L de permeado y 1,8 L de concentrado), obteniendo las fracciones de permeado y retenido. La primera fue una solución de coloración amarillo-verdoso (debido a la presencia de vitamina B2), traslúcida y de apariencia y consistencia similar a la del agua, mientras que el retenido o concentrado presentó mayor viscosidad y una consistencia similar a la de la leche, pero menos traslúcido que la solución original; es en esta donde se encuentran principalmente las proteínas del LS α-La y β-Lg, ya que son las más abundantes, tienen pesos moleculares ligeramente mayores al corte de la membrana, pero menores al criterio que garantiza una retención absoluta. En la Tabla VII se presentan los valores de concentración de lactosa y proteínas obtenidas por Murcia Muñoz [59].
Como se observa, la concentración de proteínas (g/L) obtenida es superior a la encontrada en la solución inicial de LS que fue de 7,7 (g/L). No obstante, ya que los resultados anteriores fueron obtenidos con una reducción del volumen concentrado (VCR) de 10, es decir, hasta que el volumen del concentrado fue una décima parte del volumen inicial del LS (16,2 Lpermeado y 1,8 Lconcentrado) y el Js (flujo de permeado) no fue un valor constante, el autor decidió ajustar el VCR a 6, con el fin de alcanzar un valor constante en el valor del flujo asumiéndolo como flujo en estado estacionario. A continuación, se muestra la ecuación que representa el VCR.
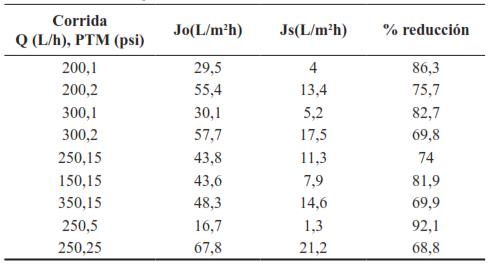
En la Tabla VIII se presenta el valor de Js para cada corrida, el porcentaje de reducción del flujo desde el flux inicial hasta Js., donde las condiciones ideales de procesamiento serían aquellas que representen un valor de Js alto y un porcentaje de reducción del flujo bajo, de acuerdo con Murcia Muñoz [59].
Tabla VIII Cambio del flujo en estado estacionario (Js) con las condiciones de proceso. J0 representa el valor del flujo en t = 0.
Finalmente, con los datos anteriores ajustado a un modelo de regresión cuadrático con R2 de 99,5%, establece que la variable con mayor efecto sobre la respuesta fue la PTM, seguido del caudal de alimentación y el efecto de las dos variables combinadas, representado en la siguiente ecuación:
Con la que obtuvo que la mejor combinación presión vs velocidad de flujo a 25 Psi es 350 L/h, con un valor de Js de 28 L/m2h (flujo relativamente alto).
VI. CONCLUSIONES
La UF es una interesante alternativa en el proceso de separación de proteínas y péptidos del LS, componentes que presentan funcionalidad nutricional y tecnológica. Sin embargo, para lograr mejores resultados se debe: acompañar de otras TM 9MF, NF, ED, DF), seleccionar el tipo de membrana de UF a utilizar, y ajustar las mejores condiciones de presión transmembranaria, pH y temperatura.