I. INTRODUCCIÓN
El sistema energético global debe completar una transición a un sistema descarbonizado para reducir las emisiones de gases de efecto invernadero y mitigar el cambio climático [1,2]. Los combustibles fósiles convencionales han contribuido a suplir la demanda mundial de energía primaria, pero su consumo se considera insostenible debido a la acumulación acelerada de gases de efecto invernadero en la atmósfera que ya ha superado el umbral "peligrosamente alto" de 450 ppm de CO2. Esto genera diferentes desafíos ambientales, incluido el calentamiento global, la pérdida de biodiversidad, el retroceso de los glaciares, el aumento del nivel del mar, etc. [3].
A partir de lo anterior, con el aumento de la demanda y los precios de la energía, y la implementación de políticas para la reducción del calentamiento global, las fuentes de energía renovable se han popularizado [4]. Dentro de esas fuentes de energía renovables, los biocombustibles, tales como el bioetanol, biodiésel o biohidrógeno, obtenidos a partir de materias primas renovables, podrían ser el reemplazo de combustibles no renovables [5].
Los biocombustibles se clasifican en tres grupos: Los de primera generación obtenidos a partir de cultivos alimentarios y oleaginosos mediante métodos mecánicos, químicos y biológicos. Los de segunda generación producidos a partir de cultivos lignocelulósicos no comestibles, desechos orgánicos y básicamente cualquier residuo rico en carbohidratos mediante el uso de microorganismos. Finalmente, los de tercera generación producidos por microalgas, gracias a la conversión de energía solar a energía química a través de la fotosíntesis. Entre estos biocombustibles se encuentran el biodiésel elaborado a partir de lípidos acumulados en el interior de las células y, más recientemente, el biohidrógeno [6,7]. El biohidrógeno tiene ventajas respecto a los combustibles fósiles: alta eficiencia de conversión, reciclabilidad, naturaleza no contaminante y producción de alta cantidad de energía. Así mismo, se puede usar directamente en motores de combustión interna o en pilas de combustible para la producción de electricidad [7].
Justamente, las microalgas tienen alta capacidad para acumular lípidos y altos rendimientos fotosintéticos; del 3% al 8% de la energía solar se puede convertir en biomasa, mientras que los rendimientos observados para las plantas terrestres son del 0,5% [8]. Además, se pueden usar como materias primas para la fabricación de biocombustibles [9]. Por otro lado, presentan ventajas adicionales como la capacidad de crecer 5 - 10 veces más rápido que los cultivos terrestres; pueden cultivarse en áreas no agrícolas, inclusive en aguas residuales ricas en nutrientes sin que haya competencia por el agua dulce; y ayudan a disminuir los niveles de CO2 atmosférico [10,11]. Así, las microalgas tienen un gran potencial para la generación de biohidrógeno junto con un sistema eficiente de captura de carbono [9,12]. Sus desventajas son las bajas tasas de producción, la baja eficiencia de conversión del sustrato y la acumulación de metabolitos intermedios ricos en ácido del proceso acidogénico [13].
En este trabajo se presenta una revisión de la literatura sobre la implementación de biohidrógeno a partir de microalgas en el mundo y en Colombia. Se realizó una búsqueda exhaustiva en las bases de datos de Science Direct y Springer Link, haciendo una clasificación según el número de citas. La mayoría de las fuentes corresponden a artículos científicos actuales, pero también se consultaron libros. A partir de la información, se discuten los mecanismos de producción; factores que afectan al proceso, técnicas para incrementar la producción, y perspectivas para la implementación de esta tecnología en Colombia.
II. MECANISMOS DE PRODUCCIÓN DE BIOHIDRÓGENO
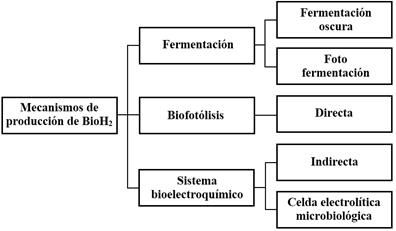
Existen varios microorganismos como las microalgas (algas verdes y cianobacterias), bacterias fotosintéticas y bacterias no fotosintéticas que pueden producir hidrógeno a través de diferentes rutas metabólicas [12]. La producción de biohidrógeno a partir de microalgas se clasifica en dos categorías principales: dependiente de la luz e independiente de la luz [14]. Una clasificación de los métodos se muestra en la Fig. 1.
La vía dependiente de la luz para la producción de hidrógeno, realizada por microalgas verdes y cianobacterias, se relaciona con la biofotólisis. Estos microorganismos cuentan con una eficiente maquinaria fotosintética para la producción de hidrógeno fotobiológico a partir de los recursos naturales más abundantes: la luz solar y el agua. Este proceso se puede diferenciar en dos vías distintas: biofotólisis directa y biofotólisis indirecta [12], como se observa en la Fig. 1.
La vía independiente de la luz para la producción de hidrógeno incluye la fermentación oscura, realizada por bacterias anaeróbicas a partir de materia prima de biomasa de microalgas rica en carbohidratos [12].
No obstante, también se puede producir biohidrógeno por medio de celdas electrobioquímicas, (MEC, por sus siglas en inglés) adaptaciones de las conocidas celdas de combustible microbianas (MFC). Una MEC es un dispositivo que emplea microorganismos para degradar la materia orgánica presente en aguas residuales liberando electrones que viajan por un circuito externo a un cátodo en el que se reducen protones a gas hidrógeno [13]. En estas MEC un factor clave en la eficiencia de remoción de materia orgánica y generación de hidrógeno, es la elección del catolito, o biocátodo [16,17,18]. Aunque esta tecnología es muy efectiva en la generación de hidrógeno, su desventaja está en los costos del cátodo, por ello se han estudiado nuevos materiales como carbón activado dopado con nitrógeno en lugar de los tradicionales metales como Pt o Pd [17]. Una variación de la tecnología MEC es la celda de combustible con membrana de intercambio de protones (PEMFC, por sus siglas en inglés), estudiada por [19] para producir biohidrógeno a partir de Chlorella vulgaris mediante fermentación oscura con privación de azufre, y más recientemente por [20].
A. Biofotólisis
Es el paso inicial de la fotosíntesis e implica la división de la molécula de agua, u otros compuestos orgánicos, por acción de la energía lumínica y cianobacterias [13]. El papel principal de las reacciones lumínicas es proporcionar el reductor bioquímico (NADPH) y la energía química (ATP) para asimilar el carbono inorgánico. Los componentes del aparato fotosintético están ubicados en las membranas tilacoides del interior del cloroplasto y del citoplasma de las microalgas verdes y cianobacterias, respectivamente [21]. Los dos complejos pigmento-proteína Fotosistema II (PSII) y Fotosistema I (PSI), que contienen pigmentos unidos a apoproteínas específicas y operan en serie [23], capturan la energía lumínica. Para conectar PSII con el receptor final de electrones (NADP+) se emplean: plastoquinona (PQ), citocromo b6f (Cytb6f), plastocianina (PC), PSI y ferredoxina (Fd) [3]. El NADPH da el poder reductor para la asimilación de CO2 en carbohidratos. Empero, en condiciones favorables y anaeróbicas, los electrones de la ferredoxina reducida (Fd) se pueden dirigir hacia las enzimas hidrogenasa o nitrogenasa para producir hidrógeno [23,24].
1) Biofotólisis directa
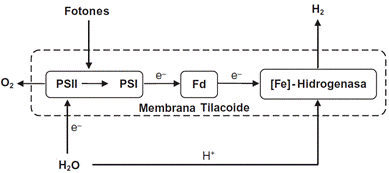
Emplea la luz solar como fuente de energía para dividir el agua en el PSII; los electrones residuales se transfieren a PSI donde la hidrogenasa conduce a la producción de hidrógeno sin emisiones de gases de efecto invernadero y con liberación simultánea de oxígeno [6,11]. Las microalgas verdes tienen enzimas hidrogenasas altamente activas con una eficiencia de conversión de energía solar a hidrógeno entre 12% - 14% [25].
En la Fig. 2 se describe el proceso en detalle. El agua sufre oxidación fotoquímica en la membrana tilacoide por PSII (agua - PQ - oxidoreductasa); luego, PSII energiza electrones usando fotones de luz solar transfiriéndolos a PSI a través de la cadena de transporte de electrones y luego a Fd, donde Fd-oxidorreductasa genera Fd reducido, que actúa como donador de electrones a la enzima hidrogenasa que facilita la reducción de H+ a H2 y la producción simultánea de O2 a PSI [3,6,26].
La reacción global de conversión de agua en hidrógeno por microalgas verdes y la reacción de reducción de Fd en PSI se presentan a continuación [6].
2H2O + Luz → 2H2 + O2 (1)
2H+ + 2Fd- → H2 + Fd (2)
La importancia de la fotólisis directa radica en que la alimentación principal es el agua y la luz solar, ambas fácilmente disponibles. Si bien esta tecnología es muy prometedora, también se enfrenta a enormes retos, como la incompatibilidad en la producción simultánea de hidrógeno y oxígeno molecular, ya que el oxígeno es un fuerte supresor de las reacciones generadoras de hidrógeno y un potente inhibidor de la enzima [Fe]-hidrogenasa, lo que impide la producción continua de hidrógeno en condiciones aeróbicas [13]. Además, el proceso requiere un área de cultivo significativa para colectar suficiente luz [27].
2) Biofotólisis indirecta
En esta ruta los electrones generados por la división de la molécula de agua se utilizan en la asimilación de CO2 para la síntesis de almidón en microalgas verdes. Posteriormente, los carbohidratos almacenados se catabolizan para servir como donadores de electrones para la producción de hidrógeno. El mecanismo general de la biofotólisis indirecta se puede representar con las siguientes reacciones [3].
12H2O + 6CO2 → C6H12O6 + 6O2 (3)
C6H12O6 + 12H2O → 12H2 + 6O2 (4)
Durante la primera etapa, o fase aeróbica, se permite que las microalgas crezcan en condiciones normales de cultivo, convirtiendo la energía solar y fijando CO2 en energía química como carbohidratos, lípidos y otras moléculas orgánicas, incrementando el contenido de sustrato endógeno y liberando oxígeno como subproducto [28]. Cuando se logra el agotamiento del oxígeno, la cadena de transporte de electrones deja de funcionar, induciendo la segunda etapa, o fase anaeróbica, donde los electrones del proceso catabólico de los sustratos endógenos (vía glucolítica y ciclo del ácido cítrico) se utilizan en PSI para la reducción no fotoquímica de la reserva de PQ mediante la reducción de Fd dependiente de la luz, luego los electrones se transfieren a enzimas hidrogenasas que conducen a la producción de hidrógeno [14,29].
La principal ventaja de esta vía es la capacidad de superar la sensibilidad al oxígeno de las enzimas hidrogenasas; sin embargo, las tasas de producción no son altas ya que las microalgas verdes carecen de heterocistos, lo que conlleva una ineficiente fijación de nitrógeno en condiciones anaeróbicas, y luego a una baja producción [6,27].
B. Fermentación oscura
También llamada fermentación anaeróbica. Permite producir hidrógeno en un ambiente anaeróbico sin la necesidad de energía lumínica, e implica la descomposición fermentativa de sustratos orgánicos en metabolitos solubles (ácidos grasos volátiles y alcoholes), hidrógeno y dióxido de carbono [3]. Se fundamenta en el uso de agentes bacterianos heterótrofos presentes en los lodos de biomasa de algas, a través de diferentes vías metabólicas. Estas bacterias productoras de hidrógeno se pueden utilizar como cultivos puros o mixtos, dependiendo del tipo de sustrato [30]. Una forma simple de carbohidrato, principalmente glucosa, es el sustrato preferido para el proceso de fermentación. No obstante, si se parte de un polímero complejo, se requiere una etapa de hidrólisis para convertirlo en glucosa [3]. Así, los sustratos orgánicos se convierten en piruvato (CH3COCOOH) a través de la glucólisis, (reacción 5); luego el piruvato se oxida a acetil coenzima A (acetil-CoA) dando como resultado la generación de ATP y la liberación de acetato (reacción 6). La reducción de Fd es fundamental para oxidar el piruvato en acetil-CoA; este Fd reducido se oxida aún más por la hidrogenasa que libera los electrones necesarios para producir hidrógeno [6], como se muestra en la reacción 7. Las reacciones de glucólisis, de producción de CO2 a partir del piruvato y de producción de hidrógeno a partir de la oxidación de Fd se presentan a continuación [27,31].
C6H12O6 + 2NAD+ → 2CH3COCOOH + 2NADH + 2H+ (5)
CH3COCOOH + CoA + 2Fd(ox) → Acetil-CoA + 2Fd(red) + CO2 (6)
2H+ + Fd(red) → H2 + Fd(ox) (7)
Finalmente, la fermentación tiene varias ventajas sobre la biofotólisis: no demanda grandes espacios de cultivo, ya que no implica la captación de luz; el hidrógeno se produce a un ritmo elevado mediante el uso de sustratos orgánicos haciendo posible utilizar aguas residuales e industriales ricas en carbono y abaratando el proceso. Además, se pueden obtener subproductos valiosos tales como antioxidantes, ácidos grasos, polisacáridos, glicerol y antibióticos sin mencionar una eficiencia de conversión de sustrato cercana al 80% [6,32].
III. PARÁMETROS QUE AFECTAN EL PROCESO
A. Especie
Se pueden resaltar las siguientes como las microalgas más empleadas: Nannochloropsis sp. por [33]; Scenedesmus subspicatus GY-16, Chlorella vulgaris FSP-E y Anistrodesmus gracilis GY-09, por [34]; Chlorella sorokiniana por [19]; Chlamydomonas sp. y Scenedesmus sp. por [35]. En la Tabla 1 se muestran los aspectos más relevantes de estos trabajos, desde 2015, con algunas excepciones y los resultados más destacados con algunas bacterias, como Clostridium butyricum.
B. Sustratos y medios de cultivo
Se han usado desde medios de cultivo tradicionales hasta aguas residuales industriales. Hay que aclarar que, aunque varios autores coinciden en llamar a su medio de cultivo “TAP”, el cual corresponde a tris-acetato fosfato [36], este es solo un agente tampón del pH [37]. [38] presenta una revisión de 13 medios de cultivo incluyendo Bold basal, BG11, f/2, Johnson. Uno de los que mejores resultados corresponden al Bold basal [39].
C. pH
Este factor tiene varios efectos sobre el cultivo, como el cambio en la carga de la membrana celular o disociación no polar de ácidos grasos volátiles que alteran el pH interno de las células [41]. Como se observa en la Tabla 1, el pH predominante en la mayoría de los trabajos es neutro (6 a 7), con microalgas; pero básico para bacterias (pH > 8).
D. Temperatura
Para microalgas la temperatura mínima usada ha sido 23 °C y la máxima 28 °C, dependiendo de la especie. Para bacterias, resalta el caso de la Caloramator celer con 67 °C [41].
E. Intensidad lumínica
Se han usado desde intensidades bajas: 50 o 60 μmol m-2 s-1 hasta intensidades altas, en el orden de 450 mmol m-2 s-1. No obstante, una mayor intensidad de luz puede causar fotoinhibición [42]. Según [43], la interacción de la luz con el crecimiento celular dependerá del diseño del fotobiorreactor, por lo cual no necesariamente a mayor intensidad lumínica se tendrá mayor generación de hidrógeno (Tabla 1).
F. Privación de macronutrientes
El proceso consiste en alcanzar la fase media logarítmica y luego separar la biomasa del medio de cultivo para realizar la privación de determinados nutrientes [44,45]. Según [46] el llamado “estrés nutricional”, disminuye el crecimiento celular y aumenta la producción de metabolitos. Los nutrientes que se limitan son azufre, fósforo, o nitrógeno. [47] privaron de azufre un cultivo de Chlorella sometido a fermentación oscura logrando aumentar la producción de hidrógeno. Según [48], la privación de azufre es más efectiva. Sin embargo, para [45] la privación de magnesio parece dar mejores resultados. [49] implementó la carencia de azufre, pero con adición de sulfitos.
G. Presión parcial del hidrógeno
La alta presión parcial del hidrógeno en el reactor inhibe su producción, tanto en cultivos de microalgas, como de bacterias [50,51], como lo explica [52] mediante el principio de Le Chatelier y contribuye a la formación de otros productos valiosos como etanol, propanol, lactato, entre otros. El diseño del reactor influye en la remoción del hidrógeno producido [53], pero también la ingeniería genética aporta opciones para contrarrestar esta merma en la producción [50].
H. Consorcios microalgales y de microalgas y bacterias
Un consorcio microalgal entre Chlorella vulgaris y Dunaliella tertiolecta se usó para estudiar la producción de H2 y CH4 [54]. En [49] se estudió un consorcio de microalgas y bacteria: Chlamydomonas reinhardtii y Thiomonas intermedia, respectivamente. Ellos privaron de azufre el cultivo, pero agregaron sulfitos. Un cocultivo de Chlamydomonas reinhardtii con la bacteria aeróbica Bradyrhizobium japonicum fue realizado por [55], mediante fotólisis directa con privación de azufre alcanzando un máximo de 280 μmol H2 mg-1. En [56] se usaron diferentes cepas de microalgas en cocultivo con Escherichia coli y la que produjo mejor rendimiento de hidrógeno fue la Chlorella sp. Así mismo, evaluaron la influencia de la concentración inicial de microalga y la relación gas / líquido en el reactor, correlacionando los resultados con el análisis de gases en el espacio libre del reactor. Concluyeron que, además de remover el gas producido, se debe retirar biomasa para asegurar la relación gas / líquido que favorece el proceso.
I. Ingeniería genética
Para [50] hay varios retos a solventar mediante la ingeniería genética de las células, entre los que se resaltan la sensibilidad extrema de las hidrogenasas al oxígeno; el bajo nivel de intensidad lumínica al que se inhibe el crecimiento fotosintético; la naturaleza reversible de las hidrogenasas que conduce a que, a altas presiones parciales de hidrógeno, este se consuma.
J. Diseño del biorreactor
En [53] se clasificaron los fotobiorreactores para producción de hidrógeno en matraces agitados; tanques con sistema de agitación, tubular horizontal, vertical tubular, que se divide a su vez en columnas de burbujeo y en airlift; cultivos inmovilizados [57]; y, reactor de panel plano. El diseño del fotobiorreactor (FBR) debe incluir el control de pH, iluminación, temperatura, contenido de carbono y relación carbono / nitrógeno [58,59]. El modelamiento por medio de dinámica de fluidos computacional se ha usado para el diseño de un fotobiorreactor de termosifón (TPBR) [60] y para un tanque agitado [61].
TABLA I PRINCIPALES ASPECTOS DE LA PRODUCCIÓN DE BIOHIDRÓGENO A PARTIR DE MICROALGAS Y BACTERIAS
| Especie | Mecanismo | Condiciones | Producción de H2 | Ref. |
|---|---|---|---|---|
| Microalga | ||||
| Chlamydomonas sp. | Fermentación oscura | 25 °C; pH 7 - 8; 50 μmol m−2s−1 | 1.15 ± 0.09 mL H2 L−1 | [35] |
| Chlamydomonas moewusii | Biofotólisis directa | 24 °C; pH 5.2; 60 μmol m−2s−1 | 61.1 ± 7.16 mL H2 L−1 | [62] |
| Chlamydomonas reinhardtii | Fotólisis | 25 °C; pH 7; 107 cd de int. lumínica | 111.1 μmol H2 L-1d-1 | [55] |
| Chlamydomonas reinhardtii | Fermentación oscura; adición de sulfitos; privación de S | 25 °C; pH 7 | 19.1 ± 1.1 μmol H2 mg−1h-1 | [49] |
| Chlorella sorokiniana | Fotólisis directa; supresión de S | 23 ± 2 °C; pH 7.2; 100 fotones m-2s-1 | 20.9 mL H2 L-1día-1 | [19] |
| Chlorella sp. | Sacarificación, fermentación oscura con prehidrólisis | 35 ± 2 °C; pH 5 en sacarificación previa. Y 6 en fermentación | 38.4 mL H2 g SV-1 día-1 | [63] |
| Chlorella vulgaris | Fotólisis | 30 °C; pH 8 ± 0.2; 160 W de potencia lumínica | 38.4 mL H2 Conc. Inicial: 10 g glucosa L-1 | [64] |
| Chlorella vulgaris | Sin S | 27 °C; pH 8.6; luz fluorescente fría 120 mmol m-2s-1 | 530 ± 5 mL H2 L-1d-1 | [65] |
| Chlorococcum minutum | Fotólisis | 25 °C; pH 7; 107 cd de int. lumínica | 295.1 μmol H2 L-1d-1 | [36] |
| Nannochloropsis sp. | Fermentación oscura | 25 °C | 24.2 g H2 mL-1 microalga | [33] |
| Scenedesmus obliquus | Fase 1: fotosintética; Fase 2: anaeróbica sin S | 25 ± 1 °C | 204.8 mL H2 L-1día-1 | [66] |
| Scenedesmus sp. | En cocultivo con Chlamydomonas sp. Sin S y Streptocos. | 25 °C; 50 μmol m−2s−1 | 1.52 ± 0.09 mL H2 L−1 | [48] |
| Bacteria | ||||
| Caloramator celer | Fermentación oscura | 67 °C; pH 8.2 | 50 mol H2 / mol glucosa | [41] |
| Clostridium butyricum | Fermentación oscura | 37 °C; 200 rpm; condiciones anaerobias | 6.95 mL H2 h-1 g glucosa-1 | [67] |
| Clostridium butyricum | Hidrólisis de microalgas (C. vulgaris) y Fermentación oscura | 28 ± 1 °C; pH 7.5; 450 mmol m-2s-1 | 176.9 mL H2 L-1día-1 | [34] |
| Thiomonas intermedia | Fermentación oscura; adición de sulfitos; privación de S | 30 °C; pH 6 | 19.1 ± 1.1 μmol H2 mgMF* −1h-1 | [49] |
| Enterobacter aerogenes | Fermentación oscura sobre sustrato de C.vulgaris | 30 °C | 40.8 mL H2 g SV-1 | [68] |
| Clostridium butyricum | Fermentación oscura sobre sustrato de biomasa de S. obliquus | 37 °C | 113.1 mL H2 g SV-1; 90.3 mL H2 g de biomasa-1; 2030 mL H2 LMF* -1 día-1 | [69] |
*MF: Medio fermentativo; SV: Sólidos volátiles
IV. Panorama del biohidrógeno en Colombia
En [70] se describieron los fundamentos de los sistemas de producción biológica, con énfasis en la fermentación oscura, haciendo un recuento de los métodos para la producción y purificación del hidrógeno. En [71] se discutió la posibilidad de una biorrefinería a partir de microalgas para producir biocombustibles y otros metabolitos; no se habló de hidrógeno, pero su estudio propuso una metodología para determinar la viabilidad de un proyecto similar. En [10] se presentó una recopilación de trabajos sobre la producción de hidrógeno a partir de microalgas con su desarrollo experimental, condiciones operativas y principales resultados. En [6] se proporcionó una descripción de los parámetros clave para producir hidrógeno a partir de microalgas, brindando observaciones sobre las aplicaciones a escala industrial. En [67] se aplicó biofotólisis directa a cultivos mixtos de microalgas verdes no axénicos, generados a partir de muestras del humedal Santa María del Lago (Bogotá, Colombia). En [40] se propuso el diseño de un biorreactor para la producción de hidrógeno a partir de biomasa, utilizando Clostridium butyricum, determinando las características y condiciones de crecimiento, el medio de cultivo y el sustrato. Por último, en [72] se evaluó la capacidad de producción de hidrógeno de cepas nativas de Clostridium spp. aisladas de suelo colombiano utilizando sustrato de glicerol.
En definitiva, la producción de hidrógeno por procesos biológicos ejemplifica un área prometedora en la producción de bioenergía; además, es una alternativa real al uso de los combustibles fósiles, pese a que se encuentre en investigación, para mejorar su aplicabilidad a gran escala [7]. Las condiciones climáticas, así como la diversidad de organismos tales como las microalgas, hacen que Colombia tenga un potencial importante en generación de hidrógeno por medios biológicos [67].
V. CONCLUSIONES
El biohidrógeno es un vector energético prometedor en el mercado de la energía sostenible; se puede utilizar de muchas maneras y sólo produce agua como subproducto en la combustión. Se puede obtener a partir de varios microorganismos, entre los que se encuentran las microalgas verdes.
La fermentación oscura presenta varias ventajas en comparación con la biofotólisis: no demanda grandes espacios de cultivo, el hidrógeno se produce a un ritmo elevado y con alta eficiencia, tiene menores costes netos de producción y permite obtener subproductos valiosos.
Los factores que influyen en el crecimiento del microorganismo son independientes de los que incrementan la producción de hidrógeno. Según el proceso a aplicar, hay tres puntos a considerar: la cepa, o consorcio, que brinde buenos resultado y sea tolerantes a condiciones cambiantes, el diseño adecuado del fotobiorreactor, y los mecanismos para retirar el hidrógeno.
Existen muchas barreras técnicas y económicas aún que no están permitiendo la aplicación real del biohidrógeno a escala industrial. Sin embargo, los avances en ingeniería y diseño de biorreactores podrían preparar un escenario positivo para el mejoramiento de los procesos de producción de biohidrógeno.