Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Ingeniería Biomédica
Print version ISSN 1909-9762
Rev. ing. biomed. vol.1 no.1 Medellín Jan./June 2007
INTERFACES NEURONALES Y SISTEMAS MÁQUINA-CEREBRO: FUNDAMENTOS Y APLICACIONES. REVISIÓN
Felipe García Quiroz1,2, Adriana Villa Moreno1, Paula Castaño Jaramillo1
1 Línea de Bioinstrumentación, Señales e Imágenes Médicas.
2 Dirección para correspondencia: bmfegar@eia.edu.co.
Recibido 02 de octubre de 2006. Aceptado 08 de diciembre de 2006.
RESUMEN
Debido a la alta incidencia de personas en situación de discapacidad motora y sensorial, la investigación en el desarrollo de interfaces neuronales y sistemas de comunicación máquina-cerebro ha tenido gran auge a través de los últimos diez años. La construcción de estas interfaces requiere un trabajo coordinado de disciplinas como: fisiología, ciencia de los materiales, instrumentación y procesamiento de señales, inteligencia computacional, mecánica, electrónica, robótica e informática, entre otras. Todas ellas para lograr una correcta interconexión entre el funcionamiento del sistema nervioso, la construcción de electrodos biocompatibles, la obtención de señales aptas para el procesamiento, la clasificación e identificación de patrones codificados y el diseño de los elementos efectores que den sentido a la interfaz. En esta revisión se hace un recorrido por las tres etapas fundamentales de las interfaces neuronales: la detección de las señales, el procesamiento de estas y la amplia gama de posibilidades para los mecanismos efectores.
PALABRAS CLAVE: Microelectrodos, Neuroingeniería, Telemetría, Corteza cerebral, Redes neuronales, Microfabricación, Biocompatibilidad, Estimulación eléctrica, Discapacidad.
ABSTRACT
During the past ten years the Neural Interfaces and brain-computer communication systems area has become an important field for research, in part due to the increasing statistics of motor and sensorial disabilities. The development of these systems and interfaces requires the coordinated work of different areas such as physiology, materials science, instrumentation and signal processing, computational intelligence, mechanics, electronics, robotics, and informatics, among others. They allowed the right integration between the nervous system physiology, the construction of biocompatible electrodes, the acquiring of proper signals for processing, the classification and identification of coded patterns and the design of the actuators elements to finally achieve the goal of the interface. In this review the three basic stages of neural interfaces are shown. This includes: signal acquiring, signal processing and the wide variety of applications with the effectors systems.
KEY WORDS: Microelectrode, Neural engineering, Telemetry, Cerebral cortex, Neural networks, Microfabrication, Biocompatibility, Electrical stimulation, Disability.
I. INTRODUCCIÓN
La búsqueda de soluciones de ingeniería para las personas en situación de discapacidad motora, bloqueo de las vías de comunicación y expresión de las experiencias cognoscitivas ha llevado al desarrollo de interfaces neuronales artificiales. En el caso particular de las lesiones medulares, sólo en los Estados Unidos de América se tienen 250000 casos, con 11000 pacientes nuevos cada año [1]. Estas estadísticas justifican las intensas investigaciones desarrolladas en este campo, sobre todo si se considera que las condiciones de vida de estos pacientes aumenta la tendencia a aceptar nuevos estudios que implican el implante crónico de electrodos en la corteza cerebral [2, 3, 4].
Los sistemas para el registro de la actividad bioeléctrica de neuronas individuales en primates y humanos se desarrollaron hace aproximadamente cuarenta años, pero sólo en la última década se potenció el implante de arreglos de electrodos directamente en el cerebro [5]. Este hecho se debe a la elevada carga computacional que se requiere para procesar y decodificar las complejas señales derivadas de la actividad de múltiples neuronas individuales [6]. La digitalización de la actividad eléctrica, por ejemplo, se debe realizar a altas velocidades (>20KHz) en varios canales, junto con las demandas para separar los potenciales de acción del ruido y traducir la actividad neuronal en un comando de acción apropiado. Todo en una referencia temporal útil de unos 200ms [7].
Si bien los recientes progresos en el desarrollo de una interfaz máquina-cerebro completa han sido importantes, aún se tienen limitantes en cuanto a la bioestabilidad y biofuncionalidad de los electrodos y hacen falta avances en telemetría para los generadores de pulso implantables. Además ha sido imposible obtener imágenes de alta resolución de los implantes debido a los materiales utilizados en la fabricación de los electrodos [8].
Las aplicaciones derivadas del desarrollo de las interfaces neuronales y los sistemas máquina-cerebro constituyen la base no sólo para el desarrollo de sistemas artificiales de control motor y de propiocepción, sino también para la regeneración neuronal y la reparación del sistema nervioso al combinar estas tecnologías con los avances en otros campos como la ingeniería de tejidos y la terapia génica [8]. En este artículo se realiza una revisión tanto de los principios aplicados en el desarrollo de los sistemas computadora-cerebro y las interfaces neuronales, como una aproximación a las principales aplicaciones y desarrollos futuros en el área.
II. INTERFACES NEURONALES, CONECTANDO LOS SISTEMAS COMPUTADOR-CEREBRO
Las interfaces neuronales se consideran como sistemas de transducción bidireccionales que permiten establecer un contacto directo entre el dispositivo técnico y la estructura neurológica, cuyo objetivo es registrar las señales bioeléctricas del cuerpo y la excitación artificial de los músculos y nervios. La interfaz neuronal comprende: los electrodos o sensores, las conexiones internas (cables), las conexiones al procesador externo, los circuitos para la adquisición de los datos y la unidad controladora del sistema efector [9]. Uno de los elementos clave en la interfaz es el electrodo, encargado de capturar la actividad bioeléctrica o de aplicar las corrientes eléctricas a los tejidos vivos. En adelante, se describen las principales características y requerimientos de los electrodos utilizados en los sistemas máquina-cerebro y la ingeniería neuronal.
2.1 Biocompatibilidad y reacciones del tejido
La interacción electrodo-tejido neuronal exige tanto biocompatibilidad de la superficie del electrodo como biocompatibilidad estructural [9]. Esta última se refiere al diseño, tamaño y superficie total del electrodo, la cual se relaciona con el daño ocasionado por la acción mecánica de introducir el elemento en el tejido y las fuerzas o distribución de presiones generadas en las regiones adyacentes. Por otro lado, se considera la biocompatibilidad de los materiales en contacto con el tejido, cuya disolución incluso en cantidades mínimas podría generar respuestas del sistema vivo como inflamación, alergia, rechazo, entre otras. Los implantes eléctricamente activos en una prótesis neuronal deben cumplir con las mayores exigencias en cuanto a la bioestabilidad y biofuncionalidad, de modo que se pueda asegurar la estabilidad temporal de las propiedades de la interfaz electrodo-electrolito durante la vida del implante. Además, la elección de un diseño estructuralmente compatible de los electrodos se debe equilibrar con los cambios generados en otras características esenciales del desempeño del electrodo, tales como impedancia, relación señal-ruido y selectividad. La última se refiere a la capacidad de registrar o estimular eléctricamente grupos particulares de neuronas o fibras nerviosas.
El tejido neuronal responde de diversas maneras a la introducción de los electrodos, aunque en todos los casos se produce un daño del tejido. En efecto, durante la inserción de cualquier objeto en el cerebro se genera un daño del parénquima, se rompen vasos sanguíneos (microhemorragias), se activa la microglia (derivados de los monocitos) y aumenta la proliferación de los astrocitos, lo que lleva al encapsulamiento del electrodo, pudiendo producir cambios importantes en su impedancia [5]. Schmidt et al. (1993) demostraron la relación existente entre la disminución de la relación señal-ruido y el encapsulamiento, al recuperar la actividad del electrodo haciendo circular corriente eléctrica a través de él [5]. La corriente remueve el tejido o crea orificios en la cápsula disminuyendo la impedancia y reactivando los puntos de registro (sensores propiamente) en el electrodo.
Actualmente, algunos investigadores están trabajando en la modificación de la superficie de los electrodos usando hidrogeles, polímeros tipo seda y nanotubos, los cuales se puedan unir a materiales bioactivos, como las neurotrofinas (factores neurotróficos), que potencien el acercamiento de neuritas en crecimiento [10]. De igual manera se busca disminuir la respuesta inflamatoria usando microtubos que liberen moléculas inhibitorias de los factores transcripcionales de algunos genes reguladores de la liberación de citoquinas proinflamatorias.
2.2 Materiales
La estabilidad de los materiales en el electrodo es fundamental, especialmente si se busca mantener los implantes dentro del cuerpo del paciente por varios años. Por esto, el electrodo debe ser resistente a la corrosión durante la estimulación eléctrica o al ataque de los fluidos biológicos, enzimas y macrófagos producidos durante las primeras etapas de reacción del tejido vivo.
En cuanto a la selección de materiales hay diferentes opciones tanto para la conducción de señales bioeléctricas como para el aislamiento de los electrodos, los cables y en algunos casos, de los circuitos electrónicos [9]. Los materiales conductores más utilizados son: platino, iridio, tungsteno y acero inoxidable. El aislamiento se realiza generalmente con elastómero de silicona, politetrafluoroetileno y poliimida [11].
El elastómero de silicona es el más utilizado no sólo para el aislamiento de los cables, sino también en recubrimientos adicionales para circuitos electrónicos herméticamente cerrados.
Otras características importantes que deben tener estos materiales incluyen la estabilidad electroquímica, consumo bajo de energía durante la estimulación, impedancia y frecuencia de respuesta estable y estabilidad contra el ruido y otros artefactos. Además, se requiere un comportamiento adecuado en la fase anterior durante la polarización y en la fase posterior al potencial [12].
2.3 Electrodos
Los primeros electrodos utilizados en las interfaces neuronales fueron los microcables, los cuales consisten en cables muy finos con diámetros entre 20 y 50µm. Comúnmente se fabrican de acero inoxidable o tungsteno y materiales aislantes como teflón o poliimida. Estos cables se organizan en arreglos al soldarlos a un pequeño conector con espaciamientos en un rango de (100-300)µm, utilizando polimetilmetacrilato o glicol polietileno como separadores [5]. Un hecho curioso sobre el desempeño de los microcables se refiere al encapsulamiento que se produce durante la inserción del electrodo, el cual ha permitido su uso para el registro de señales bioeléctricas en la corteza cerebral. El encapsulamiento produce un aumento de la impedancia al reducir el diámetro del cable en el área expuesta, cuyo tamaño inicial sería muy grande para permitir el registro de unidades neuronales aisladas.
En la nueva era de electrodos penetrantes desarrollados principalmente para estimulación y registro de la actividad eléctrica del sistema nervioso central, aunque utilizados en estudios preliminares con el sistema nervioso periférico (SNP), se encuentran los electrodos cuyo diseño y construcción se explica a continuación.
Se han desarrollado multielectrodos con números variables de electrodos ubicados en agujas o bloques portadores fabricados de vidrio, silicona o poliimida. Los electrodos se disponen en arreglos 1D, 2D, o 3D (ver Fig. 1). Además, se ha desarrollado una gran variedad de diseños y métodos de fabricación para la construcción en masa de estos dispositivos, incluyendo técnicas de mecánica de precisión y microfabricación [9, 10]. Dos de los diseños más reconocidos en la actualidad se desarrollaron en la Universidad de Utah y la Universidad de Michigan, e incluso han sido comercializados.
El arreglo de electrodos de Michigan puede fabricarse con varias configuraciones y formas debido al protocolo de fabricación desarrollado. La principal característica es la disposición de varios puntos de registro (sensores) a lo largo de cada columna (electrodo). Este diseño permite asegurar que al menos algunos de los puntos de registro se ubicarán en profundidades corticales apropiadas para medir la actividad bioeléctrica. El arreglo estándar para implantes crónicos consta de cuatro columnas paralelas tipo daga conectadas a una cinta de microsilicona (ver Fig. 1. A, B). Las columnas tienen 15µm de grosor y (50-100)µm de ancho [5].
Los investigadores de la Universidad de Utah utilizaron un enfoque totalmente diferente, con un único punto de registro ubicado en la punta de cada electrodo. Los cables atraviesan la longitud del electrodo hasta la parte posterior del bloque, donde se encuentran canales de oro para la unión de los cables que se proyectan al cráneo (ver Fig. 1. C, D). Las puntas de registro son de platino, con una longitud de (35-75)µm y una impedancia de (100-500)KOhms. Por las características del método de fabricación desarrollado, el rango para la longitud de las columnas es de 1-1,5mm. Estos electrodos, al tener un único punto de registro, presentan el problema de ubicación de los microcables, sin embargo, permite ubicar una gran cantidad de puntos de registro en un volumen compacto de corteza. Además, se considera que el extremo del electrodo es el mejor punto para muestrear el campo producido por un potencial de acción [4].
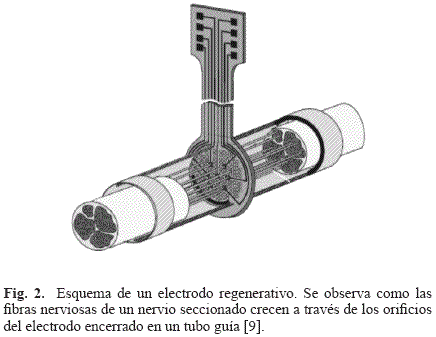
En el caso particular del SNP, se han utilizado electrodos regenerativos, los cuales fueron diseñados con el objetivo de permitir la regeneración de las fibras nerviosas en zonas medulares segmentadas o en extremidades amputadas [9]. El diseño se basa en una serie de orificios rodeados por electrodos que permiten el crecimiento de los axones o de las fibras nerviosas hacia su interior, posibilitando el registro de potenciales de acción y estimulación directa sobre axones individuales o pequeños fascículos (ver Fig. 2). Idealmente, un diseño 1:1 permitiría el acceso a cada axón regenerado en un orificio del dispositivo (2-10µm), pero se ha demostrado que no se da regeneración con tamaños tan pequeños. Entonces, los diseños buscan el equilibrio entre el número de perforaciones y el diámetro en un rango de 40-65µm. Otros electrodos utilizados en SNP son los de tipo brazalete (cuff electrodes), los electrodos intrafasciculares (LIFE), los interfasciculares y los electrodos epineurales.
La ubicación inadecuada de los electrodos durante el procedimiento de inserción o la pérdida de calidad de la señal debida al movimiento del electrodo en la corteza (producido por la respiración, los cambios en la presión sanguínea o el encogimiento del cerebro) han llevado al desarrollo de electrodos ajustables [7]. Éstos permitirían aumentar la calidad de la señal registrada, aislar o buscar grupos celulares particulares e incrementar la estabilidad y la vida útil de los implantes crónicos.
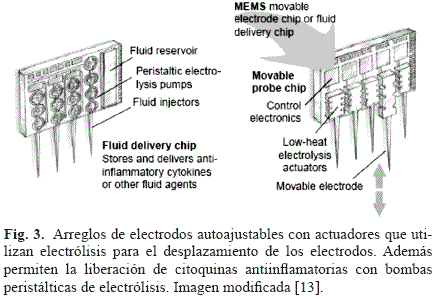
El objetivo es desarrollar sistemas microelectromecánicos (MEMS) que permitan el movimiento y la ajustabilidad del arreglo de electrodos implantados. Uno de los métodos con mayor potencial utiliza las técnicas de electrólisis para mover y fijar la posición de los electrodos [13]. En resumen, el movimiento se da al pasar corriente eléctrica a través de unas cámaras plegadas (tipo acordeón) llenas de fluido. La electrólisis de éste produce una fase gaseosa que aumenta la presión en las cámaras y desplaza el electrodo (ver Fig. 3). Algunas ventajas de este método incluyen: poca disipación de calor, bajo consumo de voltaje, y la posibilidad de generar grandes fuerzas y desplazamientos controlados de cientos de micras.
2.4 Interfaces neuronales híbridas
Este tipo de interfaces combinan los conocimientos del cultivo de células, los trasplantes celulares, la ingeniería de tejidos y la microfabricación; y constituyen el punto de convergencia entre la regeneración neuronal y las prótesis neuronales [14]. Las interfaces híbridas son dispositivos sintéticos implantables que tienen un elemento adicional de tipo biológico que facilita su integración al sistema nervioso del paciente. La primera aproximación consiste en cultivar células sobre el elemento sintético y promover su crecimiento para que establezcan conexiones sinápticas con las neuronas en el tejido huésped. Un segundo enfoque consiste en agregar al implante algunas sustancias neurofílicas que obliguen al tejido a extender prolongaciones o procesos que permitan realizar la conexión del electrodo [15].
Por ejemplo, se han cultivado exitosamente neuronas septales en electrodos de silicona, y una vez implantados se da la migración de las células hacia el tejido del paciente debido a la mayor disponibilidad de nutrientes. Sin embargo, la migración de las células es tal que se pierden las conexiones con el electrodo. Entonces, se debe trabajar en la modificación de los electrodos de modo que las células cultivadas mantengan la conexión una vez implantadas. Se está explorando la posibilidad de incluir modificaciones fenotípicas que obliguen a las neuronas a extender sus procesos, en lugar de migrar hacia el tejido del paciente [14, 15].
III. PROCESAMIENTO DE LA SEÑAL
La información contenida en los electrodos puede ser extraída por diferentes métodos y procesos de decodificación. Éstos se clasifican en dos grandes grupos: los métodos deductivos y los clasificadores.
Los métodos deductivos son modelos basados en la comprensión de los mecanismos implicados en la generación de las señales bioeléctricas. Por ejemplo, la actividad de una población neuronal se puede representar con un vector, donde cada dimensión corresponde a una neurona y la magnitud de cada dimensión se supone proporcional a la tasa de descarga de esa célula. El algoritmo de extracción realiza un ajuste direccional de las funciones para transformar el vector en uno de movimiento en el espacio. Este fue uno de los primeros acercamientos que permitió decodificar la tasa de descarga eléctrica de las neuronas para predecir la trayectoria del movimiento de las extremidades superiores, usando modelos lineales (ajuste aproximado con funciones coseno) que relacionan la rata de descarga con la posición, la velocidad y la aceleración de la extremidad [5, 8].
En contraposición, los algoritmos clasificadores no requieren un conocimiento previo de cómo la actividad neuronal está relacionada con el movimiento, sino que se basan en el reconocimiento de patrones en las señales bioeléctricas registradas. Este método utiliza los principios de la inteligencia artificial y redes neuronales para los procesos de clasificación y, por tanto, depende de una relación entre las tasas de descarga eléctrica y el movimiento. Por ejemplo, un algoritmo de clasificación conocido como SOFM (del inglés self-organizing feature map) consiste en una red de nodos (neuronas artificiales), cada uno de los cuales esta conectado a un vector de entrada con un sistema de pesos. Los vectores de entrada son los registros de las tasas de descarga neuronal y se utilizan inicialmente para el entrenamiento de la red y el ajuste de los pesos (inicializados aleatoriamente). El elemento con el vector de pesos más cercano al vector de entrada es el ganador y es modificado para acercarse al valor de entrada. Este proceso se repite durante el entrenamiento de la red y cada grupo se asocia a una dirección. Se ingresan los nuevos vectores de entrada y la dirección prevista del movimiento se elige como la dirección más cercana que se encuentre dentro de las categorías de la red creada. Otro tipo de redes neuronales que han sido usadas de manera exitosa para convertir poblaciones de actividad neuronal en movimiento, usan los principios de back propagation y estimaciones no lineales de la máxima probabilidad [5].
En ambas categorías los algoritmos para decodificar la información neuronal se dividen en dos pasos. Estos se resumen a continuación.
3.1. Detección y clasificación de la señal
La señal digitalizada puede pasar por diferentes procesos de extracción de las características relevantes como: filtrado espacial, medida de la amplitud de voltaje, análisis espectral o separación de una sola neurona. Mediante estos procesos se espera obtener las características que codifican la orden del paciente. Estas características pueden estar en el dominio del tiempo (p. ej. amplitudes de potenciales evocados o tasa de descargas neuronales) o en el dominio de la frecuencia (p. ej. amplitudes de los ritmos µ o β). Una interfaz neuronal que use ambos podría ser mucho más exacta.
En la actualidad las características reflejan cómo la descarga de una neurona cortical o la activación sináptica sincronizada de la corteza motora produce un ritmo µ. La ubicación, el tamaño y la función del área cortical que genera un ritmo o un potencial evocado indican cómo debe ser registrado. Pueden usarse también los sistemas de parámetros autoregresivos que se correlacionan con la intención del paciente, pero no reflejan necesariamente acontecimientos específicos del cerebro [16].
En todos los casos es muy importante asegurarse de que las características elegidas no estén contaminadas por señales bioeléctricas no neuronales como electromiografía (EMG), electrooculografía (EOG), entre otros.
3.2 Transducción de la señal
Una vez se ha realizado la extracción de las características especiales de las señales bioeléctricas registradas, se requiere de una etapa adicional que permita traducir estas características a los comandos del dispositivo encargado de realizar la orden del paciente. Estos algoritmos pueden usar tanto métodos lineales (análisis estadísticos clásicos) como no lineales (redes neuronales). Un algoritmo eficaz debe adaptarse al usuario en tres niveles [10]:
- El algoritmo se adapta a las características de un paciente nuevo. Entonces, si la característica es la amplitud del ritmo µ, el algoritmo se adapta al rango de amplitudes µ del paciente. Una interfaz con sólo este nivel será efectiva si la actividad eléctrica del paciente es muy estable ya que solo se ajusta al paciente en la fase inicial.
- Ajustes periódicos para reducir el impacto de las variaciones espontáneas debidas a niveles hormonales, medio ambiente, fatiga, enfermedades, entre otras.
- El tercer nivel acomoda las capacidades adaptativas del cerebro ante los resultados obtenidos con cada acción de la interfaz. Este nivel implica la interacción de dos controladores adaptativos: el cerebro y el sistema de interfaz neuronal. Esto explica la importancia de crear algoritmos de extracción cuya salida pueda ser entendida por el paciente, de modo que éste pueda alterar la actividad neuronal de manera consistente. Este ciclo cerrado de control permite producir cambios predecibles en la forma como se mueve la prótesis o el sistema efector.
IV. APLICACIONES
Una vez realizado el procesamiento de la señal, los potenciales bioeléctricos decodificados, provenientes de las funciones neuronales, son utilizados como señales de control para una amplia gama de aplicaciones [16]. Muchas de las investigaciones que se han realizado en el campo de las interfaces neuronales se han enfocado al control y a la ejecución de funciones de mecanismos efectores. Algunos de los más estudiados son: neuroprótesis, exoesqueletos, robots telemétricos y, de manera especial, sistemas de comunicación directa con computadores [1, 14, 16]. Estos permitirían la sustitución de partes corporales, la restitución de funciones para las que se ha perdido capacidad, la realización de tareas en ambientes inaccesibles para los humanos, entre otras funciones.
Las interfaces neuronales también incluyen las aplicaciones relacionadas con los dispositivos de estimulación neuromuscular (FES systems) y cerebral (DBS systems) para la recuperación funcional, así como los dispositivos de obtención de la información sensorial que es llevada al cerebro para su interpretación cuando hay deficiencias en los órganos de los sentidos [7, 17].
4.1. Interfaces neuronales para funciones motoras
Las interfaces neuronales han demostrado su capacidad para dar buenos resultados en el control de dispositivos externos mediante las señales corticales o periféricas.
Se han enfocado de manera especial en el desarrollo de comandos de fácil ejecución como controles ambientales de temperatura, luz, televisión, respuesta a preguntas tipo sí/no, procesamiento de palabras a bajas velocidades (máxima velocidad alcanzada 2 letras/min.) [10]. Otros más complejos incluyen la operación de dispositivos o mecanismos como sillas de ruedas, control de prótesis, ortesis, exoesqueletos, robots y cursores de computador [5, 10]. Sin embargo, muchos pacientes, principalmente los que conservan el control muscular de algunos miembros, tienen mejores opciones en comparación con las interfaces neuronales. Para estos pacientes generalmente es más sencillo y menos traumático utilizar las contracciones musculares mediante EMG como señales de control para estas aplicaciones o incluso señales del movimiento ocular con EOG. Aunque el control con estos últimos es más rápido y preciso que con las interfaces neuronales actuales, las señales de electroencefalografía (EEG) pueden permitir el control de un mayor número de grados de libertad en comparación con las prótesis mioeléctricas (cuatro grados de libertad) [9]. Además existen muchos pacientes que han perdido totalmente el control muscular, se fatigan con facilidad o presentan desórdenes en el movimiento [16].
La información neuronal puede resultar excelente para el control si se le hace el procesamiento correcto, pues se ha demostrado que las neuronas motoras pueden proveer estimaciones fiables de las intenciones motoras, incluyendo fuerza y dirección [7]. De esta manera sería posible sustituir de forma casi natural los movimientos de la mano para tareas cotidianas como el alcance de alimentos que se encuentran en diferentes posiciones, su agarre y posterior transporte a la boca, entre muchos otros ejemplos [5]. En estudios realizados con interfaces con computadores, se ha mostrado que los sujetos pueden controlar un cursor en una pantalla, indicando que se puede alcanzar más que un simple control on-off. Así, las señales neuronales pueden resolver algunos de los problemas que se presentan con las señales electromiográficas para el control de prótesis, robots y demás aplicaciones que lo requieren. Incluso algunos estudios han llegado más allá de permitir movimientos de cursores en 2D logrando extender el control de los movimientos de manera continua a tres dimensiones [1]. Taylor et al. (2002) lograron con primates el movimiento de un cursor en 3D mediante realidad virtual, tanto con un control manual como con uno neuronal [18]. A su vez estos experimentos se han modificado cambiando el movimiento de cursores por el movimiento de robots virtuales.
En ensayos de lazo abierto se ha logrado el control de manos robóticas que reproducen su trayectoria según una reconstrucción 2D. Sin embargo las prótesis neuronales requieren controles de lazo cerrado donde haya una realimentación, que casi siempre es visual, por parte del sujeto. Estos controles cerrados mejoran de manera significativa la habilidad para realizar determinada tarea con mayor rapidez y precisión. De hecho, los pacientes al ver los resultados de los procesos de control en tiempo real, aprenden a modificar su actividad neuronal para mejorar su desempeño en la tarea [5]. Experimentos con animales han mostrado que es posible mover el cursor con un control de ciclo cerrado para seleccionar objetos que aparecen de manera aleatoria en el monitor, alcanzando desempeños muy cercanos a los controles manuales [1]. Los diseños de estas interfaces aún están en una etapa temprana de desarrollo y se requiere el control de funciones adicionales para llegar a una aplicación clínicamente relevante, como lograr hacer clic.
Para mejorar los alcances de estas interfaces se están introduciendo y estudiando muchas mejoras, entre ellas nuevas modalidades para la comunicación como la telemetría, y se están explorando otras áreas del cerebro que podrían permitir controles neuronales de más alto nivel [1]. Incluso se está estudiando el reconocimiento de movimientos más complejos, como gestos, ya que éstos podrían codificarse para convertirse en palabras, comandos o acciones [1].
4.2. Interfaces neuronales para funciones sensitivas
Como ya se mencionó, hay muchas aplicaciones de las interfaces neuronales con fines motores que permiten a los individuos con parálisis, desórdenes motores u otras patologías, integrarse al ambiente al tener un mejor control y comunicación con él. Sin embargo, la información sensitiva que los individuos reciben del ambiente es un aspecto fundamental en el desempeño de las tareas motoras y permite una comunicación bidireccional con el medio, tal como ocurre con las personas sin afecciones en las vías motoras y sensitivas.
Por esta razón, una interfaz de comunicación ideal para estos pacientes debe ser capaz de llevar a la corteza señales que de manera natural son indistinguibles, lo cual se puede lograr con microestimulación local [7]. Los principales desarrollos e investigaciones que se han realizado en este campo buscan recuperar las funciones de visión y audición mediante prótesis que estimulan eléctricamente áreas específicas de la corteza correspondientes a la percepción de estos sentidos. De acuerdo con esto se han logrado varios avances en implantes cocleares, que ya llevan varias generaciones, algunos de ellos con la utilización de arreglos basados en polímeros de cristal líquido como material dieléctrico [14]. De manera similar se han desarrollado prótesis de retina intraocular que cuentan con dispositivos de electrodos de platino para permitir a los pacientes discriminar la forma y el movimiento de objetos visibles con una precisión mayor al 80% [14].
También se han realizado estudios para otras interfaces, como aquellas para el sentido táctil. En estos casos se hace uso de la microestimulación en la corteza sensorial somática para sustituir vibraciones en la piel de manera que se logre un reconocimiento de su frecuencia [7]. Esto ha sugerido la posibilidad de desarrollar patrones de estimulación que se puedan utilizar para percibir información significativa y de gran importancia como señales de alerta.
Además, la función sensorial también presenta gran utilidad como sistema de realimentación para mecanismos efectores de movimiento. En las acciones motoras naturales el cuerpo humano utiliza los sensores de propiocepción para regular la posición de sus miembros y controlar el movimiento. Las señales de estos receptores podrían utilizarse en la regulación de los movimientos de miembros externos cuando los comandos provienen de otra interfaz neuronal, teniendo como ventaja que las señales sensitivas pueden detectarse directamente del sistema nervioso sin causar alteraciones en el comportamiento de la persona [9].
La obtención de la información sensorial también se ha estudiado para mejorar el desempeño de los sistemas de estimulación eléctrica funcional, es decir, cuando lo que está siendo controlado eléctricamente es un miembro propio del individuo. Las características variables del sistema neuromuscular hacen necesario tener un ciclo cerrado de control con una unidad de sensado que provea información acerca de la tarea motora que se esté ejecutando. Si bien el sensado puede ser artificial, es un nuevo reto utilizar la información de los sensores naturales mediante el procesamiento de sus señales nerviosas [9].
4.3. Interfaces neuronales para estimulación
Existe otro tipo de estimulación eléctrica que es la estimulación funcional, la cual intenta dirigir el comportamiento o modificar la función cerebral o nerviosa, sin la intervención de receptores cognitivos. Difiere de la estimulación para fines sensitivos que tiene la función de remplazar los órganos sensoriales por otros construidos de manera artificial.
La estimulación eléctrica se ha usado desde 1950 para tratar desórdenes neurológicos en humanos [7]. Actualmente una de las aplicaciones más estudiadas es el alivio de algunas de las manifestaciones del síndrome de Parkinson, para el cual se han diseñado y construido implantes para estimulación profunda del cerebro (DBS por su sigla en ingles). Gracias a esto se han estudiado terapias mediante la manipulación del ganglio basal que buscan aliviar el temblor, la rigidez y la bradikinesia propias de esta enfermedad [7]. Sin embargo, aún es necesario tener un mayor conocimiento de la fisiopatología de los desórdenes de movimiento que se manifiestan en las funciones sensoriales-motoras anormales para obtener mayores avances en las interfaces de estimulación cerebral [14]. Los experimentos han demostrado que la estimulación del núcleo subtalámico mejora significativamente la velocidad del movimiento de la articulación del codo y de la rodilla en pacientes con enfermedad de Parkinson, mejorando la calidad de vida de estos individuos. Una explicación probable de este fenómeno es el aumento de la activación de los músculos agonistas y antagonistas, lo cual se ha evidenciado por medio de mediciones electromiográficas [14]. Sin embargo, esta estimulación directa trae algunas contraindicaciones como el impacto negativo en la fluencia verbal que hipotéticamente es causado por la extensión del estímulo eléctrico más allá de las regiones patológicas localizadas [14]. Para responder a esto se han sugerido mejoras en los electrodos de estimulación, creándose propuestas como el desarrollo de tecnologías de microelectrodos con microactuadores que permitan posicionar el dispositivo de manera precisa, logrando un menor tiempo de cirugía y posibilitando el ajuste de la profundidad del electrodo después de ésta.
Otras aplicaciones terapéuticas que se han evaluado para la DBS presentan especial interés en pediatría, aplicadas en desórdenes en los recién nacidos, principalmente en algunas patologías asociadas a la sordera. En este caso, los sistemas presentan nuevos requerimientos tecnológicos en comparación con los desarrollados para personas de edad avanzada, enfocados, por ejemplo, a la enfermedad de Parkinson [14]. La mayoría de veces, se requiere la unión de interfaces para DBS con prótesis cocleares, por lo que surge la necesidad de diseñar interfaces neuronales múltiples para implantar en un mismo paciente por largos periodos de tiempo [14]. En otros casos existe la posibilidad de estimular de manera directa las neuronas de la vía auditiva que aún conservan algo de función.
La estimulación funcional también puede ser efectuada en zonas diferentes al cerebro. Actualmente los sistemas FES (Functional Electrical Stimulation) brindan la posibilidad de aplicar corrientes eléctricas en nervios periféricos o en porciones neuromusculares para estimular o suprimir alguna actividad específica del sistema nervioso. Esta estimulación posibilita el control del movimiento de un miembro paralizado; la activación de funciones viscerales, como el control de la vejiga o de la respiración; la creación de percepciones, como sensibilidad en la piel; la interrupción de experiencias indeseadas, como el dolor o el espasmo; y además, facilita la recuperación natural [17]. De todas maneras, para producir mediante estimulación el movimiento natural de un miembro paralizado, se requiere un entendimiento más profundo de cómo interactúan los músculos para producir movimientos complejos, y en algunos casos, por ejemplo en la marcha, se necesita la integración de señales vestibulares [7].
Existe una interfaz para controlar movimientos de la mano aprobada por la FDA (del inglés Food and Drug Administration). En ésta, los movimientos de agarre de la mano son controlados por un dispositivo externo que estimula los músculos de manera selectiva mediante electrodos.
La estimulación también puede realizarse directamente en la médula espinal, con la ventaja de proveer un contacto directo con el tejido neuronal. Para esto se han desarrollado sistemas con fotodiodos que convierten la longitud de onda de la luz incidente del infrarrojo cercano en estímulos eléctricos [14]. Estudios realizados en gatos muestran la utilidad de la microestimulación intraespinal por medio de microcables para permitir movimientos funcionales de algunos miembros [14]. La estimulación espinal con relación a la periférica, presenta la ventaja de aumentar el tiempo requerido para producir fatiga muscular; sin embargo, tiene como desventaja la dificultad técnica con el posicionamiento y la estabilidad de los electrodos, ya que las diferencias de 10µm en la posición del electrodo pueden determinar el éxito o fracaso de la aplicación. Dicho efecto es menos importante en los nervios periféricos. Por otro lado los sistemas de estimulación con láser pueden generar efectos fototérmicos evidenciados por elevaciones locales de la temperatura [14].
Algunos trabajos de mayor alcance en cuanto a interfaces neuronales se han centrado en modelos matemáticos que describen la dinámica no lineal de las redes de neuronas.
Un potencial campo de aplicación consiste en el desarrollo de microchips que capturan el comportamiento de las neuronas de una región específica del cerebro en 3D. Mediante el desarrollo de estos modelos matemáticos de múltiples entradas es posible prever la dinámica de las uniones sinápticas. Por ejemplo, para el hipocampo se han integrado las aproximaciones del modelo con arreglos de electrodos, de tal manera que al implementar el chip con el modelo matemático predictivo ha sido posible replicar algunas funciones que sustituyen la región CA3 [14].
V. CONCLUSIÓN
Los diferentes avances mostrados tanto en el desarrollo de los electrodos como en el procesamiento y la clasificación de las señales bioeléctricas, además del gran número de aplicaciones de estas tecnologías, hacen pensar en el rápido crecimiento e implementación de estas técnicas en el campo clínico en los próximos años. Sin embargo, se debe señalar que uno de los mayores limitantes que presentan estos sistemas se relaciona con la bioestabilidad de los sistemas implantados. En este sentido, se debe plantear una inquietud ética relacionada con la utilización de pacientes en situación de discapacidad para experimentar con los implantes crónicos. En la actualidad, estos implantes son de corta duración, con tiempos máximos de registro activo de la actividad neuronal no superior a un año. Además, presentan alta probabilidad de desarrollar reacciones infecciosas y no siempre son la opción con la mejor relación costo-beneficio para el paciente (p. ej. se podrían utilizar electrodos superficiales para el control con EEG o EMG). Debido a todo esto, el desarrollo de arreglos de electrodos con mayor estabilidad y capacidad de registro de manera activa por largos períodos es uno de los grandes retos en este campo. Además, es necesario implementar tecnologías telemétricas que reduzcan la posibilidad de desarrollar reacciones infecciosas en la interfaz neuronal. Todo esto permitiría realizar estudios clínicos de mayor duración que impulsen nuevos desarrollos en los sistemas de identificación y clasificación de la señales bioeléctricas.
AGRADECIMIENTO
Al programa de Ingeniería Biomédica del Convenio EIA-CES.
REFERENCIAS
[1] Black M. J., Bienenstocky E., Donoghuey J.P, Serruyay M., Wuz W., Gaoz Y. Connecting Brains with Machines: The Neural Control of 2D Cursor Movement. 1st International IEEE/EMBS Conference on Neural Engineering, pp. 580-583, Capri, Italy, March, 2003. [ Links ]
[2] Kelly S., Burke D., Chazal D., Reilly R. Parametric models and Classification for Direct Brain Interfaces. Proceedings of the Irish Signal and Systems Conference, Cork, Ireland, June 2002. [ Links ]
[3] Curran E., Stokes M. Learning to control brain activity: A review of the production and control of EEG components for driving brain-computer interface (BCI) systems. Brain and Cognition, 51, 326-336, 2003. [ Links ]
[4] Engel K., Moll C., Fried I., Ojemann G. Invasive recordings from the human brain: clinical insights and beyond. Nature reviews (Neuroscience), 6, 35-47, June 2005. [ Links ]
[5] Schwartz A. B. Cortical Neural Prosthetics. Anual Review of Neuroscience, 27, 487-507, Marzo 2004. [ Links ]
[6] Mussa-Ivaldi F., Miller L. Brain-machine interfaces: computational demands and clinical needs meet basic neuroscience. Trends in Neurosciences, 26, 329-334, Junio 2003. [ Links ]
[7] Donhoghue P. Connecting cortex to machines: recent advances in brain interfaces. Nature Neuroscience suplement, 5, 1085-1088, Noviembre 2002. [ Links ]
[8] Ball T., Nawrot M.P., Pistohl T., Aertsen A., Schulze-Bonhage A., Mehring C. Towards an implantable brain-machine interface based on epicortical field potentials. Biomedizinische Technik, 49, 756-759, 2004. [ Links ]
[9] Navarro X., Krueger T. B., Lago N., Misera S., Stieglitz T., Dario P. A critical review of interfaces with the peripheral nervous. Journal of the Peripheral Nervous System, 10, 229-258, 2005. [ Links ]
[10] Shoham S. Advances towards an implantable motor cortical interface. August 2005. Disponible en: http://www.bm.technion.ac.il/niel/index_files/pubs/Shoham_dissertation01.pdf. [ Links ]
[11] Heiduschka P., Thanos S. Implantable bioelectronic interfaces for lost nerve functions. Progress in Neurobiology, 55, 433-461, August 1998. [ Links ]
[12] Stieglitz T., Gross M. Flexible BIOMEMS with electrode arrangements on front and back side as key component in neural prostheses and biohybrid systems. Sensors and Actuators B: chemical, 83, 8-14, Marzo 2002. [ Links ]
[13] Andersen R.A., Burdick J.W., Musallam S., Pesaran B., Cham J.G. Cognitive neural prosthetics. Trends in Cognitive Sciences, 8, 486-493, November 2004. [ Links ]
[14] Pancrazio J. J., Chen D., Fertig S. J., Miller R. L., Oliver E., Peng G.C.Y., Shinowara N. L., Weinrich M., Kleitman N. Toward Neurotechnology Innovation: Report from the 2005 Neural Interfaces Workshop. An NIH-Sponsored Event. Neuromodulation, 9, 1-7, September 2005. [ Links ]
[15] Grill W. M., McDonald J.W., Peckham P. H., Heetderks W., Kocsis J., Weinrich M. At the interface: Convergence of neural regeneration and neural prostheses for restoration of function. Journal of Rehabilitation Research and Development, 38, 633-639, December 2001. [ Links ]
[16] Wolpaw J. R., Birbaumer N., McFarland D.J., Pfurtscheller G., Vaughan T.M. Brain-computer interfaces for communication and control. Clinical Neurophysiology, 113, 767-791, 2002. [ Links ]
[17] Cleveland FES Center. Agosto 2006. Disponible en: http://fescenter.case.edu/Who_We_Are/mission_history.htm. [ Links ]
[18] Taylor D., Tillery S., Schwartz A. Direct cortical control of 3D neuroprosthetic devices. Science, 296, 1829-1832, July 2002. [ Links ]