Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Ingeniería Biomédica
versão impressa ISSN 1909-9762
Rev. ing. biomed. vol.2 no.3 Medellín jan./jun. 2008
SOLUCIONES TERAPÉUTICAS PARA LA RECONSTRUCCIÓN DE LA DERMIS Y LA EPIDERMIS. OPORTUNIDADES EN EL MEDIO ANTIOQUEÑO
Diego A. Velásquez Puerta1,2,3, Catalina Pineda Molina1,2, María E. Cardona Cano1, Nicolás E. Gómez Suarez1, Grete J. Gartz Moises1, Isabel C. Úsuga Gómez1, Diana F. Tróchez Wilchez1, Carolina Londoño Peláez1,2
1 Semillero de Investigación en Biotecnología en Salud, EIA-CES.
2 Laboratorio de Cultivo Tisular, Grupo de Investigación en Ingeniería Biomédica EIA-CES (GIBEC).
3 Dirección para correspondencia: dvelasquez@ces.edu.co.
RESUMEN
En Antioquia, es necesario buscar una solución disponible, efectiva y económicamente viable para afrontar los problemas de la piel de los pacientes que, por accidentes o enfermedades, han disminuido su calidad de vida y se encuentran aislados a la espera de tratamientos que les permitan recuperar la funcionalidad de su cuerpo y les reduzcan los riesgos por la exposición de los tejidos internos. Las diferentes soluciones existentes en el mercado todavía no han llegado a superar algunos obstáculos tales como el cubrimiento de todas las extensiones, los altos costos, la funcionalidad de los tejidos restaurados, los rechazos de tipo inmune y la escasez de los sitios donantes. Este artículo presenta una revisión literaria que busca mostrar las diferentes alternativas de solución para pacientes con problemas de piel, dando énfasis en las soluciones clásicas aplicables y económicamente viables desde la ingeniería de tejidos en el sector antioqueño.
PALABRAS CLAVE: Cultivo de piel, Dermis, Epidermis, Quemaduras, Queratinocitos, Fibroblastos, Regeneración de tejido, Úlceras.
ABSTRACT
In Antioquia (Colombia), there are many patients who suffer dermal injuries caused by accident or disease. Therefore, it is necessary to pursue available, effective and affordable solutions to overcome dermal problems. Physicians and patients are both expecting corrective treatments that can reduce inner tissue exposition and allow the possibility of recovering skin functionality. Although there are many solutions for skin replacement, some obstacles remain, such as: high costs, limited availability of skin for implantation in extended areas, adequate functionality of the restored tissue and immunological rejection. Due to these issues, this article presents some of the existing alternative solutions for patients with skin injuries, considering the histology and physiology of the skin, and regarding the classical and economically attainable solutions to be used in Antioquia.
KEY WORDS: Skin culture, Epidermis, Dermis, Burns, Keratinocytes, Fibroblasts, Tissue regeneration, Ulcers.
I. INTRODUCCIÓN
A pesar del crecimiento y los avances en la tecnología médica, la pérdida de tejidos u órganos como consecuencia de los procesos de envejecimiento, las enfermedades degenerativas o infecciosas, y los accidentes y quemaduras, sigue siendo un serio problema de salud a nivel mundial [1, 2].
Se estima que aproximadamente el 1% de la población mundial puede sufrir de una quemadura seria en algún momento de su vida [1]. En Europa, anualmente, alrededor de un millón de personas recibe atención médica por quemaduras [1]. En Estados Unidos, la incidencia de personas quemadas es de 1,5 millones al año, de las cuales 60.000-80.000 requieren hospitalización, y entre 5.000-6.500 mueren [1, 2]. En Suramérica, las investigaciones epidemiológicas revelan que las causas más usuales corresponden a incidentes domésticos, industriales o laborales, y los agentes más frecuentes son líquidos calientes, seguidos de llama directa y electricidad [1].
Particularmente en Antioquia, se presentan múltiples casos de pacientes con quemaduras accidentales ocasionadas por la manipulación inadecuada de líquidos calientes y pólvora [3]; de igual forma, existe una alta incidencia de pacientes con lesiones crónicas y agudas de la piel, como las úlceras de variada etiología, producidas por la descamación de los tejidos necróticos inflamatorios [3-6].
Gracias al reconocimiento de los elementos de la dermis como soporte para la proliferación celular, y de la piel como sistema de protección para prevenir infecciones y disecaciones, se ha incrementado el desarrollo de sustitutos biológicos y sintéticos para el tratamiento de heridas dermatológicas, facilitando el proceso de curación [7, 8]. Las técnicas de cultivo celular se han convertido en una opción para tal fin; de hecho, la piel fue el primer órgano que se desarrolló en el campo de la ingeniería de tejidos [7, 9]. La ciencia biomédica, enmarcada en la aplicación del conocimiento para la construcción o reparación de órganos, se fundamenta en la aplicación de los principios científicos para el diseño, construcción, modificación, crecimiento y mantenimiento de los tejidos vivos, con la intención de reparar, reemplazar, mantener o mejorar la función particular de un órgano o tejido [10]. El objetivo de este trabajo consiste en realizar una revisión sobre los aspectos histológicos básicos de la piel y las opciones terapéuticas disponibles para el reemplazo de la dermis y la epidermis, ahondando en las soluciones viables, en el sector antioqueño, desde la ingeniería de tejidos.
II. ESTRUCTURA DE LA PIEL: EPIDERMIS Y DERMIS
Es importante conocer la estructura y las funciones de la piel como base para la búsqueda de soluciones alternativas para pacientes con compromiso de dicho tejido. La piel es el órgano más extenso del cuerpo, representa el 15% del peso corporal y cubre aproximadamente 1,7 m2 en el adulto promedio. Como órgano esencial, la piel realiza funciones como proteger contra agresiones externas y microorganismos, mantener el contenido corporal de agua y controlar la temperatura mediante la regulación de las excreciones de sudor, la regulación sensitiva, y absorber la luz ultravioleta, todas ellas funciones fundamentales para una buena calidad de vida [9, 11, 12].
La piel está compuesta por dos capas principales: la epidermis y la dermis [7, 9, 13]. La epidermis es un epitelio plano poli-estratificado y queratinizado que se caracteriza porque las células más superficiales, llenas de queratina, mueren continuamente y se descaman, al tiempo que, para mantener el equilibrio de la estructura, las células más profundas (células madre basales), proliferan y se diferencian continuamente. La epidermis es un modelo completo de diferenciación celular donde hay células madre que progresivamente se diferencian hasta morir [7, 14].
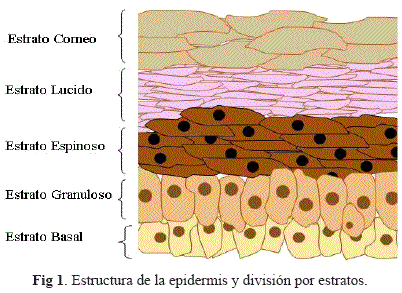
Los queratinocitos son el tipo de células más abundante en esta capa de la piel. Son mitóticamente activos en la capa basal, lo que hace que los recién formados desplacen a los otros queratinocitos hacia la superficie, generando así cinco estratos en la epidermis (Fig. 1) que en orden de profundidad son: estrato basal, estrato espinoso, estrato granuloso, estrato lúcido y estrato córneo [9, 15].
La dermis está formada por tejido conjuntivo que se adhiere a la epidermis y se continúa con la hipodermis. Confiere a la piel resistencia, elasticidad y flexibilidad [2]. Consta de dos capas: una profunda o reticular y otra superficial o papilar [7, 16]. La capa reticular está formada por haces de colágeno tipo I, que se disponen en conjuntos de fibras paralelas que se entrecruzan, y por fibras elásticas que soportan tensiones, evitan desgarros y dotan a la piel de distensibilidad [7, 13, 14]. La capa papilar está compuesta por tejido conectivo laxo con tipos celulares como fibroblastos, macrófagos y mastocitos; y se encuentra constituida por las papilas dérmicas que son profusiones cónicas, a modo de relieves, que se interdigitan con la epidermis [7, 14].
Los fibroblastos dérmicos son un componente esencial de la piel, son los encargados de la producción y organización de la matriz extracelular de la dermis y, además, se comunican unos con otros, llevando a cabo un papel crucial en la regulación de la fisiología de la piel. Son los encargados de liberar factores de crecimiento y citoquinas en los procesos de reparación para modular la actividad de los queratinocitos [3].
III. SOLUCIONES TERAPÉUTICAS MEDIANTE EL USO DE SUSTITUTOS DE PIEL
El reconocimiento de que las heridas de gran extensión requieren una barrera de protección para prevenir las infecciones y disecaciones ha llevado a la evolución de diferentes apósitos naturales y sintéticos así como de sustitutos de piel que restauren las funciones de la barrera epidérmica y se integren para realizar el proceso de curación de la herida [7]. A continuación se muestran algunas de las diferentes alternativas terapéuticas existentes, iniciando con una breve descripción de los injertos, que constituyen, sin lugar a dudas, un estándar básico para la evaluación del desempeño de las soluciones propuestas desde la ingeniería de tejidos [7].
Dichos sustitutos son elaborados en andamios (scaffolds), los cuales pueden ser de diferentes materiales, siempre que permitan la recuperación de la funcionalidad y la apariencia de la piel. Uno de los materiales más usados es el colágeno, abundante en las capas reticular y papilar de la dermis (abarca más del 50% de la piel). Este es ampliamente usado como andamio para cultivos tridimensionales [17], gracias a que no presenta reacción inflamatoria y a que los fibroblastos cultivados en él presentan buena adherencia [18]. Algunos polisacáridos como el ácido hialurónico han sido empleados en conjunto con el colágeno para formar andamios que propicien la migración y la división celular [19].
1. Apósitos naturales
Tradicionalmente se han utilizado diversos métodos quirúrgicos para restaurar la barrera defensiva cutánea dañada. La piel representa uno de los tejidos que más versatilidad ofrece ante el uso de técnicas de criopreservación [20], lo que permite una disponibilidad de tejido casi ilimitada [21]; su aplicación es sencilla permitiendo la conservación y, al momento de uso, descongelación y ubicación directa sobre el área afectada; sin embargo, las propiedades mecánicas y cosméticas de la piel injertada pueden ser pobres y a menudo evoluciona con cicatrización hipertrófica [24].
1.1. Autoinjertos
Una técnica usualmente empleada corresponde al injerto de piel autólogo (autoinjerto), mediante el trasplante de piel desde los sitios sanos hacia las zonas quemadas o lesionadas. Fue introducido por Reverdin en 1871, e incluye la epidermis y cantidades variables de la dermis gracias a que su utilización multi-fenestrada permite la máxima expansión de la piel disponible para el injerto [7, 23-26]. Desde entonces, se ha convertido en un estándar para cubrir las heridas de la piel; no obstante, su uso en pacientes extensamente quemados es limitado por la falta de áreas donantes sanas; además, se requiere de dos o más semanas para poder reutilizarse una misma área donante [21, 26-28]. Debido a que el pronóstico de estos pacientes está determinado por la velocidad en el cierre de sus lesiones, se ha utilizado una gran variedad de coberturas temporales, que en la mayoría de los casos requieren posteriormente el cierre de las áreas con autoinjertos de piel [29].
1.2. Aloinjertos
Dentro de los apósitos biológicos o naturales, los aloinjertos cumplen una función temporal y se dividen en dos tipos: homoinjerto o piel homóloga alogénica, de distinto genotipo entre seres humanos, y heteroinjerto o piel heteróloga alogénica (xenogénica), de otra especie no humana [24, 26, 28]. Este tipo de injertos se trasplanta de una parte orgánica íntegra, como es la piel total o de espesor parcial de otro ser vivo o de cadáver, fresca o preservada [30, 31].
Estudios clínicos han reportado que el uso de aloinjertos de epidermis cultivada in vitro como apósitos biológicos temporales acelera la fase de epitelización de las lesiones de espesor parcial profundo, como en quemaduras de segundo grado, dermoabrasión, úlceras por venostasis o diabetes [32-34]; y en áreas donantes de injertos activan la epitelización de un 30% a un 40% [21, 24, 26, 35-37]. En general, la fijación de este tipo de apósitos a la piel es transitoria y los aloinjertos de piel cultivada son reemplazados por la migración de queratinocitos autógenos a partir de los bordes de la herida y de los elementos epiteliales remanentes [28]. Sin embargo, la duración de los injertos homólogos alogénicos, depende del mecanismo inmunológico de compatibilidad entre las células trasplantadas y las del receptor [38, 39]. Por otro lado, la baja disponibilidad de piel sana para ser ubicada en las grandes extensiones de la lesión, la ausencia de compuestos biológicamente activos en estos apósitos que promuevan una rápida reparación tisular y el riesgo de transmisión de enfermedades, hacen de estos apósitos un recurso poco confiable en el tratamiento del paciente quemado.
2. Apósitos sintéticos
En quemaduras de gran extensión en las que hay una considerable pérdida de piel, se hace necesaria la generación de diferentes sustitutos de piel, temporales o permanentes, que permitan cubrir la demanda de piel sana, insuficiente en los autoinjertos.
Entre los sustitutos temporales sintéticos o acelulares, se encuentran los apósitos aloplásticos, que en algunos casos están formados por delgadas membranas de colágeno procesadas especialmente hasta obtener un material final acelular, pobremente inmunogénico, biocompatible y biodegradable. Dentro de estos sustitutos, la aplicación de polímeros de polisiloxano presenta la ventaja de una mayor accesibilidad clínica. Sin embargo, a pesar de la adición de componentes biológicos como proteoglicanos y colágeno, su duración en el sitio del implante es limitada. Algunos apósitos sintéticos consisten en membranas construidas a partir de dermis natural que se adhieren sobre la lesión y estimulan la vascularización y la formación de gránulos, lo que facilita el implante del injerto [40, 41].
Una técnica utilizada con los sustitutos temporales sintéticos consiste en la regeneración de tejido in vivo usando una bicapa de piel artificial compuesta por una epidermis de silicona que evita la pérdida de agua tal y como lo hace la epidermis normal, y una dermis porosa formada por colágeno bovino y condroitin-sulfato de cartílago de tiburón. Luego de la implantación en el lugar afectado, la porción dérmica es poblada con fibroblastos y vasos sanguíneos, con lo cual se da la correcta regeneración de la dermis. Esta técnica permite la esterilización de la piel producida, así como la disponibilidad inmediata para pacientes quemados [42].
En la actualidad, ya se cuenta con marcas comerciales de piel sintética como Integra® (Integra Lifesciences Corp, Plainsboro, NJ), una matriz porosa de colágeno bovino covalentemente unido a condroitin-6-sulfato que, luego de implantarse, facilita la colonización de los fibroblastos y de células endoteliales que actúan en el remodelado de la matriz dérmica original, permitiendo la regeneración de grandes extensiones de piel lesionadas [43]. Además consta de una cubierta de silicona, que funciona como un sustituto temporal de epidermis, impidiendo el paso de bacterias y la pérdida de líquidos corporales. Una vez la neodermis ha tenido una vascularización parcial, la capa de silicona es removida y reemplazada por queratinocitos autólogos [2] expandidos in vitro, con lo que se logra completamente el sustituto dermo-epidérmico. Esta tecnología posee desventajas en términos económicos, debido a su elevado costo, a los extremos cuidados postoperatorios y a que se requieren dos etapas quirúrgicas: la primera, en la cual se hace el implante de Integra® y la segunda, en la que se cambia el recubrimiento de silicona por el autoinjerto de queratinocitos [44].
3. Sustitutos de piel viviente
Los sustitutos de piel viviente o Apligraf® son el primer y único material humano vivo que hasta ahora ha sido aceptado por la FDA (Food and Drug Administration) para su comercialización. De la misma manera que la piel humana, Apligraf® consta de células vivientes y proteínas estructurales. La capa dérmica combina colágeno bovino tipo I y fibroblastos humanos derivados del prepucio neonatal que producen proteínas adicionales a la matriz. La capa epidérmica se forma por los queratinocitos humanos derivados del prepucio neonatal, que primero se multiplican y luego se diferencian para reproducir la arquitectura de la epidermis humana [45].
Sin tener en cuenta el costo, los sustitutos de piel viviente se consideran como una mejor opción que los reemplazos de piel sintéticos, ya que permiten la producción de un verdadero injerto dermo-epidérmico in vitro, cuyas ventajas son el uso de células autólogas y una rápida disponibilidad. En cambio, los sintéticos no obvian la necesidad de una posterior implantación de queratinocitos, luego de que la dermis ha sido regenerada [45].
4. Cultivo in vitro de piel autóloga
El desarrollo de equivalentes biológicos de la epidermis y dermis corresponde a uno de los objetivos clínicos prioritarios de la ingeniería de tejidos. Esta área de la bioingeniería utiliza concepciones y métodos propios de la ingeniería para el desarrollo de órganos y tejidos de reemplazo que, en el caso de la piel, corresponden a su producción in vitro o incluso in vivo.
En la década de los setenta se desarrollaron los primeros acercamientos. Karasek y Charlton encontraron que los queratinocitos tratados con tripsina son capaces de crecer sobre láminas plásticas [46-48]. Rheinwald y Green describieron un sistema capaz de generar grandes superficies de epitelio estratificado mediante la proliferación y crecimiento in vitro de los queratinocitos, a través del uso combinado de fibroblastos murinos 3T3 irradiados, factor de crecimiento epidérmico [46], medio de cultivo y diversos factores biológicos tales como insulina para facilitar la absorción de glucosa y aminoácidos, transferrina para la detoxificación del hierro, hidrocortisona que promueve la proliferación celular y la formación de contactos intercelulares, triodotironina, que tiene acción mitogénica sobre los queratinocitos y la toxina colérica que activa el AMPc. Los fibroblastos irradiados contribuyen transitoriamente al crecimiento y adhesión de los queratinocitos mediante la producción de factores que en su mayor parte no son bien conocidos [49]. Desde entonces, la técnica se ha perfeccionado y desarrollado ampliamente, ofreciendo la oportunidad de realizar diversas investigaciones tanto in vivo como in vitro [50-56].
La reconstrucción in vitro de la piel comprende el aislamiento de los queratinocitos epidérmicos y los fibroblastos dérmicos del propio paciente, así como su expansión mediante técnicas de cultivo específicas, pasando por la construcción de una matriz o soporte dérmico para el cultivo final de las células en cuestión [57].
En el laboratorio, los queratinocitos son aislados a partir de biopsias de piel mediante la digestión con tripsina en presencia del ácido [etilendiamina] tetra-acético (EDTA), un quelante de Ca2+ [46]. La suspensión celular obtenida contiene normalmente cierta cantidad de fibroblastos dérmicos, los cuales no entorpecen el cultivo de los queratinocitos. No obstante, para evitar el crecimiento excesivo de los fibroblastos, se prefiere como paso previo aislar la dermis mediante tratamiento enzimático a nivel de las uniones intercelulares [58].
Este fiable procedimiento permite expandir los queratinocitos aproximadamente 10.000 veces su número inicial [57]. Así, 2 cm2 de piel donante son suficientes para cubrir una superficie corporal equivalente a 2m2, lo que constituye una de las bases fundamentales del interés clínico en los sustitutos epidérmicos [59]. Sin embargo, desde una perspectiva clínica, presenta dificultades relacionadas con la elevada fragilidad que los injertos de epidermis cultivada poseen en ausencia de equivalentes dérmicos.
Para solventar esta dificultad, y basados en las características funcionales de la dermis, como soporte mecánico, barrera de defensa y nutrición, elasticidad y resistencia a las fuerzas de tracción, se han utilizado matrices de colágeno bovino (permeables y porosas), a las cuales se les inyectan los fibroblastos dérmicos obtenidos a partir de la misma biopsia de piel inicial [60]. Dentro de las matrices producidas se encuentran aquellas que contienen mezclas de colágeno tipos I y III, como gel o como malla, que proporcionan firmeza y resistencia a través del colágeno; también están las matrices que poseen fibroblastos embebidos en otros constituyentes de la lámina basal como la laminina y la fibronectina, que ayudan al anclaje de las células epiteliales [20].
Posteriormente, las matrices completas son sumergidas en un medio de crecimiento e incubadas durante siete días para obtener la capa dérmica. Finalmente, los queratinocitos epidérmicos son cultivados sobre la capa dérmica de forma similar a la piel natural. Con esta metodología se consigue que los equivalentes dérmicos permitan la diferenciación de los queratinocitos epidérmicos de manera más eficiente y completa, aumentando notablemente la estabilidad mecánica de la epidermis trasplantada y sus propiedades cosméticas [60].
Potencialmente, el compartimiento epidérmico podría ser completado con melanocitos para asegurar la pigmentación normal de la piel injertada. En la piel ideal construida in vitro todos los constituyentes tisulares, sus relaciones espaciales y funcionales deberían estar conservados, incluyendo las singulares propiedades estéticas de la piel.
IV. CONCLUSIÓN
Los sustitutos disponibles a nivel mundial permiten reemplazar la pérdida de piel en los pacientes quemados o con heridas crónicas. En Antioquia, región donde se necesita encontrar una solución terapéutica para el gran número de pacientes quemados, los sustitutos de piel autóloga cultivados in vitro son una opción viable. Además de ser económica, con su utilización se logran disminuir las reacciones inmunológicas del implante y el riesgo de transmisión de enfermedades.
Para lograr el objetivo, es necesario realizar una búsqueda constante de las investigaciones en el campo de la ingeniería de tejidos de piel y aprovechar los avances tecnológicos mundiales para aplicarlos en el ámbito local. Esto permitirá mejorar las características y la ejecución de los sustitutos de piel desarrollados.
En el futuro cercano, la estandarización de los protocolos para la extracción y cultivo de células dermo-epidérmicas, el desarrollo de matrices para dichos cultivos y su optimización, a través de la inclusión de componentes de la matriz extracelular y de factores de crecimiento propios de la piel, contribuirán al desarrollo de nuevas terapias de regeneración de piel efectivas. Así mismo, abrirán una puerta de esperanza para los pacientes antioqueños que han sufrido quemaduras extensas o úlceras y que por tal motivo han disminuido su calidad de vida.
REFERENCIAS
[1] Franco M., Gonzáles N., Díaz M., Pardo S., Ospina S. Epidemiological and clinical profile of burn victims Hospital Universitario San Vicente de Paúl, Medellín, 1994-2004. Burns, 32, 1044-1051, marzo 2006. [ Links ]
[2] Schulz III J.T., Tompkins R.G., Burke J.F. Artificial skin. Annual Review of Medicine, 51:231-244, 2000. [ Links ]
[3] Vélez L. M., Moreno J.A. Balance de la campaña de prevención de accidentes por pólvora en Antioquia 1986-2005: aún son muchas las personas quemadas. Boletín Información para la Acción-BIA-. Dirección Seccional de Salud de Antioquia, Dirección de Salud Pública. Medellín, noviembre 2005. [ Links ]
[4] Cony M., Donatien P.H., Beylot C., Géniaux M., Maleville J., Bézian J.H., Taïeb A. Treatment of leg ulcers with an allogeneic cultured-keratinocyte-collagen dressing. Clinical and Experimental Dermatology, 15(6), 410-414, Nov 1990. [ Links ]
[5] Pineda G, Rodríguez, B. Las úlceras por presión: un reto para el cuidado de enfermería y la rehabilitación en el ámbito domiciliario. Trabajo de grado. Enfermeras, Universidad de Antioquia, 2000. [ Links ]
[6] Pérez D, Ramírez L.M. Plan de negocios para la comercialización de colchones antiescaras. Trabajo de Grado, Ingenieros Biomédicos, EIA-CES, 2006. [ Links ]
[7] Horch R.E., Kopp J., Kneser U., Beier J., Bach A.D. Tissue engineering of cultured skin substitutes. Journal of Cellular and Molecular Medicine, 9(3), 592-608, Jul-Sep 2005. [ Links ]
[8] Jaksic T., Burke J.F. The use of "artificial skin" for burns. Annual Review of Medicine, 38:107-117, 1987. [ Links ]
[9] Souto L.R., Rehder J., Vasallo J., Cintra M.L., Kraemer M.H., Puzzi M.B. Model for human skin reconstructed in vitro composed of associated dermis and epidermis. Sao Paulo Medical Journal, 124(2), 71-76, Mar 2006. [ Links ]
[10] Langer R., Vacanti J.P. Tissue engineering. Science, 260: 920-926, 1993. [ Links ]
[11] Pérez P., Cote C., Arévalo F. Obtención de láminas de piel humana mediante ingeniería de tejidos. Acta Científica Venezolana, 55(1), 74-82, 2004. [ Links ]
[12] Boranic M., Jakic Razumovic J., Stanovic S., Kljenak A., Fattorini I. Skin cell culture: utilization in plastic surgery and laboratory studies. Lijec Vjesn, 121(4-5), 137-143, Apr-May 1999. [ Links ]
[13] Tortora G.J., Grabowski S.R. Principios de anatomía y fisiología. Harcourt, 1996. Capítulos 5-22, 127, 139, 701. [ Links ]
[14] García J.A., Hurlé J.M. Anatomía Humana. McGraw Hill-Interamericana, 2005, Capítulo 2, 16-18. [ Links ]
[15] Watt F.M. The epidermal keratinocyte. Bioessays, 8(5), 163-167, 1988. [ Links ]
[16] Gartner L. P., Hiatt J. L., Texto Atlas de Histología Segunda Edición, McGraw-Hill, 2001. Capitulo 14, 311-327. [ Links ]
[17] Friess W. Collagen - biomaterial for drug delivery. European Journal of Pharmaceutics and Biopharmaceutics. 45, 113 - 136. 1998. [ Links ]
[18] Kisnser A, Lesiak-Cyganowska E, Sladowski D. In Vitro reconstruction of full thickness human skin on a composite collagen material. Cell and Tissue Banking, 2, 165-171. 2001. [ Links ]
[19] Park SN, Park JC, Kim HO, Song MJ, Suh H. Characterization of oporous collagen/hyaluronic acid scaffold modified by 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide cross-linking. Biomaterials, 23, 1205-1212. 2002. [ Links ]
[20] Teepe R.G.C., Koebrugge E.J., Ponec M., Vermeer B.J. Fresh versus cryopreserved cultured allografts for the treatment of chronic skin ulcers. British Journal of Dermatology, 122(1), 81-89, 1990. [ Links ]
[21] Arámbula H., Sierra E., Gónzalez N.E., Rodríguez A., Juarez E., Marsch M., Kuri W. Frozen human epidermal allogeneic cultures promote rapid healing of facial dermabrasion wounds. Dermatologic Surgery, 25(9), 708-712, Sep. 1999. [ Links ]
[22] Tamariz E., Meytha M., Castro F., Tsutsumi V., Kuri W. Frozen cultured sheets of human epidermal keratinocytes enhance healing of full-thickness wounds in mice. Cell and Tissue Research, 296(3), 575-585, 1999. [ Links ]
[23] Davis J.S. The story of plastic surgery. Annals of Surgery, 113(5), 641-656, May 1941. [ Links ]
[24] Núñez H., Castro F., Kuri W. Combined use of allograft and autograft epidermal cultures in therapy of burns. Plastic and Reconstructive Surgery, 98(6), 929-939, 1996. [ Links ]
[25] Reverdin J.L. Greffe épidermique. Bull. De la Soc. Impériale de Chir. de Paris, 493-511, 1869. [ Links ]
[26] Rivas M.T., Amato D., Arámbula H., Kuri W. Controlled clinical study of skin donor sites and deep partial-thickness burns treated with cultured epidermal allografts. Plastic and Reconstructive Surgeon, 98(2), 279-287, Aug 1996. [ Links ]
[27] De Luca M., Albanese E., Bondanza S., Megna M., Ugozolli L., Molina F., Cancedda R., Santi P.L., Bormiolli M., Stella M., Magliacani G. Multicentre experience in the treatment of buns with autologous and allogenic cultured epithelium, fresh or preserved in a frozen state. Burns: journal of the International Society for Burn Injuries, 15(5), 303-309, Oct 1989. [ Links ]
[28] Cuenca J., Alvarez C.J. Tratamiento de quemaduras masivas con autoinjertos mallados y aloinjertos. Cirugía Plástica, 9(2), 78-82, 1999. [ Links ]
[29] Rivas TT. Comparación de los resultados clínicos obtenidos con aloinjertos de epidermis cultivada y vendaje seco adhesivo (papel de poro fino) en áreas donadoras de piel de espesor intermedio en pacientes quemados. Tesis de maestría, UNAM 1993. [ Links ]
[30] Barletta L., Mansilla, E.R. Skin substitutes for burns: classification. Revista Argentina de Quemaduras, 15(1), enero-abril, 2000. [ Links ]
[31] Heck E.L., Bergstresser P.R., Baxter C.R. Composite skin grafts: frozen dermal allografts support the engraftment and expansion of autologous epidermis. The Journal of Trauma, 25(2), 106-112, Feb. 1985. [ Links ]
[32] Nanchahal J., Dover R., Otto W.R. Allogeneic skin substitutes applied to burns patients. Burns: journal of the International Society for Burn Injuries, 28(3), 254-257, May 2002. [ Links ]
[33] Leigh I.M., Purkis P.E., Navsaria H.A., Phillips T.J. Treatment of chronic venous leg ulcers with sheets of cultured allogenic keratinocytes. British Journal of Dermatology, 117, 591-597, 1987. [ Links ]
[34] Leigh I.M., Purkis P.E., Navsaria H.A., Phillips T.J. Treatment of chronic venous ulcers with sheets of cultured allogenic keratinocytes, British Journal of Dermatology, 117(5), 591-597, 1987. [ Links ]
[35] Bolívar J., Poumian E., Marsch M., Montes de Oca G., Kuri W. Use of cultured human epidermal keratinocytes for allografting burns and conditions for temporary banking of the cultured allografts. Burns: journal of the International Society for Burn Injuries, 16(1), 3-8, 1990. [ Links ]
[36] Bolívar J., Kuri W. Cryopreserved epidermal cultures promote healing of chronic and complicated leg ulcers. Dermatol Surg, 25, 610, 1999. [ Links ]
[37] Alvarez C., Cuenca J., Sosa A., Juárez E., Kuri W. Controlled clinical study of deep partial thickness burns treated with frozen cultured human allogeneic epidermal sheets. The Journal of Burn Care and Rehabilitation, 21(4), 291-299, Jul-Aug 2000. [ Links ]
[38] Mackenzie I.C, Fuseniq N.E. Regeneration of organized epithelial structure. The Journal of Investigative Dermatoly, 81(1 suppl), 189s-194s, jul 1983. [ Links ]
[39] Mindikoglu A.N., Centinkale O. Prolonged allograft survival in a patient with extensive burns using cyclosporin. Burns: journal of the International Society for Burn Injuries, 9(1), 70-72, 1993. [ Links ]
[40] Wainwright DJ. Use of an cellular allograft dermal matrix (AlloDerM) in the management of full-thickness burns. Burns 1995, 21(4):243-248. [ Links ]
[41] Wainwright D., Madden M., Luterman A., Hunt J., Monafo W., Heimbach D., Kagan R., Sittig K., Dimick A., Herndon D. Clinical evaluation of an acellular allograft dermal matrix in full thickness burns, The Journal of Burn Care and Rehabilitation, 17(2), 124-136, Mar-Apr 1996. [ Links ]
[42] Burke J.F., Yannas I.V., Quinby W.C., Bondoc C.C., Jung W.K. Successful use of physiologically acceptable artificial skin in the treatment of extensive burn injury. Annals of Surgery, 194(4), 413-428, 1981. [ Links ]
[43] Yannas I.V., Burke J.F., Orgill D.P., Skrabut E.M. Wound tissue can utilize a polymeric template to synthesize a functional extension of skin. Science, 215, 174-176, Jan. 1982. [ Links ]
[44] Vásquez F, Ayala J, et al. Primeros avances en el tratamiento del niño gran traumatizado con piel artificial Integra®, Cir. Pediatr, 14, 91-94, 2001. [ Links ]
[45] Schuster K.M., Martens M., Goldenberg M., Tai C., Strande L., Hewitt C.W. Production of a novel fibroblast-populated platelet matrix cocultured with keratinocytes, Tissue Engineering, 13(7), 1493-500, Jul 2007. [ Links ]
[46] Rheinwald J.G., Green H. Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells. Cell, 6(3), 331-344, 1975. [ Links ]
[47] Llombart A. Explantaciones celulares. Ed. Icharompena S. L. Zarauz, San Sebastián, España, Centro de Estudios Científicos, 1938. [ Links ]
[48] Liu J.J, Karasek M. Isolation and Growth of Adult Human Epidermal Keratinocytes in Cell Culture. Journal of Investigative Dermatology, 71, 157-164, 1978. [ Links ]
[49] Calderón W., Calderón R. Cultivo de queratinocitos humanos en monocapa. Revista Boliviana de dermatología, 1(1), 11-14, 2002. [ Links ]
[50] Grossman R.M., Krueger J., Yourish D, Granelli P., Murphy D.P., May L.T., Kupper T.S., Sehgal P.B., Gottlieb A.B. Interleukin 6 is expressed in high levels in psoriatic skin and stimulates proliferation of cultured human keratinocytes. Proceedings of the National Academy of Sciences of the United States of America, 86(16), 6367-6371, 1989. [ Links ]
[51] O'Connor N.E, Mulliken J., Banks O., Green H. Grafting of burns with cultured epithelium prepared from autologous epidermal cells. Lancet, 1, 75-78, January 1981. [ Links ]
[52] O'Connor N.E, Gallico C.G., Compton C.C., Kehinde O., Green H. Grafting of burns with cultured epithelium prepared from autologous epidermal cells II: intermediate term results in three pediatric patients. Soft and Hard tissue repair, Biological and clinical aspects, 11, 283-292, 1984. [ Links ]
[53] Gallico C.G., O' Connor N.E., Compton C.C., Kehinde O., Green H. Permanent wound coverage of large burn wounds with autologous cultured human epithelium. The New England Journal of Medicine, 331(7), 448-451, Aug 1984. [ Links ]
[54] Cuono C, Landon R, McGuire J. Use of cultured epidermal autograft and dermal allografts as skin replacement after burn injury. Lancet, 1, 1123-1124, May 1986. [ Links ]
[55] Madden M.R., Finkelstein J.L., Staiano L, Goodwin C.W., Shires G.T., Nolan E.E., Hefton J.M. Grafting of cultured allogeneic epidermal on second and third degree burn wounds on 26 patients. The Journal of Trauma, 26(11), 955-962, 1986. [ Links ]
[56] Kumagai N., Nishina H., Tanabe H., Hosaka T., Ishida H., Ogino Y. Clinical application of autologous cultured epithelia for the treatment of burn wounds and burn scars. Plastic and Reconstructive Surgery, 82(1), 99-110, Jul 1988. [ Links ]
[57] Liu S.C., Karasek, M. Isolation and growth of adult human epidermal keratinocytes in cell culture, The Journal of Investigative Dermatology, 92(4 Suppl), 164s, 1989. [ Links ]
[58] Concha M., Vidal M.A., Moreno I., Salem C., Figueroa C.D., Schmitt D., Péquet J. Evidence for modulation of human epidermal differentiation and remodeling by CD40. British Journal of Dermatology, 148(6), 1105-1114, Jun 2003. [ Links ]
[59] Liu S.C., Parsons C.S. Serial cultivation of epidermal keratinocytes from psoriatic plaques. Journal of Investigative Dermatology, 81(1), 54-61, 1983. [ Links ]
[60] Kangesu T., Navsaria H.A., Manek S., Fryer P.R., Leigh I.M., Green C.J. Kerato-dermal grafts: the importance of dermis for the in vivo growth of cultured keratinocytes. British Journal of Dermatology, 46(5), 401-409, 1993. [ Links ]
[61] Lago G, Coto G, Oruña L., En: Rev. Cubana de Farmacia. 2002; 36: no.3, 182-188. [ Links ]
[62] Zhang L., Ma D., Wang F., Zhang Q. The modification of scaffold material in building artificial dermis. Artificial cells, Blood Substitutes and Biotechnology, 30, 319-332, 2002. [ Links ]
[63]Yan J., Xuemin L., Liu L., Wang F., Zhu T., Zhang Q. Potential use of collagen-chitosan-hyaluronan tri-copolymer scaffold for cartilage tissue engineering. Artificial Cells, Blood Substitutes and Biotechnology, 34, 27-39, 2006. [ Links ]