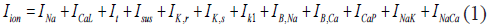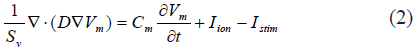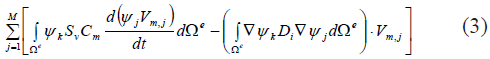Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Ingeniería Biomédica
Print version ISSN 1909-9762
Rev. ing. biomed. vol.2 no.4 Medellín July/Dec. 2008
EFECTO DEL REMODELADO ELÉCTRICO AURICULAR EN UN MODELO TRIDIMENSIONAL DE AURÍCULA HUMANA
Catalina Tobón Zuluaga1,2, Carlos Ruiz Villa1,3, Javier Saiz Rodríguez1, Elvio Heidenreich4
1 Instituto de Investigación e Innovación en Bioingeniería, Universidad Politécnica de Valencia, España.
2 Grupo de Investigación en Ingeniería Biomédica EIA-CES (GIBEC), Colombia. catozu1@doctor.upv.es.
3 Facultad de Ingeniería, Universidad de Caldas, Colombia.
4 Grupo de Estructuras y Modelado de Materiales, Universidad de Zaragoza, España.
Recibido 18 de agosto de 2008. Aceptado 20 de septiembre de 2008
RESUMEN
Las arritmias cardíacas más frecuentes en humanos tienen origen auricular. El modelado de la actividad auricular se ha convertido en una importante herramienta en el análisis de arritmias como la fibrilación auricular. Estudios experimentales han demostrado que la fibrilación auricular tiende a perpetuarse, generando cambios electrofisiológicos denominados remodelado auricular. En este trabajo se presenta un modelo tridimensional geométricamente realista de la aurícula humana, al cual se le incorporan: anisotropía, dirección de las fibras y heterogeneidad en la conductividad. En un modelo del potencial de acción acoplado al modelo tridimensional, se estudió el efecto del remodelado auricular sobre el potencial de acción y su propagación teniendo en cuenta sus efectos sobre las corrientes iónicas. El modelo reprodujo el comportamiento de la actividad eléctrica en toda la superficie auricular. El remodelado redujo la duración del potencial de acción, el periodo refractario efectivo y la velocidad de conducción. Los resultados sugieren que en el modelo tridimensional desarrollado, es posible simular la actividad eléctrica auricular en condiciones fisiológicas y con remodelado eléctrico auricular.
PALABRAS CLAVE: Arritmias auriculares, Corrientes iónicas, Modelo tridimensional, Potencial de acción, Remodelado auricular.
ABSTRACT
The most common cardiac arrhythmias in humans originate in the atrium. Modelling of the atrial activity has become an important tool to analyze arrhythmias such as atrial fibrillation. Experimental studies have shown that atrial fibrillation tends to be perpetual, generating electrophysiological changes called atrial remodeling. In this study we present a geometrically realistic three-dimensional (3D) model of human atrium, which incorporates anisotropy, direction of the fibers and conductive heterogeneity. The effects of remodeling on the ionic currents were applied to an action potential model coupled to the 3D model. The effects of remodeling on the action potential and its propagation were studied the model reproduced the electrical activity behavior across the atrial surface. Remodelling induced a reduction in the action potential duration, the effective refractory period and the conduction velocity. Our results suggest that in the developed 3D model of human atrium is possible to simulate the atrial electrical activity under physiological conditions and with atrial electrical remodeling.
KEY WORDS: Atrial arrhythmias, Ionic currents, 3D Models, Action potential, Atrial remodeling.
I. INTRODUCCIÓN
Las arritmias cardíacas son perturbaciones eléctricas en el corazón, que pueden variar en severidad. Las arritmias más frecuentes en humanos están relacionadas con las aurículas; la fibrilación auricular (FA), por ejemplo, provoca con frecuencia síntomas discapacitantes y severas complicaciones tales como fallo y paro cardíacos [1]. Típicamente, las taquiarritmias auriculares se caracterizan por una activación rápida e irregular de la aurícula (300-500 bpm) [2], lo cual resulta en una masiva reducción de su contractilidad. Clásicamente se han utilizado dos teorías para explicar esta actividad caótica; por un lado, la presencia de un foco ectópico que emitiría impulsos eléctricos de forma muy rápida que se conducirían al resto de la aurícula. Por otro lado, se ha desarrollado la teoría de múltiples frentes de onda re-entrantes que recorrerían de forma aleatoria el miocardio. Asimismo, se ha demostrado que la FA induce alteraciones en las propiedades auriculares que la perpetúan; estos cambios son llamados "remodelado auricular". El remodelado auricular se ha descrito en varios modelos animales [3] y humanos [4]. Es un conjunto de cambios en las propiedades auriculares: cambios en la estructura anatómica, cambios eléctricos y cambios en las uniones intercelulares llamadas gap junctions.
Los cambios eléctricos causan una disminución del periodo refractario, producido por un acortamiento significativo de la duración del potencial de acción (DPA) [2,4-5]. Se cree que el acortamiento de la DPA es el responsable de la iniciación y favorece la permanencia de múltiples ondas reentrantes en una masa limitada de tejido auricular, como lo sugieren diferentes estudios experimentales [2,4]. Otros estudios han demostrado que, bajo condiciones de remodelado eléctrico, la velocidad de conducción en el tejido auricular sufre cambios importantes [6-7]. Además, la compleja geometría de las aurículas, la anisotropía del tejido en la conducción y la orientación de las fibras en el tejido auricular cumplen un papel importante durante la propagación del potencial de acción (PA) y en la iniciación y perpetuación de las arritmias auriculares [8-9].
Hoy en día, algunos de los tratamientos de las arritmias auriculares están basados en consideraciones empíricas y experimentación en animales o humanos; todavía muchos de los mecanismos subyacentes siguen sin estar claros.
El desarrollo de modelos tridimensionales (3D) electrofisiológicamente detallados y anatómicamente realistas permite, por tanto, reproducir con mayor precisión el comportamiento eléctrico del tejido, tanto en condiciones fisiológicas como con remodelado eléctrico, permitiendo así una mejor comprensión de las patologías auriculares. Sin embargo, la compleja anatomía de la aurícula y los altos costes computacionales han hecho que la mayoría de los estudios se lleven a cabo en modelos de tejido auricular simplificados. Los modelos computacionales requieren una transacción entre los siguientes aspectos: complejidad del modelo de membrana celular, complejidad de la estructura del tejido cardíaco (monodominio o bidominio), tamaño del tejido y número de nodos espaciales, complejidad de la anatomía representada, duración de los eventos simulados, estabilidad y precisión de los métodos numéricos. Por tanto, los modelos típicos desarrollados consisten en tejido bidimensional (2D) de unos pocos centímetros cuadrados [10-11], o modelos 3D de estructura anatómica simplificada [12] o con una extremada simplificación del comportamiento celular [13]. En la actualidad se están desarrollando modelos 3D mejorados [14] que tienen en cuenta estructuras como los músculos pectíneos, venas pulmonares, cresta terminal y haz de Bachmann, los cuales tienen gran importancia en las patologías auriculares.
En este trabajo, se presenta un modelo computacional de aurícula humana, de estructura tridimensional y acoplado a él un modelo electrofisiológico complejo de miocito auricular, con el objetivo de reproducir la actividad eléctrica auricular, tanto en condiciones fisiológicas como con remodelado eléctrico auricular.
II. MATERIALES Y MÉTODOS
Modelo electrofisiológico
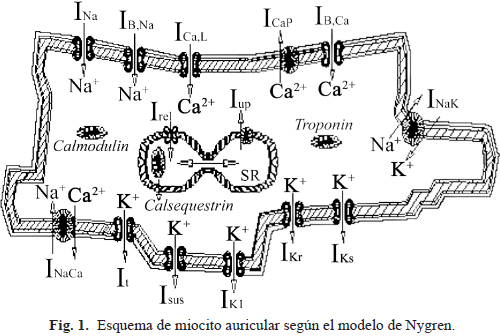
El modelo electrofisiológico del PA de célula de aurícula humana implementado es el formulado por Nygren et al. [15] (Fig. 1). La membrana celular es modelada eléctricamente como un condensador conectado en paralelo con resistencias variables que representan los canales iónicos. La corriente iónica total (Iion) viene dada por:
Iion incluye cada una de las corrientes iónicas que se conoce contribuyen al potencial de acción en los miocitos de aurícula humana: corriente rápida de sodio (INa), corriente de calcio de los canales tipo L (ICaL), corrientes de potasio, transitoria y sostenida (It y Isus), corriente de potasio independiente del tiempo (IK1), componentes lenta y rápida de la corriente diferida rectificadora de potasio (IK,s y IK,r); las corrientes a través de las bombas de calcio (Ca2+) y de sodio-potasio (Na+-K+) e intercambiadores Na+-Ca+ responsables de mantener las concentraciones iónicas intracelulares (ICaP, INaK y INaCa), y las corrientes de fondo de Na+ y Ca+ (IB,Na y IB,Ca). El modelo celular actualiza constantemente las concentraciones de Na+, K+ y Ca2+. El modelo consiste en el circuito equivalente de Hodgkin-Huxley [16] para el sarcolema, acoplado con un modelo de compartimento fluido, en el cual el retículo sarcoplásmico es dividido en dos compartimentos: de entrada de calcio y de salida de calcio. Adicionalmente, el modelo tiene en cuenta el espacio intercelular, pequeño espacio que rodea la célula en el cual puede ocurrir acumulación o agotamiento de iones.
La propagación eléctrica a través del tejido cardíaco incluye tanto el compartimiento intracelular como el extracelular (bidominio). Sin embargo, ya que el dominio extracelular tiene una conductividad mucho mayor que el dominio intracelular, hemos reducido el tiempo de cómputo suponiendo que el dominio extracelular está conectado a una toma de tierra, implementando así un modelo monodominio. El modelo matemático de propagación del PA se basa en aplicar la teoría de líneas eléctricas y se describe por la siguiente ecuación de reacción-difusión en el dominio intracelular:
donde Vm es el potencial transmembrana, Sv es la proporción superficie/volumen, D es el tensor de conductividad, Cm es la capacidad de membrana e Istm es la corriente de estimulación transmembrana que puede ser aplicada externamente para empezar la propagación en el tejido.
Remodelado eléctrico
Los datos experimentales reportados por Bosh et al. [5] y Workman et al. [4] han demostrado que episodios de FA inducen cambios en la conductancia y cinética de los canales iónicos de miocitos auriculares en humano. Estos cambios se han incorporado en el modelo electrofisiológico de célula de aurícula humana, con el fin de reproducir el remodelado eléctrico auricular. Las modificaciones hechas a diferentes parámetros en el modelo fueron: un incremento del 250% en la conductancia del canal IK1, una disminución del 74% en la conductancia del canal ICaL, una disminución del 85% en la conductancia del canal It, un incremento del 62% en la cinética de la rápida inactivación de ICaL, la curva de activación de It fue desplazada +16 mV y la curva de inactivación de INa fue desplazada +1,6 mV. Con estos cambios, el modelo modificado puede reproducir el potencial de acción de miocitos auriculares de pacientes que han sufrido remodelado eléctrico auricular.
Modelo anatómico
En la Fig. 2 se detallan las diferentes regiones anatómicas del modelo 3D de aurícula humana implementado. El desarrollo del modelo se describe en estudios previos [17]. El modelo fue ajustado a las especificaciones anatómicas de Wang et al. [18] y Cohen et al. [19]; de esta manera: el modelo incluye las aurículas izquierda y derecha, unión interauricular, músculos pectíneos, fosa oval y su anillo conductor, haz de Bachmann, cresta terminal, apéndices derecho e izquierdo, seno coronario, venas pulmonares derechas e izquierdas, venas cavas superior e inferior y orificios para las válvulas tricúspide y mitral. Adicionalmente, se definió una zona cercana a la vena cava superior donde se delimitó el nodo sinoauricular. El modelo consiste en 50.825 elementos hexaédricos y 98.090 nodos. La discretización espacial (separación entre nodos) varía desde 0,032 cm a 0,09 cm.
El modelo se dividió en 22 zonas de acuerdo con la dirección de los principales haces, con el fin de asignar a cada zona una dirección de fibra realista, con base en datos obtenidos de estudios histológicos de aurícula humana [20]. En cada una de las zonas se trazó un eje perpendicular a la dirección de la fibra. La perpendicular a este eje y a su normal se proyectó sobre la superficie para obtener la dirección. El sistema se resolvió algebraicamente, determinando el direccionamiento de todos los puntos de cada una de las regiones.
Se identificaron zonas de conductividad alta (cresta terminal, haz de Bachmann y anillo de la fosa oval), baja (istmo de la aurícula derecha y fosa oval) y media (el resto del tejido auricular). Los valores asignados a las conductividades fueron de 0,25, 0,40 y 0,10 S/cm para las zonas de conductividad media, alta y baja respectivamente. Las velocidades de conducción fueron medidas en tres zonas de diferente conductividad, entre dos nodos separados una distancia aproximada de 1 cm, ubicados en la dirección longitudinal de la fibra.
Se consideró una anisotropía 2:1 en el tejido auricular, excepto en el istmo de la aurícula derecha, el cual fue considerado isotrópico. La dirección en sentido longitudinal de la fibra es considerada paralela a la dirección de los grandes haces.
Los modelos electrofisiológicos de potencial de acción sin remodelado eléctrico y con él fueron integrados en el modelo 3D de aurícula humana.
Método numérico
Para resolver la ecuación (2) en cada uno de los nodos del modelo 3D, se implementó el método de los elementos finitos. Se utilizó la aproximación de Galerkin para la ecuación monodominio. Aplicando residuos ponderados, integrando por partes y discretizando el dominio en e elementos podemos escribir la ecuación como:
En donde se tiene un sistema de MxM ecuaciones. Puesto que los elementos comparten nodos globales, el sistema no puede resolverse por separado, por tanto, se ensambla todo el conjunto en un solo sistema de ecuaciones. En este punto se incorporan las características particulares de la geometría de los elementos, las propiedades estructurales del tejido para el direccionamiento de la fibra y los parámetros de la conductividad en Di.
Para generar la anisotropía 2:1 del tejido, se implementó la siguiente matriz Di (expresada en función de la resistividad total del tejido ρ):
La discretización temporal para la resolución del sistema de ecuaciones fue de 20 µs, necesaria para una apropiada discretización de la rápida corriente entrante de sodio, corriente indispensable para la despolarización de la membrana celular.
Protocolo de estimulación
Se aplicó un tren de 10 impulsos en el nodo sinoauricular, con el fin de simular el ritmo sinusal del corazón. Cada estímulo consiste en un pulso rectangular de corriente de 6 ms de duración cuya amplitud (5.600 nA) es 20 veces superior a la mínima amplitud capaz de provocar un PA en una sola célula aislada (280 pA); este incremento en la amplitud es necesario para que la corriente sea capaz de superar las resistencias de acoplamiento entre células que aparecen a la hora de formar modelos multicelulares. La longitud del ciclo base fue de 1.000 ms, equivalente a un ritmo cardíaco de 60 bpm. Para medir el periodo refractario efectivo (PRE), definido como el periodo que debe transcurrir después de haberse generado un PA para que un segundo PA pueda iniciarse y propagarse a lo largo del tejido, se aplicó un protocolo de estimulación S1-S2. Este protocolo consiste en aplicar un estímulo prematuro S2 después de establecer el ritmo sinusal con un tren de impulsos (S1). El intervalo de acoplamiento se disminuye progresivamente hasta que no se genere un segundo PA.
III. RESULTADOS Y DISCUSIÓN
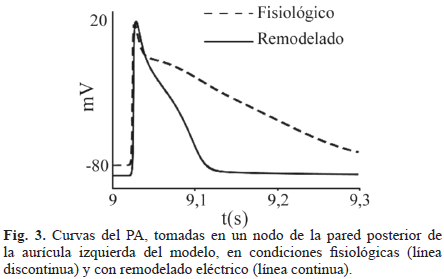
Una vez aplicado el protocolo de estimulación se seleccionó un nodo en la pared posterior de la aurícula izquierda del modelo para obtener las curvas del PA. En la Fig. 3 se muestran las gráficas del PA del décimo impulso sinusal, obtenidas tanto en condiciones fisiológicas como con remodelado eléctrico. Se observó una marcada disminución de la DPA. En condiciones fisiológicas de la DPA fue de 312 ms y con remodelado fue de 94 ms. El PRE medido fue de 285 ms en condiciones fisiológicas y de 89 ms con remodelado, lo que indica una disminución tanto de la DPA como del PRE del 70%. Estos resultados son cuantitativamente similares a datos obtenidos experimentalmente por Bosch et al. y Workman et al. [4-5] y a los obtenidos de simulaciones llevadas a cabo por Zhang et al. [21] y Semman et al. [22].
La disminución de la DPA y el PRE se debe a los cambios aplicados a las corrientes iónicas; la reducción en las corrientes It e ICaL favorecen el acortamiento de la fase de meseta del PA y el incremento en la corriente IK1 favorece una pronta repolarización, siendo esta corriente la que más contribuye al acortamiento de la DPA y el PRE. Estos cambios a su vez han generado alteraciones en las corrientes Isus e INaCa, en las cuales se observa una reducción considerable a partir de la fase de meseta del PA, contribuyendo de igual forma al acortamiento de la DPA.
Adicionalmente, el potencial en reposo fue de -74 mV en condiciones fisiológicas y de -81 mV con remodelado, lo que sugiere una hiperpolarización de 7 mV en el potencial de reposo.
Tomando el décimo impulso sinusal como referencia para analizar el patrón de conducción global en el modelo, observamos cómo en el modelo con remodelado eléctrico la secuencia de propagación se retrasó progresivamente desde 5 ms al inicio de la propagación hasta 18 ms al final de la despolarización auricular.
Una vez activado el nodo sinoauricular, la onda de propagación se extendió rápidamente por la pared posterior de la aurícula derecha, como consecuencia del incremento en la conductividad de la cresta terminal (Fig. 4A). A los 46 ms en condiciones fisiológicas y a los 55 ms con remodelado, el frente atravesó completamente el haz de Bachmann para empezar la activación de la aurícula izquierda; 7 ms más tarde el frente de onda cruzó el anillo de la fosa oval para contribuir a la activación de la aurícula izquierda (Fig. 4B). El haz de Bachmann y el anillo de la fosa oval representan las conexiones interauriculares.
A los 60 ms en condiciones fisiológicas y a los 68 ms con remodelado, el frente de onda despolarizó por completo la pared libre de la aurícula derecha; estos resultados concuerdan con datos experimentales (≈60 ms) reportados por Boineau et al. [23]. A los 91 ms en condiciones fisiológicas y a los 104 ms con remodelado, la aurícula derecha se despolarizó por completo, en la aurícula izquierda el frente se extendió por toda la pared posterior y comenzó a despolarizar el apéndice izquierdo y venas pulmonares izquierdas (Fig. 4C). La despolarización auricular se produjo a los 120 ms en condiciones fisiológicas y a los 138 ms con remodelado, terminando en la porción distal del apéndice izquierdo. Lin et al. [24] reportaron en un estudio llevado a cabo en 21 pacientes que la duración de la onda P era de 114 ms; por otra parte, Canavan et al. [25] presentaron un mapa de activación, en el cual la última activación en la aurícula ocurrió justo antes de los 120 ms. Sin embargo, estos dos autores mencionan que la última activación ocurre en la región postero-lateral de la aurícula derecha. Nuestros resultados concuerdan con observaciones publicadas por Cabrera et al. [26], en donde la activación auricular termina en el apéndice izquierdo.
Como se puede observar en la Fig. 4C, en condiciones fisiológicas la aurícula se encuentra aún en la fase de meseta del PA, por el contrario, con remodelado la mayor parte de la aurícula derecha ya se ha repolarizado. La repolarización auricular se produjo a los 432 ms en tejido normal y a los 234 ms con remodelado.
La velocidad de conducción en el sentido longitudinal de las fibras, medida en zonas de conductividad alta, haz de Bachmann y cresta terminal, fue de 101 cm/s en condiciones fisiológicas y en condiciones de remodelado fue de 75 cm/s y 78 cm/s. Los estudios experimentales llevados a cabo por Boineau et al. [23] sobre velocidades de conducción en la cresta terminal (en condiciones fisiológicas normales) presentan valores de 70 a 130 cm/s. Dolber y Spach [27] reportaron velocidades de conducción en el haz de Bachmann de 92 a 167 cm/s.
La velocidad de conducción longitudinal medida en la pared posterior de la aurícula izquierda en el modelo (zona de conductividad media) fue de 81 cm/s en condiciones fisiológicas y de 68 cm/s con remodelado. Estos valores se encuentran dentro del rango reportado por Hansson et al. [28] (68 cm/s a 103 cm/s).
La velocidad de conducción medida en el istmo, zona de baja conductividad, fue de 60 cm/s en condiciones fisiológicas y de 51 cm/s con remodelado. Estos resultados son acordes a datos experimentales. Así, Shah et al. [29] midieron velocidades de conducción en el istmo de 17 pacientes con Flutter (vuelco) auricular, el promedio fue de 60 cm/s. Por su parte, Feld et al. [30] reportaron valores similares en pacientes sin Flutter (50 cm/s a 55 cm/s).
Los valores obtenidos de las velocidades de conducción en las diferentes zonas en el modelo con remodelado eléctrico mostraron una disminución de entre un 15% y un 26%. Estos resultados son acordes a datos obtenidos en estudios experimentales [31], donde se ha observado una marcada disminución de la velocidad de conducción en el tejido auricular remodelado. En estudios llevados a cabo por Gaspo et al. [7], provocaron FA sostenida en 7 perros y obtuvieron una reducción media del 25% en las velocidades de conducción.
La Tabla 1 muestra las velocidades de conducción y el porcentaje de disminución obtenidos en las diferentes zonas de conductividad alta, media y baja en el modelo, en condiciones fisiológicas y con remodelado eléctrico.
IV. CONCLUSIÓN
Implementando un modelo de potencial de acción auricular acoplado a un modelo tridimensional geométricamente realista de aurícula humana, fue posible reproducir el patrón de activación eléctrica en toda la superficie auricular en condiciones fisiológicas y de remodelado eléctrico auricular.
El remodelado eléctrico redujo en un 70% la duración del potencial de acción y el periodo refractario efectivo, y entre un 15% y un 26% la velocidad de conducción. Estos resultados son acordes a datos publicados en estudios experimentales.
AGRADECIMIENTO
Agradecemos el soporte financiero recibido por la Consellería de Empresa Universidad y Ciencia de la Generalitat Valenciana (BFPI06/068) y el Plan Nacional de Investigación Científica, Desarrollo e Innovación Tecnológica del Ministerio de Educación y Ciencia de España (TEC2005-04199).
REFERENCIAS
[1] Wolf P., Benjamin E., Belanger A., Kannel W., Levy D., D'Agostino R. Secular trends in the prevalence of atrial fibrillation: The Framingham study. Amer. Heart J., 113, 790-796, 1996. [ Links ]
[2] Nattel S. New ideas about atrial fibrillation 50 years on. Nature, 415, 6868, 219-226, 2002. [ Links ]
[3] Wijffels M.C.E.F., Kirchhof C.J.H.J., Dorland R., Allessie M.A. Atrial fibrillation begets atrial fibrillation a study in awake chronically instrumented goats. Circulation, 92, 7, 1954-1968, 1995. [ Links ]
[4] Workman A.J., Kane A.K., Rankin A.C. The contribution of ionic currents to changes in refractoriness of human atrial myocytes associated with chronic atrial fibrillation. Cardiovasc. Res., 52, 2, 226-235, 2001. [ Links ]
[5] Bosch R.F., Zeng X., Grammer J.B., Popovic C.M., Mewis C., Kuhlkamp V. Ionic mechanisms of electrical remodeling in human atrial fibrillation. Cardiovasc. Res., 44, 121-131, 1999. [ Links ]
[6] Shinagawa K., Mitamura H., Takeshita A., Sato T., Kanki H., Takatsuki S., Ogawa S. Determination of refractory periods and conduction velocity during atrial fibrillation using atrial capture in dogs. J Am Coll Cardiol, 35, 246-253, 2000. [ Links ]
[7] Gaspo R., Bosch R.F., Talajic M., Nattel S. Functional mechanisms underlying tachycardia-induced sustained atrial fibrillation in a chronic dog model. Circulation, 96, 4027-4035, 1997. [ Links ]
[8] Lesh M.D., Kalman J.M., Olgin J.E., Ellis W.S. The role of atrial anatomy in clinical atrial arrhythmias. J Electrocardiol, 29, 1, 101-113, 1996. [ Links ]
[9] Wilders R., Wagner M.B., Golod D.A., Kumar R., Wang Y.G., Goolsby W.N., Joyner R.W., Jongsma H.J. Effects of anisotropy on the development of cardiac arrhythmias associated with focal activity. Pflugers Arch, 441, 301-312, 2000. [ Links ]
[10] Pandit S.V., Berenfeld O., Anumonwo J.M.B., Zaritski R.M., Kneller J., Nattel S., Jalife J. Ionic determinants of functional reentry in a 2-D model of human atrial cells during simulated chronic atrial fibrillation. Biophysical J, 88, 3806-3821, 2005. [ Links ]
[11] Zhang H., Liu J-H., Garratt C.J., Holden A.V. Competitive interactions between ectopic foci and reentry in virtual human atrium. Annual Conference of Computers in Cardiology, Lyon, France, 32, 73-76, 2005. [ Links ]
[12] Jacquemet V. A biophysical model of atrial fibrillation and electrograms: Formulation, validation and applications. PhD thesis, Swiss Federal Institute of Technology, 2004. [ Links ]
[13] Blanc O., Virag N., Vesin J.M., Kappenberger L. A computer model of human atria with reasonable computation load and realistic anatomical properties. IEEE Trans Biomed Eng, 48, 11, 1229-1237, nov, 2001. [ Links ]
[14] Seemann G., Höper C., Sachse F.B., Dössel O., Holden A.V., Zhang H. Heterogeneous 3D anatomical and electrophysiological model of human atria. Phil. Trans. R. Soc. A, 364, 1465-1481, 2006. [ Links ]
[15] Nygren A., Fiset C., Firek L., Clark J.W., Lindblad D.S., Clark R.B. Mathematical model of an adult human atrial cell-The role of K+ currents in repolarization. Circ. Res., 82, 1, 63-81, 1998. [ Links ]
[16] Hodgkin A.L., Huxley A.F. A quantitative description of membrane current and its application to conductance and excitation in nerve. Journal of Physiology, 117, 500-544, 1952. [ Links ]
[17] Ruiz C., Tobon C., Saiz J., Heidenreich E., Hornero F. Propagación de Potencial de Acción en un Modelo 3D Realista de Aurícula Humana. Congreso Anual de la Sociedad Española de Ingeniería Biomédica, Madrid, España, 24, 113-116, 2006. [ Links ]
[18] Wang K., Ho S.Y., Gibson D.G., Anderson R.H. Architecture of Atrial Musculature in Humans. British Heart Journal, 73, 559-565, 1995. [ Links ]
[19] Cohen G.I., White M., Sochowski R.A., Klein A.L., Bridge P.D., Stewart W.J., Chan K.L. Reference values for normal adult transesophageal echocardiographic measurements. J. Am. Soc. Echocardiogr., 8, 221-230, 1995. [ Links ]
[20] Ho S.Y., Sanchez-Quintana D., Anderson R.H. Can anatomy define electric pathways? International Workshop on Computer Simulation and Experimental Assessment of Electrical Cardiac Function, Lausanne, Switzerland, 77-86, 1998. [ Links ]
[21] Zhang H., Zhu J.J., Garratt C.J., Holden A.V. Cellular modelling of electrical remodelling in two different models of human atrial myocytes. Annual Conference of Computers in Cardiology, Thessaloniki, Greece, 30, 777-780, 2003. [ Links ]
[22] Seemann G., Ying H., Weiss D.L., Sachse F.B., Dössel O. Effects of electrophysiological remodeling in human right atrium: a simulation study. Annual Conference of Computers in Cardiology, Lyon, France, 32, 69-72, 2005. [ Links ]
[23] Boineau J.P., Canavan T.E., Schuessler R.B., Cain M.E., Corr P.B., Cox J.L. Demostration of a widely distributed atrial pacemaker complex in the human heart. Circulation, 77, 1221-1237, 1988. [ Links ]
[24] Lin J.L., Lai L.P., Lin L.I., Tseng Y.Z., Lien W.D., Huang S.K. Electrophysiological determinant for induction of isthmus dependent counterclockwise and clockwise atrial flutter in humans. Heart, 81, 73-81, 1999. [ Links ]
[25] Canavan T.E., Schuessler R.B., Boineau J.P., Corr P.B., Cain M.E., Cox J.L. Computerized global electrophysiological mapping of the atrium in patients with Wolff-Parkinson-White syndrome. Ann Thorac Surg, 46, 223-231, 1988. [ Links ]
[26] Cabrera J.A., Sanchez-Quintana D., Ho S.Y., Medina A., Anderson R.H. The architecture of the atrial musculature between the orifice of the inferior caval vein and the tricuspid valve: the anatomy of the isthmus. J Cardiovasc Electrophysiol, 11, 1186-1195, 1998. [ Links ]
[27] Dolber P., Spach M.S. Thin collagenous septa in cardiac muscle. Anat. Rec., 218, 45-55, 1987. [ Links ]
[28] Hansson A., Holm M., Blomstrom P., Johansson R., Luhrs C., Brandt J., Olsson S. Right atrial free wall conduction velocity and degree of anisotropy in patients with stable sinus rhythm studied during open heart surgery. Eur Heart J., 19, 293-300, 1998. [ Links ]
[29] Shah D.L., Jais P., Haissaguerre M., Chouairi S., Takahashi A., Hocini M., Garrigue S., Clementy J. Three-dimensional mapping of the common atrial flutter circuit in the right atrium. Circulation, 96, 3904-3912, 1997. [ Links ]
[30] Feld G.K., Mollerus M., Birgersdotter-Green U., Fujimura O., Bahnson T.D., Boyce K., Rahme M. Conduction velocity in the tricuspid valve-inferior vena cava isthmus is slower in patients with type I atrial flutter compared to those without a history of atrial flutter. J Cardiovasc Electrophysiol, 8, 1338-1348, 1997. [ Links ]
[31] Shinagawa K., Mitamura H., Takeshita A., Sato T., Kanki H., Takatsuki S., Ogawa S. Determination of refractory periods and conduction velocity during atrial fibrillation using atrial capture in dogs. J Am Coll Cardiol, 35, 246-253, 2000. [ Links ]