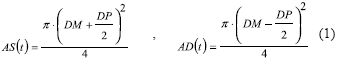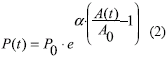Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Ingeniería Biomédica
versão impressa ISSN 1909-9762
Rev. ing. biomed. vol.3 no.6 Medellín jul./dez. 2009
SIMULACIÓN DE LA INFLUENCIA DE LA ELASTICIDAD PARIETAL SOBRE EL ÍNDICE AMBULATORIO DE RIGIDEZ ARTERIAL AASI
SIMULATION OF THE ARTERIAL ELASTICITY INFLUENCE ON THE AMBULATORY ARTERIAL STIFFNESS INDEX AASI
Matías J. Valero1, Damian Craiem1,2,3, Juan Manuel F. Caputo1, Guido Guzman1, Sebastián Graf1,2, Ricardo L. Armentano1
1 Facultad de Ingeniería, Ciencias Exactas y Naturales. Universidad Favaloro, Argentina.
2 CONICET, Argentina.
3 Dirección para correspondencia: dcraiem@favaloro.edu.ar.
Recibido 16 de abril de 2009. Aceptado 22 de octubre de 2009
RESUMEN
Recientemente se propuso un índice de rigidez arterial denominado AASI (Ambulatory Arterial Stiffness Index) derivado de mediciones ambulatorias de presión arterial durante 24 horas. Su asociación como índice de rigidez y la influencia estadística de la dispersión en los valores presivos continúa bajo discusión. Proponemos estudiar estas controversias en el contexto de un modelo estadístico. Se realizó una simulación con valores similares a los de pacientes de arterias normales, rígidas y compliantes, utilizando 3 curvas exponenciales presión-diámetro. Se generaron diámetros pulsátiles aleatorios siguiendo distribuciones normales y se obtuvieron presiones sistólicas y diastólicas en tiempos paramétricos equivalentes a 24 horas. Se calculó el AASI como uno menos la pendiente de la regresión de presión arterial sistólica y diastólica. El AASI del grupo normal resultó 0,42, aumentó a 0,50 en el rígido y disminuyó a 0,34 en el compliante (siempre con r2>0,9). Disminuir la dispersión del rango de presiones provocó una disminución de r2 en la regresión de la nube de puntos de presión sistólica y diastólica, aumentando artificialmente el AASI. Por primera vez la elasticidad no-lineal de la pared arterial ayuda a explicar la asociación del AASI como índice de rigidez arterial. La simulación corrobora que la dispersión de los valores presivos condicionan el cálculo del AASI debido a su naturaleza estadística.
PALABRAS CLAVE: AASI, Hipertensión, MAPA, Presión arterial, Rigidez arterial.
ABSTRACT
Recently, an arterial stiffness index called AASI (Ambulatory Arterial Stiffness Index) calculated from ambulatory blood pressure measurements during 24 hours was proposed. The associations with arterial stiffness and the pressure dispersion dependence remain under discussion. We propose to study these controversies in a statistical model framework. A simulation was performed including values similar to the ones in patients with normal, rigid and compliant arteries. Three exponential curves of pressure-diameter were simulated. Based on diameters randomly generated following normal distributions, systolic and diastolic pressures were calculated in a 24h parametric time. AASI was calculated as one minus the slope of the regression of systolic to diastolic pressure. The AASI for the normal group was 0,42, increased to 0,50 in the rigid group and decreased to 0,34 in the compliant case (always r2>0,9). A dispersion decrease in the pressure values was followed by an r2 decrease in the diastolic vs systolic pressure regression, artificially increasing AASI. For the first time the non-linearity of the arterial wall helps to explain the association of AASI with a stiffness index. The simulation corroborates that 24 h pressure variability conditions AASI values due to its statistical nature.
KEY WORDS: AASI, Hypertension, ABPM, Arterial pressure, Arterial stiffness.
I. INTRODUCCIÓN
Debido a que las enfermedades cardiovasculares son una de las principales causas de muerte en países desarrollados y emergentes, se trabaja permanentemente en el desarrollo de índices que permitan predecir precozmente su evolución patológica. Se ha demostrado que la velocidad de onda pulso (VOP) es un índice independiente que predice la rigidez arterial y está asociado, entre otros, a la predicción de riesgo cardiovascular [1-4]. El fenómeno físico asociado al índice se basa en que para arterias más rígidas la velocidad de propagación de la onda de presión aumenta. A pesar de medirse por un método no invasivo, la VOP requiere equipamiento relativamente sofisticado. El AASI (Ambulatory Arterial Systolic Index) se ha propuesto recientemente como un índice de rigidez arterial calculado como uno menos la pendiente de la regresión lineal entre las mediciones ambulatorias durante 24 horas de presión diastólica (PD) y presión sistólica (PS) [5]. Debido a la amplia disponibilidad de equipos de medición ambulatoria de presión arterial (MAPA) en centros de salud, la posibilidad de estimar la rigidez arterial como índice complementario resulta muy atractiva. Más aún, se ha sugerido que el AASI puede ser un estimador fiable de riesgo cardiovascular [6]. Sin embargo, muchas son las voces críticas que cuestionan la asociación directa del AASI con un índice de rigidez arterial [7-8]. Conceptualmente, la rigidez de un material requiere la medición simultánea de una fuerza y una deformación. En el caso particular de las arterias, las mismas podrían estimarse con mediciones de presión y diámetro pero difícilmente sólo con presiones periféricas como sugiere el método.
La justificación fisiológica detrás del AASI es aún un motivo de discusión. En primer lugar se discute su explicación teórica, ya que se asume que un aumento dinámico de la presión provoca un aumento proporcionalmente mayor de la PS que de la PD. Por este motivo, la regresión entre los valores de PD y PS durante el día tiende a una recta de pendiente menor que 1. La curva presión-diámetro (p-d) arterial es no lineal y tiene forma exponencial. Un aumento en la PD produce un mayor incremento de la PS. De esta manera, la regresión entre PD y PS confirmaría una pendiente menor que la identidad. Cuanto mayor sea la rigidez arterial, más pronunciada es la no-linealidad p-d, más aumenta la PS en proporción a la PD y menor sería la pendiente de la regresión PD-PS (mayor sería el AASI).
En segundo lugar, se ha criticado el hecho que en pacientes con baja dispersión en los valores de las presiones a lo largo del día, el AASI arroja valores menores por causas estadísticas. Por ejemplo, en pacientes que no presentan reducción en la presión durante la noche (denominados "non dippers"), la nube de puntos PD-PS sobre la cual se traza la regresión es más circular y cae la correlación por un efecto de dispersión [9].
El presente trabajo propone utilizar un modelo estadístico para verificar si cambios en la elasticidad arterial se asocian a cambios en el AASI. Asimismo, se analizará si desde un punto de vista estadístico, la dispersión en los valores de presión durante 24 horas influye sobre ese índice.
II. MATERIALES Y MÉTODOS
La simulación se realizó sobre la base de generar números aleatorios para los diámetros y estimar los valores de presión a través de la elasticidad arterial. La programación de los algoritmos se desarrolló en los laboratorios de la Facultad de Ingeniería, Ciencias Exactas y Naturales de la Universidad Favaloro utilizando una PC (Pentium 4, 133MHz) en C++ (Borland Builder 6.0).
A. Justificación estadística
Los valores simulados de diámetro (o área seccional) de cada latido, que alimentan el modelo propuesto, se generaron con base en una distribución normal (gaussiana). Los diámetros y presiones arteriales durante el día tienen variaciones propias del ritmo circadiano. Para analizar su distribución utilizamos datos de 1000 pacientes seleccionados aleatoriamente de la base de datos del hospital Broussais de París (Francia), provistos del centro de medicina preventiva cardiovascular. Recuperamos los valores de presión sistólica y diastólica de la medición ambulatoria de presión arterial (MAPA) y calculamos los histogramas. Se aplicaron pruebas de normalidad sobre los valores de PS y PD de 24 horas. Se utilizaron las pruebas de normalidad de Kolmogorov, Jarque-Bera y Lilliefors disponibles en Matlab® y se calculó el porcentaje de pacientes cuya distribución de valores presivos 24 horas se asumía gausseana.
B. Modelo
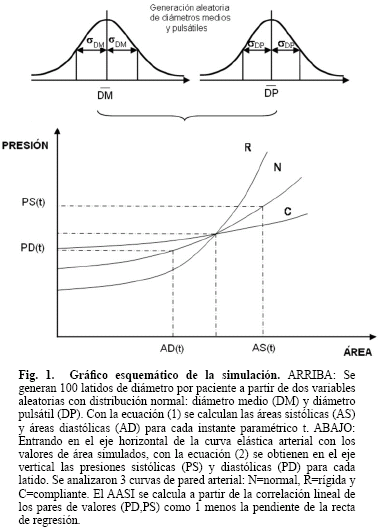
En la Fig. 1 se presenta un gráfico esquemático de la relación no lineal Presión-Área transversal arterial (P-A) adoptada para tres grupos de pacientes con rigidez N=normal, R=rígida y C=compliante. Inicialmente, se generaron dos variables aleatorias independientes con distribuciones normales: la primera para diámetros medios (DM) (media 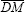 y desviación estándar σDM), y la segunda para diámetros pulsátiles (DP) (media
y desviación estándar σDM), y la segunda para diámetros pulsátiles (DP) (media 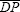 y desviación estándar σDP). Para cada par de valores de DM y DP generados en un instante paramétrico de tiempo t, se calcularon las áreas transversales sistólicas AS(t) y áreas diastólicas AD(t) correspondientes, suponiendo arterias de geometría cilíndrica:
y desviación estándar σDP). Para cada par de valores de DM y DP generados en un instante paramétrico de tiempo t, se calcularon las áreas transversales sistólicas AS(t) y áreas diastólicas AD(t) correspondientes, suponiendo arterias de geometría cilíndrica:
Ingresando en el eje de las abscisas de la Fig. 1 y a través de las curvas presión-área, se calcularon en las ordenadas las presiones sistólicas PS(t) y diastólicas PD(t) correspondientes. La curva no lineal P-A se simuló siguiendo una ley exponencial utilizada previamente en otras publicaciones [10-14]:
donde P0 es el valor de la presión para un área transversal de referencia A0 y α es una constante de rigidez. Los valores de α para generar los 3 grupos de pacientes con diferente rigidez arterial de la Fig. 1 y el resto de los parámetros de la simulación se encuentran en la Tabla 1. Se adoptaron estos valores asumiendo un diámetro braquial medio de 5 mm y eligiendo valores de α que produzcan presiones en un amplio rango (50-200 mmHg). Como la generación de valores es aleatoria, siempre existe la posibilidad que algún valor extremo salga de estos rangos. Sería equivalente a asumir que algún latido durante el día excede los valores habituales. Finalmente, estos casos poco probables no modifican los resultados del índice AASI ya que no modifican la estadística central.
C. Simulación de pacientes con diferente rigidez arterial
Se conformaron 3 grupos de 10 pacientes simulados cada uno. Cada grupo representó pacientes con diferente rigidez arterial (N: normal, R: rígida y C: compliante). Para cada paciente, se generaron 100 valores de diámetro aleatorios DM y DP para instantes paramétricos de tiempo t, siguiendo una distribución normal y utilizando los parámetros de las 2 primeras filas de la Tabla 1. Luego, se calcularon AS(t) y AD(t) según (1) y finalmente se obtuvieron las correspondientes presiones PS(t) y PD(t) utilizando la relación no lineal (2). Estos valores simulan para cada paciente las 100 mediciones en 24 horas realizadas habitualmente por un equipo de MAPA.
Con los 100 pares de valores PS y PD resultantes para cada paciente, se calculó la regresión lineal y el AASI definido como AASI = - β, donde β es la pendiente de la recta de regresión con valores PS en abscisa y PD en ordenada. También se calcularon los coeficientes de correlación de Pearson (r2) para cada regresión, la media y el desvío estándar de los valores de presión resultantes en cada caso. Se agruparon los resultados de los 10 pacientes de cada grupo, promediando los resultados.
D. Simulación de pacientes con diferente dispersión
En este caso se simularon 5 grupos de 10 pacientes cada uno. Todos con igual rigidez arterial pero con diferente dispersión en los valores de DM y DP. Se utilizaron los parámetros de la Tabla 1 para simular al paciente dispersión normal y luego se modificaron las 2 primeras líneas aumentando o disminuyendo los valores de las desviaciones estándar según los siguientes criterios:
- Referencia: DM=5,0±0,2 mm, DP=0,50±0,05 mm.
- Alta dispersión DM (ADDM): DM=5,0±0,4 mm.
- Baja dispersión DM (BDDM): DM=5,0±0,1 mm.
- Alta dispersión DP (ADDP): DP=0,5±0,1 mm.
- Baja dispersión DP (BDDP): DP=0,5±0,025 mm.
III. RESULTADOS
De los 1000 pacientes analizados, 940 registraron más de 30 mediciones en sus monitores de MAPA. Los resultados positivos de las pruebas de normalidad de la distribución de las presiones medias fueron las siguientes: la prueba de Kolmogorov arrojó un 98%, la prueba de Llilliefors 75% y la de Jarque-Bera 83%. En resumen, los valores de presión siguieron una distribución normal.
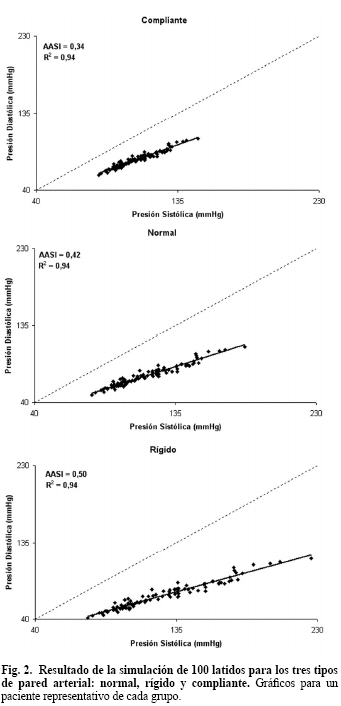
En la Fig. 2 se observan los 100 pares de valores PS- PD simulados para un paciente representativo de cada grupo. En cada caso se trazó la recta de regresión y se calculó el AASI y el coeficiente de correlación. Note cómo a medida que las arterias son más rígidas, las pendientes de las rectas de regresión disminuyen, aumentando consecuentemente el valor de AASI. En la Tabla 2 se informan los valores resumidos de presión sistólica, diastólica y pulsátil de cada grupo.
En la Fig. 3 se dibujan los resultados para diferentes dispersiones en los diámetros DM y DP. Note cómo para los pacientes con alta dispersión del DM con respecto a los de baja variabilidad del DM, la nube de puntos se extiende ampliando su rango de valores presivos, el r2 aumenta y el AASI disminuye. Al aumentar la dispersión del DP y con respecto a la baja dispersión de DP, cae el r2 y la pendiente, elevándose el valor del AASI. Los resultados numéricos para diferentes dispersiones de diámetro se informan en la Tabla 3.
IV. DISCUSIÓN
El AASI es un índice que en la literatura se asoció inicialmente a la rigidez arterial. Luego se probó que correlacionaba también con mortalidad por eventos cardiovasculares. Sin embargo, en el caso de la rigidez, las correlaciones con índices validados como la velocidad de onda de pulso (VOP) resultó pobre (coeficiente de correlación r~0.5). De hecho, las razones fisiológicas que ligan al AASI con la rigidez arterial han sido ampliamente cuestionadas. En el presente trabajo se simularon mediciones de presión arterial durante 24 horas para pacientes con diferencias en su rigidez arterial, expresadas en curvas presión-diámetro (p-d) no lineales con distinto exponente. El AASI mostró ser sensible a estas diferencias: aumentó en los pacientes de arterias rígidas y disminuyó en aquellos con vasos compliantes. Además, se verificó la dependencia del AASI con la dispersión de valores de presión 24 horas. En este sentido creemos que la simulación de arterias con una respuesta exponencial ayuda a comprender la asociación del AASI como índice indirecto de rigidez arterial y a estudiar su dependencia con la variabilidad de la presión durante el día. El efecto no lineal presente en la elasticidad de la pared arterial es el responsable que ante un aumento de presión media, la presión sistólica aumente proporcionalmente más que la diastólica. El aumento será mayor en arterias más rígidas (α mayor) y producirá una menor pendiente en la regresión PS-PD. Es así como en este trabajo se sugiere que este fenómeno es parcialmente responsable de la asociación documentada entre AASI y rigidez arterial.
Las arterias son tejidos heterogéneos y están compuestas esencialmente por elastina, colágeno y músculo liso. Para bajos niveles de presión, la elastina actúa como un resorte ideal de baja elasticidad. A medida que la presión aumenta, el reclutamiento de las rígidas fibras de colágeno evita la expansión del diámetro, aumentando la elasticidad del conjunto. Así, la curva presión-diámetro en arterias posee una relación exponencial que suele llamarse bifásica: fase elastina para bajas presiones y colágeno para altas [15]. El modelo exponencial refleja este comportamiento (Fig. 1). El músculo liso vascular interviene como regulador activo de la relación p-d, modificando la viscosidad parietal y alterando dinámicamente la curva dependiendo su grado de activación [16]. A lo largo de un día, el ventrículo bombea sangre hacia la periferia creando diámetros pulsátiles proporcionales al volumen eyectado en cada latido. Los diámetros diastólicos y sistólicos (DD y DS) se corresponden a las presiones homólogas (PD y PS, respectivamente) a través de la elasticidad arterial. Debido a la forma exponencial de la curva p-d, puede verse que en la fase lineal de elastina (bajas presiones), presión pulsátil y diámetro pulsátil son proporcionales. Sin embargo, para diámetros mayores dentro de la zona empinada del colágeno, al mismo diámetro pulsátil le corresponde una PS proporcionalmente mayor que a la PD. Para un individuo en reposo, el registro del bucle p-d gira en sentido horario en torno al codo de la curva bifásica [15]. A lo largo de 24 horas, la variabilidad en la eyección cardiaca provoca que los valores de diámetro se ubiquen en torno a ese codo. En este trabajo, donde se asumió una relación no-lineal para la curva p-d, por primera vez se permite corroborar conceptualmente por qué al aumentar la presión media, la PS aumenta proporcionalmente más que la PD. Los pacientes con mayor rigidez arterial poseen curvas aún más empinadas, aumentando la diferencia PS-PD. Esto se confirma en los registros de MAPA de pacientes con rápidas VOP, donde las regresiones PD en contra de PS tienen menor pendiente y por lo tanto mayor AASI [17], tal como se observa en los resultados simulados de la Fig. 2.
Los valores de diámetro simulados fueron estimados para la arteria braquial con una media de 5,0 mm y una pulsatilidad del orden del 10%. En el grupo normal y con un valor de coeficiente de rigidez α=2,10, las PD y PS resultaron 73 y 116 mmHg, respectivamente. Cuando se incrementó α=2,75, la PS subió hasta 127 mmHg y la PD bajó hasta 69 mmHg. En el caso de α=1,50, la PS resultó 107 mmHg y la PD 78 mmHg. Con estos valores, el AASI pasó de 0,42 para el grupo normal a 0,50 en el grupo rígido y 0,34 en el compliante. Estos resultados son coherentes con trabajos previos. Por ejemplo Baumann et al. [18], dividiendo a la población estudiada en percentiles de AASI, encontraron valores de PS y PD similares: PS=118 mmHg y PD=72 mmHg para un rango de AASI=0,27-0,34, PS=124 mmHg y PD=76 mmHg para AASI=0,34-0,50 y PS=122 mmHg y PD=76 mmHg para AASI=0,50-0,78. Además, en trabajos previos de nuestro grupo incluyendo 628 pacientes, del cual un 70% era hipertenso, PS=134±14 mmHg y PD=84±11 mmHg con AASI=0,38±0,14 [19]. Resultados similares pueden verificarse en otros trabajos [5,9,20].
Una controversia que surge en la literatura involucra el análisis estadístico de la regresión sobre la nube de puntos PD en contra de PS [20]. El inconveniente se plantea en pacientes para los cuales la dispersión de la presión durante 24 horas es limitada. Este fenómeno se da por ejemplo en casos donde durante la noche las presiones no disminuyen (pacientes denominados "non-dipers"). Para estos últimos, la nube de puntos más concentrada produce una caída en el coeficiente de correlación y puede producir una variación de la pendiente (modificando el AASI). Un coeficiente de correlación bajo produce una disminución en la pendiente de la recta de regresión y por lo tanto aumenta en forma ficticia el AASI. De hecho, recientemente se demostró que los estudios de MAPA con un r2<0.36 deben ser descartados para el análisis del AASI por estos motivos [21]. Estos resultados se confirman en la simulación observando la Fig. 3, donde al cambiar la dispersión en los DM y DP generados, efectivamente se modifica el AASI. Tal como se discutió en mediciones reales [22], la simulación confirma que si los valores de presión durante el día poseen mayor excursión, el coeficiente de correlación aumenta, la pendiente aumenta y el AASI cae (equivalente a pacientes denominados "dippers" cuya presión nocturna cae >10% con respecto a la diurna). Este efecto puede observarse en la segunda línea de la Fig. 3. También observe que aumentar la dispersión del DP disminuye el r2 y produce un aumento del AASI (tercera línea de la Fig. 3). En resumen, como el AASI se calcula con base en una regresión, el coeficiente de correlación juega un rol esencial para validar los datos de la pendiente que, en última instancia, determinan el valor del AASI.
En todo trabajo de simulación existen limitaciones debido a simplificaciones adoptadas en los modelos. En este trabajo se optó por utilizar a los diámetros como variable independiente de excitación en todos los grupos y calcular la presión como variable dependiente. Como se verificó en pacientes, las presiones durante 24 horas siguen en su mayoría una distribución normal. Evidentemente, existe un grupo de pacientes cuyo ritmo circadiano modifica esta distribución. Sin embargo, aun en pacientes non-dippers, a pesar que los valores de día y de noche sean similares (y no caigan durante la noche) la distribución podría seguir siendo gausseana. Son necesarios nuevos estudios para elucidar estos temas. Por otro lado, el valor de DP se consideró el mismo para N, R y C a pesar de que es sabido que la distensión de las arterias rígidas es menor que en los otros casos. Se podrían modificar estos valores en función de cada grupo. Se decidió mantenerlos fijos para permitir una comparación más clara. También note que los 3 grupos de pacientes fueron simulados con curvas p-d que cruzan por un mismo punto. Por ejemplo, en el grupo de arterias compliantes la PD aumentó y la PS disminuyó con respecto al grupo normal. Las curvas reales dependerán en la clínica del grupo específico de pacientes estudiados. Con respecto a la dispersión de valores de presión en 24 horas de un paciente, la misma depende de su actividad particular durante el día. Observando los resultados obtenidos y el número de casos simulados, consideramos que adoptar distribuciones normales parece razonable. En este trabajo no se consideraron fuentes de variabilidad más complejos, como la influencia de la activación de músculo liso vascular sobre la curva p-d o la variabilidad de la frecuencia cardiaca. En el primer caso, resulta sensato pensar que estas modificaciones dinámicas de activación muscular no modificarían la esencia de la curva no lineal y en el peor caso serían transitorias, afectando a alguna de las 100 mediciones pero sin modificar el resultado general de la regresión. Esto es asumiendo que la rigidez arterial es sólo una modificación estructural de elastina y colágeno y que el músculo liso (componente activo) y la estimulación nerviosa no tengan efecto a largo plazo de la rigidez arterial. En el caso de la variabilidad de la frecuencia cardiaca, sus efectos podrían estar incluidos en las dispersiones simuladas para DM y DP.
La variación de presión ambulatoria durante el día ha sido asociada a cambios en la rigidez arterial, calculada por ejemplo con tonometría de aplanación [23]. Esto contradice la formulación misma del AASI, que se calcula con todas las presiones durante el día pero genera un único valor de rigidez diario. Para validar los resultados de nuestra simulación, sería necesario registrar los valores del diámetro y la presión arterial simultáneamente durante 24 horas. De esta forma se podría calcular la verdadera elasticidad arterial durante el día y no estimarla con mediciones indirectas como el AASI, que además pueden estar contaminadas por efectos propios del ventrículo o de la variabilidad de la frecuencia cardiaca. Algunas de estas mediciones están siendo programadas en animales conscientes por nuestro grupo de trabajo para el futuro cercano.
V. CONCLUSIÓN
Se simuló por un método estadístico la medición de la presión durante 24 horas en sujetos con diferente rigidez arterial, emulando un sistema de MAPA. La curva presión-diámetro exponencial que describe la elasticidad de la pared arterial permitió explicar conceptualmente la asociación del AASI como un índice indirecto de rigidez arterial. Se verificó que la dispersión en los valores de presión 24 horas influye sobre el cálculo estadístico del AASI. La simulación resultó útil para ayudar a esclarecer las controversias en torno al AASI y validar su aplicabilidad, siempre considerando sus limitaciones metodológicas.
AGRADECIMIENTO
Agradecemos la colaboración del Prof. Alain Simon y el Dr. Gilles Chironi, quienes nos permitieron el acceso a la base de datos de la unidad de medicina preventiva del hospital Broussais en Francia para analizar los estudios de medición ambulatoria de presión arterial.
REFERENCIAS
[1] Van Popele N.M., Grobbee D.E., Bots M.L., Asmar R., Topouchian J., Reneman R.S. Hoeks A.P., Van der Kuip A., Hofman A., Witteman J.C. Association between arterial stiffness and atherosclerosis: the Rotterdam study. Stroke, 32, 454-460, 2001. [ Links ]
[2] Blacher J., Safar M.E., Guerin A.P., Pannier B., Marchais S.J., London G.M. Aortic pulse wave velocity index and mortality in end-stage renal disease. Kidney Int, 63, 1852-1860, 2003. [ Links ]
[3] Laurent S., Boutouyrie P., Asmar R., Gautier I., Laloux B., Guize L. Ducimetiere P., Benetos A. Aortic stiffness is an independent predictor of all-cause and cardiovascular mortality in hypertensive patients. Hypertension, 37, 1236-1241, 2001. [ Links ]
[4] Cruickshank K., Riste L., Anderson S.G., Wright J.S., Dunn G., Gosling R.G. Aortic pulse-wave velocity and its relationship to mortality in diabetes and glucose intolerance: an integrated index of vascular function? Circulation, 106, 2085-2090, 2002. [ Links ]
[5] Li Y., Wang J.G., Dolan E., Gao P.J., Guo H.F., Nawrot T., Stanton A.V., Zhu D.L., O'Brien E., Staessen J.A. Ambulatory arterial stiffness index derived from 24-hour ambulatory blood pressure monitoring. Hypertension, 47, 359-64, 2006. [ Links ]
[6] Dolan E., Atkins N., McCormack P., McClory S., Staessen J., Thijs L., et al. Ambulatory arterial stiffness index as a predictor of cardiovascular mortality in the Dublin Outcome Study. Hypertension, 47, 356-370, 2006. [ Links ]
[7] Schillaci G., Parati G., Pirro M., Pucci G., Mannarino M.R., Sperandini L., Mannarino E. Ambulatory arterial stiffness index is not a specific marker of reduced arterial compliance. Hypertension, 49, 986-991, 2007. [ Links ]
[8] Gavish B. Correlating ambulatory blood pressure measurements with arterial stiffness: a conceptual inconsistency? Hypertension, 48, 108-113, December 2006. [ Links ]
[9] Gosse P., Papaipanou G., Coulon P., Reuter S., Lemetayer P., Safar M. Can ambulatory blood-pressure monitoring provide reliable indices of arterial stiffness? American Journal of Hypertension, 20, 831-838, August 2007. [ Links ]
[10] Meinders J.M., Hoeks A.P.G. Simultaneous assessment of diameter and pressure wave forms in the carotid artery. Ultrasound in Med. and Biol, 30, 147-154, 2004. [ Links ]
[11] Powalowski T., Pensko B. A noninvasive ultrasonic method for the elasticity evaluation of the carotid arteries and its application un the diagnosis of the cerebro-vascular system. Arch Acoust, 13, 109-126, 1988. [ Links ]
[12] Van Loon P., Klip W., Bradley E.L. Length-force and volume-pressure relationships of arteries. Biorheology, 14, 181-201, 1977. [ Links ]
[13] Hayashi K., Handa H., Nagasawa S., Okumura A., Moritake K. Stiffness and elastic behavior of human intracranial and extracranial arteries. Journal of Biomechanics, 13, 175-184, 1980. [ Links ]
[14] Stettler J.C., Niederer P., Anliker M. Theoretical analysis of arterial hemodynamics including the influence of bifurcations. Part I: Mathematical models and prediction of normal pulse patterns. Ann Biomed Eng, 9, 145-164, 1981. [ Links ]
[15] Armentano R.L., Barra J.G., Pessana F.M., Craiem D.O., Graf S., Santana D.B., Sanchez R.A. Smart smooth muscle spring-dampers. IEEE Engineering in Medicine and Biology Magazine, 26, 62-70, January-February 2007. [ Links ]
[16] Armentano R.L., Barra J.G., Levenson J., Simon A., Pichel R.H. Arterial wall mechanics in conscious dogs. Assessment of viscous, inertial, and elastic moduli to characterize aortic wall behavior. Circulation Research, 76, 468-478, March, 1995. [ Links ]
[17] Jerrard-Dunne P., Mahmud A., Feely J. Ambulatory arterial stiffness index, pulse wave velocity and augmentation index-interchangeable or mutually exclusive measures? Journal of Hypertension, 26, 529-534, 2008. [ Links ]
[18] Baumann M., Dan L., Nürnberger J., Heemann U., Witzke O. Association of ambulatory arterial stiffness index and brachial pulse pressure is restricted to dippers. American Journal of Hipertensión, 26, 210-214, February 2008. [ Links ]
[19] Guzmán G.B., Craiem D., Caputo J.M., Valero M.J., Graf S., Armentano R.L. Análisis de un nuevo índice de rigidez derivado de la medición ambulatoria de presión arterial. XVI Congreso Argentino de Bioingeniería, San Juan, Argentina, 2007. [ Links ]
[20] Kikuya M., Staessen J.A., Ohkubo T., Thijs L., Metoki H., Asayama K., Obara T., Inoue R., Li Y., Dolan E., Hoshi H., Hashimoto J., Totsune K., Satoh H., Wang J.G., O'Brien E., Imai Y. Ambulatory arterial stiffness index and 24-hour ambulatory pulse pressure as predictors of mortality in Ohasama, Japan. Stroke, 38, 1161-1166, April 2007. [ Links ]
[21] Adiyaman A., Dechering D.G., Boggia J., Li Y., Hansen T.W., Kikuya M., Björklund-Bodegard K., Richart T., Thijs L., Torp-Pedersen C., Ohkubo T., Dolan E., Imai Y., Sandoya E., Ibsen H., Wang J., Lind L., O'Brien E., Thien T., Staessen J.A. Determinants of the ambulatory arterial stiffness index in 7604 subjects from 6 populations. Hypertension. 52, 1038-1044, November 2008. [ Links ]
[22] Gavish B., Ben-Dov I.Z., Bursztyn M. Linear relationship between systolic and diastolic blood pressure monitored over 24 h: assessment and correlates. American Journal of Hypertension. 26, 199-209, February 2008. [ Links ]
[23] Lekakis J.P., Zakopoulos N.A., Protogerou A.D., Papaioannou T.G., Kotsis V.T., Pitiriga V.Ch., Tsitsirikos M.D., Stamatelopoulos K.S., Papamichael C.M., Mavrikakis M.E. Arterial stiffness assessed by pulse wave analysis in essential hypertension: relation to 24-h blood pressure profile. International Journal of Cardiology, 102, 391-395, July 2005. [ Links ]