Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Ingeniería Biomédica
Print version ISSN 1909-9762
Rev. ing. biomed. vol.5 no.9 Medellín Jan./June 2011
LOS CAMPOS BIOELÉCTRICOS Y ALGUNAS APLICACIONES MÉDICAS - REVISIÓN
BIOELECTRIC FIELDS AND SOME MEDICAL APPLICATIONS - REVIEW
María Elena Moncada Acevedo1, Jorge Armando de la Cruz Saavedra2 y Carlos Rafael Pinedo Jaramillo2
1 Instituto Tecnológico Metropolitano, Medellín, Colombia. mariamoncada@itm.edu.co.
2 Universidad del Valle, Cali, Colombia.
Recibido 7 de Abril de 2011. Aceptado 21 de Junio de 2011
RESUMEN
Con las investigaciones de Emil Du Bois-Reymond, uno de los fundadores de la electrofisiología, se dio inicio a la era de la bioelectricidad. DuBois documentó en detalle actividades eléctricas asociadas con excitación nerviosa, contracción muscular y procesos de cicatrización. En la actualidad es reconocido que los campos eléctricos (CE) están presentes en los organismos vivos y que direccionan e influyen procesos biológicos como la embriogénesis, regeneración y cicatrización de heridas. Diversos estudios han demostrado como los CE interfieren en la biosíntesis y la migración celular, dando lugar a nuevas estrategias para la reparación de ligamentos y regeneración de tejidos. En la actualidad las corrientes y CE biológicos suministran información necesaria para diversos tipos de diagnósticos y tratamientos. En este trabajo se hace una revisión de algunos estudios realizados alrededor de la generación de campos bioeléctricos endógenos, sus sustratos biológicos y aplicaciones médicas.
PALABRAS CLAVE: Bioelectricidad, Campos eléctricos, Cicatrización de heridas, Estimulación eléctrica.
ABSTRACT
The era of bioelectricity began with the investigations of Emil Du Bois-Reymond, one of the founders of electrophysiology. DuBois documented in detail electrical activities associated with nerve excitation, muscle contraction and healing processes. It is currently recognized that electric fields (EFs) are present in living organisms and that they direct and influence biological processes such as embryogenesis, regeneration and wound healing. Several studies have shown how EFs interfere with biosynthesis and cell migration, leading to new strategies for repairing ligaments and for tissue regeneration. At present, biological EFs and currents provide information needed for different types of diagnoses and treatments. This paper reviews some studies focused on the generation of endogenous bioelectric fields, their biological substrates and medical applications.
KEY WORDS: Bioelectricity, Electric fields, Electric stimulation, Wound healing.
I. INTRODUCCIÓN
Un campo eléctrico es un campo de fuerza creado por la atracción y repulsión de cargas eléctricas. Su aplicación en el tejido biológico fue iniciada por el fisiólogo alemán Emil Du Bois-Reymond (1818-1896) quien documentó en detalle las actividades eléctricas asociadas a la excitación nerviosa, contracción muscular y heridas, llevándolo a ser uno de los fundadores de la electrofisiología moderna [1]. Los campos eléctricos (CE) se encuentran de manera natural en los organismos vivos y son encargados de controlar procesos de crecimiento y comportamientos celulares. Así por ejemplo, ante una herida, el cuerpo crea iones que modifican la dirección de la carga eléctrica positiva o negativa natural de las moléculas, generando cambios en los CE endógenos.
Cuando los CE son aplicados externamente es denominado exógeno. En la actualidad estos campos son aplicados con el fin de mejorar las características eléctricas endógenas encargadas de los procesos biológicos. En heridas, se cree que los campos exógenos mejoran, intensifican y llegan a reemplazar el campo biológico interno, promoviendo el proceso de cicatrización [2].
Los CE endógenos han sido medidos durante el desarrollo y regeneración de tejidos epiteliales y no epiteliales. El epitelio corneal por ejemplo, posee canales que transportan cationes (principalmente Na+) hacia el interior de la parte basal y aniones (Cl-) desde el fluido lagrimal. Las células externas del epitelio corneal están conectadas por estrechas uniones y forman la mayor barrera eléctrica resistiva. El transporte de iones de dirección junto con la barrera establecen el PTE [3]. Ante anormalidades esqueléticas y neuronales se ha encontrado la presencia de gradientes eléctricos [4]. Diferentes estudios en animales y humanos también han detectado alteraciones de los CE endógenos al presentarse daños en la médula espinal, las mismas que fueron promovidas y reparadas luego de la aplicación de CE externos [5, 6].
La estimulación eléctrica y electromagnética es hoy en día utilizada como coadyuvante en diversos tratamientos, como diabetes, úlceras generadas por presión [7, 8], insuficiencia vascular [9] y más ampliamente en la consolidación de fracturas [10, 11]. A nivel celular se han encontrado incrementos en la circulación y migración de células epiteliales [12, 13], neutrófilos, macrófagos y diversos factores de crecimiento [14, 15]; además de aumentar la producción de fibroblastos, los niveles de colagenasa y de disminuir el edema e inhibir el surgimiento de mastocitos y bacterias [2, 16, 17]. Se ha logrado también la recuperación de células epiteliales de la córnea y mejoras en la velocidad y direccionalidad de la migración de fibroblastos 3T3 en heridas [18].
Algunos grupos de investigación en Colombia estudian el comportamiento eléctrico de los tejidos evaluando elementos como medición de propiedades eléctricas [19, 20] y aplicaciones celulares de campos eléctricos y magnéticos [21, 22]. El grupo creador de este trabajo viene también investigando en diversas características de señales de CE y campos magnéticos para aplicaciones celulares, clínicas y computacionales [22-27]. En este trabajo se hace una recopilación de las condiciones de generación de señales eléctricas en tejidos (en heridas de manera especial) y la forma como éstas infieren con los procesos biológicos. Se hace una revisión de algunas aplicaciones clínicas e in vitro, presentando algunos de los hallazgos más importantes y las diferentes características de los CE encontrados y utilizados.
II. FISIOLOGÍA ELÉCTRICA DE LA PIEL
La epidermis tiene normalmente una alta resistencia eléctrica debido a la espesa capa de células muertas que generan una gruesa membrana de queratina. Toda la epidermis (con la excepción de las células de descamación) constituye la capa de barrera que se comporta como una membrana pasiva. Sin embargo, la capa córnea (superficie de la piel) es conformada por los conductos sudoríparos que al evaporar el sudor enfría la piel y genera muchos caminos paralelos de baja resistencia. La medida de la salida del sudor por las glándulas sudoríparas con respuesta electrodérmica, proporciona una medida simple del nivel y extensión de la actividad simpática del organismo.
2.1 Potencial de la piel
El potencial eléctrico en los sistemas biológicos se origina como una consecuencia de los gradientes de concentración de iones a través de las membranas que rodean las células del organismo. El comportamiento de la membrana es del tipo ventana, de tal forma que deja pasar algunos iones fácilmente pero ofrece mucha más resistencia a otras especies. Esto crea una diferencia en la concentración de iones a cada lado de la membrana, generando una diferencia de potencial que en un momento dado llega a un punto de equilibrio [28]. Esta diferencia de potencial es conocida como el potencial transepitelial (PTE).
A nivel científico (experimental y clínico) se utilizan los potenciales de la piel para seguimiento y evaluación de la actividad simpática del organismo, aprovechando la actividad de las glándulas sudoríparas, la excitación y los estados emocionales. En la rama de la fisiología, el potencial eléctrico se relaciona con los cambios microscópicos en la membrana celular y en pequeña escala de las variaciones de flujo iónico, que generan el comportamiento de los tejidos gruesos [29]. Los potenciales han sido también estudiados como un fenómeno cuantificable basado en lo neural y como sistemas de control, especialmente relacionados con el crecimiento embrionario, la respuesta a la lesión y la reparación de los tejidos [30, 31]. Otras de las aplicaciones involucran cicatrización, reparación de lesiones crónicas de la piel y tratamientos pos quirúrgicos [32-37].
2.2 Potenciales de batería de la piel
A partir de los potenciales de herida detectados, diversos grupos (trabajando principalmente en anfibios) sugirieron que los potenciales que siguen a la amputación eran derivados de la piel actuando como generador de corriente (o batería) [38, 39]. Foulds y Barker (1983) estudiaron los potenciales de batería de piel humana (sin presencia de herida), encontrando entre dos sitios de la piel valores del orden de 1 mv, siendo mayores en las manos y los pies (más negativos) y menores (cercanos a cero) en la cabeza y la parte superior del brazo [40]. De sus estudios concluyeron que la variación anatómica del potencial de batería de la piel, es una compleja combinación de factores entre los que se incluye la concentración de glándulas sudoríparas y la densidad de los vellos. En humanos, los voltajes de batería de la piel son del orden de 10 a 60 mv dependiendo de la región de medida, usualmente a través del cuero cabelludo o a través de varias regiones de piel [41].
III. COMPORTAMIENTO BIOELÉCTRICO DE HERIDAS
3.1 Proceso de cicatrización
La presencia de los CE en el proceso natural de cicatrización de heridas es quizás una de las condiciones de aplicación de los CE más reconocida. en éstas los ce tienen la capacidad de direccionar e influir sobre las etapas de embriogénesis, regeneración y cicatrización [5, 42-44] y están directamente relacionados con migración y reorganización del tejido [2, 45].
En el epitelio, las células corneales externas forman la mayor barrera eléctrica resistiva. cuando se presenta una herida, la barrera epitelial es interrumpida y es producido un cortocircuito en el Pte, el cual provoca una caída de potencial más negativa en la herida que debajo de la epidermis ilesa y lejana a ésta. La diferencia de potencial genera una corriente direccionada hacia el sitio más negativo, la herida, como se observa en la Fig. 1. El borde de la herida está caracterizado por un gradiente de voltaje mayor a 200 mv/mm y una corriente entre 1 y 1, 5 ma/mm (por milímetro de circunferencia de la herida) la cual fluye a través del circuito creado llegando a las capas subcorneales y evidenciando la ubicación de las células dentro de un ce. Sin embargo, el cambio de la conductividad de la herida a lo largo del proceso de cicatrización hace que a medida que esta va secando (volviéndose altamente resistiva) el flujo de la corriente cese [46].
El transporte vectorial de iones es mantenido gracias a la distribución polarizada de los canales iónicos y bombas en el epitelio [47]. En el epitelio corneal, la perfecta combinación de iones de na+, K+ y cldetermina en gran medida el sistema de transporte de electrógenos, las diferencias de potencial creadas [48, 49] y las corrientes eléctricas de la herida [48, 50] como puede observarse en la Fig. 2.
El proceso de cicatrización se produce desde las capas superficiales (de mayor gradiente lateral) hacia las capas profundas. Este proceso persiste hasta que la re-epitelización remueve completamente la barrera de resistencia eléctrica funcional del epitelio. cuando los puntos llegan a la unión es entonces restablecida la superficie y el gradiente lateral desaparece. Un fenómeno conocido como electrogénica está presente en este proceso y el que se encarga de direccionar un mayor número de cargas positivas a la parte basal y cargas negativas a la parte apical [48, 51].
Para heridas de piel y córnea el potencial dérmico permanece intacto en 2 a 3 mm alrededor del borde de la herida actuando como un estímulo mitótico en el borde de la lesión. La corriente eléctrica es entonces orientada hacia la herida desde el tejido alrededor y las células epiteliales comienzan a crecer hasta encontrar el lado opuesto [32]. Los CE presentes en heridas de córnea están estimados entre 40-50 mV/mm y para heridas de piel entre 100-150 mV/mm [5]. Los PTE varían durante el desarrollo de la herida y se ha propuesto como contribuyente en el control de su cicatrización [52, 53].
3.2 La señal eléctrica de la herida
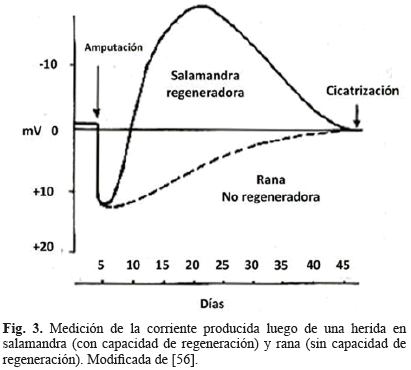
La primera medición de la corrientes eléctricas endógenas fue realizada por el alemán du Bois-Reymond [1]. Años después, Becker y su equipo detectaron que las heridas se comportaban de forma diferente para especies no regeneradoras (como la rana) y especies regeneradoras (como la salamandra). al amputar un miembro de cada animal, encontraron potenciales inmediatos de polaridad positiva y de magnitudes cercanas para ambas especies. sin embargo los potenciales de la rana retornaron lentamente al potencial inicial, ligeramente negativo, como un proceso de escarificación y epitelización, mientras en la salamandra el potencial positivo se volvía rápidamente negativo coincidiendo con la formación de blastema y la regeneración [53-55]. La Fig. 3, ilustra los resultados del experimento del grupo de Becker.
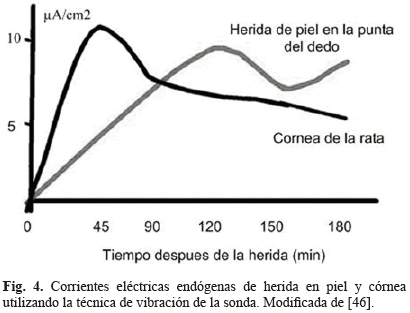
Finalmente en 1974, el grupo de Becker demostró que ante una herida, el trauma provocaba una alteración en el patrón del cuerpo y que dicho cambio podía ser detectado como una corriente cambiante producida en la herida [57]. O'Leary y Goldring (1964) sugirieron que el potencial de herida desarrollado entre las células de los nervios, músculo o piel heridos, podría ser vulnerable a la despolarización de la membrana como resultado del trauma [58]. En la actualidad esta misma corriente de herida ha sido medida utilizando un método más avanzado y conocido como la técnica de vibración de la sonda [32] y es mostrada en la Fig. 4 para dos tipos de herida.
3.3 Dependencias temporales y espaciales
Aunque es conocido que las células y tejidos desarrollan mecanismos altamente organizados para el control de fluidos iónicos que regulan las propiedades y características eléctricas de los materiales biológicos, el uso de la electricidad ha dado la impresión de unidireccionalidad, linealidad y propiedades eléctricas globales. sin embargo esta consideración es errónea ya que las propiedades y tejidos son totalmente no homogéneos, anisotrópicos y dependientes de múltiples factores. En heridas el cambio de los valores del potencial eléctrico en la zona misma de la herida, es quien activa el flujo de la corriente sobre la que puede medirse el proceso eléctrico de cicatrización. Se ha encontrado que las corrientes son más fuertes en los bordes de las heridas, mientras en su centro tienen flujos de corrientes mucho menores [33, 59].
Por otra parte, el comportamiento y características eléctricas de las heridas también cambian con el tiempo. Por ejemplo, ante una herida corneal, las corrientes eléctricas aparecen inmediatamente después y pueden ser del orden de 4 µA/cm2; 60 minutos después las magnitudes de corrientes son encontradas del orden de 4 a 8 µA/cm2 [15, 41]. Con el paso del tiempo, y a medida que va cicatrizando, la herida se va volviendo menos húmeda, aumentando su resistividad, y con esto disminuyendo la generación de corriente endógena [46].
3.4 Heridas estimuladas con CE
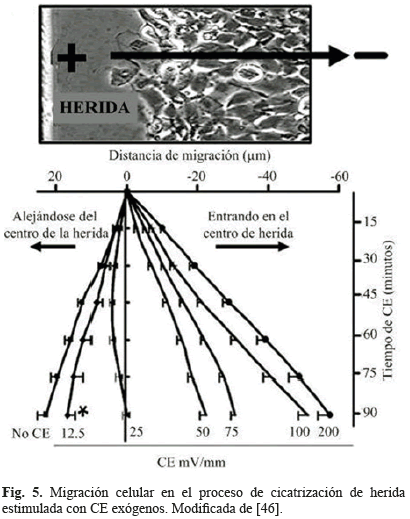
Cuando se presenta una herida, los queratinocitos y las células epiteliales corneales migran en la dirección del ce endógeno (como se muestra en las Figs. 1 y 5). Cuando los CE son aplicados externamente, el comportamiento celular presenta migración hacia el lado negativo de la señal (cátodo), aún para CE tan débiles como 25 mv/mm y para CE dentro de los rangos fisiológicos 40-180 mV/mm (in vivo) [32].
En la cicatrización de herida monocapa las células migran de manera natural hacia el interior de la herida, esto de acuerdo a la dirección impuesta por el CE endógeno (como lo muestra la Fig. 1). Ante esta circunstancia, el equipo de trabajo de Zhao realizó investigaciones con el objeto de caracterizar el comportamiento eléctrico de las heridas cuando estas eran estimuladas por CE externos [12, 15, 33, 46]. En sus resultados encontraron que ante CE externos, utilizando la dirección de cicatrización endógena por defecto, la migración celular fue incrementada significativamente desde los bordes de la herida hacia el interior de ésta. Por su parte cuando fueron aplicados en dirección opuesta, ocasionaron un decrecimiento significativo en la migración celular al interior de la herida para valores de CE desde 12, 5 mv/mm, llegando a detenerla completamente a 25 mV/mm [15, 33]. La Fig. 5 representa el comportamiento descrito por los investigadores.
Otra de las pruebas realizadas consistió en la variación de polaridad de CE de 150 mv/mm. inicialmente los CE fueron aplicados con la polaridad endógena natural, encontrando una respuesta de migración reforzada de células; posteriormente la polaridad del CE fue invertida, y una hora después de ser estimulada con esta nueva polaridad, la migración fue igualmente invertida. Al cambiar nuevamente la polaridad, 6 horas después las células migraron de acuerdo a su nueva dirección impuesta. A las 8 horas de estimulación fue modificada la polaridad a su estado inicial encontrando que nuevamente las células migraron en busca del cátodo [15]. Este comportamiento mostró como las células ignoraron completamente otras señales coexistentes y simplemente siguieron la dirección dada por los CE externos. así los CE dentro de los rangos de esfuerzo fisiológico, reemplazaron completamente otra señal guía coexistente y dirigieron las células a migrar hacia el interior o exterior de la herida [12, 46].
3.5 Manipulación Farmacológica de los CE
Los CE de una herida pueden ser también manipulados por blancos farmacológicos de transportadores de Cl- y Na+ [60, 61]. En la córnea, por ejemplo, algunos de los fármacos promueven la secreción de Cl- y la absorción de Na+, incrementando los PTE y CE de la herida o decreciéndolos significativamente [2, 33, 62]. Cuando los CE endógenos son reducidos a partir de tratamientos farmacológicos, se ha encontrado que las heridas presentan una reducción en su respuesta de migración celular [2].
La liberación iontoforética en la piel, se da cuando un CE es creado a través de ella forzando los iones del fármaco a moverse en una dirección particular, esto de acuerdo a la polaridad del ion, la fuerza del CE y la movilidad de los iones en la piel. sin embargo, la piel es un órgano complejo con muchas funciones, propiedades y componentes que influyen y determinan el comportamiento de los iones y la entrega efectiva de medicamento transdermal, la cual es usualmente suministrada con técnicas de energía térmica, ultrasonido, energía de radio frecuencia y electroforesis [60].
3.6 Actividad endógena y CE
La actividad eléctrica en el organismo tiene múltiples investigaciones que apoyan sus ya conocidos procesos y efectos. La Fig. 6 muestra un diagrama donde se describe y resume de manera general el comportamiento bioeléctrico asociado a la piel y tejidos blandos, junto con el efecto de la lesión, el trauma y las enfermedades que relacionan la bioelectricidad [63]. Otras actividades endógenas como la morfogénesis, reparación de los nervios y regeneración de las extremidades no fueron consideradas en su diagrama.
IV. OTRAS APLICACIONES MÉDICAS DE LOS CE
4.1 Efecto bactericida de los CE
Cuando una herida es infectada se presenta un retraso en su proceso de cicatrización, con esta base diversos estudios in vitro fueron realizados encontrando respuestas positiva de inhibición y destrucción de agentes patógenos ante la aplicación de corrientes eléctricas externas. Los principales mecanismos que relacionan la aplicación de CE o corrientes eléctricas en heridas infectadas y su posterior respuesta fisiológica, involucran los fenómenos de difusión, galvanotaxis y la presencia y activación de oxígeno, incluso más que la polaridad de la señal aplicada.
Kincaid y Lavoie (1989) desarrollaron un estudio in vitro en el que lograron inhibir y disminuir la proliferación bacterial de tres microorganismos presentes en heridas humanas (escherichia coli, pseudomona aeruginosa y estafilococo aereus) [64]. El voltaje aplicado fue de polaridad negativa, magnitudes entre 150 y 300 V y tiempos de exposición entre 1 y 4 horas. Los resultados mostraron destrucción de bacterias a partir de los 250 V, con tiempos de estimulación de 2 horas. Barranco y colaboradores. (1974) lograron inhibir el crecimiento de estafilococos con corrientes entre 0, 4 y 400 mA [65]. Merriman y colaboradores. (2004), evaluaron la efectividad de cuatro tipos de aplicación de la corriente sobre el crecimiento bacterial de estafilococo aureus, aplicando señales de 250 V y 500µA de corriente directa, corriente pulsada bifásica simétrica de bajo voltaje y corriente pulsada monofásica de bajo voltaje [66]. Como resultados encontraron una mayor inhibición para la estimulación de alto voltaje, seguida por la corriente directa continua, mientras las corrientes monofásica y bifásica de bajo voltaje, obtuvieron la menor inhibición del crecimiento bacterial. Aunque este y otros estudios han mostrado una mayor inhibición a más altas intensidades y mayores tiempos de aplicación, estos resultados son restringidos en humanos debido a las altas intensidades de voltajes utilizados.
4.2 Aplicaciones ortopédicas
Los CE y los campos electromagnéticos son hoy en día ampliamente utilizados en prácticas ortopédicas para el tratamiento de pseudoartrosis de fractura y fusión espinal [67, 68]. Varios estudios han demostrado que los CE estimulan la proliferación y diferenciación celular, y la síntesis de factores de crecimiento y proteínas de la matriz extracelular [69-71]. Asimismo, se ha explorado también su uso en cartílagos y ligamentos [72, 73]. En estudios clínicos se encontrado que las corrientes eléctricas promueven la osteogénesis, la cicatrización de fracturas en no-unión y la fusión espinal [69, 74]. Algunos estudios in vitro aplicando CE de intensidades entre 0, 1 a 10 V/cm sobre células de especie bovina, queratinocitos humanos y fibroblastos de embriones de ratón, han mostrado una alta migración hacia el cátodo [44]. Mientras células como los granulocitos humanos, las células endoteliales corneales de conejo y las células vasculares endoteliales presentan migración hacia el ánodo [75]. Consecuentemente, dada la diversidad en las respuestas, se ha concluido que los efectos de los CE en las células dependen del tipo y especie, razón por la cual deben ser examinados caso por caso [61].
Las características de las señales más estudiadas en reportes clínicos incluyen la frecuencia, magnitud, forma de onda y tiempo de exposición. Estas se han encontrado partiendo de la relación que lleva la frecuencia con las actividades celulares, incluyendo la proliferación celular y la biosíntesis [75]. Un estudio desarrollado por Chi-Sing Chu y colaboradores. (1976) evaluó el efecto de corrientes entre 4 y 40 mA sobre la formación del edema en quemaduras en ratas [76]. Dentro de sus resultados encontraron que para corrientes superiores a 0, 1 mA/cm2 la respuesta fisiológica fue independiente de la polaridad del electrodo y de la densidad de la corriente con mejor respuesta de la polaridad negativa en los primeros cuatro días de la herida. Mientras, en el tiempo posterior a estos cuatro días, la polaridad positiva aceleró el proceso de cicatrización.
Lippielo y colaboradores. (1990) encontraron un aumento en la reparación de defectos osteocondrales y obtuvieron resultados exitosos en la cicatrización de ligamentos de conejo y de rata ante la aplicación de CE directos [77]. En la ingeniería de ligamento el estudio de la aplicación de CE es considerado relevante, debido a la particularidad que ofrece la estructura de los fibroblastos de ligamento, cuya morfología es alineada a la fibra [61]. Algunos estudios sugieren que los CE de aplicación estática y pulsante pueden ser utilizados para guiar la biosíntesis, provocar la migración de células de fibroblastos, modificar su expresión génica y acelerar la cicatrización de heridas [78-80]. En estudios in vivo se han reconocido los CE como un posible mecanismo influyente en la tasa de movilidad celular [37] y cicatrización de las heridas [59].
V. DISCUSIÓN
El reconocimiento del papel de la bioelectricidad en la reparación del tejido está generando nuevas alternativas de diagnóstico y usos terapéuticos. Las diferentes formas de uso conllevan aplicación de micro-corrientes, CE, campos electromagnéticos y campos magnéticos, todos en una variedad de magnitudes, frecuencias y en general presentando diversas características de la señal. Los CE han demostrado ser beneficiosos en reparación de tejido óseo y piel, con abundante evidencia que lo apoya como parte del proceso de regeneración. El cuerpo humano es hoy reconocido como una fuente de energía eléctrica presente en cada célula, que al ser modificada genera mal funcionamiento de ésta y de los procesos asociados. Por esta razón, el estudio, investigación y avance en el área de la bioelectricidad y el biomagnetismo prometen ser una fuente generadora de nuevas alternativas a tratamientos y métodos de diagnóstico.
VI. CONCLUSIÓN
El trabajo realizado presenta una descripción del proceso eléctrico de CE endógenos en la regeneración, proliferación y otros efectos celulares y se realizó un barrido sobre los procedimientos y resultados obtenidos en algunos de los estudios más relevantes en el tema. Se inicia un camino con múltiples inquietudes aún por corroborar y abordar. Agradecimiento Al comité editorial de Revista Ingeniería Biomédica y a los pares evaluadores por su dedicación y excelentes observaciones, que hicieron de éste un trabajo mejor.
REFERENCIAS
[1]. Reymond DB.E. Vorläufiger Abriss einer Untersuchung uber den sogenannten Froschstrom und die electomotorischen Fische. Ann Phys U Chem, 58, 1-30, 1843. [ Links ]
[2]. Song B., Zhao M., Forrester J.V., McCaig C.D. Electrical cues regulate the orientation and frequency of cell division and the rate of wound healing in vivo. 99, 13577-82, 2002. [ Links ]
[3]. Klyce S.D, Crosson C.E., Transport processes across the rabbit corneal epithelium: a review. Curr Eye Res, 4, 323-31, 1985. [ Links ]
[4]. Hotary K.B., Robinson K.R. Endogenous electrical currents and voltage gradients in Xenopus embryos and the consequences of their disruption. Dev Biol., 166(2), 789-800, 1994. [ Links ]
[5]. Song B., Gu Y., Pu J., Reid B., Zhao Z., Zhao M. Application of direct current electric fields to cells and tissues in vitro and modulation of wound electric field in vivo. Nat Protoc, 2, 1479-89, 2007. [ Links ]
[6]. Kenneth R., Robinson P.C. Electric field effects on human spinal injury: Is there a basis in the in vitro studies? Developmental Neurobiology, 68(2), 274-280, 2008. [ Links ]
[7]. Tomonori S., Akira S., Shoichiro S., Kazutomo I., Junji M. An Extremely Low Frequency Magnetic Field Attenuates Insulin Secretion From the Insulinoma Cell Line, RIN-m. Bioelectromagnetics, 25, 160-166, 2004. [ Links ]
[8]. Sakarai T., Yoshimoto M., Koyama S., Miyakoshi J. Exposure to extremely low frequency magnetic fields affects insulin-secreting cells. Bioelectromagnetics. 29(2), 118-24, 2008. [ Links ]
[9]. Ieran M., Zafuto S., Bagnacani M., Annovi M., Moratti A., Cadossi R. Effect of low frequency pulsing electromagnetic fields on skin ulcers of venous origin in humans: A double-Blind Study. Journal of Orthopaedic Research, 8, 276-282, 1990. [ Links ]
[10]. Scott G, King J.B. A prospective, double-blind trial of electrical capacitive coupling in the treatment of non-union of long bones. J Bone Joint Surg Am, 76, 820-826, 1994. [ Links ]
[11]. Betti E., Marchetti S., Cadossi R., Faldini C., Faldini A. Effect of stimulation by low-frequency pulsed electromagnetic fields in subjects with fracture of the femoral neck. In: Bersani F, editor. Electricity and magnetism in biology and medicine. New York: Kluwer Academic/Plenum, 1999, 853-855. [ Links ]
[12]. Zhao M., Pu J., Forrester JV., McCaig CD. Membrane lipids, EGF receptors, and intracellular signals colocalize and are polarized in epithelial cells moving directionally in a physiological electric field. The FASEB Journal. 16, 857-859, 2002. [ Links ]
[13]. Wang E., Zhao M., Forrester J.V., McCaig C.D. Re-orientation and Faster, Directed Migration of Lens Epithelial Cells in a Physiological Electric Field. Exp. Eye Res., 71, 91-98, 2000. [ Links ]
[14]. Bai H., McCaig C.D., Forrester J.V., Zhao M. DC electric fields induce distinct preangiogenic responses in microvascular and macrovascular cells. Arterioscler Thromb Vasc Biol, 24, 1234-9, 2004. [ Links ]
[15]. Zhao M. Electric stimulation and angiogenesis: electrical signals have direct effects on endothelial cells. In: Janigro D, editor. The cell cycle in the central nervous system. Totowa, NJ: Humana Press, 2006, 495-509. [ Links ]
[16]. Pierre O., Bagnaninchi N.D. Real-time label-free monitoring of adipose-derived stem cell differentiation with electric cellsubstrate impedance sensing. Proc. Natl. Acad. Sci., 108 (16), 6462-6467, 2011. [ Links ]
[17]. Steffensen B., Hakkinen L., Larjava H. Proteolytic events of wound-healing-coordinated interactions among matrix metalloproteinases (mmps), integrins, and extracellular matrix molecules. Crit. Rev. Oral Biol. Med, 12, 373-398, 2001. [ Links ]
[18]. Finkelstein E., Chang W., Chao P., Gruber D., Minden A., Hung C.T., Bulinski J.C. Roles of microtubules, cell polarity and adhesion in electric-field-mediated motility of 3t3 fibroblasts. J. Cell Sci, 117, 1533-1545, 2004. [ Links ]
[19]. Gonzalez C., Gonzalez C.H., Ramos A. Best published equation for the calculation of Body Fat in a sample of Colombian young males using Bioelectrical Impedance, IFMBE Proceedings, 17(1), 803-806, 2007. [ Links ]
[20]. Gonzalez C.; Brown B., Tidy J., Bremmer J. Impedance spectral measurements made through a membrane infection barrier. Medical and Biological Engineering and Computing, 44(12), 1085-1091, 2006. [ Links ]
[21]. Gonzalez C.; Padilla L., Zuñiga O. Detection of animal tissue thickness using simple vertical electric sounding (VES). Physiological Measurement, 18, 85-91, 1997. [ Links ]
[22]. Moncada M.E., Pinedo C., Criollo W., Gutiérrez J., Cadavid H. Modelo computacional 3D para estimar variables eléctricas inducidas en un cultivo in vitro estimulado por campos magnéticos de baja frecuencia. Ingeniería y Competitividad, 12(2), 69-79, 2010. [ Links ]
[23]. Moncada M.E., Martínez A., Pinedo C. Desarrollo experimental y computacional para estimar variables eléctricas inducidas en muestras de fémur bovino estimuladas por campos magnéticos de baja frecuencia. Revista Cubana de Investigaciones Biomédicas. 27(2), 1-9, 2008. [ Links ]
[24]. Moncada M.E., Cadavid H. Metodología de construcción de muslos 3D para estimar variables eléctricas inducidas por campos magnéticos de baja frecuencia. Revista Brasilehira de Engenharia Biomédica, 23, 123-130, 2007. [ Links ]
[25]. Moncada M.E., Cadavid H. Estimación de variables eléctricas en un muslo 3D con fractura de diáfisis femoral estimulado magnéticamente. Revista Facultad de Ingeniería Universidad de Antioquia, 42, 120-131, 2007. [ Links ]
[26]. Moncada M.E., Saldarriaga M., Bravo A., Pinedo C. Medición de Impedancia Eléctrica en Tejido Biológico-Revisión. Revista Tecno Lógicas, 25, 51-76, 2010. [ Links ]
[27]. Moncada M.E., Martínez A., Pinedo C.R., Cadavid H. Desarrollo e implementación de una técnica para la medición de impedancia en muestras de hueso húmedo de bovino, Revista Facultad de Ingeniería Universidad de Antioquia, 44, 75-82, 2008. [ Links ]
[28]. Offner F. Bioelectric potentials - Their source, recording and significance. IEEE Trans Biomed Eng, 31(12), 863-868, 1984. [ Links ]
[29]. Jaffe L., Robinsonk F., Nuccitelli R. Local cation entry and selfelectrophoresis as an intracellular localization mechanism. Annals of the New York Academy of Sciences 238, 372-389, 1974. [ Links ]
[30]. McCaig C.D., Rajnicek A.M., Song B., Zhao M. Has electrical growth cone guidance found its potential?, Trends in Neurosciences, 25(7), 354-359, 2002. [ Links ]
[31]. Altizer A.M., Moriarty L.J., Bell S.M., Schreiner C.M., Scott W.J., Borgens R.B. Endogenous electric current is associated with normal development of the vertebrate limb. Dev Dyn, 221, 391-401, 2001. [ Links ]
[32]. Nuccitelli R., Nuccitelli P., Ramlatchan S., Sanger R., Smith P.J. Imaging the electric field associated with mouse and human skin wounds, Wound Repair Regen, 16, 432-441, 2008. [ Links ]
[33]. Zhao M., Song B., Pu J., Wada T., Reid B., Tai G., Wang F., Guo A., Walczysko P., Gu Y., Sasaki T., Suzuki A., Forrester J.V., Bourne H.R., Devreotes P.N., McCaig C.D., Penninger J.M. Electrical signals control wound healing through phosphatidylinositol-3-OH kinase-gamma and PTEN. Nature, 442, 457-60, 2006. [ Links ]
[34]. Nuccitelli R. A role for endogenous electric fields in wound healing. Curr Top Dev Biol, 58, 1-26, 2003. [ Links ]
[35]. Ojingwa J.C., Isseroff R.R. Electrical stimulation of wound healing. J Invest Dermatol, 121, 1-12, 2003. [ Links ]
[36]. Kloth L.C. Electrical stimulation for wound healing: A review of evidence from in vitro studies, animal experiments, and clinical trials. Int J Low Extrem Wounds, 4, 23-44, 2005. [ Links ]
[37]. Chao P.G., Lu, H.H., Hung C.T, Nicoll S.B., Bulinski J.C. Effects of Applied DC Electric Field on Ligament Fibroblast Migration and Wound Healing, Connective Tissue Research, 48, 188-197, 2007. [ Links ]
[38]. Vanable, J. Integumentary potentials and would healing. Electrical fields in vertebrate repair. New York, Alan Liss Inc, 1989, 171-224. [ Links ]
[39]. Borgens R. Endogenous ionic currents traverse intact and damaged bone, Science, 225, 478-482, 1984. [ Links ]
[40]. Foulds I., Barker A. Human skin battery potentials and their possible role in wound healing, British Journal of Dermatology, 109, 515-522, 1983. [ Links ]
[41]. Reid B., Nuccitelli R., Zhao M. Non-invasive measurement of bioelectric currents with a vibrating probe. Nat Protoc, 2, 661-669, 2007. [ Links ]
[42]. Li X., Kolega J. Effects of direct current electric fields on cell migration and actin filament distribution in bovine vascular endothelial cells, J. Vasc. Res, 39, 391-404, 2002. [ Links ]
[43]. Levin M. Large-scale biophysics: Ion flows and regeneration. Trends Cell Biol, 17, 261-70, 2007. [ Links ]
[44]. Stewart S. Bioelectricity and epimorphic regeneration. BioEssays, 29, 1133-1137, 2007. [ Links ]
[45]. Robinson K.R., Messerli M.A. Electric embryos: the embryonic epithelium as a generator of developmental information, in, C.D. McCaig (Ed.), Nerve Growth and Nerve Guidance, Portland Press, London, 1996, 131-141. [ Links ]
[46]. Zhao M. Electrical fields in wound healing-An overriding signal that directs cell migration-Review. Seminars in Cell and Developmental Biology, 20, 674-682, 2009. [ Links ]
[47]. Garty H., Palmer L.G. Epithelial sodium channels: Function, structure, and regulation. Physiol Rev, 77, 359-96, 1997. [ Links ]
[48]. Levin M.H., Verkman A.S. Aquaporins and CFTR in ocular epithelial fluid transport. J Membr Biol, 210, 105-15, 2006. [ Links ]
[49]. Candia O.A. Electrolyte and fluid transport across corneal, conjunctival and lens epithelia. Exp Eye Res, 78, 527-35, 2004. [ Links ]
[50]. Hibino T., Ishii Y., Levin M., Nishino A. Ion flow regulates left-right asymmetry in sea urchin development. Dev Genes Evol, 216, 265-276, 2006. [ Links ]
[51]. Dunn J.J., Lytle C., Crook R.B. Immunolocalization of the Na-K-Cl cotransporter in bovine ciliary epithelium. Invest Ophthalmol Vis Sci, 42, 343-53, 2001. [ Links ]
[52]. Ojingwa J.C., Isseroff R.R. Electrical stimulation of wound healing. J Invest Dermatol, 121, 1-12, 2003. [ Links ]
[53]. Pullar C.E., Isseroff R.R. Cyclic AMP mediates keratinocyte directional migration in an electric field. J Cell Sci, 118, 2023-34, 2005. [ Links ]
[54]. Becker R. The electrical control of growth processes, Medical Times, 95, 657-669, 1967. [ Links ]
[55]. Becker R. The direct current control system: A link between environment and organism, Journal of Medicine, 62, 1169-1176, 1962. [ Links ]
[56]. Becker R.O. The bioelectric factors in amphibian limb regeneration. J. Bone Joint Surg., 43-A, 643-56, 1961. [ Links ]
[57]. Becker R. The significance of bioelectric potentials, Bioelectrochemistry and Bioenergetics, 1, 187-199, 1974. [ Links ]
[58]. O'Leary J.L., Goldring S. D-C Potentials of the Brain, Physiol Rev, 44(1), 91-125, 1964. [ Links ]
[59]. Reid B., Song B., McCaig C.D., Zhao M. Wound healing in rat cornea: The role of electric currents. FASEB J., 19, 379-86, 2005. [ Links ]
[60]. Prausnitz M.R., Mitragotri S., Langer R. Current status and future potential of transdermal drug delivery, Nat. Rev. Drug Discov, 3, 115-121, 2004. [ Links ]
[61]. Hammerick K.E., Longaker M.T., Prinz F.B. In vitro effects of direct current electric fields on adipose-derived stromal cells. Biochemical and Biophysical Research Communications, 397, 12-17, 2010. [ Links ]
[62]. Levin M.H., Kim J.K., Hu J., Verkman A.S. Potential difference measurements of ocular surface Na+ absorption analyzed using an electrokinetic model. Invest Ophthalmol Vis Sci, 47, 306-16, 2006. [ Links ]
[63]. Poltawski L., Watson T. Bioelectricity and microcurrent therapy for tissue healing-a narrative review, Physical Therapy Reviews, 14(2), 104-114, 2009. [ Links ]
[64]. Kincaid C.B., Lavoie K.H. Inhibition of Bacterial Growth In Vitro Following Stimulation with High Voltage, Monophasic, Pulsed Current. Physical Therapy, 69(8), 651-655, 1989. [ Links ]
[65]. Barranco S.D., Spadaro J.A., Berger T.J. In vitro effect of weak direct current on Staphylococcus aureus. Clinic Orthop, 100, 250-5, 1994. [ Links ]
[66]. Merriman H.L., Hegyi C.A., Albright-Overton C.R., Carlow J.Jr., Putnam B.W., Mulcare J.A. A comparison of four electrical stimulation types on Staphylococcus aureus growth in vitro. Journal of Rehabilitation Research and Development, 41(2), 139-146, 2004. [ Links ]
[67]. Akail M., Hayashi K. Effect of electrical stimulation on musculoskeletal systems: A meta-analysis of controlled clinical trials. Bioelectromagnetics, 23, 132-143, 2002. [ Links ]
[68]. Kahanovitz N. Electrical stimulation of spinal fusion: A scientific and clinical update. Spine, 2, 145-150, 2002. [ Links ]
[69]. Cannolli J. Electrical Treatment of non union. Orth. Clin. N. Am. 15(1), 89-106, 1984. [ Links ]
[70]. Aaron R.K., Ciombor D.McK., Jones A.R. Bone induction by decalcified bone matrix and mRNA of TGFb and IGF-1 are increased by ELF field stimulation. Trans. Orthop. Res. Soc, 22, 548, 1997. [ Links ]
[71]. Ciombor McK.D., Lester G., Aaron R.K., Neame P., Catersi N.B. Low frequency EMF regulates chondrocytes differentiation and expression of matrix proteins. J Orthop Res, 20, 40-50, 2002. [ Links ]
[72]. Becker R.O. Electrical behavior or cartilage during loading, Science, 178, 982-983, 1961. [ Links ]
[73]. Bassett C.A., Pawluk R.J. Electrical behavior of cartilage during loading. Science, 178, 982, 1972. [ Links ]
[74]. Kucharzyk D.W. A controlled prospective outcome study of implantable electrical stimulation with spinal instrumentation in a high-risk spinal fusion population. Spine, 24, 465-468, 1999. [ Links ]
[75]. Zhao M., Bai H., Wang E., Forrester J.V., McCaig C.D. Electrical stimulation directly induces pre-angiogenic responses in vascular endothelial cells by signaling through VEGF receptors. J Cell Sci, 117, 397-405, 2004. [ Links ]
[76]. Chi-Sing C., Marylevich N.P., McManus A., Mason A.D., Pruitt B.A. Direct current reduces wound edema after full - thickness burn injury in rats. The Journal of Trauma: Injury, Infection and Critical Care, 40(5), 738-742, 1996. [ Links ]
[77]. Lippiello L., Chakkalakal D., Connolly J.F. Pulsing direct currentinduced repair of articular cartilage in rabbit osteochondral defects. J. Orthop. Res., 8, 266-275, 1990. [ Links ]
[78]. Ferguson M., Byrnes C., Sun L., Marti G., Bonde P., Duncan M., Harmon J.W. Wound healing enhancement, electroporation to address a classic problem of military medicine. World J. Surg, 29(1), S55-S59, 2005. [ Links ]
[79]. Sandoval M.C., Herrera E. Efectos de la estimulación eléctrica sobre el proceso de cicatrización de las heridas. SaludUIS, 39, 54-61, 2007. [ Links ]
[80]. Lu H.H., Cooper J., James A., Manuel S., Freeman J.W., Attawia M.A., Ko F.K., Laurencin C.T. Anterior cruciate ligament regeneration using braided biodegradable scaffolds: In vitro optimization studies. Biomaterials, 26, 4805-4816, 2005. [ Links ]