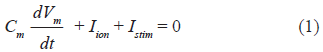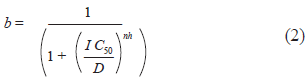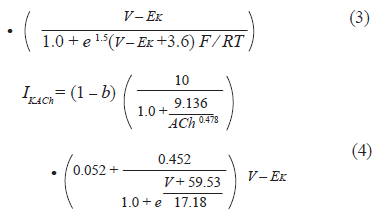Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Ingeniería Biomédica
versão impressa ISSN 1909-9762
Rev. ing. biomed. vol.8 no.15 Medellín jan./jun. 2014
EFECTO DEL FÁRMACO CLOROQUINA EN LA TERMINACIÓN DE UN ROTOR DURANTE FIBRILACIÓN AURICULAR PAROXÍSTICA. ESTUDIO DE SIMULACIÓN
CHLOROQUINE DRUG EFFECT ON A ROTOR TERMINATION DURING PAROXYSMAL ATRIAL FIBRILLATION. A SIMULATION STUDY
O EFEITO DO MEDICAMENTO CLOROQUINA NO FECHAMENTO DE UM ROTOR DURANTE FIBRILAÇÃO ATRIAL PAROXÍSTICA. SIMULAÇÃO ESTUDO
Maryuris Duarte1, Ana L. Restrepo1 , Catalina Tobón1,2, Karen Cardona3
1 Grupo de Investigación e Innovación Biomédica, Instituto Tecnológico Metropolitano, Medellín, Colombia.
2 Dirección para correspondencia: catalinatobon@itm.edu.co.
3 Grupo de Bioelectrónica, I3BH, Universitat Politècnica de València, Valencia, España.
Recibido 04 de septiembre de 2013. Aprobado 04 de marzo de 2014.
RESUMEN
La fibrilación auricular (FA) es la arritmia más común. Algunos episodios de FA son mantenidos por rotores. La FA paroxística (FAp) se refiere a episodios recurrentes que se autolimitan. Si la FAp no se trata puede convertirse en crónica. Se ha demostrado que la inhibición de las corrientes IKACh e IK1 contribuye a la terminación de la FA. El fármaco antimalárico cloroquina, al inhibir estas corrientes podría ser un fármaco antiarrítmico eficaz en humanos. El objetivo del trabajo es simular los efectos de la cloroquina y estudiar su eficacia en la terminación de un rotor en condiciones de FAp. Para esto, se desarrolló un modelo 2D de tejido auricular en condiciones de FAp. Se implementó un modelo del efecto de la cloroquina sobre las corrientes IK1 e IKACh para estudiar su eficacia en la terminación de un rotor simulado. La cloroquina alargó el potencial de acción a medida que se incrementó su concentración. A concentraciones de 0.3 µM y superiores, finalizó la actividad del rotor. Este es el primer trabajo que ha desarrollado modelos matemáticos del fármaco cloroquina para estudiar su efecto en la terminación de un rotor. Los resultados sugieren que la cloroquina podría ser un potente agente antiarrítmico en el tratamiento de la FAp.
PALABRAS CLAVES: Cloroquina; Fármacos antiarrítmicos; Fibrilación auricular paroxística; Modelos virtuales.
ABSTRACT
Atrial fibrillation (AF) is the most common arrhythmia. Some AF episodes are maintained by rotors. Paroxysmal AF (pAF) refers to self-limiting recurrent episodes. If the pAF is not treated it could become chronic. It has been demonstrated that inhibition of the IK1 and IKACh currents contributes to AF termination. Antimalarial drug chloroquine by inhibiting these currents could be an effective antiarrhythmic drug in humans. The aim of this work is to simulate the effects of chloroquine and study their effectiveness in the rotor termination in pAF conditions. For this, we developed a 2D model of atrial tissue under pAF conditions. We implemented a model of the effect of chloroquine on IK1 and IKACh currents to study its effectiveness in the termination of a simulated rotor. Chloroquine lengthened the action potential as the concentration increased. At concentrations of 0.3 µM and higher, the activity of the rotor finished. This is the first work that developed a chloroquine mathematical models to study its effect on the rotor termination. The results suggest that chloroquine could be a potent antiarrhythmic drug for the pAF treatment.
KEYWORDS: Antiarrhythmic drugs; Chloroquine; Paroxysmal atrial fibrillation; Virtual models.
RESUMO
A fibrilhação auricular (FA) é a arritmia mais comum. Alguns episódios de FA são mantidos por rotores. A FA paroxística (FAp) refere-se a episódios recorrentes que são autolimitantes. Se a FAP não tem nenhum tratamento, pode se tornar crônica. Tem sido demonstrado que a inibição das correntes IKACh e IK1 contribui para o término da AF. O medeicamento antimalárico cloroquina, para inibir essas correntes poderia ser um medicamento anti-arrítmico eficaz em seres humanos. O objetivo deste trabalho é simular os efeitos da cloroquina e estudar a sua eficácia na terminação de um rotor capaz em condições FAp. Para isso, um modelo 2D foi desenvolvido de tecido auricular em condições de FAp. foi implementado um modelo do efeito da Cloroquina sobre as corrente IK1 e IKACh para estudar a sua eficácia na terminação de um rotor simulado. A Cloroquina alongou o potencial de ação na medida em que foi aumentada a sua concentração. Em concentrações de 0,3 µM e superiores, terminou a atividade do rotor. Este é o primeiro trabalho que desenvolveu modelos matemáticos do medicamento cloroquina para estudar seu efeito sobre a terminação de um rotor. Os resultados sugerem que a cloroquina poderia ser um potente agente anti-arrítmico para o tratamento de FAp.
PALAVRAS-CHAVE: Cloroquina; Medicamentos antiarrítmicos; Fibrilhação auricular paroxística; Os modelos virtuais.
I. INTRODUCCIÓN
La arritmia cardíaca sostenida más común en los seres humanos es la fibrilación auricular (FA). Pueden ocurrir episodios que duran desde minutos hasta días y de terminación espontanea, denominados fibrilación auricular paroxística (FAp), si la FAp no se trata, puede convertirse en FA permanente o crónica [1]. Una de las hipótesis del mecanismo de la FA es la hipótesis del rotor, propuesta por [2], quienes describieron una o varias microrreentradas girando alrededor de un punto singular, denominadas reentradas tipo vórtice o rotores, de actividad regular de alta frecuencia y localizados principalmente en la aurícula izquierda, los cuales sostienen la FA.
El tratamiento de los diferentes tipos de FA está lejos de ser plenamente satisfactoria, los fármacos antiarrítmicos con frecuencia no son eficientes e incluso pueden producir efectos proarrítmicos [3, 4]. Se continúa en la búsqueda de fármacos más eficaces y con menos efectos secundarios.
Estudios experimentales, han demostrado que la inhibición de la corriente de potasio activada por acetilcolina IKACh, termina o impide la FA mediante el aumento de la duración del potencial de acción (APD del término en inglés Action Potential Duration) y prolongación del período refractario efectivo [5, 6]. Adicionalmente, algunos agentes antifibrilatorios son bloqueadores de la corriente entrante rectificadora de potasio IK1 [7-9].
La cloroquina es el medicamento contra la malaria más prescrito en el mundo. Inicialmente se utilizó solo para el tratamiento de la malaria, luego se encontraron otras aplicaciones: para la amebiasis extraintestinal, artritis reumatoide (por sus propiedades antiinflamatorias), lupus erimatoso sistémico y lupus erimatosodiscoide [10].
Recientes estudios experimentales en animales [11], sugieren que la cloroquina podría ser un fármaco antiarrítmico eficaz en la terminación de la FA.
El objetivo del presente trabajo es simular los efectos del fármaco cloroquina y estudiar su eficacia en la terminación de un rotor simulado en condiciones de FAp, implementando un modelo 2D de tejido auricular.
II . MATERIALES Y MÉTODOS
Modelo electrofisiológico
Para simular la actividad eléctrica auricular, se implementó el formalismo Courtemanche-Ramírez-Nattel-Kneller de célula de aurícula humana [12, 13]. Se simuló una concentración de acetilcolina (ACh) de 0.005 µM. La ecuación básica para calcular el potencial transmembrana es:
Donde Cm es la capacidad de membrana específica (100 pF), Iion es la corriente iónica total que atraviesa la membrana, Vm es el potencial transmembrana, Istim es la corriente de estimulación.
Modelo celular de FAp
Se introdujo al modelo celular los cambios en la conductancia de diferentes canales iónicos, observados en estudios experimentales [14, 15], con el fin de obtener las condiciones generadas por FAp en células de la aurícula humana izquierda.
Para esto, las conductancias para las corrientes IKACh e IK1 fueron incrementadas en un 100 %.
Modelo del efecto del fármaco cloroquina sobre las corrientes IK1 e IKACh
Se implementó la ecuación de Hill [16] para modelar matemáticamente el efecto del fármaco cloroquina sobre las corrientes IK1 e IKACh. Se implementó esta ecuación, ya que estudios experimentales del fármaco cloroquina han mostrado que el estado estable de bloqueo es muy rápido [17]. En este modelo la cinética del canal se considera sin cambios en la presencia del fármaco, por lo que:
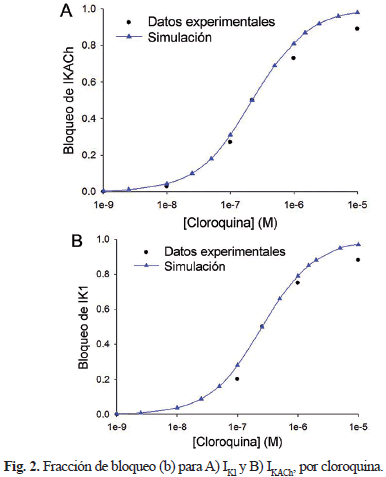
Donde b corresponde a la fracción de bloqueo, D es la concentración de cloroquina, IC50 es la concentración a la cual se logra un bloqueo del 50 %, y nh es el coeficiente de Hill. No se han documentado valores de IC50 para las corrientes IK1 e IKACh en miocitos auriculares humanos. Por lo tanto, se utilizaron valores de 0,257 µM y 0,22 µM para las corrientes IK1 e IKACh respectivamente, encontrados por [18] en islotes de células auriculares de cobayas.
Se asumió un coeficiente de Hill de 1. Benavides-Haro et al. [18] obtuvieron coeficientes de Hill de 1,01 para la IC50 de la corriente IKACh inducida mediante carbacol en miocitos de aurícula de cobaya y de 1,18 para la IC50 de la corriente IK1 en miocitos ventriculares de cobaya. Rodríguez-Menchaca et al. [19] obtuvieron un coeficiente de Hill de 1 para la IC50 de las corrientes Kir2.1 en células HEK-293.
El factor de bloqueo se introdujo en las ecuaciones matemáticas para las corrientes IK1 e IKACh como un factor (1-b) que multiplica la conductancia del canal, como se muestra a continuación:
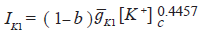
Modelo 2D de tejido auricular
Se desarrolló un modelo 2D de tejido de aurícula humana implementando el software FEMAP®. El cual consiste en una matriz de 6 cm x 6 cm, discretizada por una resolución espacial de 400 µm, para formar un mallado de 150 x 150 elementos. El modelo consiste en 22500 elementos hexaédricos y 42602 nodos.
A este modelo se le integró el modelo electrofisiológico en condiciones de FAp.
Modelo de propagación eléctrica
Se implementó el modelo monodominio de propagación eléctrica [20]. La ecuación de propagación se resolvió implementando el método de elementos finitos (FEM), usando el software EMOS para simulación en paralelo, desarrollado por la Universidad de Zaragoza [21].
Protocolo de estimulación
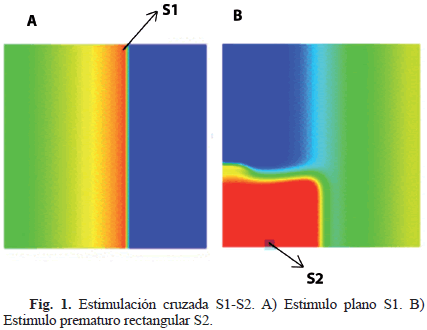
Para simular una reentrada tipo rotor como mecanismo de mantenimiento de la FAp, se aplicó un protocolo de estimulación cruzada S1-S2, el cual consiste en una estimulación plana S1, aplicada en un extremo del modelo 2D (Fig. 1A), para posteriormente aplicar un estímulo prematuro rectangular S2 de 2 cm x 3 cm (Fig. 1B).
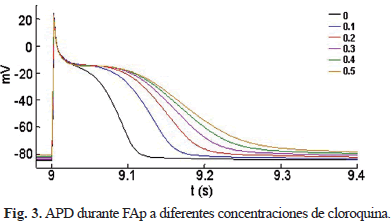
La simulación se mantuvo durante 5 segundos. Posteriormente, se simuló la aplicación de diferentes concentraciones de cloroquina: 0; 0,1; 0,2; 0,3; 0,4 y 0,5 µM, y se mantuvo la simulación durante 5 segundos más.
III . RESULTADOS
Efecto de la cloroquina sobre las corrientes IK1 , IKACh y potencial de acción
La Fig. 2 muestra las curvas de fracción de bloqueo para las corrientes IK1 e IKACh, a diferentes concentraciones de cloroquina (rango de 0,001 a 10 µM). Se observa un buen ajuste a los datos experimentales publicados por [18].
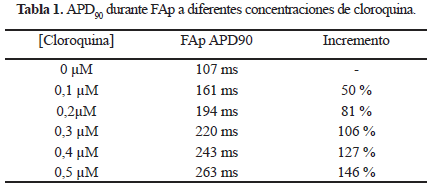
A medida que se incrementa la concentración de cloroquina, los picos máximos de ambas corrientes se reducen en amplitud y se desplazan a la derecha, contribuyendo al alargamiento de la fase de repolarización y por lo tanto al alargamiento del APD (Fig. 3 y Tabla 1).
El APD90 (APD al 90 % de la repolarización) se incrementó desde un 50 % a una concentración de 0,1 µM de cloroquina, hasta un 146 % a 0,5 µM (Tabla 1).
La Fig. 4 muestra el rotor obtenido al aplicar el protocolo de estimulación cruzada S1-S2, en condiciones de FAp. El rotor consiste en una onda espiral reentrante, girando en sentido de las manecillas del reloj y de trayectoria relativamente estable, con centro de giro en la zona central del tejido (Fig. 4A).
Efecto de la cloroquina en la terminación del rotor
A concentraciones de cloroquina de 0,1 y 0,2 µM, la actividad del rotor no es finalizada dentro de los 5 segundos de simulación. El alargamiento del potencial de acción afectó la trayectoria del rotor, haciendo que su centro de giro se desplace a lo largo del tejido, perdiendo la estabilidad que presentaba en la zona central (Fig. 4B). Esto se debe a que la cabeza del rotor busca tejido excitable para continuar su propagación.
A concentraciones de 0.3, 0.4 y 0.5 µM, la actividad del rotor fue finalizada a los pocos milisegundos después de aplicado el fármaco cloroquina. Esto se debe a que un mayor alargamiento del APD (≥ 106 %) provoca que la cabeza del rotor al reentrar choque con la cola y se extinga, ya que ésta aún no ha recuperado su excitabilidad continuando en estado refractario (Fig. 4C).
IV. DISCUSIÓN
Se simularon los efectos del fármaco cloroquina sobre las corrientes IK1 e IKACh, y se estudió su eficacia en la terminación de un rotor en condiciones de FAp. Hasta nuestro conocimiento, este es el primer trabajo de simulación que estudia el efecto antiarrítmico del fármaco cloroquina implementando un modelo 2D de tejido auricular.
Los principales resultados del estudio muestran que: 1) El fármaco cloroquina alarga el potencial de acción a medida que se incrementa su concentración, mostrando un efecto antiarrítmico. 2) A concentraciones de 0,3 µM y superiores, el fármaco cloroquina terminó la actividad de un rotor estable en tejido auricular bajo condiciones de FAp.
Efecto de la cloroquina sobre el potencial de acción
Los modelos desarrollados del efecto del fármaco cloroquina presentaron un efecto inhibitorio sobre las corrientes IK1 e IKACh. Recientemente, estudios experimentales de patch-clamp a nivel celular, demostraron que la cloroquina es un bloqueador de la corriente IK1 e IKACh [5-9], tanto en miocitos auriculares y ventriculares de animales. Por lo que la cloroquina podría desempeñar un papel antiarrítmico similar sobre la FA en seres humanos.
En este trabajo, el bloqueo de ambas corrientes por la acción de la cloroquina causó un alargamiento del APD a medida que se incrementó su concentración, como ha sido demostrado experimentalmente en animales [5-7, 22]. No se han reportado estudios en seres humanos que evalúen el efecto antiarrítmico del fármaco cloroquina en células auriculares.
Simulación de un rotor estable
Experimentalmente se ha demostrado la necesidad de un tamaño de tejido cardiaco crítico para mantener mecanismos reentrantes [23]. En estudios de simulación, Xie et al. [24] obtuvieron un tamaño de tejido crítico de 10 x 10 cm2 para mantener una onda espiral durante 5 segundos en condiciones de control, implementando el modelo celular de Courtemanche. En condiciones de FAp el APD se reduce en un 51 % [25], por lo tanto, es posible mantener ondas espirales en una masa menor de tejido. Para este estudio se desarrolló un modelo de 4 x 4 cm2, pero no fue posible mantener la reentrada, por lo que se incrementó a 6 x 6 cm2. Adicionalmente, teniendo en cuenta que el diámetro de la aurícula izquierda es de aproximadamente 4,5 cm [26] y el área de total de la aurícula izquierda es en promedio de 20 cm2, se simuló un trozo de tejido aproximado a las dimensiones de la pared posterior de la aurícula izquierda, donde han sido documentados rotores [2].
Adicionalmente, se aplicó 0,005 µM de ACh para generar un rotor como mecanismo de mantenimiento de FAp. Algunos estudios experimentales implementan ACh para generar episodios de FA [27], es necesario aclarar que la ACh reduce el potencial de acción.
Efecto de la cloroquina en la terminación de un rotor bajo condiciones de FAp
El rotor es considerado hoy día uno de los principales mecanismos de mantenimiento de la FA [2], por lo que es de gran importancia en el tratamiento de esta arritmia el estudio de la eficacia de posibles fármacos sobre la terminación de rotores.
Los resultados de este estudio demuestran, mediante simulación, la eficacia del fármaco cloroquina a concentraciones de 0,3 µM y superiores, en la terminación de un rotor bajo condiciones de FAp. Esto sugiere que el fármaco cloroquina a determinadas concentraciones podría ser un potente antiarrítmico para tratar episodios de FAp en humanos.
V. CONCLUSIÓN
Hasta donde sabemos, este es el primer trabajo que ha desarrollado modelos matemáticos de los efectos del fármaco cloroquina para estudiar su efecto en la terminación de un rotor. Los resultados sugieren que el fármaco cloroquina podría ser un potente agente antiarrítmico en el tratamiento de la FAp a concentraciones de 0.3 µM y superiores.
AGRADECIMIENTOS
El trabajo de Maryuris Duarte fue parcialmente soportado por el «Programa de Planeación Local y Presupuesto Participativo» de la Alcaldía de Medellín; y el trabajo de Ana L. Restrepo fue parcialmente soportado por el «Fondo EPM» de Medellín.
REFERENCIAS
[1]. Kerr C.R., Humphries K.H., Talajic M., Klein G.J., Connolly S.J., Green M., et al., Progression to chronic atrial fibrillation after the initial diagnosis of paroxysmal atrial fibrillation: results from the canadian registry of atrial fibrillation. Am Heart J., 149, 489-496, 2005. [ Links ]
[2]. Jalife J. Rotors and spiral waves in atrial fibrillation. J. Cardiovasc Electrophysiol, 14(7), 776-780, 2002. [ Links ]
[3]. Jaïs P., Cauchemez B., Macle L., Daoud E., Khairy P., Subbiah R., Hocini M., Extramiana F., Sacher F., Bordachar P., Klein G., Weerasooriya R., Clémenty J., Haïssaguerre M. Catheter ablation versus antiarrhythmic drugs for atrial fibrillation: the A4 study. Circulation, 118(24), 2498-2505, 2008. [ Links ]
[4]. Cardona K. Modelización matemática y simulación de los efectos de la lidocaína sobre la actividad eléctrica cardíaca en tejido ventricular. Tesis doctoral. SPUPV, 2008. [ Links ]
[5]. Benavides D., Sánchez J. Chloroquine blocks the background potassium current in guinea pig atrial myocytes. Naunyn-Schmiedeberg's Arch Pharmacol, 361, 311-318, 2000. [ Links ]
[6]. Noujaim S.F., Stuckey J.A., Ponce-Balbuena D., Ferrer-Villada T., López-Izquierdo A., Pandit S.V., et al., Structural bases for the different anti-fibrillatory effects of chloroquine and quinidine. Cardiovasc Res, 89, 862-869, 2011. [ Links ]
[7]. Harris L., Downar E., Shaikh N.A., Chen T. Antiarrhythmic potential of chloroquine: new use for an old drug. Can J Cardiol, 4, 295-300, 1988. [ Links ]
[8]. Wang J., Bourne G.W., Wang Z., Villemaire C., Talajic M., Nattel S. Comparative mechanisms of antiarrhythmic drug action in experimental atrial fibrillation: importance of use-dependent effects on refractoriness. Circulation, 88, 1030-1044, 1993. [ Links ]
[9]. Salinas-Stefanon E., Cebada J. Chloroquine selectively blocks the inward rectifying potassium channel in dog cardiac myocytes. J Mol Cell Cardiol, 25, A77, 1993. [ Links ]
[10]. Bernabéu A. Atención visual primaria control ocular en el tratamiento sistémico con cloroquina. Gacetaóptica, 429, 18-23, 2008. [ Links ]
[11]. Noujaim S.F., Pandit S.V., Berenfeld O., Vikstrom K., Cerrone M., Mironov S., et al. Up-regulation of the inward rectifier K+ current (IK1) in the mouse heart accelerates and stabilizes rotors. J Physiol, 578, 315-326, 2007. [ Links ]
[12]. Courtemanche M., Ramirez R.J., Nattel S. Ionic mechanisms underlying human atrial action potential properties: insights from a mathematical model. Am J Physiol, 275(1), H301-H321, 1998. [ Links ]
[13]. Kneller J., Zou R., Vigmond E.J., Wang Z., Leon L.J., Nattel S. Cholinergic atrial fibrillation in a computer model of a two-canine atrial cells with realistic ionic properties. Circ Res, 90(9), E73-E87, 2002. [ Links ]
[14]. Sarmast F., Kolli A., Zaitsev A., Parisian K., Dhamoon A.S., Guha P.K., et al. Cholinergic atrial fibrillation: IK,ACh gradients determine unequal left/right atrial frequencies and rotor dynamics. Cardiovasc Res, 59, 863-873, 2003. [ Links ]
[15]. Voigt N., Trausch A., Knaut M., Matschke K., Varró A., Van Wagoner D.R., et al. Left-to-right atrial inward rectifier potassium current gradients in patients with paroxysmal versus chronic atrial fibrillation. Circ Arrhythm Electrophysiol, 3, 472-480, 2010. [ Links ]
[16]. Ponce D. Caracterización del mecanismo de inhibición del canal de potasio sensible a ATP (KATP) por los fármacos tamoxifén y cloroquina. Tesis doctoral. Universidad de Colima, 2011. [ Links ]
[17]. Wagner M., Riepe K.G., Eberhardt E., Volk T. Open channel block of the fast transient outward K+ current by primaquine and chloroquine in rat left ventricular cardiomyocytes. Eur J Pharmacol, 647, 13-20, 2010. [ Links ]
[18]. Benavides-Haro D.E., Sánchez-Chapula J.A. Chloroquine blocks the background potassium current in guinea pig atrial myocytes. Naunyn-Schmiedeberg's Arch Pharmacol, 361, 311-318, 2000. [ Links ]
[19]. Rodríguez-Menchaca A.A., Navarro-Polanco R.A., Ferrer-Villada T., Rupp J., Sachse F.B., Tristani-Firouzi M., Sánchez-Chapula J.A. The molecular basis of chloroquine block of the inward rectifier Kir2.1 channel. PNAS, 105(4), 1364-1368, 2008. [ Links ]
[20]. Clayton R.H., Holden A.V. Propagation of normal beats and re-entry in a computational model of ventricular cardiac tissue with regional differences in action potential shape and duration. Prog Biophys Mol Biol, 85, 473-499, 2004. [ Links ]
[21]. Heidenreich E.A., Ferrero J.M., Doblare M., Rodriguez J.F. Adaptive macro finite elements for the numerical solution of monodomain equations in cardiac electrophysiology. Ann Biomed Eng, 38, 2331-2345, 2010. [ Links ]
[22]. Sánchez-Chapula J.A., Salinas-Stefanon E., Torres-Jácome J., Benavides-Haro D.E., Navarro-Polanco R.A. Blockade of currents by the antimalarial drug chloroquine in feline ventricular myocytes. J Pharmacol Exp Therapeut, 297(1), 437-445, 2001. [ Links ]
[23]. Kim Y-H., Garfinkel A., Ikeda T., Wu T-J., Athill C.A., Weiss J.N., Karagueuzian H.S., Chen, P-S. Spatiotemporal Complexity of Ventricular Fibrillation Revealed by Tissue Mass Reduction in Isolated Swine Right Ventricle. J Clin Invest, 100(10), 2486-2500, 1997. [ Links ]
[24]. Xie F., Qu Z., Garfinkel A., Weiss, J.N. Electrical refractory period restitution and spiral wave reentry in simulated cardiac tissue. Am J Physiol Heart Circ Physiol, 283, H448-H460, 2002. [ Links ]
[25]. Duarte M., Restrepo A.L., Tobón C., Cardona K., Saiz, J. Effect of chloroquine on atrial action potential under normal conditions and during paroxysmal and chronic atrial fibrillation. A simulation study. Proceedings of Pan American Health Care Exchange, 71-75, 2013. [ Links ]
[26]. Ho S.Y., Sanchez-Quintana D., Cabrera J.A., Anderson R.H. Anatomy of the left atrium: implications for radiofrequency ablation of atrial fibrillation. J Cardiovasc Electrophysiol, 10(11), 1525-1533, 1999. [ Links ]
[27]. Chou C.C., Nguyen B.L., Tan A.Y., Chang P.C., Lee H.L., Lin F.C, et al. Intracellular calcium dynamics and acetylcholine-induced triggered activity in the pulmonary veins of dogs with pacing-induced heart failure. Heart Rhythm, 5, 1170-1177, 2008. [ Links ]