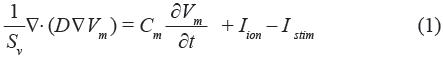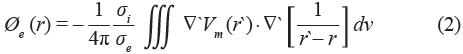Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Ingeniería Biomédica
versión impresa ISSN 1909-9762
Rev. ing. biomed. vol.8 no.16 Medellín jul./dic. 2014
LOCALIZACIÓN DE FOCOS ECTÓPICOS DURANTE FIBRILACIÓN AURICULAR PERMANENTE, MEDIANTE UN NUEVO ÍNDICE OHF. ESTUDIO DE SIMULACIÓN
ECTOPIC FOCI LOCATION DURING PERMANENT ATRIAL FIBRILLATION USING A NEW INDEX OHF. A SIMULATION STUDY
LOCALIZAÇÃO DE FOCOS ECTÓPICOS DURANTE FIBRILAÇÃO ATRIAL PERMANENTE EM UM NOVO ÍNDICE OHF. ESTUDO DE SIMULAÇÃO
Catalina Tobón1, Daniel A. Romero1, Karen Cardona2
1 Grupo de Investigación e Innovación Biomédica, Instituto Tecnológico Metropolitano, Medellín, Colombia. Dirección para correspondencia: catalinatobon@itm.edu.co (CT).
2 Grupo de Bioelectrónica, I3BH, Universitat Politècnica de València, Valencia, España.
Recibido 4 de septiembre de 2013. Aprobado 19 de octubre de 2014.
RESUMEN
La fibrilación auricular (FA), en ciertos casos, es mantenida por focos ectópicos de actividad automática, organización espacio temporal y de alta frecuencia. La ablación de estos sitios da como resultado la terminación de la FA en un alto porcentaje en paciente con FA paroxística, sin embargo, en pacientes con FA permanente estos sitios son difíciles de reconocer debido a la capacidad de las aurículas remodeladas para ser activadas a altas frecuencias. Es necesario un método más preciso para acotar mejor estas zonas. En el presente trabajo se plantea desarrollar un nuevo índice, a partir de los índices de frecuencia dominante (DF) e índice de organización (IO), para la identificación de estas zonas. Para esto, se simularon episodios de FA permanente mantenidos por focos ectópicos de actividad continua en tres diferentes regiones, implementando un modelo 3D de aurícula humana. Se obtuvieron electrogramas en toda la superficie auricular y se calculó su DF and IO. El índice OHF (Organization High Frequency), se calculó como el producto entre el valor de la DF y del IO de cada uno de los electrogramas y se crearon mapas de falso color sobre el modelo 3D. Los resultados muestran que el índice OHF es capaz de identificar el foco ectópico de actividad continua durante episodios de FA permanente simulados.
PALABRAS CLAVES: Fibrilación auricular permanente; Focos ectópicos; Índice OHF; Simulación 3D.
ABSTRACT
Atrial fibrillation in some cases is maintained by ectopic foci with automatic activity, spatiotemporal organization and high frequency. Ablating these sites results in the AF termination in a high percentage of patients with paroxysmal AF, however, in patients with permanent AF these sites are difficult to recognize due to the ability of the remodeled atria to be activated at high frequencies. A more accurate method is needed to delimit better these areas. In the present work, we developed a new index, based on dominant frequency (DF) and organization index (OI), to identify these areas. For this, we simulated permanent AF episodes maintained by ectopic foci with continuous activity in three different regions, implementing a 3D model of human atrium. Electrograms were obtained across the atrial surface and its DF and IO were calculated. The OHF index (Organization High Frequency), was calculated as the product of the DF and IO values of individual electrograms and we created false color maps in the 3D model. The results show that the OHF index is able to identify ectopic foci of continuous activity during simulated permanent AF episodes.
KEYWORDS: Permanent atrial fibrillation, Ectopic foci, OHF index, 3D simulation.
SUMÁRIO
A fibrilação atrial (FA), em alguns casos, é mantida por focos de actividade ectópica automático, organização e espaço de alta frequência temporal. Ablação desses locais determina a resolução da FA em uma alta porcentagem de pacientes com FA paroxística, no entanto, em pacientes com fibrilação atrial permanente desses sites são difíceis de reconhecer devido à capacidade dos átrios remodelado para ser ativado em alta frequências. Essas áreas para melhor abordagem é necessário um limite mais preciso. Neste artigo propõe-se a desenvolver uma freqüência novos índices com base em índice dominante (DF) e índice de organização (OI) para a identificação dessas áreas. Para isso, episódios de FA permanente mantido por focos ectópicos de atividade contínua em três regiões diferentes, implementando um modelo 3D de átrios humanos foram simulados. Eletrocardiogramas foram obtidos ao longo da superfície auricular e calculado o DF e IO. O OHF (Organização High Frequency) índice foi calculado como o produto do valor do DF e IO de eletrocardiogramas individuais e falsos mapas de cores do modelo 3D é criado. Os resultados mostram que o índice de OHF é capaz de identificar o foco ectópico de actividade contínua durante episódios de FA permanentes simulados.
PALAVRAS-CHAVE: A fibrilação atrial permanente; Focos ectópicos; Índice OHF; Simulação 3D.
I. INTRODUCCIÓN
La fibrilación auricular (FA) es la arritmia más común en la práctica clínica. Su presencia se encuentra asociada con un incremento considerable en la morbilidad y mortalidad [1]. Típicamente, las arritmias auriculares se caracterizan por una activación rápida e irregular de la aurícula (300-500 bpm), lo cual resulta en una masiva reducción de su contractilidad. Estudios experimentales han demostrado que la FA induce alteraciones en las propiedades auriculares que la perpetúan, estos cambios son llamados "remodelado auricular" [2-4].
Ciertos casos de FA (FA focal) se mantienen por fuentes ectópicas focales [5-7], las cuales consisten en regiones localizadas de actividad automática, organización espacio temporal y de alta frecuencia dominante (DF). La ablación de estos sitios de alta DF da como resultado la terminación de la FA en un alto porcentaje en paciente con FA paroxística [8, 9].
Sin embargo, en pacientes con FA permanente los sitios DF son difíciles de reconocer debido a la capacidad de las aurículas remodeladas para ser activadas a frecuencias similares. Por otra parte, los mapas de índice de organización (IO) permiten acotar mejor las zonas que presentan una mayor organización [10], sin embargo se requiere un método más preciso para acotar mejor estas zonas.
El objetivo del presente trabajo, es desarrollar un nuevo índice, a partir de los índices DF e IO, para la identificación de fuentes ectópicas focales durante FA permanente.
II. MATERIALES Y MÉTODOS
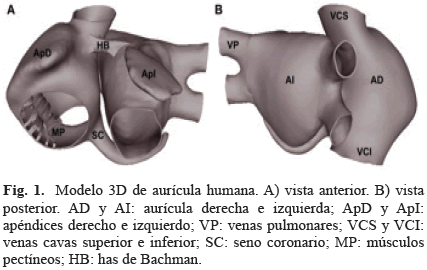
2.1 Modelo 3D de auricular humana
Un modelo 3D de aurícula humana altamente realista, ha sido desarrollado previamente [11], el cual incluye orientación de fibras y anisotropía.
2.2 Modelo celular y de propagación eléctrica
Se implementó el modelo de célula de auricular humana desarrollado por Nygren et al. [12]. Al modelo se le introdujo la heterogeneidad electrofisiológica reportada por Feng et al. [13], para reproducir los potenciales de acción en diferentes zonas de la aurícula.
El modelo monodominio para la propagación eléctrica del potencial de acción a lo largo del modelo 3D se describe mediante la siguiente ecuación de reacción-difusión:
donde Cm es la capacidad de membrana, Iion es la corriente total iónica a través de la membrane cellular, Vm es el potencial de membrana, Istim es la corriente de estimulación, Sv corresponde a la proporción superficie-volumen y D es el tensor de conductividad.
Se asignaron valores de conductividad para obtener velocidades de conducción dentro de rangos reportados en la literatura [14]. Se asumió conducción anisotrópica 2:1 para el tejido.
2.3 Modelo de fibrilación auricular permanente
Con el fin de reproducir el remodelado electrico generado por episodios de FA permanente, se realizaron cambios en la conductancia de diferentes canales iónicos observados experimentalmente en células de aurícula humana durante FA permanente [3, 4], como se describe a continuación: la conductancia para las corrientes IKur e Ito fueron reducidas en un 50 %, la conductancia para la corriente ICaL fue reducida en un 70 % y la conductancia para la corriente IK1 fue incrementada en un 100 %.
2.4 Protocolo de estimulación
Episodios de FA permanente fueron generados aplicando un protocolo de estimulación S1-S2, donde un tren de estímulos es aplicado en la región del nodo sinoauricular a una longitud de ciclo base de 1000 ms durante 5 segundos (S1). Posteriormente, un foco ectópico de actividad continua (S2) a alta frecuencia es aplicado en tres diferentes regiones: 1) en la desembocadura de las venas pulmonares izquierdas (Fig. 2A, panel izquierdo); 2) desembocadura de las venas pulmonares derechas (Fig. 2B, panel izquierdo); y 3) en la vena cava superior (Fig. 2C, panel izquierdo). Los episodios de FA fueron mantenidos por 5 segundos.
2.5 Electrogramas
Electrogramas unipolares (EGM) fueron simulados en toda la superficie auricular. El potencial extracelular (Φe) está dado por:
donde  'Vm es el gradiente especial del potencial transmembrana Vm, σi es la conductividad intracelular, σe es la conductividad extracelular, r es la distancia desde la fuente (x, y, z) y el punto de medida (x', y', z') y dv es el diferencial de volumen.
'Vm es el gradiente especial del potencial transmembrana Vm, σi es la conductividad intracelular, σe es la conductividad extracelular, r es la distancia desde la fuente (x, y, z) y el punto de medida (x', y', z') y dv es el diferencial de volumen.
Los EGM fueron computados cada 1 ms en 42835 puntos sobre la malla a una distancia de 0.2 mm de la superficie.
2.6 Frecuencia dominante, índice de organización e índice OHF
Los EGM fueron procesados mediante filtrado pasobanda de 40 a 250 Hz, rectificados y filtrados con filtro paso-bajo a 20 Hz. Se aplicó el análisis espectral mediante FFT (Fast Fourier Transfor). La frecuencia con mayor potencia espectral dentro del rango 3-20 Hz es considerada la frecuencia dominante (DF).
El índice de organización (IO) se calcula de la siguiente forma: sobre el espectro de potencia se estima la energía de la DF y de sus armónicos, computando el área dentro de una banda de ≈0.75 Hz alrededor de la DF y de cada uno de sus armónicos. El IO es la diferencia de ésta área sobre la energía total de todo el espectro.
En este trabajo, se plantea la implementación de un nuevo índice, denominado índice OHF (Organization High Frequency), calculado como el producto entre el valor de la DF y del IO de cada uno de los EGM. Se crean mapas de falso color sobre el modelo 3D, donde las zonas con mayores OHF son mostradas en color rojo y en azul las de valores más bajos.
III. RESULTADOS
Al aplicar el foco ectópico continuo en la desembocadura de las venas pulmonares izquierdas, se generó conducción fibrilatoria. En la aurícula derecha se observa actividad periódica proveniente de la aurícula izquierda, presentando fragmentaciones y colisiones de onda en la pared posterior. Se observan episodios de un rotor (onda espiral reentrante) de trayectoria irregular actuando en la aurícula derecha en la zona de la cresta terminal y vena cava superior. La aurícula izquierda es activada de forma relativamente periódica por el foco ectópico, observándose fragmentaciones y rotores de corta duración (Fig. 2A, panel central).
Al aplicar el foco ectópico continuo en la desembocadura de las venas pulmonares derechas, se generó conducción fibrilatoria. Se observan múltiples frentes reentrantes, generalmente tipo rotor de trayectorias irregulares en la aurícula derecha que colisionan y se fragmentan, generando nuevos frentes de activación. La aurícula izquierda es activada de forma relativamente periódica por el foco ectópico, observándose fragmentaciones y colisiones en diversos instantes de tiempo en la pared posterior, pared superior y anterior (Fig. 2B, panel central).
Al aplicar el foco ectópico continuo en la vena cava superior, se generó de igual forma conducción fibrilatoria. Se observan múltiples frentes de onda entre la cresta terminal y vena cava superior, debido a la fragmentación y colisión de los frentes de onda. Se observan entre tres y cuatro diferentes frentes reentrantes que colisionan en la aurícula derecha durante gran parte de la simulación. La aurícula izquierda es activada por el frente de activación proveniente de la aurícula derecha; se observa además una reentrada en la pared superior y anterior de corta duración, y la generación de un rotor en la pared posterior (Fig. 2C, panel central).
En los mapas de falso color desarrollados con los valores de OHF, la escala de colores muestra en rojo los valores máximos obtenido para cada uno de los tres casos.
Los resultados obtenidos al implementar el índice OHF desarrollado, muestran que este método permite localizar las fuentes focales. En la Fig. 2A, panel derecho, se observa como el mapa de OHF permite identificar una pequeña zona muy próxima a la fuente focal ubicada en la desembocadura de las venas pulmonares izquierdas. Esta zona incluye elementos de la zona ectópica.
De igual forma sucede para la fuente focal ubicada en la desembocadura de las venas pulmonares derechas (Fig. 2B, panel derecho). El mapa de OHF permite identificar una pequeña zona muy próxima a la fuente focal, en la cual se incluyen elementos de la zona ectópica.
En la Fig. 2C, panel derecho, se observa como el mapa de OHF permite localizar con precisión la fuente focal ubicada en la vena cava superior.
IV. DISCUSIÓN
Los resultados muestran que el índice OHF es capaz de identificar el foco ectópico de actividad continua durante episodios de FA permanente simulados.
La ablación focalizada sería el tratamiento a seguir para tratar episodios de arritmias automáticas generadas por una actividad rápida y continua de una fuente focal, según algunos autores [7, 15, 16, 17]. Por lo que la localización de la fuente focal es de vital importancia para llevar a cabo el procedimiento de forma eficaz.
Diversos estudios han implementado mapas de DF para la localización de fuentes focales durante episodios de FA [18, 19, 20]. Durante FA paroxística, analizaron la distribución de frecuencias en múltiples sitios de mapeo y demostraron que los sitios con la mayor DF correlacionaban bien con sitios ectópicos. Sin embargo, durante la FA permanente esta correlación no está tan clara. Sanders et al. [8], en 32 pacientes, mediante el análisis espectral y un mapeo de frecuencias identificaron sitios focalizados de actividad a alta frecuencia durante FA, con diferentes distribución en FA paroxística y permanente. En pacientes con FA paroxística, las zonas de alta DF fueron localizadas en las venas pulmonares, por el contrario, en pacientes con FA permanente, las zonas de alta DF fueron localizas por toda la aurícula, incluyendo la aurícula derecha. La ablación de estos sitios de alta DF terminó la arritmia sólo en los pacientes con FA paroxística. El fracaso en los pacientes con FA permanente puede deberse a que la ablación no incluya sitios críticos que mantienen la FA, debido a la diferente distribución de estos puntos, o a que no fue posible reconocer un gradiente debido a la habilidad de la aurícula remodelada a ser activada a una frecuencia similar a la de la fuente ectópica.
Es posible que esta habilidad de la aurícula remodelada a ser activada a alta frecuencia, sea lo que no permita localizar de forma precisa las fuentes focales mediante los mapas de DF. Con base a esto, se propuso implementar mapas del índice OHF propuesto, para localizar las fuentes focales.
Un uso combinado de este método y el análisis de EGM fragmentados podría ayudar a identificar con mayor precisión el sustrato crítico para ablacionar, en aurículas previamente remodeladas.
IV. CONCLUSIÓN
Se desarrolló un nuevo índice, a partir de la DF y el IO, para la localización de focos ectópicos. Los resultados muestran que el índice OHF desarrollado identifica de forma eficaz focos ectópicos de actividad continua durante episodios de FA permanente simulados.
AGRADECIMIENTOS
Este trabajo fue soportado por el proyecto P14112 del ITM.
REFERENCIAS
[1]. Schnabel R.B., Wilde S., Wild P.S., Munzel T., Blankenberg S. Atrial Fibrillation: Its Prevalence and Risk Factor Profile in the German General Population. Dtsch Arztebl Int, 109, 293-299, 2012. [ Links ]
[2]. Wijffels M.C.E.F., Kirchhof C.J.H.J., Dorland R., Allessie M.A. Atrial-fibrillation begets atrial fibrillation - a study in awake chronically instrumented goats. Circulation, 92(7), 1954-1968, 1995. [ Links ]
[3]. Bosch R.F., Zeng X., Grammer J.B., Popovic C.M., Kuhlkamp V. Ionic mechanisms of electrical remodelling in human atrial fibrillation. Cardiovasc Res, 44, 121-131, 1999. [ Links ]
[4]. Workman A.J., Kane A.K., Rankin A.C. The contribution of ionic currents to changes in refractoriness of human atrial myocytes associated with chronic atrial fibrillation. Cardiovasc Res, 52(2), 226-235, 2001. [ Links ]
[5]. Haissaguerre M., Jais P., Shah D.C., Takahashi A., Hocini M., Quiniou G., Garrigue S., Le M.A., Le M.P., Clementy J. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med, 339(10), 659-666, 1998. [ Links ]
[6]. Chen S.A., Hsieh M.H., Tai C.T., Tsai C.F., Prakash V.S., Yu W.C., Hsu T.L., Ding Y.A., Chang M.S. Initiation of atrial fibrillation by ectopic beats originating from the pulmonary veins: electrophysiological characteristics, pharmacological responses, and effects of radiofrequency ablation. Circulation, 100(18), 1879-1886, 1999. [ Links ]
[7]. Tsai C.F., Tai C.T., Hsieh M.H., Lin W.S., Yu W.C., Ueng K.C., Ding Y.A., Chang M.S., Chen S.A. Initiation of atrial fibrillation by ectopic beats originating from the superior vena cava: electrophysiological characteristics and results of radiofrequency ablation. Circulation, 102(1), 67-74, 2000. [ Links ]
[8]. Sanders P., Berenfeld O., Hocini M., Jais P., Vaidyanathan R., Hsu L.F., Garrigue S., Takahashi Y., Rotter M., Sacher F., Scavee C., Ploutz-Snyder R., Jalife J., Haissaguerre M. Spectral analysis identifies sites of high-frequency activity maintaining atrial fibrillation in humans. Circulation, 112(6), 789-797, 2005. [ Links ]
[9]. Berenfeld O., Mandapati R., Dixit S., Skanes A.C., Chen J., Mansour M., Jalife J. Spatially distributed dominant excitation frequencies reveal hidden organization in atrial fibrillation in the Langendorff-perfused sheep heart. J Cardiovasc Electrophysiol, 11(8), 869-879, 2000. [ Links ]
[10]. Saiz J., Tobon C., Rodriguez J.F., Hornero F., Ferrero J.M. DF and OI maps identify areas of high-frequency activity in biophysical models of permanent atrial fibrillation. A simulation study. Europace, 13(Suppl 3), P1082, 2011. [ Links ]
[11]. Tobón C., Ruiz-Villa C.A., Heidenreich E., Romero L., Hornero F., Saiz J. A three-dimensional human atrial model with fiber orientation. Electrograms and arrhythmic activation patterns relationship. PLoS One, 8(2), e50883, 2013. [ Links ]
[12]. Nygren A., Fiset C., Firek L., Clark J.W., Lindblad D.S., Clark R.B., Giles W.R. Mathematical model of an adult human atrial cell: the role of K+ currents in repolarization. Circ Res, 82(1), 63-81, 1998. [ Links ]
[13]. Feng J., Yue L., Wang Z., Nattel S. Ionic mechanisms of regional action potential heterogeneity in the canine right atrium. Circ Res, 83(5), 541-551, 1998. [ Links ]
[14]. Boineau J.P., Canavan T.E., Schuessler R.B., Cain M.E., Corr P.B., Cox J.L. Demonstration of a widely distributed atrial pacemaker complex in the human heart. Circulation, 77(6), 1221-1237, 1988. [ Links ]
[15]. Lin W.S., Tai C.T., Hsieh M.H., Tsai C.F., Lin Y.K., Tsao H.M., Huang J.L., Yu W.C., Yang S.P., Ding Y.A., Chang M.S., Chen S.A. Catheter ablation of paroxysmal atrial fibrillation initiated by nonpulmonary vein ectopy. Circulation, 107(25), 3176-3183, 2003. [ Links ]
[16]. Jais P., Haissaguerre M., Shah D.C., Chouairi S., Gencel L., Hocini M., Clementy J. A focal source of atrial fibrillation treated by discrete radiofrequency ablation. Circulation, 95(3), 572-576, 1997. [ Links ]
[17]. Haissaguerre M., Jais P., Shah D.C., Garrigue S., Takahashi A., Lavergne T., Hocini M., Peng J.T., Roudaut R., Clementy J. Electrophysiological end point for catheter ablation of atrial fibrillation initiated from multiple pulmonary venous foci. Circulation, 101(12), 1409-1417, 2000. [ Links ]
[18]. Lin Y.J., Tai C.T., Chen S.A. Can mapping and ablation of atrial fibrillation be guided by frequency analysis of fibrillatory waves? J Cardiovasc Electrophysiol, 17(3), S44-S49, 2006. [ Links ]
[19]. Stiles M.K., Brooks A.G., Kuklik P., John B., Dimitri H., Lau D.H., Wilson L., Dhar S., Roberts-Thomson R.L., Mackenzie L., Young G.D., Sanders P. High-density mapping of atrial fibrillation in humans: relationship between high-frequency activation and electrogram fractionation. J Cardiovasc Electrophysiol, 19(12), 1245-1253, 2008. [ Links ]
[20]. Kalifa J., Tanaka K., Zaitsev A.V., Warren M., Vaidyanathan R., Auerbach D., Pandit S., Vikstrom K.L., Ploutz-Snyder R., Talkachou A., Atienza F., Guiraudon G., Jalife J., Berenfeld O. Mechanisms of wave fractionation at boundaries of high-frequency excitation in the posterior left atrium of the isolated sheep heart during atrial fibrillation. Circulation, 113(5), 626-633, 2006. [ Links ]