Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Ingeniería Biomédica
versión impresa ISSN 1909-9762
Rev. ing. biomed. vol.9 no.18 Medellín jul./dic. 2015
PROTOCOLOS PARA VALIDACIÓN DE TECNOLOGÍA MÉDICA
PROTOCOLS FOR VALIDATION OF MEDICAL TECHNOLOGY
PROTOCOLOS DE VALIDAÇÃO DE TECNOLOGIA MÉDICA
Juliana Acevedo López, Nataly Saldarriaga Herrera, J. H. Garcíao
Universidad de Antioquia. Medellín, Colombia.
Dirección para correspondencia: juliana.acevedo1@udea.edu.co.
RESUMEN
Las empresas productoras de tecnologías requieren un mejor conocimiento de los procesos en la prestación de los servicios con dispositivos médicos, al igual que el mejoramiento constante de los equipos existentes para lograr una transformación más productiva y eficiente, que involucre el proceso completo de salida al mercado de las nuevas tecnologías, las normas aplicables a los procesos, procedimientos de venta y características propias de dichas tecnologías. La elaboración de estándares específicos para cada equipo médico en particular no resulta fácil, por esto es importante que todos los equipos con funcionabilidad en el área de la medicina antes de salir al mercado o ya estando en él, tengan un análisis que verifique su correcto funcionamiento, con el fin de proteger y mejorar la calidad de vida no solo de los diferentes pacientes sino también de todos los que se encuentren en constante contacto con ellos. En este artículo se presenta una metodología para diseñar protocolos de validación a tecnología médica; iniciando con una revisión de las normas y procesos aplicables para obtener la certificación internacional por parte de FDA o INVIMA a nivel nacional; se continúa con una búsqueda de las empresas o laboratorios que pueden realizar las pruebas necesarias y el diseño de protocolos y listas de chequeo, para esto se desarrollarán una serie de pruebas en los dispositivos médicos que permitan comprobar el cumplimiento de las normas establecidas por las diferentes entidades encargadas de la vigilancia y regulación de dispositivos médicos, se realizaron los protocolos para dos equipos médicos y se dejan las bases para el desarrollo de protocolos similares a otros dispositivos siguiendo los lineamientos planteados en la metodología.
PALABRAS CLAVE: Normas; equipo biomédico; diseño para la calidad; tecnología.
ABSTRACT
The companies producing technologies require a better understanding of the processes in providing services for medical devices, as well as the constant improvement of existing equipment to achieve a more productive and efficient transformation, involving the complete process of marketing new technologies, the rules applicable to processes, sales specific procedures, and technology features. The development of specific standards for each particular medical team is not easy, so it is important that all equipment functionality in the area of medicine before going to the market or already being in it, have an analysis to verify correct operation in order to protect and improve the quality of life, not only in patients, but also of all who are in constant contact with them. This article presents a methodology for designing validation protocols to medical technology; starting with a review of the rules and procedures applicable for international certification by FDA or INVIMA at national level; It is followed by a search of companies or laboratories that can perform the necessary tests and the design of protocols and checklists, for this, a series of tests on medical devices in order to check compliance with the standards set will be developed by different agencies responsible for monitoring and regulation of medical devices. Protocols for two medical teams were held and allowed the foundations for the development of similar protocols to other devices along the lines proposed in the methodology.
KEYWORDS: Standards; Biomedical Equipment; Design for Quality; Technology.
RESUMO
As Empresas produtoras de tecnologias requerem uma melhor compreensão dos processos na prestação de serviços para os dispositivos médicos, bem como a constante melhoria dos equipamentos existentes para alcançar um processamento mais produtivo e eficiente, envolvendo todo o processo para o mercado de novas tecnologias, processos, normas aplicáveis, as vendas e as características específicas deste tipo de tecnologias. O desenvolvimento de normas específicas para cada equipe médica particular não é fácil, por isso é importante que toda a funcionalidade de equipamentos na área de medicina antes de ir ao mercado ou já estar nele, tem uma análise para verificar o funcionamento correto a fim de proteger e melhorar a qualidade de vida não só dos pacientes, mas também de todos os que estão em contato constante com eles. Este artigo apresenta uma metodologia para a concepção de protocolos de validação de tecnologia médica; começando com uma revisão das regras e procedimentos aplicáveis para a certificação internacional pela FDA ou INVIMA a nível nacional; Ele é seguido por uma busca de empresas ou laboratórios que podem realizar os testes necessários e o desenho de protocolos e listas de verificação, por isso uma série de testes sobre dispositivos médicos, a fim de verificar a conformidade com o conjunto de normas serão desenvolvidos por diferentes órgãos responsáveis pela vigilância e regulamentação dos dispositivos médicos, realizaram-se protocolos para equipes médicos e permitiu a base para o desenvolvimento de protocolos semelhantes a outros dispositivos ao longo das linhas propostas na metodologia.
PALAVRAS-CHAVE: Standards; Equipamentos biomédicos; Design de qualidade; Tecnologia.
I. INTRODUCCIÓN
Las nuevas tecnologías se desarrollan de acuerdo a las necesidades actuales y al beneficio de las entidades de salud, por lo que es necesario centrar la atención en el mejoramiento de la calidad en aspectos como la forma de asegurar la eficiencia; por lo tanto toda empresa que diseñe y fabrique dispositivos debe tener un sólido sistema de aseguramiento de calidad enfocado a lograr productos y servicios libres de defectos y que cumplan conscientemente las especificaciones planteadas por la empresa y las normas del país.
El que un equipo médico sea aceptado o no para la atención médica, depende de la certificación que se le ha otorgado por parte de los organismos encargados de controlar el sector de la salud, ejemplo de estos organismos es el FDA en Estados Unidos y el INVIMA en Colombia [1].
Los dispositivos médicos se regulan en los Estados Unidos por el Centro para Dispositivos y Salud Radiológica (CDRH por sus siglas en inglés) de la FDA. El objetivo de la FDA / CDRH es promover y proteger la salud pública mediante la fabricación de dispositivos médicos seguros y eficaces disponibles en el momento oportuno [2].
En Colombia las políticas de regulación son entregadas por el Ministerio de Protección Social y abarcan la producción, mantenimiento y vigilancia de dispositivos médicos y son ejecutadas por el INVIMA [3].
La certificación de un equipo médico que permita su producción y comercialización depende principalmente del producto final obtenido y de los procedimientos aplicados en su diseño para la verificación y validación de dicho equipo, en los cuales deben ser aplicados los estándares vigentes.
A nivel mundial la producción de dispositivos médicos se ha incrementado debido al progreso científico y tecnológico de la industria además de la demanda de servicios de salud, tanto que ascendió a más de 600 millones de dólares anuales, de esta cifra la participación en la producción de Norteamérica es del 38,7%, mientras que América latina tiene una participación del 1,4% [4].
Actualmente la orientación de la seguridad de los dispositivos es estimar el potencial de que un dispositivo se convierta en un peligro, lo que podría dar lugar a problemas de seguridad [5].
La International Medical Device Regulators Forum reportó que entre el 50% y el 70% de los incidentes con dispositivos médicos están relacionados con errores en el ensamble, supresión de alarmas, conexiones erradas, uso clínico incorrecto, incorrecta selección de parámetros de uso, programación incorrecta y falla en el monitoreo [6].
Actualmente no solo a nivel internacional sino también nacional, las empresas productoras de dispositivos médicos necesitan establecer manuales o protocolos, que faciliten a los funcionarios de las organizaciones seguir unos lineamientos y evitar eventos adversos en el proceso de salida al mercado de dichos dispositivos.
Un manual protocolario para la calidad de los nuevos dispositivos médicos contribuye a mejorar la eficacia y la eficiencia en el desarrollo de los mismos, con el fin de salvaguardar la operatividad de las instituciones prestadoras de servicios de salud. Así mismo, para el departamento de almacén es indispensable un protocolo puesto que le permitirá contar con una herramienta para obtener información rápida y oportuna, ya que con el buen uso del mismo se lleva el control en cada uno de los procedimientos para la salida al mercado de los dispositivos médicos.
A continuación se desarrollarán una serie de estudios que permitan a partir de las normas legales vigentes y regulatorias validar la calidad de los dispositivos médicos, por medio de la implementación de un protocolo previamente planteado a partir de diseños experimentales tales como el factorial y análisis estadístico, que mejoren y aporten a la seguridad de quienes están en constante contacto con las tecnologías médicas.
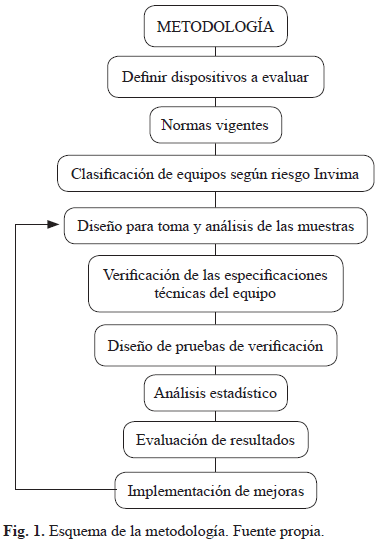
II. METODOLOGÍA
Revisión bibliográfica de las normas existentes para la validación de equipos médicos con la cual crear una plantilla con las normas regulatorias nacionales e internacionales para dispositivos médicos, con el fin de diseñar correctamente las pruebas de verificación; paralelamente a partir de la revisión bibliográfica de los registros del INVIMA se obtiene la clasificación existente para los dispositivos médicos para así poder escoger el mejor método experimental y proceder a diseñar y verificar las pruebas pertinentes para la validación de los dispositivos (también sometidas a mejoras), que a partir de análisis estadísticos avalan la información.
III. RESULTADOS
A partir de la revisión bibliográfica se corroboró la justificación del proyecto, que en la actualidad es una deficiencia del mercado de dispositivos médicos la ausencia de empresas dedicadas a la validación. Esto puede ser debido a la existencia de normas que no son de carácter obligatorio y al desconocimiento de lo que implican estos procesos, ya que se confunden los términos de certificar, verificar y calibrar con validar.
Se encontró que actualmente en la ciudad de Medellín solamente existen dos empresas dedicadas a la validación, una de ellas es Zoser la cual presta servicios de validación de Autoclaves odontológicas , hospitalarias y laboratorios, calificación de sistemas de aire clasificado o confort, calificación de equipos de laboratorio, calibración de instrumentación en las variables temperatura, presión y humedad [7] y FEMTO S.A.S una empresa avalada por uno de los laboratorios de calibración más importantes en el área de los equipos médicos y además presta servicios de validación de esterilizadores como autoclaves y de calificación de congeladores y refrigeradores industriales.
Para la realización de este proyecto se escogieron 3 dispositivos a evaluar: Oxímetro de pulso, EKG (electrocardiograma) y NIBP (monitor de presión arterial no invasiva), los cuales en conjunto forman un monitor de signos vitales. Para este artículo sólo se mencionan lo resultados para el oxímetro de pulso.
Todos los dispositivos médicos son clasificados según su nivel de riesgo para el paciente mediante un sistema de 3 niveles (clase I, IIa, IIb o III). El oxímetro de pulso se clasifica según riesgo INVIMA en clase IIB
A. Validación de un proceso
La validación de un proceso es el mecanismo usado por el fabricante para planear, obtener, registrar, e interpretar datos. Esas actividades caen en tres fases [8]:
- Calificación inicial del equipo usado y la disposición de los servicios necesarios, también conocida como calificación de instalación. Las consideraciones importantes de son [8]:
- Características de diseño de equipo (limpieza de los materiales de construcción, etc.)
- Condiciones de instalación
- Calibración, mantenimiento preventivo
- Características de seguridad
- Documentación, gráficos y manuales
- Documentación del software
- Lista de repuestos
- Condiciones ambientales.
- Demostración de que el proceso generará resultados aceptables y establecerá limites (en el peor de los casos) de los parámetros del proceso, también conocida como calificación operacional.
En esta fase los parámetros de proceso deben ser estudiados para asegurar que darán como resultado productos que cumplan todos los requerimientos definidos bajo todas las condiciones anticipadas de fabricación, es decir, la prueba en el peor de los casos. Las consideraciones incluyen [8]:
- Límites de control de proceso (tiempo, temperatura, presión, condiciones de configuración, etc.)
- Parámetros de software.
- Especificaciones de materia prima.
- Procedimientos de operación de proceso.
- Requerimientos de manejo de material.
- Control de cambios de proceso.
- Entrenamiento.
- Estabilidad y capacidad a corto plazo del proceso.
- Modos de falla potencial.
- Establecimiento de la estabilidad del proceso a largo plazo, también conocida como calificación de desempeño En esta fase el objetivo clave es demostrar que el proceso producirá de manera consistente un producto aceptable bajo condiciones normales de operación. Las consideraciones incluyen [8]:
- Parámetros de producto y procedimientos establecidos.
- Aceptabilidad del producto
- Aseguramiento de la capacidad de proceso.
- Repetibilidad del proceso, estabilidad del proceso a largo plazo.
B. Recopilación de normas
Se realizó una colección de las normas necesarias para los equipos a validar, con el fin de diseñar las pruebas correctamente conforme a los estándares nacionales e internacionales. Basados en esto se seleccionaron las normas correspondientes a especificaciones de calidad, seguridad eléctrica, usabilidad, software e interferencia de equipos médicos, en especial para este caso se recopilaron las referentes a los oxímetros. En la Tabla 1 se evidencian solo algunas de las normas seleccionadas.
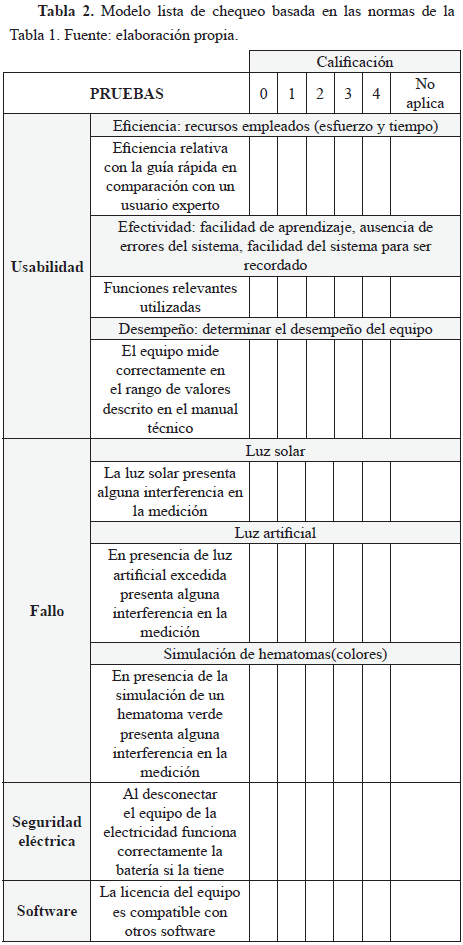
C. Lista de chequeo conforme a las normas
Se realizó una lista con preguntas basadas en las normas mencionadas en la Tabla 1 y en las consideraciones para la validación de un proceso, todo esto para evaluar el comportamiento del equipo. Algunas de las preguntas basadas en las normas seleccionadas se evidencian en la Tabla 2.
Para la Tabla 2 se debe tener en cuenta los siguientes ítems:
0 = No cumple o no lo tiene
1 = Insatisfactorio/mucho tiempo/muchos errores
2 = Medianamente satisfactorio
3 = Cumple pero con errores
4 = Cumple satisfactoriamente
D. Pruebas realizadas al módulo de oximetría del equipo Poet plus 8100 (criticare)
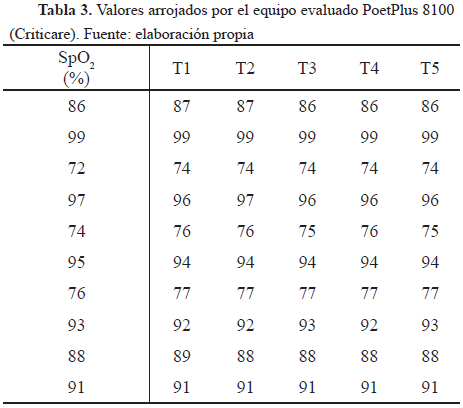
Para la prueba de desempeño se realizaron 10 tomas aleatorias para 30 diferentes porcentajes de saturación dentro del rango de importancia, con el fin de eliminar el error de aleatorización y además corroborar el estado del funcionamiento del equipo. Esta prueba se realizó para una frecuencia cardíaca constante de 75 bpm, cada dato en un intervalo de 15 segundos como tiempo de estabilización. Algunos de los valores registrados se observan en la Tabla 3.
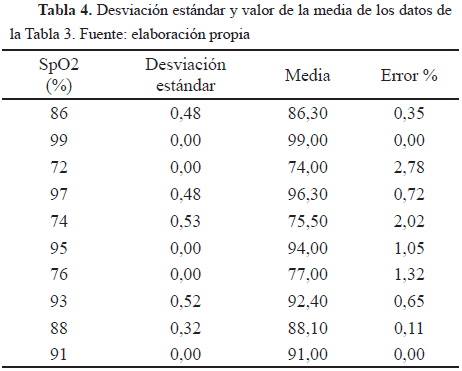
La Tabla 4 muestra la desviación estándar y el valor de la media aritmética de los datos de la Tabla 3, además del cálculo del porcentaje de error entre los valores nominales y la media de los valores reales.
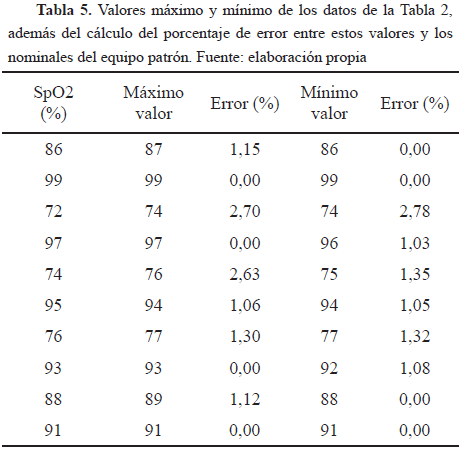
La Tabla 5 muestra los valores máximo y mínimo de los datos de la Tabla 2, además del cálculo del porcentaje de error entre estos valores y los valores nominales del equipo patrón.
E. Simulación de hematomas
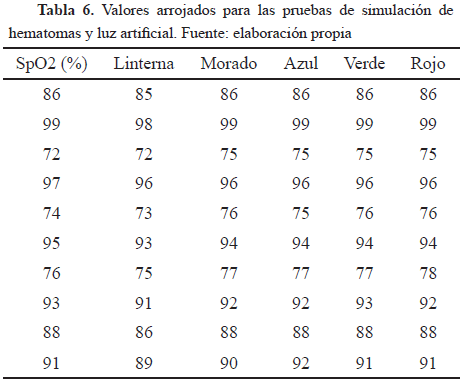
También se diseñó una prueba correspondiente a los posibles errores de fallo que pueda tener el equipo, esta fue pensada partiendo del punto que los diferentes pacientes pueden tener hematomas en los dedos que afectan la medición de la saturación de oxígeno. Para esto se tomaron cuatro colores impresos en acetatos (rojo, morado, verde y azul) correspondientes a las posibles tonalidades de los hematomas, con el fin de simularlas y así mirar que tanto esto afectaba la medición.
IV. DISCUSIÓN
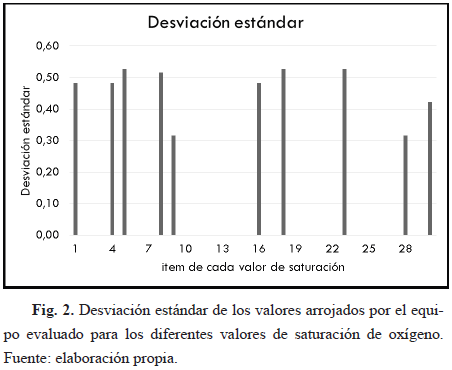
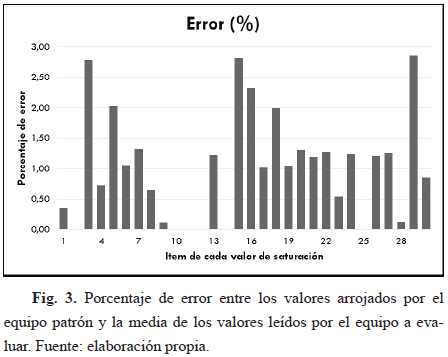
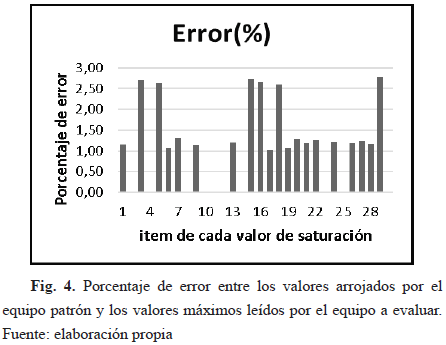
Conforme a los datos obtenidos para las pruebas diseñadas, en especial para la de desempeño, donde se comprobó que el equipo midiera satisfactoriamente los datos en los rangos estipulados en el manual, específicamente para el rango de importancia de los niveles de oxígeno que es de 70%-100%, pero en este caso de 70%-99% por el registro del manual, se evidencia claramente en las Tablas 4 y 5 que el porcentaje de error es aceptable, ya que no es mayor a 3%, es decir, no sobrepasa el error máximo permitido registrado en el manual del equipo. Esto se observa también en las Fig. 3, 4 y 5, las cuales muestran el porcentaje de error para los valores tomados del equipo evaluado.
Durante la prueba el equipo mostraba la onda pero no mostraba los valores correspondientes a la saturación, esto es un problema que se debe corregir en el equipo ya que genera errores en las medidas. Estos ocurría especialmente cuando había cambios súbitos en la toma de datos, es decir, cuando se pasaba de medidas por debajo de noventa por ciento, como por ejemplo 70% o 71% de saturación de oxígeno, inmediatamente a valores hasta por encima de noventa por ciento como 97% o 98% de saturación de oxígeno.
Los resultados según la Tabla 3 donde se simularon los hematomas, evidencia que no hay cambios en los datos obtenidos lo que demuestra que el equipo funciona perfectamente sobre estas condiciones, aunque esta prueba no es descartable todavía, puesto que es recomendable probarla con otros materiales que simulen mejor el hematoma,. Además se debe buscar el color exacto para la simulación de los hematomas.
Otra prueba a fallo realizada fue poner a funcionar el equipo bajo una luz artificial exagerada como se muestra en la Fig. 6, con el fin de comprobar si esto generaba algún tipo de interferencia con la toma de los datos, los resultados obtenidos mostrados en la Tabla 3 evidencian claramente que las medidas se reducen lo que genera un porcentaje de error en comparación con los valores del equipo patrón pero dentro del rango permitido.
También se realizaron pruebas reduciendo la temperatura del ambiente y poniendo el equipo en presencia de otros equipos eléctricos, con el fin de observar el comportamiento del equipo bajo esas condiciones y poder medir los valores para hacer comparaciones. Estos resultados tampoco presentaron cambios significativos, los cambios evidenciados se encuentran dentro del rango permitido descrito en el manual.
V. CONCLUSIÓN
La validación de dispositivos y/o equipos en etapa de pre-mercado automáticos o semiautomáticos de medida clínica, es fundamental para los profesionales y para el público en general debido a la importancia creciente en un futuro cercano la utilización de estos aparatos en la práctica clínica. Considerando que no existen protocolos disponibles para la validación de equipos próximos a salir al mercado, la creación de uno de estos aporta una simplificación en el método y supone un esfuerzo para facilitar la validación de las nuevas tecnologías o de los ya existentes.
Se logró el principal objetivo de diseñar y probar protocolos de validación para dispositivos médicos, esto utilizando un equipo simulador de Oximetría y un monitor de signos vitales. De este último sólo se utilizó el módulo de saturación de oxígeno para corroborar su funcionamiento. Los resultados obtenidos en las pruebas realizadas de acuerdo a las normas fueron satisfactorios pero se deben implementar mejoras para la seguridad en los resultados.
En una segunda etapa de este proceso se debe implementar mejoras en el diseño de las pruebas y realizar nuevas pruebas conforme a los estándares nacionales e internacionales de los nuevos equipos, en especial para el oxímetro de pulso, el EKG y el monitor de frecuencia cardiaca que conforman un monitor de signos vitales.
Para la creación de un protocolo que funcione para cualquier equipo se hace indispensable mejorar la estandarización de metodologías a utilizar en las pruebas para los equipos, verificar el número de ensayos necesarios que se deben realizar sin que se puedan generar costos desmedidos y se logre conseguir un resultado confiable. Además el diseño experimental a emplear es una parte fundamental en el diseño de los protocolos ya que le aporta validez a los resultados.
AGRADECIMIENTOS
Agradecemos al ingeniero Juan David Rendón y a la gerente de la empresa FEMTO S.A.S por brindarnos parte de su tiempo para la explicación de los procedimientos realizados en dicha empresa. Además agradecemos al Bioingeniero Juan Camilo Guerrero por su colaboración con su conocimiento, ya que gracias a él se logró avanzar en la recopilación de las normas de regulación para dispositivos médicos.
REFERENCIAS
[1]. Rubio D., Ponce S., Abril A., Fascioli E. Acreditación de Laboratorios de Ensayos de Equipamiento Electromédico. IV Latin American Congress on Biomedical Engineering 2007, Bioengineering Solutions for Latin America Health, 873-876, 2007. [ Links ]
[2]. Kaplan A.V, Baim D. S., Smith J. J., Feigal D., Simons M., Jefferys D., Fogarty T. J., Kuntz R. E., Leon M. B. Medical device development: from prototype to regulatory approval. Circulation, 109(25), 3068-72, Jun. 2004. [ Links ]
[3]. Alfonso Marín L., Salazar López C., Franco Herrera A. Incidencia de eventos adversos asociados a dispositivos médicos en una institución de salud en Colombia. Revista Ingeniería Biomédica, 4 (8), 71-84, 2010. [ Links ]
[4]. Obregón A. La industria de dispositivos médicos 2010. Secretaría de Economía de México, p. 40, 2012. [ Links ]
[5]. Cheng M. Medical device regulations: Global overview and guiding principles, World Health Organization, 2003. [ Links ]
[6]. Zoser. Página oficial, disponible en: http://www.zoser.com.co/quienesomos.htm. [ Links ]
[7]. Jacobson E.D. GHTF Chair. The Global Harmonization Task Force. Orientación de Validación de Proceso. Junio 29, 1999. [ Links ]