Introducción
Los antivenenos son abordados desde el punto de vista del médico que debe instaurar un tratamiento contra la mordedura de serpiente o accidente ofídico, la industria farmacéutica que elabora el producto y los pacientes que son mordidos por serpientes venenosas y deben recibir el tratamiento. En el mundo, cada año se reportan cerca de cinco millones de personas mordidas por serpientes (1), y en Latinoamérica se han cuantificado cerca de cuatro mil muertes cada año por esta causa (2). Colombia ocupa el tercer lugar en biodiversidad ofídica en América (3); de ahí que anualmente se informe de más de cinco mil accidentes ofídicos, con una mortalidad del 5 % al 9 % y una discapacidad por eventos graves del 6 % al 10 % (4). En la actualidad se considera un problema de salud pública y su notificación es obligatoria desde el 2004 (5). En los informes del Instituto Nacional de Salud (INS) se encontró que el 94,6 % corresponde a accidentes por serpientes del género Bothrops; el 3,30 %, a accidentes ocasionados por el género Micrurus, y el 2,06 %, a accidentes por Crotalus sp. (6).
Los medicamentos efectivos para contrarrestar el envenenamiento producido por la mordedura de serpiente son los antivenenos antiofídicos, producidos desde el siglo XIX, que corresponden fundamentalmente a inmunoglobulinas de plasma equino, obtenido bajo un esquema de inmunización con veneno de serpiente (7,8).
Teniendo en cuenta la importancia de los antivenenos antiofídicos para contrarrestar el envenenamiento por mordedura de serpiente, el objetivo de este artículo es dar a conocer los aspectos generales de su mecanismo de acción, parámetros farmacocinéticos y los efectos adversos de las diferentes generaciones de antivenenos, para comparar objetivamente sus diferencias clínica e in vitro.
La ganancia de conocer los diferentes antivenenos antiofídicos y sus generaciones radica en que el personal de salud pueda tener las herramientas necesarias para seleccionar el antiveneno que requiere el paciente (9), basado en su especificidad, parámetros farmacocinéticos y seguridad (10). Además, se puede disminuir el costo de la atención a los pacientes al utilizar antivenenos con bajo peso molecular, debido a la evidencia de mayor seguridad, o altamente específicos, porque se disminuye el número de viales requeridas para la neutralización; sin embargo, idealmente todos los países deberían tener antivenenos que cumplan con ambos requisitos.
Materiales y métodos
Se buscó literatura sobre el tema en las bases de datos Toxicology Bibliographic Information (Toxline), una base de datos de Toxicology Data Network (Toxnet) de la Biblioteca Nacional de Medicina de Estados Unidos (http://toxnet.nlm.nih.gov) y Pubmed, utilizando combinaciones de los descriptores y términos MeSH, en inglés y español, para antiveneno, mordedura de serpiente, suero antiofídico, faboterápico, F(ab´)2, inmunización, veneno, Viperidae, Elapidae, Micrurus, Bothrops, coral. Se consideraron los documentos publicados posteriores al 2000 y la última búsqueda se realizó el 18 de enero del 2019. Se definieron como criterios de inclusión:
Artículos de revisión, ensayos preclínicos y clínicos publicados después del 2000.
Disponibilidad del documento completo, protocolos de producción de inmunoglobulinas, técnicas inmunoquímicas de producción y artículos de antivenómica.
Artículos sugeridos y enviados por los coautores directamente.
Se definieron como criterios de exclusión:
Artículos en idioma diferente al inglés y español.
Artículos con datos insuficientes o bajo poder estadístico, incluyendo reportes de caso con un paciente.
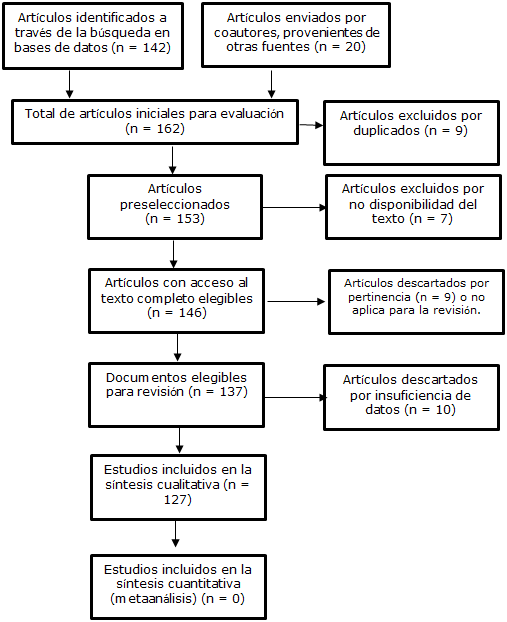
De esta manera se obtuvieron un total de 162 artículos, que se evaluaron con los criterios mostrados en la figura 1 para un total de 127 documentos incluidos. No se realizó un análisis estadístico cuantitativo de los datos encontrados en la revisión, dado que no son comparables en población y tipo de antiveneno utilizado entre ellos.
Resultados
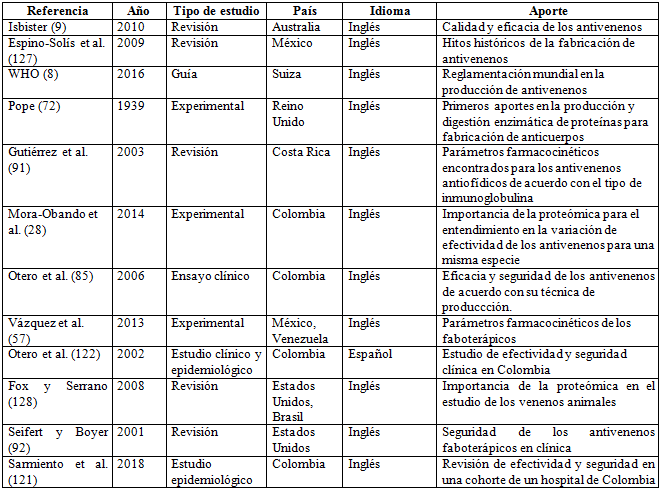
De los 127 artículos revisados, 56 fueron estudios de tipo experimental, 26 revisiones sistemáticas de la literatura, 6 guías de práctica clínica, 5 guías de laboratorio, un acta médica, 28 estudios clínicos, 4 estudios epidemiológicos y el Plan de Desarrollo Nacional colombiano. De los estudios más relevantes para este artículo que se mencionan en la tabla 1, se encuentran 5 artículos de revisión llevados a cabo en países como Australia, México, Costa Rica, Estados Unidos y Brasil; 3 estudios experimentales realizados en Reino Unido, México-Venezuela y Colombia; un protocolo de elaboración de antivenenos realizado por la Organización Mundial de la Salud; 4 estudios de farmacocinética, efectividad y seguridad en clínica, uno de los cuales es un artículo de revisión y tres de estudio experimental; además de 3 estudios clínicos y epidemiológicos realizados en Colombia. La mayoría de los artículos se encuentran escritos en inglés.
Los venenos de serpientes
El veneno es el primer eslabón para buscar la especificidad en la producción de las inmunoglobulinas, dado que la respuesta del sistema inmune depende de los epítopes a los cuales se expone el animal destinado para la producción de anticuerpos (11,12).
La serpiente produce el veneno en una glándula exocrina especializada (13,14,15). La composición química es compleja y presenta diferencias inter e intraespecie, debido a variaciones ontogénicas y geográficas, polimorfismos en los componentes enzimáticos, edad del animal, alimentación y estado de salud, lo que redunda en un amplio espectro de actividades biológicas y farmacológicas del veneno, así como en su respuesta a los antivenenos (16,17,18,19).
Familia Viperidae
Dentro de los componentes del veneno de las serpientes de familia Viperidae se encuentran algunas sustancias inorgánicas, en su gran mayoría iones y péptidos libres (20). Se han descrito trazas de minerales, zinc (asociado con la actividad anticolinesterasa) y calcio, que activa la fosfolipasa A2 (PLA2) (21). A nivel orgánico se encuentran aminoácidos libres como histidina, aspartato, glicina, glutamato, serina, alanina y péptidos ricos en prolina, glicoproteínas, fosfatidilcolina y aminas biogénicas (22,23), como histamina, bradicinina, serotonina y acetilcolina (24).
En cuanto a los compuestos proteicos, son de vital importancia las enzimas proteolíticas, las cuales se clasifican según el sustrato de acción en dos grandes grupos: específicas o inespecíficas (25). Las segundas son liasas tipo endopeptidasas que afectan tanto proteínas tisulares como células sanguíneas; además, tienen especial importancia a nivel clínico las peptidohidrolasas, peptidasas y proteasas, las cuales al actuar sobre proteínas de tejido causan lisis de tejidos, hemorragia y necrosis (22). Las enzimas específicas incluyen una serie de proteasas que tienen alto grado de afinidad y especificidad hacia los factores de coagulación, como serinas proteasas (SP), metaloproteinasas (SVMP), PLA2 y L-aminoácido-oxidasas (26,27).
Gracias a los estudios de proteómica se han establecido tanto las familias de proteínas presentes como la abundancia relativa (28,29,30,31) y, con esto, algunas tendencias en su composición. Se evidencian tres tipos de proteínas predominantes pertenecientes a las familias de las fosfolipasas: PLA2, SP y SVMP (26,32,33).
En general, las PLA2 son enzimas que hidrolizan glicerofosfolípidos y liberan lisofosfolípidos y ácidos grasos. Este veneno muestra una variedad de efectos biológicos que incluyen miotoxicidad, inhibición de agregación plaquetaria, edema, hemólisis, hipotensión, coagulación intravascular diseminada y choque distributivo (34,35,36,37), además de un efecto nefrotóxico y cardiotóxico directo (38,39,40).
Las SP muestran actividad sobre las proteínas de la cascada de coagulación, actividad similar a la trombina sobre el fibrinógeno, activación del factor V de la proteína C, del plasminógeno, fibrinogenólisis e inducción de agregación plaquetaria. Además, algunas SP ejercen actividad similar a calicreína, al liberar bradicinina o Lys-bradicinina, lo que promueve un aumento de la permeabilidad vascular e hipotensión (26,41,42).
Las SVMP, representadas con mayor actividad por las del tipo SVMP P-III, inducen sangrado sistémico por un mecanismo de hidrólisis inicial de enlaces peptídicos en la lámina basal. Ello debilita su estabilidad mecánica e interrumpe la integridad de las células endoteliales que finaliza en extravasación. Se encontró que este proceso es el principal mecanismo que promueve colapso cardiovascular por la pérdida masiva de sangre, secundaria a hemorragia local y sistémica (43,44).
Familia Elapidae
Por otra parte, los venenos de la familia Elapidae, cuyo género más importante es Micrurus (conocidas como corales), se caracterizan por propiciar neurotoxicidad, con mínimo efecto histotóxico y miotóxico y sin alterar los factores de coagulación (45). El resultado del cuadro clínico es una parálisis progresiva muscular hasta los músculos diafragmáticos, lo que lleva a la muerte por este efecto (46).
Conocida la predominancia neurotóxica de estos venenos, entre sus componentes proteicos principales se encuentran la familia de las PLA2 y las toxinas de 3 dedos (3FTx) (47,48). Estos grupos actúan sobre la placa neuromuscular de dos maneras: la primera altera la conducción en la terminal nerviosa mediante hidrólisis de fosfolípidos, lo que provoca descarga, depleción de las vesículas sinápticas de acetilcolina o interferencia en la fusión de las vesículas cargadas con el neurotransmisor y la membrana presináptica (β-neurotoxinas, que son del tipo PLA2), y la segunda bloquea la unión de la acetilcolina con el receptor postsináptico nicotínico (α-neurotoxinas, del tipo 3FTx), que causa parálisis flácida del músculo esquelético (49).
Estudios de proteómica y transcriptómica han permitido caracterizar los venenos (50,51) y relacionar los efectos miotóxicos (PLA2), neurotóxicos, nefrotóxicos y cardiotóxicos (3FTx) de los diversos componentes (52,53). El conocer la composición de las toxinas presentes en los venenos es fundamental para el tratamiento del accidente ofídico y para seleccionar especímenes para la producción de antivenenos.
La complejidad de la fisiopatología del envenenamiento ofídico demanda un conocimiento sobre los componentes del veneno a partir de un abordaje bioquímico funcional, con el fin de evaluar su relevancia para el tratamiento más adecuado.
Los antivenenos antiofídicos
El antiveneno antiofídico se considera la terapia específica para el tratamiento del accidente ofídico o mordedura de serpiente (8,54,55), y es un producto biológico obtenido a través de la inducción de inmunidad en un animal hospedero, usualmente un caballo (56,57,58), para extraer el suero hiperinmunizado purificado y utilizarlo como antídoto en el paciente intoxicado con veneno de serpiente (59). A través de la historia de los antivenenos y la comercialización de estos, se han conocido cuatro generaciones de antivenenos de acuerdo con su proceso de fabricación (8).
El antiveneno de primera generación está compuesto de inmunoglobulinas G (IgG) completas de un peso aproximado de 150.000 Da, que incluye algunas fracciones de proteínas —la albúmina, por ejemplo— (59). Se conoce como antiveneno de segunda generación al compuesto por IgG purificadas sin proteínas séricas, que eliminan una gran proporción de albúmina; sin embargo, puede contener entre un 1 % y un 5 % de proteínas de mediano y alto peso molecular (60,61,62).
El antiveneno de tercera generación está compuesto por fracciones ab unidas, conocidas como F(ab´)2, las cuales tienen un peso aproximado de 100.000 Da; mientras que el antiveneno de cuarta generación se compone de fragmentos ab, monovalentes, conocidos como Fab, con un peso molecular aproximado de 50.000 Da (7,63). Comercialmente, son sueros antiofídicos preparados de inmunoglobulinas purificadas, es decir, primera y segunda generación; entre tanto, se denominan faboterápicos los antivenenos compuestos por fracciones F(ab´)2 o Fab, de tercera y cuarta generación, respectivamente (57).
Elaboración de los antivenenos
Para elaborar los antivenenos se requiere que haya una producción de anticuerpos inducida por inoculaciones seriadas de veneno de serpiente, teniendo en cuenta su dosis letal 50 (DL50) (64,65). El animal usado por excelencia como productor de inmunoglobulinas es el equino, dado su volumen sanguíneo, resistencia y capacidad para generar anticuerpos contra el veneno (56,58,66). Dentro de los estudios analizados se encontró que la inoculación directa del veneno crudo no es bien tolerada por el hospedero (66), por lo que es necesario utilizar coadyuvantes en el momento de la aplicación del veneno, para formar depósitos del antígeno y propiciar una liberación controlada que conserve la inmunogenicidad de los toxoides purificados y estimule la respuesta inmune (67).
El esquema de inmunización es variable, dependiendo de la DL50 del veneno (64), la especie utilizada para la producción de las inmunoglobulinas y la técnica para la purificación de las proteínas (68). Se debe analizar periódicamente un título de anticuerpos para evaluar la producción de las inmunoglobulinas de interés (57,69). Una vez obtenido el título de anticuerpos deseado, se realiza una sangría y se separa el plasma por centrifugación; después, se precipita con sulfato de amonio y se retornan glóbulos rojos y albúmina al animal a través de plasmaféresis, para disminuir el riesgo de anemia en el equino (8,70,71).
La metodología descrita por Pope es la base para la elaboración de los antivenenos (72,73). Los antivenenos de primera y segunda generación son inmunoglobulinas completas purificadas con sulfato de amonio o técnicas de precipitación con ácido caprílico (74,75). Para extraer las fracciones F(ab')2 se desarrollan métodos de digestión de las proteínas plasmáticas de IgG completa utilizando pepsina (proteasa aspártica), la cual hidroliza las cadenas pesadas a partir de su extremo C terminal y escinde el fragmento Fc de las inmunoglobulinas. Así se separa la fracción F(ab')2 de la IgG (76,77). La fracción F(ab')2 se purifica con sulfato de amonio (75,78,79).
Así mismo, por medio del proceso llamado desespeciación, las moléculas reducen su tamaño por la digestión del Fc, debido al clivaje proteolítico, por medio del cual se digieren más del 50 % de las porciones constantes de la IgG (80). El rendimiento durante este proceso puede afectarse dependiendo de la enzima utilizada y de la termocoagulación de la IgG (68,70). En ocasiones, se realizan procesos adicionales para la purificación de F(ab')2 como la cromatografía de intercambio iónico y el uso de ácido caprílico para eliminar lipoproteínas (8).
Los fragmentos Fab, por lo general, se obtienen a través de la digestión con papaína a un pH neutro (76,81) y requieren incubación con un agente reductor para que los anticuerpos tengan un clivaje en la región bisagra, rompan los puentes disulfuro y generen tres partes: dos fragmentos Fab y un fragmento Fc (82). Estos últimos pueden eliminarse por métodos cromatográficos o en tratamiento con pepsina, lo que resulta en fragmentos Fab monovalentes purificados (77,83). La purificación se puede realizar por medio de cromatografía de intercambio iónico o cromatografía de afinidad (84). Los fragmentos Fab también se pueden obtener por medio de la reducción del F(ab')2, mediante una “reducción suave” (mild reduction) con mercaptoetilamina (63,85). De esta reacción resultan dos fragmentos Fab que pueden tener el Fc del anticuerpo (86,87). Se encontró que, de acuerdo con el proceso de digestión enzimática o la técnica de ADN recombinante, se pueden obtener diversas conformaciones de los anticuerpos de acuerdo con el fin para lo cual se diseñan (88,89).
Una vez producido el antiveneno se realiza la primera verificación inmunocitoquímica de la inmunogenicidad por electroforesis en gel o por Western blot (68,86,90). Idealmente, el antiveneno debe reaccionar con todas las fracciones de las proteínas del veneno después de la electrofóresis (73,91,92,93,94). Además, se debe controlar la calidad microbiológica y de efectividad midiendo la capacidad neutralizante del producto, utilizando la técnica de dosis efectiva 50 (DE50) (95,96,97). Una vez cumplidos los controles para evaluar la seguridad y la efectividad del antiveneno, este es envasado en viales en forma líquida o liofilizada (8,86,98). En la figura 2 se visualiza en un esquema las diferencias estructurales de la IgG, fragmentos F(ab´)2 y Fab.
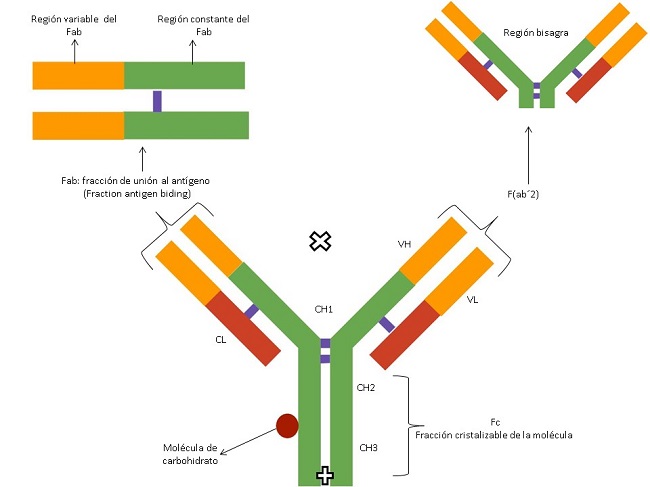
Figura 2 Esquema de la inmunoglobulina G, fragmentos F(ab´)2 y FabRegión variable del Fab: sitio que se une al antígeno; región constante del Fab: no se une al antígeno, estructural; X: extremo aminoterminal de la molécula; +: extremo carboxilo de la molécula; molécula de carbohidrato: relacionada con la cadena pesada de la inmunoglobulina; Fc: fracción cristalizable de la molécula, no se une al antígeno, pero posee los dominios a los que se fijan leucocitos y el complemento; F(ab´2): dos fracciones Fab, unidas por puentes disulfuro. Los anticuerpos tratados con pepsina dan este producto. Es la presentación farmacéutica que presentan la mayoría de los antivenenos para uso terapéutico en Argentina; C: dominio constante de las inmunoglobulinas. Hay tres para la cadena pesada (CH1, CH2 y CH3); uno para las livianas (CL); V: dominio variable de las inmunoglobulinas. Hay una para cada cadena (VL para la cadena liviana y VH para la cadena pesada); CH: dominio constante de la cadena pesada; VH: dominio variable de la cadena pesada; CL: dominio constante de la cadena liviana; VL: dominio variable de la cadena liviana.
Aspectos farmacocinéticos y farmacodinámicos
Se encontraron estudios que midieron algunos parámetros farmacocinéticos, como tiempo de vida media de distribución, tiempo de vida media de eliminación, volumen de distribución y depuración, comparando diferentes antivenenos (57,61,81,90,96,99). Los aspectos farmacocinéticos más relevantes se consignaron en la tabla 2.
Tabla 2 Parámetros farmacocinéticos de acuerdo con la generación de antiveneno antiofídico
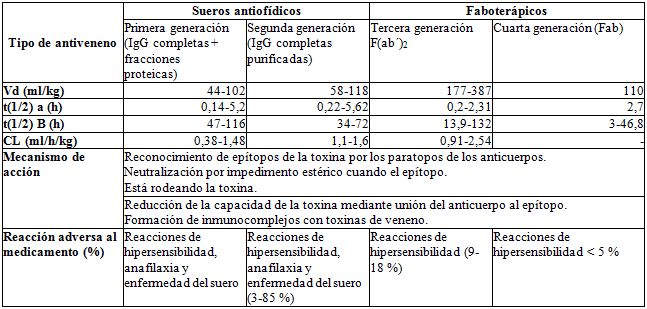
CL: depuración; t (1/2) a(h): vida media de distribución; t (1/2) B(h): vida media de eliminación; Vd: volumen de distribución.
Fuente: elaborado por los autores.
Se encontró una vida media de distribución de aproximadamente una hora para los faboterápicos de cuarta generación y de hasta tres horas para los antivenenos compuestos con IgG completas (91). Se evidenció en los estudios de farmacocinética una adecuada distribución de los antivenenos faboterápicos (F(ab´)2 y Fab) en tejidos de difícil acceso como el lecho renal con disminución de la fagocitosis del fragmento, que le confieren mayor biodisponibilidad a esa molécula (57,82,100,101).
Con respecto a la vida media de eliminación, se encontró para los faboterápicos Fab una capacidad de eliminación del 50 % en un lapso de 5 horas (91,102); mientras que para las IgG completas más de 100 horas (100). Además, para los F(ab´)2 y Fab una tasa de filtración renal más alta que para las IgG completas (57). Con respecto a la eliminación se encontró que los antivenenos con IgG completas tienen catabolismo en bazo e hígado con excreción por células inmunocompetentes con fijación al complemento; mientras que el catabolismo de los fragmentos Fab se efectúa a través del riñón (61,91,100).
Respecto al mecanismo de acción de los antivenenos, estos neutralizan las toxinas de los venenos a través de cuatro mecanismos: a) reconocimiento de epítopos de la toxina por parte de los paratopos de los anticuerpos; b) neutralización mediante impedimento estérico cuando el epítopo está localizado rodeando la toxina; c) reducción de la capacidad de la toxina para interactuar con su objetivo mediante la unión del anticuerpo a un epítopo, y d) formación de inmunocomplejos con toxinas de veneno que limitan la interacción de las toxinas con su objetivo y propician su eliminación por el sistema mononuclear de fagocitos, únicamente para los antivenenos IgG y F(ab´)2 (103). Los dominios variables son los encargados de interactuar directamente con el antígeno; entre tanto, los dominios constantes conforman la porción Fc para activar la modulación de las células inmunitarias y la activación del complemento (104).
Una vez llega el antígeno a la sangre, la inmunoglobulina reconoce y se une al epítopo a través de la porción Fab, mediante enlaces débiles no covalentes, neutralizando el antígeno por precipitación y aglutinación; adicionalmente, se inicia la cascada inmunitaria activando macrófagos, polimorfonucleares y linfocitos natural killer (103).
Este proceso de activación de las células fagocíticas se conoce como opsonización e inicia con la modificación de la porción Fc de las inmunoglobulinas al unirse a los antígenos; ello une macrófagos con polimorfonucleares, y de esta manera se promueve la fagocitosis de los complejos antígeno-anticuerpo y las reacciones de hipersensibilidad (66,105).
Los antivenenos compuestos por fracciones monovalentes Fab tienen un único sitio de unión a los epítopos, los complejos son pequeños, irreversibles e inestables; mientras que los antivenenos con inmunoglobulinas completas y los compuestos por F(ab´)2 tienen dos sitios de unión al antígeno y forman inmunocomplejos más estables (92,106). Además, se encontró que el menor tamaño de los faboterápicos les permite realizar neutralización en un compartimiento vascular y extravascular de difícil acceso para las IgG (42,92).
Seguridad
Para evaluar la seguridad es primordial la pureza de la preparación y la reducción de proteínas de mediano y alto peso molecular (8,66,107). A nivel clínico se evalúa la seguridad con la presencia de reacciones adversas medicamentosas (RAM), entre las que son frecuentes las reacciones de hipersensibilidad de tipo inmediato, como la anafilaxia, y las de tipo tardío, como la enfermedad del suero (85,108). La fracción constante (Fc) de las IgG y las proteínas de alto peso molecular, como la albúmina, cumplen un papel importante en la generación de anafilaxia en los pacientes (109). No se han reportado reacciones tóxicas con el uso de estos medicamentos.
La RAM puede tener presentación cutánea leve o grave, como erupción cutánea, prurito, habones, edema facial, angioedema laríngeo, edema en miembros inferiores y reacciones de hipersensibilidad (77,110,111,112). Además, puede estar asociada a un proceso de sensibilización previo al medicamento (pacientes con uso de antivenenos en un accidente ofídico previo), incluso reacciones de tipo anafiláctico. Esta diversidad en la expresión de RAM es independiente del tipo de inmunoglobulina utilizada (IgG completa o F(ab´)2), debido a que todos los antivenenos hasta el momento son proteínas heterólogas y su respuesta depende también del sistema inmunológico del paciente. Sin embargo, las investigaciones muestran que entre más pequeña sea la fracción de la inmunoglobulina existe menos probabilidad de generar RAM (77,113). Los faboterápicos con fracciones Fab son los que tienen menos reportes de RAM, seguido de los antivenenos compuestos con F(ab´)2, debido a su capacidad para activar el complemento por la vía clásica a través de la porción bisagra, relacionada estrechamente con la inmunogenicidad y activación del complemento; mientras que el antiveneno con mayor probabilidad de RAM continúa siendo el compuesto de IgG completa (68,77,85,111,113,114,115).
En la tabla 3 se muestra una recopilación corta de ensayos clínicos en la que se compara la frecuencia de RAM observadas de acuerdo con el antiveneno utilizado. Se encontró que a nivel clínico los autores informaron sobre la eficacia neutralizante de los antivenenos en el manejo del paciente con ofidiotoxicosis; también se reportó en la mayoría de los artículos una adecuada neutralización de los efectos miotóxico e histolítico de los venenos, con ligera disminución de RAM con el uso de faboterápicos de tercera y cuarta generación (77,85,110,113,116,117,118,119,120,121,122).
Tabla 3 Frecuencia de la reacción adversa medicamentosa con antivenenos antiofídicos
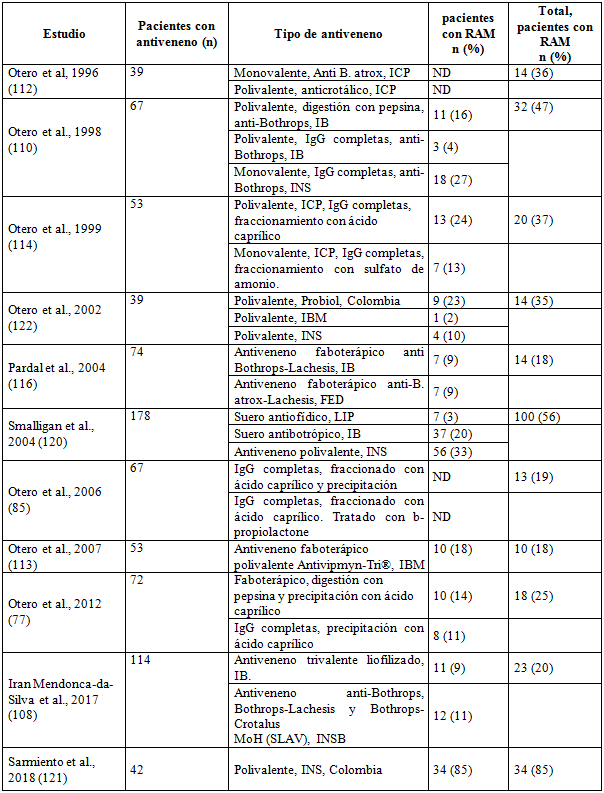
n: dato numérico; ICP: Instituto Clodomiro Picado, Costa Rica; IB: Instituto Butantan, Brasil; INS: Instituto Nacional de Salud, Colombia; FED: Fundación Ezequiel Dias del Estado de Minas Gerais, Brasil; LIP: Leopoldo Izquieta Pérez, Instituto Nacional de Higiene y Medicina Tropical, Guayaquil, Ecuador; IBM: Instituto Bioclón, México; INSB: Instituto Nacional de Salud de Brasil; ND: el dato no está disponible.
Fuente: Elaborado por los autores.
Antivenenos comercializados en Colombia
En Colombia se declaró la mordedura de serpiente como una enfermedad huérfana desatendida y al antiveneno antiofídico como un medicamento vital no disponible, lo que permite la importación de antiveneno para ambas familias desde otros países. De la misma forma que ocurre para el suero antiarácnido, antiescorpión y antilonómico.
Los antivenenos antiofídicos comerciales en Colombia están planteados para ser polivalentes, diseñados con veneno de varias especies de serpientes de una misma familia. Un antiveneno polivalente para la familia Viperidae y un antiveneno polivalente para la familia Elapidae:
El suero antiofídico polivalente para familia Viperidae producido por el INS, se ofrece en una presentación comercial, una caja con dos viales de 10 mL, conteniendo solución inyectable de inmunoglobulina G (IgG) específica purificada proveniente de plasmas hiperinmunes de ejemplares equinos inmunizados con venenos de serpientes de los géneros Bothrops y Crotalus. Cada 10 mL de suero neutralizan mínimo: 10 mg de veneno Crotalus y 70 mg de veneno Bothrops. Por reacción cruzada, cada vial neutraliza como mínimo 15 mg de veneno Lachesis muta (Ecorregión Amazónica) y 50 mg de Lachesis acrochorda (Ecorregiones Pacífica y Valles Interandinos). (123)
El antiveneno polivalente para familia Elapidae del INS, a la fecha, se encuentra en trámite de aprobación por el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima):
El antiveneno anticoral polivalente del INS, se presenta en un vial de 10 mL que contiene una solución inyectable de inmunoglobulina G (IgG), específica y no específica, purificada, proveniente de equinos inmunizados con venenos de serpientes pertenecientes a la familia Elapidae (Elápidos o corales verdaderas). Cada 10 mL de antiveneno, neutralizan cómo mínimo: 3 mg de veneno de Micrurus dumerilii, 8 mg de veneno de Micrurus mipartitus, 20 mg de veneno de Micrurus isozonus y 3 mg de veneno de Micrurus surinamensis. (124)
A la fecha, el Invima aprobó al Instituto Bioclón, de México, para la comercialización del antiveneno polivalente para serpientes de la familia Viperidae, antiveneno polivalente para serpientes de la familia Elapidae y el polivalente antialacrán. De la misma forma, autorizó al Instituto Clodomiro Picado, de Costa Rica, para comercializar antiveneno polivalente para la familia Viperidae.
El antiveneno Antivipmyn, producido por el Laboratorio Bioclón de México, se ofrece en una presentación comercial de caja con un frasco ámpula liofilizado con solución inyectable. El frasco o ampolla con liofilizado contiene faboterápico F(ab´)2 polivalente antiofídico con capacidad neutralizante de 30 mg de Bothrops sp., 7 mg de veneno de Crotalus sp. y 15 mg de veneno de Lachesis sp. (125).
El antiveneno Polival-ICP, producido por el Instituto Clodomiro Picado de Costa Rica, se ofrece en una presentación comercial de caja con un frasco de 10 ml con solución inyectable liofilizado:
El frasco o ampolla con liofilizado contiene inmunoglobulinas IgG equinas purificadas con capacidad para neutralizar al menos 3 mg de veneno de Bothrops asper, 2 mg de veneno de Crotalus simus y 3 mg de veneno de Lachesis stenophrys Los ensayos clínicos y preclínicos desarrollados por el ICP demuestran que es eficaz para neutralizar en Colombia veneno de serpiente Bothrops asper y Bothrops atrox y no es efectivo contra el veneno de Cascabel sudamericanas. (126)
Discusión
La literatura revisada destaca la importancia de los parámetros farmacocinéticos y farmacodinámicos de los antivenenos, teniendo en cuenta que dichas propiedades pueden diferir de acuerdo con el método de elaboración (8,91).
De esta manera, el volumen de distribución de los faboterápicos es mayor en comparación con el de las IgG completas, probablemente debido al menor peso molecular de los primeros, que le confieren la capacidad de difundir al compartimiento extravascular con mayor rapidez para efectuar su acción neutralizante y favorecer un aclaramiento renal más veloz (61,91).
La biodisponibilidad del suero antiofídico mejora su efectividad; sin embargo, dado que todos los antivenenos se aplican vía intravenosa, su biodisponibilidad es alta, independiente de su generación (61).
La efectividad de los antivenenos depende de su mecanismo de acción, el cual mejora con la afinidad para neutralizar los epítopes de los venenos. Entre más afinidad exista entre el antígeno y el anticuerpo, más efectivos son los antivenenos, independiente del peso de la inmunoglobulina (91,94,122). Adicionalmente, los fragmentos con menor masa molecular como los Fab poseen un solo sitio de unión específico con el antígeno (parátopo); mientras que los F(ab´)2 y las IgG tienen dos cada uno. Ello favorece la formación de inmunocomplejos estables, lo que les procura un gran peso molecular con la posibilidad de hacer depósitos en los vasos sanguíneos que, a su vez, incrementan la respuesta inflamatoria y la producción de radicales libres. Así se acrecienta la lesión vascular sobre diversos órganos. Lo anterior, junto con la especificidad propia de cada antiveneno, debe tenerse en cuenta al momento de la selección del tratamiento (22,29,115,116).
Entre los parámetros más discutidos está la vida media de eliminación de los antivenenos. Los fragmentos Fab tienen vida media más corta, dado su menor peso molecular (50 KDa), se eliminan rápidamente por excreción renal y son una de las causas por las cuales son más seguros (61,99,101). Por su parte, los fragmentos F(ab´)2 y las IgG completas (100-150 KDa), dado su mayor peso molecular, poseen semividas más prolongadas. Sin embargo, también se ha discutido la posibilidad de ser esta la causa de algunas reacciones inmunológicas como reacción alérgica y anafiláctica, dado que son inmunoglobulinas equinas expuestas por mayor tiempo al sistema del complemento, lo que facilita la potenciación de la respuesta inflamatoria (103).
En este aspecto, las inmunoglobulinas completas activan toda la respuesta inmune y tienen el mayor número de reacciones adversas; no obstante, algunos estudios muestran que los faboterápicos de tercera generación F(ab´)2 también activan la cascada de complemento por la región bisagra, aunque en menor proporción que las IgG (79,106). En los ensayos clínicos, el antiveneno que menos tiene reacciones adversas en los pacientes son los faboterápicos de cuarta generación con Fab (107,110,113,114,121).
Es pertinente el estudio proteómico de los venenos, en búsqueda de la especificidad y afinidad molecular con los antivenenos que están incursionando en Colombia; además, se hace pertinente la implementación de tecnologías necesarias para desarrollar medicamentos más seguros, lo cual es parte de la responsabilidad social de las empresas farmacéuticas, de acuerdo con los parámetros de la Organización Mundial de la Salud (8).
Conclusiones
La elaboración de los antivenenos antiofídicos ha evolucionado conforme aumentan las metodologías analíticas de los venenos y los procesos de manufactura farmacéutica. La especificidad de los antivenenos incrementa cuando su fabricación implica el veneno de la especie relacionada; sin embargo, la reacción cruzada con especímenes de ancestros comunes ejerce una tarea suplementaria para solventar dificultades como la consecución de ciertos tipos de veneno.
Las farmacéuticas han modificado paulatinamente la fracción de la inmunoglobulina de los antivenenos para hacerla cada vez más pequeña y cambiar así sus características farmacocinéticas. Las primeras dos generaciones se componen de la inmunoglobulina completa; mientras que la tercera y cuarta generación, conocidas como faboterápicos, contienen porciones F(ab´)2 y Fab, respectivamente.
Con respecto a la seguridad de este medicamento, hay que tener en cuenta que los antivenenos antiofídicos son proteínas heterólogas, y al aplicarlos se generará una respuesta dependiendo del sistema inmunológico del paciente.
El peso molecular de los antivenenos afecta el volumen de distribución y la vida media. En este aspecto, las inmunoglobulinas completas son las que tienen mayor peso molecular, lo cual disminuye su volumen de distribución y aumenta su vida media. Al permanecer más tiempo en la circulación sanguínea central, se exponen durante un periodo más largo al sistema inmunológico del paciente, activando las cascadas proinflamatorias, lo cual es evidenciado al tener el mayor porcentaje de RAM de todos los antivenenos. Con respecto a su bajo volumen de distribución, el medicamento no cruza a nivel microvascular, lo que impide la neutralización directa en el lecho renal, cardiovascular y distal.
Por su parte, los faboterápicos —debido a su bajo peso molecular— tienen un alto volumen de distribución que les permite llegar a la vasculatura distal y microvasculatura, con lo cual disminuye la frecuencia de falla renal y cardiovascular. Además, tienen una vida media corta, se eliminan más fácil que las inmunoglobulinas completas y disminuyen el tiempo de exposición al sistema inmunológico del paciente.
Los faboterápicos de cuarta generación no activan el sistema de complemento, por lo que se consideran más seguros, comparados con los otros tipos de antivenenos; mientras que los de tercera generación F(ab´)2, aunque tienen una reducción significativa de RAM, continúan activando el complemento por su región bisagra y, por lo tanto, presentan RAM a un nivel intermedio entre las inmunoglobulinas completas y los Fab.
Con respecto a la farmacodinamia de los antivenenos antiofídicos, no se han realizado modificaciones; las cuatro generaciones se basan en el acoplamiento del epítope a la porción Fab de la inmunoglobulina de manera específica, dependiendo del veneno con el que se inmunizaron los animales productores de las inmunoglobulinas. Por esta razón, se hace hincapié en la necesidad de generar antivenenos antiofídicos con venenos de diferentes especies y regiones de un mismo país, con el fin de afinar la neutralización.
En general, se considera, y como recomendación de la Organización Mundial de la Salud, que la producción de los antivenenos debe actualizarse para mejorar su eficacia, especificidad, efectividad y seguridad en el momento de usarse en los pacientes con ofidiotoxicosis.