Introducción
Los tumores del sistema nervioso representaron aproximadamente el 1,4 % de los nuevos diagnósticos de cáncer en 2018 en Estados Unidos. Su prevalencia disminuye con la edad, aun cuando entre los 0 y los 14 años constituye la primera causa de neoplasia, ya que representan aproximadamente el 30 % de las muertes por cáncer en esta población (1,2,3,4,5,6,7,8,9). Los tumores del sistema nervioso central (SNC) más frecuentes en la edad pediátrica son el astrocitoma pilocítico, los tumores embrionarios y los gliomas malignos; mientras que en los adultos se encuentran los meningiomas, los tumores pituitarios y los gliomas malignos (1,2,3,10,11,12,13,14).
Nuestro equipo ha centrado la atención en la importancia de recolectar datos sobre la patología tumoral craneal, y recientemente publicó un trabajo sobre la epidemiología general de los tumores cerebrales, basado principalmente en registros poblacionales de Norteamérica y Europa, dado que en Colombia son escasos los reportes sobre la epidemiología y la carga de enfermedad de tumores cerebrales, y aquellos que existen señalan la realidad de ciudades específicas, sin mostrarlos de manera global (9,15,16,17).
Consideramos necesario conocer la epidemiología y la sobrevida de nuestro país de los tumores cerebrales, a fin de poder plantear políticas en salud, llevar a cabo tamizajes diagnósticos y gestionar estrategias para la planificación de actividades preventivas que permitan mejorar la calidad de la atención médica y la prestación del servicio de salud (18,19,20,21). Este artículo reporta la sobrevida de los tumores cerebrales de Colombia a los seis meses, al año, a los dos y a los tres años, a partir de los registros de cáncer de base poblacional de diferentes ciudades, recolectados durante un periodo de diez años; además, constituye uno de tres artículos en los cuales se recopila la información epidemiológica de los tumores cerebrales de nuestro país, con el fin de generar conocimiento y proveer datos a los actores que intervienen en el sistema de seguridad social y a los entes reguladores de salud.
Materiales y métodos
Se llevó a cabo un estudio retrospectivo observacional descriptivo utilizando las bases de datos de registros de cáncer de base poblacional colombianos, recolectadas por el Sistema de Información de Cáncer de Colombia (SICC-Infocáncer), el cual recopila información general de mortalidad e incidencia de las ciudades de Bucaramanga, Pasto, Manizales y Barranquilla (22,23). Adjunto a este, se incluyó el registro poblacional individual de Cali (Valle del Cauca, Colombia) (24) y la información de entes internacionales (red de institutos e instituciones nacionales de cáncer, Ministerio de Salud, Centro Internacional de Investigaciones sobre el Cáncer [IARC]/Globocan) (3,4).
Se extrajeron los datos anonimizados desde el 2003 al 2012 de aquellos pacientes con tumores cerebrales (malignos o benignos). La información, sin restricción de grupo etario, se agrupó así: pacientes pediátricos (menores de 18 años) y pacientes adultos (mayores o igual a 18 años). Se analizaron las características poblacionales generales y la caracterización de tumores cerebrales. Se calculó la mortalidad general para cada departamento de Colombia, presentada en SICC-Infocáncer; pero extraída del Departamento Administrativo Nacional de Estadística (DANE). También se promediaron las tasas estandarizadas de mortalidad, agrupadas por cinco años (2003-2007 y 2008-2012), para mayor comodidad a la hora de ejecutar los análisis, sin que se viera afectada la confiabilidad de los datos, dada la mínima variabilidad en el transcurso de los 10 años. Por otro lado, dado que el registro abarca desde el 2003 hasta el 2012, para la referencia histológica de los subtipos tumorales se usó la clasificación previa a la última actualización propuesta por la Organización Mundial de la Salud, en el 2016.
Análisis estadístico
En primer lugar, se creó una base con los datos y con la información cruda recolectada. Así mismo, se realizó análisis estadístico descriptivo para todas las variables consideradas en el análisis y para los subgrupos seleccionados. Se aplicó el test de Shapiro-Wilk con el objetivo de determinar la normalidad de los datos; aquellos que seguían una distribución normal se presentan como promedio y desviación estándar (DE), mientras que las variables categóricas se presentan en proporciones o porcentajes. Las incidencias y las mortalidades se presentan como frecuencias relativas, tasas crudas y tasas ajustadas por edad (menores de 18 años y mayores de 18 años) expresadas por 100.000 años-persona.
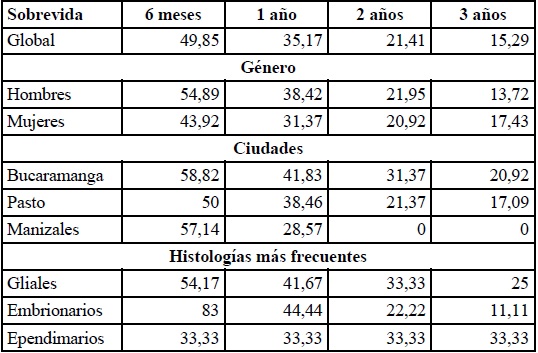
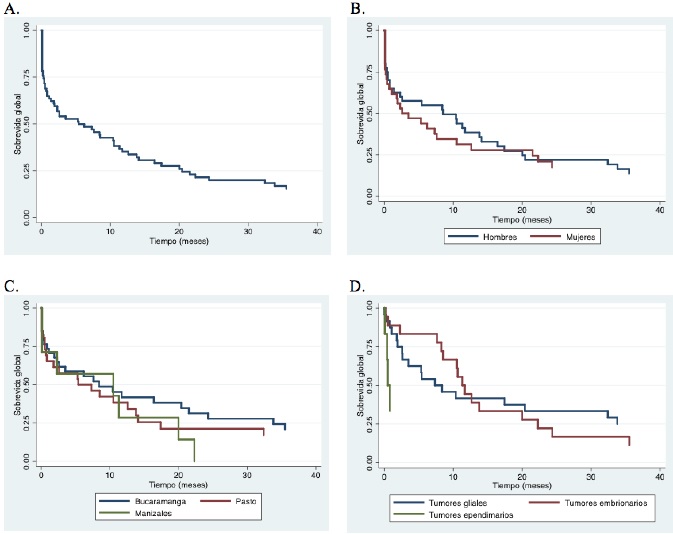
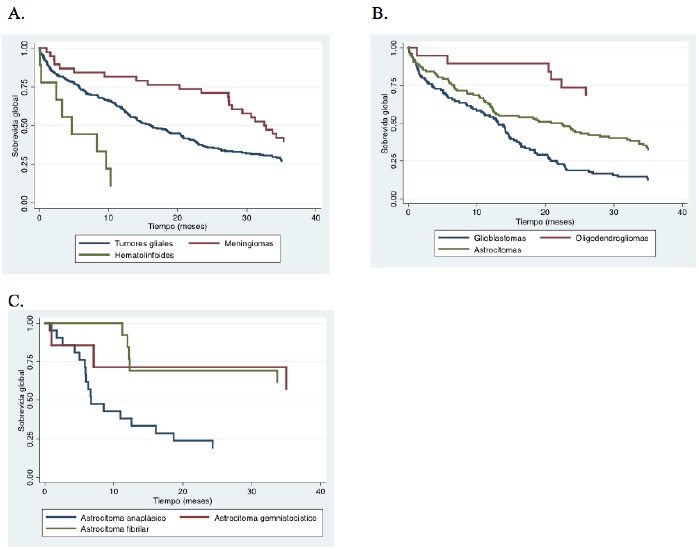
La población estándar utilizada fue la población mundial, según Mitsou Segi (SEGI), como es convención al comparar tasas estandarizadas utilizando datos de registros de cáncer de base poblacional (23). Se calcularon las sobrevidas globales, por grupo etario, género, ciudad e histología, usando el método de Kaplan-Meier. Para el análisis y subanálisis de la sobrevida se tomaron los primeros tres años en las curvas de Kaplan-Meier, dado que el número de casos reportados no fue representativo después de este periodo. Se utilizó el programa Stata versión 14.0 para el análisis estadístico.
Resultados
Tumores del sistema nervioso central en pediátricos
Características demográficas generales. En la población pediátrica se reportaron un total de 123 casos de tumores cerebrales en SICC-Infocáncer en el periodo 2003-2012, la mayoría para hombres (53,7 %), con un promedio de edad en el momento del diagnóstico de 8,4 años (DE ± 5,43 años). Respecto a su comportamiento, el 95,1 % fue maligno, el 3,3 % de comportamiento incierto y el 1,6 % benigno. La tasa de incidencia fue de 1,55 por 100.000 años-persona y la tasa de mortalidad fue de 0,063 por 100.000 años-persona (tabla 1).
Tabla 1 Caracterización sociodemográfica de población pediátrica y adulta
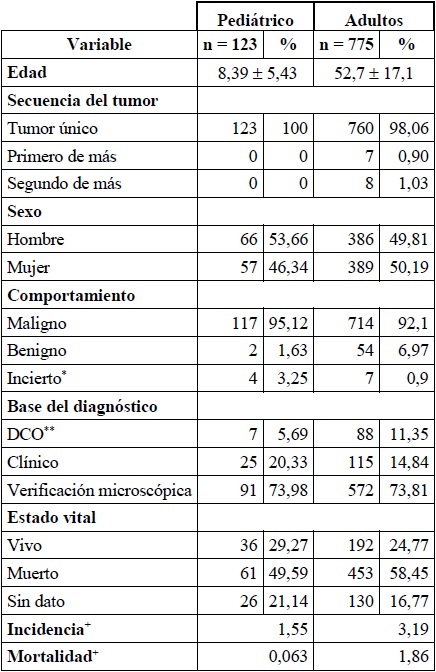
*Si es benigno o maligno.
**Certificado de muerte únicamente.
+Tasas expresadas por 100.000 años-persona, población estándar SEGI.
Caracterización de los tumores cerebrales. Los tumores más frecuentes fueron los supratentoriales malignos, que representaron un 63,4 %. De acuerdo con el subgrupo histológico, los más frecuentes en orden ascendente fueron las lesiones gliales, los tumores embrionarios y los tumores ependimarios, de los cuales los subtipos histológicos predominantes fueron el astrocitoma, el meduloblastoma y el ependimoma.
Sobrevidas. La sobrevida global a los 6 meses, al año, a los 2 años y a los 3 años fue del 49 %, 35 %, 21 % y 15 %, respectivamente. Para la sobrevida por género y por ciudades, esta fue mejor en los hombres y en Bucaramanga, respectivamente. Con respecto a la sobrevida para los subtipos histológicos más frecuentes, esta fue mayor para las lesiones gliales, siendo a los 6 meses, al año, a los 2 años y a los 3 años del 54 %, 42 %, 33 % y 25 %, respectivamente (tabla 2, figura 1).
Tumores del sistema nervioso central en adultos
Características demográficas generales. Un total de 775 casos de tumores cerebrales en adultos se reportaron a SICC-Infocáncer. La edad promedio fue de 52,7 años (DE ± 17,1 años), con una distribución equitativa por género. El 92,1 % de los tumores mostraron un comportamiento maligno; mientras que el 7 % tuvieron un comportamiento benigno y el 0,9 % un comportamiento incierto. La principal base del diagnóstico fue histológica, representada en el 73,8 % de los casos. La tasa de incidencia fue 3,19 por 100.000 años-persona y la tasa de mortalidad de 1,86 por 100.000 años-persona.
Caracterización de los tumores cerebrales. El 92 % de los tumores fueron supratentoriales, y dentro de estos las lesiones gliales, los meningiomas y los tumores hematolinfoides constituyeron los tipos histológicos más frecuentes, en un 82,4 %, 8,9 % y 2,3 %, respectivamente.
Sobrevidas. La sobrevida global a los 6 meses, al año, a los 2 años y a los 3 años fue del 70 %, 59 %, 43 % y 35 %, respectivamente. Para la sobrevida por género y por ciudades, esta fue mejor en los hombres y en Manizales. Con respecto a la sobrevida para los subtipos histológicos más frecuentes, esta fue mayor para los meningiomas, siendo a los 6 meses, al año, a los 2 años y a los 3 años del 84 %, 82 %, 71 % y 39 %, respectivamente. Dentro del subanálisis de los tumores neuroepiteliales, los oligodendrogliomas representan los tumores con mejor sobrevida. Por otro lado, dentro de los subtipos histológicos de las lesiones gliales de bajo y alto grado, el patrón fibrilar obtuvo mejores sobrevidas (tabla 3, figuras 2 y 3).
Tabla 3. Sobrevidas de adultos: general, ciudades, género, histología, tumores gliales, subtipos de astrocitomas (en porcentajes)
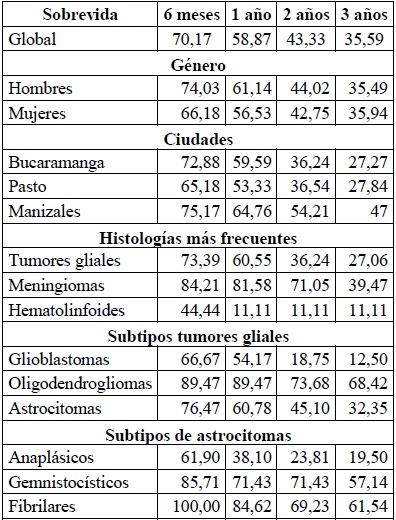
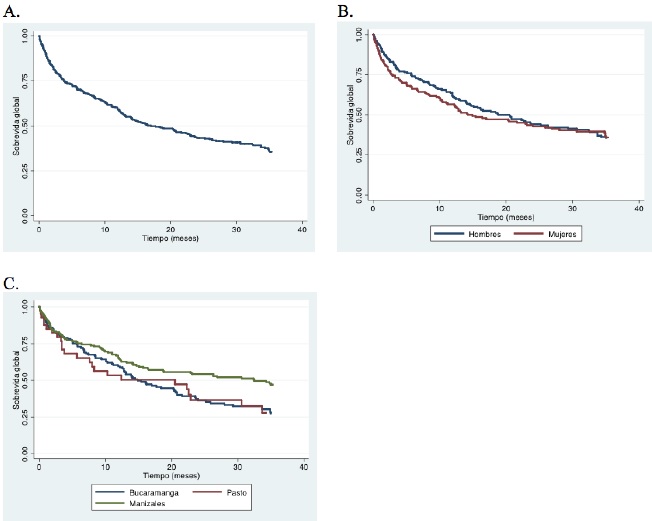
Figura 2. Curvas de Kaplan-Meier para sobrevidas adultos hasta 3 años. A) Sobrevida global. B) Sobrevida por sexo. C) Sobrevida por ciudades
Discusión
Según los últimos datos estadísticos del Registro Central de Tumores Cerebrales de Estados Unidos, para ese país, en el 2015, la tasa de incidencia de tumores cerebrales malignos primarios fue de 6,95, y fue de 15,64 para tumores no malignos (25,26). En comparación con datos de países de altos ingresos, las tasas varían entre 10,57 y 25,5 en países como Japón, Francia e Italia (27,28,29,30). Al compararlas con América Latina, tienden a ser similares a nuestro reporte, al hallarse tasas de incidencia en Brasil, México y Ecuador de 5,5, 2,4 y 3,7 por 100.000 habitantes, respectivamente (8). Las cifras de mortalidad presentan un comportamiento similar: para el 2018, Estados Unidos informó una tasa de mortalidad de 4,3 por 100.000 habitantes (26); mientras que en Australia fue de 5,3 por 100.000 habitantes (31). Al igual que las incidencias, los países de Latinoamérica tienden a tener menores tasas en relación con países de mayores ingresos (Brasil con 3,6, México con 1,9 y Ecuador con 1,9 por 100.000 habitantes); posiblemente relacionado con el bajo registro de bases poblacionales (8).
Las sobrevidas globales se comportaron de forma similar tanto en la población pediátrica como en la adulta, con porcentajes bajos desde el seguimiento inicial, lo cual puede correlacionarse con el subregistro generalizado de las bases de datos. Además, en su mayoría, las lesiones neoplásicas del SNC en la población pediátrica se diagnostican tras el fallecimiento del niño, por lo que no hay claridad diagnóstica sobre el grado de la lesión (maligno y benigno) previo del fallecimiento. Resultados similares los evidenció un estudio local publicado por Páez-Rodríguez et al. (15), donde la sobrevida global fue de 3,4 años y en un 45 % de pacientes no fue posible definir su supervivencia, por la dificultad de obtener datos personales actualizados en la historia clínica.
Los tumores más frecuentes reportados por la literatura para la población pediátrica son las lesiones gliales de bajo grado y alto grado, además de tumores embrionarios, lo cual se correlaciona con lo encontrado para el presente estudio (9). Para las lesiones gliales de bajo grado se ha demostrado una buena sobrevida a largo plazo, hasta del 87 % acumulado a 20 años por Bandopadhayay et al. (32). Según el Instituto Nacional de Cancerología (22), los gliomas WHO I tienen una sobrevida al primer, segundo y quinto año del 95 %, 93 % y 91 %, respectivamente; y para los WHO II, en los mismos periodos, es del 82 %, 66 % y 52 %, respectivamente.
Al evaluar las sobrevidas del astrocitoma pilocítico, se encuentran similitudes en las sobrevidas globales de las diferentes publicaciones. La sobrevida a los 5 y 10 años oscila entre el 80 y el 100 % y entre el 81 y el 95,8 %, respectivamente (33,34,35). El panorama de supervivencia es menos favorable con las lesiones gliales de alto grado en esta población, pues para los WHO III y IV la sobrevida a los 5 años fue del 29 % y del 18 %, respectivamente (36,37). Respecto a los tumores embrionarios, se ha descrito una sobrevida global a uno, dos y cinco años del 80,6 %, 71 % y 62,6 %, respectivamente (26).
De acuerdo con los subtipos histológicos, el estudio alemán de Tulla et al. (38) presentó una sobrevida para el meduloblastoma del 69 % a 5 años y del 61 % a 10 años, y para los tumores neuroectodérmicos primitivos periféricos del 38 % a 5 años y del 34 % a 10 años. Datos similares encontró el trabajo de Indelicato et al. (39). En el presente estudio, las sobrevidas no se pudieron comparar con las descritas previamente, dado el número reducido de pacientes incluidos.
Para la población adulta, los tumores primarios más reportados en la literatura son los meningiomas, los adenomas hipofisiarios y los glioblastomas, lo cual varía respecto a lo encontrado en nuestro estudio, en el cual, al igual que en la literatura, encontramos que el meningioma y el glioblastoma hacían parte de los tres subtipos más frecuentes; sin embargo, no encontramos los adenomas hipofisiarios, sino los tumores hematolinfoides como los terceros más frecuentes (9). Esto puede deberse al sesgo en el registro de la base de datos, dado que se ingresan pacientes cuya causa de muerte esté relacionada con un tumor cerebral, por lo cual es poco probable que un adenoma hipofisiario, per se, sea el vínculo causal de la muerte. Por otro lado, muchos pacientes pudieron haber tenido de manera incidental un adenoma hipofisiario, sin ser diagnosticados previamente o en la autopsia.
La sobrevida global de los meningiomas tiende a ser buena; para los meningiomas benignos se reporta una sobrevida a 1, 2 y 5 años del 92,6 %, 90,7 % y 86,7 %, respectivamente; sin embargo, para los meningiomas malignos se reporta una sobrevida a 1, 2 y 5 años del 82,1 %, 74,9 % y 63,8 %, respectivamente (40,41,42). Para los adenomas hipofisiarios se observó un comportamiento similar en las sobrevidas; usualmente, tienen un comportamiento benigno, con una sobrevida global a un año entre el 96 y el 98 % (40).
En el estudio iraní de Anvari et al. (43) se encontraron diferencias con base a si eran o no funcionantes. Para los adenomas funcionantes la sobrevida a 1 y 3 años fue del 84,6 % y 23 % respectivamente, y para aquellos adenomas no funcionantes en el mismo periodo fue del 90,9 % y 22,7 % respectivamente. Para este último subgrupo de tumores hipofisiarios no funcionantes, el estudio europeo de Ntali et al. (11) encontró una diferencia de sobrevida según si el diagnóstico se había realizado antes de los 50 años o después, obteniendo una sobrevida del 98,5 % a 10 años para diagnósticos antes de los 50 años y una sobrevida de 80,9 % a 10 años para aquellos diagnosticados por encima de ese corte de edad.
Por último, para el glioblastoma multiforme, que corresponde al tumor maligno primario más frecuente, es conocido que su sobrevida es baja, a pesar del manejo médico-quirúrgico. Se encontraron diferentes tasas de sobrevida en los estudios; no obstante, la sobrevida global al año, a los 2 y a los 5 años oscilan entre el 20 y el 38 %, el 17 y el 27 % y el 10 %, respectivamente (40,41,44,45,46,47). Actualmente, en la era molecular de los tumores cerebrales, Lin et al. (48) correlacionaron los subtipos moleculares del glioblastoma (clásico, mesenquimal, proneural y neural) y demostraron que no hay una relación clara con la sobrevida global; sin embargo, lograron establecer que el subtipo proneural tuvo un buen pronóstico; los neurales y mesenquimales, uno intermedio, y el subtipo clásico, el peor pronóstico.
Conclusiones
El presente estudio constituye el trabajo más reciente sobre la epidemiología y, más precisamente, las sobrevidas acerca de los tumores cerebrales en Colombia, cuyas estadísticas son bajas en relación con lo reportado en la literatura mundial. Este artículo no refleja la epidemiología total de los tumores cerebrales en Colombia, dado que estos resultados son la representación de algunas ciudades del país y se asocia a un subregistro encontrado en las bases de datos; sin embargo, se requieren estudios adicionales para su comparación con otros países. Consideramos indispensable para futuros estudios poblacionales ampliar la cobertura y la recolección de datos en los registros de cáncer de base poblacional, necesarios para implementar políticas y estrategias en salud.
Limitaciones y direcciones futuras
En Colombia se cuenta con escasos informes sobre la epidemiología de los tumores cerebrales (15,18,20), y los que existen son registros locales que no son ni rigurosos ni masivos. En Colombia, pocas ciudades (cinco de las 118 ciudades del país) tienen un registro de cáncer de base poblacional formal y de estos se recolectan datos generales (49,50,51). Estos resultados nos han ayudado a visualizar el panorama actual del registro en bases de datos en Colombia, que no solo aplica para los tumores del sistema nervioso, sino que también podría extrapolarse a otros tipos de neoplasias (mama, pulmón, tubo digestivo), lo cual es un llamado a las autoridades a mejorar y crear registros de base poblacional. Estos últimos nos van a ayudar a crear estrategias para la toma de decisiones en políticas de salud que permitan la planificación de actividades preventivas y ensayos clínicos que para optimizar la calidad de la atención médica (19,52).











 text in
text in